Какие вирусы убивает химиотерапия
Обновлено: 12.05.2024
Лекарственная противоопухолевая терапия, в том числе и химиотерапия, – один из основных методов лечения рака. При химиотерапии в человеческий организм вводятся различные токсические вещества, которые губительно воздействуют на клетки злокачественных опухолей. Важно при этом, чтобы яды и токсины оказывали наименьшее отрицательное воздействие на весь организм больного.
Схемы химиотерапевтического лечения регламентируются международными методиками и правилами, и рассчитываются индивидуально. Врач-химиотерапевт подбирает пациенту лечение, руководствуясь различными критериями, среди которых:
- морфологическая форма рака
- распространённость процесса
- возраст пациента
- наличие сопутствующих заболеваний и так далее.
Процедура представляет собой внутривенное введение химиопрепаратов или приём таблеток и капсул. Чаще всего терапия назначается несколькими циклами и должна повторяться через определённый промежуток времени – это связано с клеточным циклом.
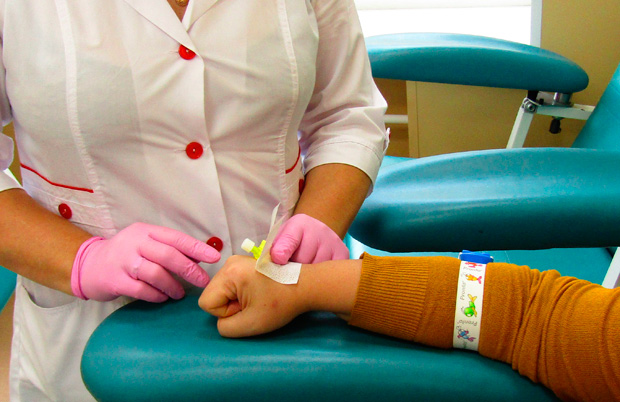

Виды химиотерапии
- монохимиотерапия — лечение одним препаратом;
- полихимиотерапия — лечение несколькими препаратами одновременно.
Сложные комбинации из нескольких химиопрепаратов на сегодняшний день используются чаще, так как они более эффективные.

Химиотерапия нередко применяется как часть комбинированного лечения рака:
- неоадъюватная — проводится до радикального лечения;
- адъювантная — назначается после хирургической операции.
Дозы и режимы применения противоопухолевых препаратов
Противоопухолевые лекарственные препараты и их дозировка подбираются строго индивидуально.
У каждого препарата имеются свои характеристики и особенности. При проведении химиотерапии важными являются следующие параметры:
- доза препарата
- режим и методика его введения
- интервал между введениями
- осложнения на фоне его применения.


Дозу препарата рассчитывают исходя из схемы химиотерапии, роста, веса, возраста, состояния больного, а в некоторых случаях, на основании лабораторных показателей пациента.
Режимы
Если необходимо повысить интенсивность химиотерапии, то увеличивают дозу препарата, это так называемая высокодозная терапия, либо сокращают интервал между курсами ХТ, то есть вводят уплотненные режимы.
Также существуют метрономные режимы применения цитостатических препаратов, когда вводятся малые дозы препаратов, но постоянно в течение длительного времени.
После каждого курса химитерапевтического лечения обязательно делается определенный перерыв для восстановления организма. Как правило, повторные курсы ХТ проводят через каждые три-четыре недели, это период, в течение которого восстанавливаются показатели лейкоцитов, тромбоцитов и пр.
При использовании некоторых химиопрепаратов, к примеру, нитрозопроизводных, этот интервал увеличивается до 6 недель.
Продолжительность лечения и количество курсов химиотерапии зависит от вида опухоли, от особенностей течения болезни от того, как организм реагирует на лечение. Иногда возникает необходимость прекратить или изменить лечение, и это решение принимает лечащий врач.
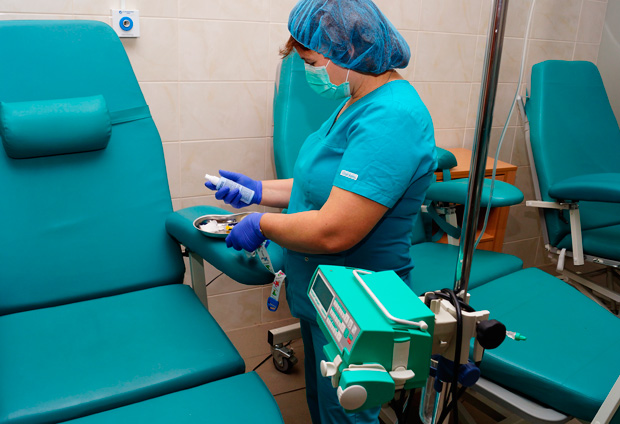
Способы применения химиопрепаратов
- Системная химиотерапия
Препараты вводятся внутрь (через рот), подкожно, внутривенно, внутримышечно, ректально.
Системная химиотерапия подразумевает воздействие на весь организм. - Регионарная химиотерапия
Подразумевается воздействие цитостатического препарата в повышенных концентрациях на опухолевую массу с ограничением его поступления в другие органы путем введения в сосуды, питающие новообразование (например, при меланоме). - Локальная химиотерапия
Препараты в виде мазей или растворов наносят на поверхностные опухолевые очаги (кожные язвы), вводят в серозные полости (асцит, плеврит), спинномозговой канал (интратекально) при поражении мозговых оболочек и внутрипузырно – при новообразованиях мочевого пузыря.
Правила введения противоопухолевых препаратов
Наиболее широко используется внутривенное введение противоопухолевых средств. При этом врач обязательно учитывает индивидуальные особенности вен пациентов.

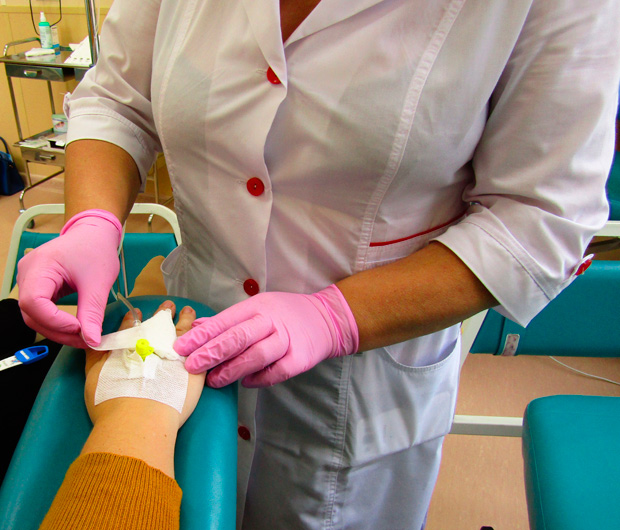

Имплантируемые порт-системы
Порт-системы помогают проходить лечение более эффективно, безопасно и качественно. Особенно актуальна их установка в качестве устройства сосудистого доступа пациентам, которым назначено длительное лечение, при осложнениях на фоне химиотерапии, которые привели к затруднению венозного доступа.
При этом терапию пациент может получать как в условиях стационара, так и амбулаторно.
Инфузия лекарственных препаратов производится с помощью специальных игл типа Губера, которые, пунктируя силиконовую мембрану порта, позволяют вводить инфузионный раствор в резервуар, не повреждая силиконовую мембрану. Далее препарат попадает через катетер в кровоток или полость, в зависимости от вида порт-системы и места расположения катетера.
Порт- система полностью скрыта под кожей. Поэтому она подходит для длительного использования, не обременяет пациента и не мешает проведению гигиенических процедур. Необходимо помнить, что при отсутствии использования порт-систему необходимо промывать как минимум 1 раз в 2 месяца.
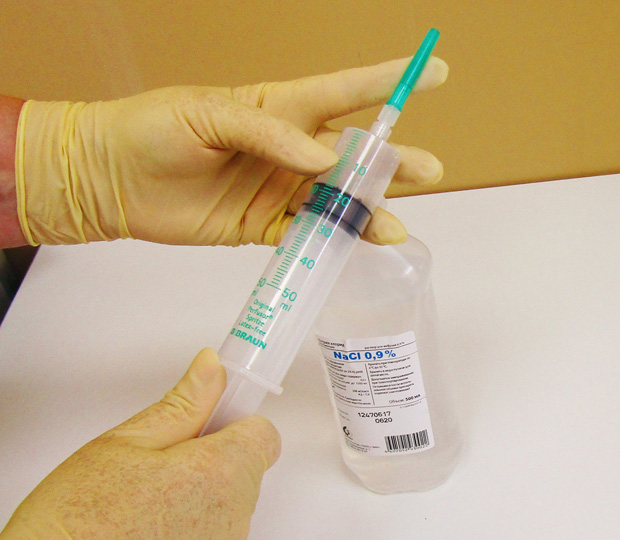
Подготовка к химиотерапии
Химиотерапия – это лечение ядами, поэтому врач перед проведением терапии требует выполнить большой список анализов и обследований для мониторинга функционирования различных органов и выбора схемы лечения. Желательно еще до начала химиотерапии пройти курс лечения всех хронических очагов инфекции: кариеса, хронического гастрита и прочих.
Чтобы не было проблем с поиском вен и установкой катетера за день до химиотерапии желательно выпить 1,5-2 литра жидкости.
Для тренировки вен рекомендуется периодически сжимать кистевой эспандер по 10 мин 3 раза в день или до усталости. При этом рука должна быть свешена ниже уровня сердца.
В день проведения ХТ нужно держать руки в тепле, возможно применение теплых обертываний на места инъекций. Можно периодически обрабатывать руки теплыми полотенцами.
Во время прохождения химиотерапии
В день химиотерапии, с утра необходимо позавтракать.
Далее необходимо соблюдать несколько несложных правил:
Об осложнениях после химиотерапии читайте здесь.
Возможно ли повысить эффективность химиотерапии?
Поиск основных направлений повышения эффективности терапии опухолей осуществляется в разных направлениях:
- разработка препаратов нового типа, в частности таргетной терапии, избирательно действующих на опухолевые клетки;
- разработка комбинированного применения двух и более препаратов — полихимиотерапии;
- совершенствование химиотерапии как этапа комбинированного лечения опухолей;
- применение иных лекарств для уменьшения побочного действия химиотерапии;
- доработка методик применения препаратов — дозирования, режима.

Авторская публикация:
ЯНЧИЙ МАРИНА НИКОЛАЕВНА
врач-онколог отделения краткосрочной химиотерапии
НМИЦ онкологии им Н.Н. Петрова Минздрава России
Лекарственная терапия инфекций. Химиотерапия инфекционных заболеваний
Чтобы правильно и успешно использовать весь богатейший арсенал лекарственных средств при лечении инфекционных больных, необходимо руководствоваться научной методологией лечения, основанной на современном понимании инфекционного процесса при каждой нозоформе В этой области накопилось очень много новых данных которые требуют от врача их осмысления и рационального использования у постели больного, не забывая при этом об опасностях которые подстерегают и больного, и врача при назначении каждого нового лекарственного средства.
Назначая тот или иной лекарственный препарат этиотропного действия следует отказаться от бытовавших многие десятилетия представлений об их стерилизующем действии (П. Эрлих) или, напротив только о стимулирующем влиянии их на защитные силы организма (П. Брихер, Д. Л. Романовский) благодаря чему достигается лечебный эффект Надо помнить что химиопрепараты обладают бактериостатическим действием а не бактерицидным, и достижение выздоровления (саногенез) при назначении антибактериальных лекарственных средств обусловлено несомненным участием защитных сил макроорганизма.
При лечении инфекционного больного следует всячески использовать защитный потенциал организма для усиления лекарственного воздействия другими препаратами на процессы саногенеза (комбинированная терапия) При этом в зависимости от стадии болезни следует отдавать предпочтение препаратам того или иного действия В начале болезни необходимо назначение лекарственных средств этиотропного действия и дезинтоксикационных средств Этиотропная терапия должна строго соответствовать острому периоду болезни и не иметь продолжения без достаточного на то обоснования Так, антитоксические сыворотки, применяемые при дифтерии ботулизме, столбняке, анаэробной гангрене, оказывают прекрасное лечебное действие, снижая специфическую интоксикацию, только в начальном периоде болезни (желательно их введение в 1-й день) в более поздний период, когда токсины уже вызвали поражение соответствующих тканей и органов введение АТ-сывороток бессмысленно Прежде врачи сравнивали действие специфических АТ-сывороток с водой при пожаре которая спасает только то, что еще не успело сгореть.
Оказалось неэффективным и лечение бактерионосительства при кишечных и других инфекциях (брюшной тиф, дизентерия и др ) несмотря на чувствительность возбудителя к применяемым с этой целью лекарственным препаратам Неэффективность антибактериальной терапии для лечения бактериовыделителей (продолжающееся выделение возбудителя после стихания клинических проявлений), так называемого острого постинфекционного бактериовыделения и особенно хронических бактерионосителей (продолжающегося бактериовыделения после 3 мес от начала клинического выздоровления) объясняется тем, что в основе бактерионосительства лежат глубокие механизмы чаще всего связанные с несовершенством иммунологических реакций организма, не позволяющих ему очиститься от возбудителя; нельзя исключить при этом роли иммуногенетических факторов, включая антигенную мимикрию.
Долгое время обсуждалось место экспериментальной химиотерапии в клинике. Нередко данным эксперимента отводилась роль примата в построении этиотропного лечения многих инфекционных болезней, что следует признать ошибочным, так как последняя инстанция оценки эффективности химиопрепарата - это клиническая практика, основанная на репрезентативных данных. Большое значение в клинике имеет правильная оценка феномена резистентности микроба-возбудителя к химиопрепаратам. Многочисленные клинические исследования, проведенные при лечении дизентерии, брюшного тифа и других болезней, включая гонорею и сифилис, показали, что между лекарственной чувствительностью и эффективностью терапии нет параллелизма.
При высокочувствительных штаммах возбудителя лечебный эффект может быть хуже, чем при лекарственно-устойчивых. Путем глубокого анализа взаимодействия микроба -лекарственного препарата - макроорганизма пришли к согласованному выводу, что химиотерапия нечто большее, чем действие только на микроба-возбудителя. Применяя химиотерапию, как подчеркивал А.Ф. Билибин, мы воздействуем не только на микроб и макроорганизм, а на их взаимодействие, которое динамично, пластично, опосредовано и неодинаково на разных стадиях инфекционного процесса. В этом смысле задача врача при лечении инфекционных болезней химиопрепаратом состоит также в том, чтобы находить адекватные лечебные подходы к выбору стимулирующих иммунные силы организма лечебных средств и методов. В конечном итоге это и будет определять индивидуальный подход к лечению конкретного инфекционного больного, а не инфекционной болезни.
На этом лечебном принципе горячо настаивали классики отечественной медицины (Мудров, Боткин, Захарьин, Пирогов, Остроумов и др.).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Острые респираторные вирусные инфекции (ОРВИ), включая грипп, составляют основную часть всей мировой инфекционной заболеваемости и, несмотря на огромное к ним внимание, продолжают являться нерешенной проблемой. Эпидемии гриппа остаются непредсказуемыми, а время их возникновения и структура очередного штамма вируса практически непрогнозируемы. Больше всего от гриппа страдают дети и пожилые люди, а также хронические больные. Вместе с тем, как показала вспышка, обусловленная пандемическим вирусом A/California/04/2009 (H1N1), группой риска могут стать и лица среднего возраста, а также отдельные специфические контингенты: беременные, лица с рядом сопутствующих заболеваний (сахарный диабет, ожирение и т.д.). Характеризуя эпидемиологическую ситуацию в мире и России, необходимо иметь в виду, что данные заболеваемости обычно являются заниженными, это, в первую очередь, связано с низкой обращаемостью населения за медицинской помощью. На самом деле в период подъема заболеваемости простудные заболевания в той или иной форме переносит подавляющая часть населения, особенно его активная составляющая.
По данным ВОЗ, в 6% случаев грипп является причиной летальных исходов, около 60% случаев смерти связано с вирус-ассоциированными респираторными болезнями. Непосредственной причиной смерти обычно является развитие на фоне вирусной респираторной инфекции тяжелых осложнений, таких как пневмонии, бронхиты, синуситы, отиты, энцефалопатия, бронхиальная астма. Во время эпидемий гриппа смертность от соматических (неинфекционных) заболеваний существенно повышается, причем до 50% избыточной смертности приходится на сердечно-сосудистые заболевания и 15-20% на болезни легких и злокачественные новообразования. Особое место среди осложнений занимает так называемый синдром послевирусной астении, который может развиваться у 65% больных в течение 1 месяца от начала инфекции.
Низкая эффективность современных методов борьбы с гриппом и ОРВИ обусловлена целым рядом причин: убиквитарность, скорость распространения, массовость поражения; высокая контагиозность вирусов и чувствительность макроорганизма к инфицированию; полиэтиологичность возбудителей и смешанный характер инфекций; уникальная изменчивость антигенных свойств вирусов, особенно гриппа; быстро развивающая резистентность к препаратам; развитие вторичного иммунодефицита; узкая специфичность действия большинства этиотропных лекарственных препаратов и нерациональная фармакотерапия.
В структуре мер, направленных на улучшение ситуации по ОРВИ и гриппу, одно из важнейших составляющих - это рациональная фармакотерапия и профилактика, которая подразумевает комплексный и системный подход с учетом периода эпидемии. На первом, предэпидемическом этапе особую значимость приобретает комплекс санитарно-оздоровительных мероприятий, средства специфической профилактики (вакцинация) и применение препаратов, повышающих неспецифическую резистентность организма (иммунокорректоры, адаптогены, поливитамины). Во время эпидемического подъема заболеваемости ведущую роль начинают играть этиотропные препараты, которые становятся средствами первой линии защиты и обладают прямым и ингибирующим действием на репродукцию вирусов. Основными требованиями, которые предъявляются к данным средствам являются: широкий спектр противовирусной активности, низкая токсичность, хорошее проникновение в мозговую ткань, отсутствие отрицательного влияния на иммунитет; подавление размножения вируса, сочетаемость с другими лекарственными средствами, доступность, удобные формы применения, высокая комплаентность. Также большое значение имеет и обоснованное использование иммунокорригирующих средств, особенно индукторов интерферона. При появления типичных симптомов гриппа или ОРВИ, уже в первые 24-48 ч необходимо использовать средства, предназначенные для интенсивной терапии (химиопрепараты и индукторы интерферона) наряду с симптоматической терапией (противокашлевые, жаропонижающие, бронхолитические, антигистаминные препараты).
Останавливаясь на этиотропных средствах для лечения ОРВИ и гриппа необходимо отметить, что имеется целый ряд средств, которые потенциально действуют на различные этапы взаимодействия вируса и клетки: часть из них подавляет внеклеточные вирионы, другие препятствуют проникновению вируса внутрь клетки, третьи ингибируют процессы репликации, сборки вирусов на различных этапах и выход вируса из клетки. Вместе с тем, круг препаратов, с реальной и достаточной противовирусной активностью, отвечающий вышеуказанным требованиям, прошедший многоцентровые клинические исследования и рекомендованный во всем мире к практическому применению крайне ограничен. К данным препаратам относятся ингибиторы нейраминидазы (осельтамивир, занамивир), блокаторы М2-белка гриппа А (амантадин, римантадин) и новый препарат Ингавирин ® .
Одно из больших достижений в области фармакотерапии гриппа - это создание таких препаратов, как осельтамивир и занамивир. Оба препарата блокируют ключевой фермент репликации вирусов гриппа А и В-нейраминидазу. При ингибировании данного фермента нарушается способность вируса проникать в здоровые клетки, нарушается выход вирионов из инфицированной клетки, что приводит к ограничению распространения инфекции в организме. Препараты характеризуются системностью действия, относительно медленным формированием резистентности, их применение резко снижает развитие вторичных бактериальных осложнений.
С конца 60-х годов XX века известны такие химиопрепараты как римантадин (мидантан) и амантадин. В педиатрической практике применяется римантадин в сиропе со специальным матричным носителем, усиливающим противовоспалительное действие римантадина и снижающим его токсичность (альгирем). Римантадин используется как для профилактики, так и для лечения гриппа А в период эпидемий у взрослых и детей от 2-х лет и старше. Противовирусный эффект римантадина реализуется путем ингибирования синтеза М-белка вируса гриппа, при этом нарушается процесс репродукции и сборки полноценных вирионов. Опыт массового применения в течение последних 20 лет показал его эффективность, особенно при раннем назначении в первые дни заболевания. Тем не менее, высокая токсичность и быстрое развитие устойчивости вирусов к римантадину существенно ограничивают его применение.
Известный российский препарат Арбидол ® (подавляет слияние липидной оболочки вируса с мембранами эндосом) показал меньшую противовирусную эффективность в отношении вируса гриппа в эксперименте, вместе с тем, он обладает иммуномодулирующими потенциями.
Необходимо отметить, что ингибиторы нейраминидазы и блокаторы M2-белка имеют узкий спектр действия и проявляют противовирусное действие только в отношении вирусов гриппа (или даже отдельных видов гриппа). И ингибиторы нейраминидазы и амантадин применяются для профилактики и лечения уже более 20-40 лет. Особенности механизмов антивирусной активности данных препаратов, наряду с длительным периодом использования, обуславливают формирование резистентности вирусов гриппа к данным средствам и при их назначении необходимо всегда учитывать актуальный циркулирующий штамм вируса и его устойчивость к противовирусным медикаментам.
Создание новых средств для лечения гриппа крайне важная и сложная задача современной медицины. В свете этого крайне важным, особенно с учетом последней пандемии гриппа, является появление на рынке противовирусного препарата Ингавирин ® , активного в отношении вирусов, вызывающих ОРВИ, таких как грипп А, В, парагрипп, аденовирус и респираторно-синцитиальный вирус, который является синтетическим аналогом эндогенного псевдопептида, выделенного из тканей морского моллюска Aplysia californica. Механизм противовирусного действия Ингавирина ® заключается в нарушении конформационного созревания и задержки миграции синтезированного нуклеокапсидного белка вируса гриппа из цитоплазмы в ядро. К настоящему времени завершен весь необходимый цикл исследований, предваряющий появления лекарственного средства на рынке. Так, результаты экспериментального изучения противовирусной активности Ингавирина ® в отношении вирусов гриппа А и В в культуре клеток и на лабораторных животных свидетельствуют о высокой лечебной и профилактической эффективности препарата при экспериментальной гриппозной инфекции белых мышей, вызванной вирусом A(H3N2) A(H1N1sw1), A(H5N1) и B.
Особенно важными представляются результаты, полученные при оценке эффективности Ингавирина ® в отношении возбудителей аденовирусной инфекции. Подавление репродукции аденовируса в культуре клеток открывает дальнейшие перспективы для практического использования препарата после проведения необходимых исследований.
В эксперименте проведено изучение хронической и специфической токсичности субстанции Ингавирина ® . Результаты показали, что активное вещество Ингавирина ® не обладает токсическим эффектом, канцерогенным и мутагенным действием. При доклиническом изучении субхронической токсичности лекарственной формы Ингавирина ® на кроликах не отмечено каких-либо изменений в поведении и общем состоянии животных, не выявлено патологических изменений гематологических и биохимических показателей, в структуре внутренних органов, местно-раздражающее действие отсутствовало.
При изучении интерферонового статуса у добровольцев показано, что Ингавирин ® обуславливает повышение содержания интерферона в крови до физиологической нормы, стимулирует и нормализует сниженную α-интерферон продуцирующую способность лейкоцитов крови, стимулирует γ-интерферон продуцирующую способность лейкоцитов. Вызывает генерацию цитотоксических лимфоцитов и повышает содержание NK-T клеток, обладающих высокой киллерной активностью по отношению к трансформированным вирусами клеткам и выраженной противовирусной активностью.
Безопасность и переносимость препарата изучена в первой фазе клинических исследований у 15 здоровых добровольцев при однократном приеме препарата Ингавирин ® в дозе 90 мг. Значимых нежелательных явлений в течение первых суток и в отдаленный период после приема препарата не отмечалось.
Существенным преимуществом Ингавирина ® в сравнении с ингибиторами нейраминидазы является его более высокая комплаентность (препарат принимается перорально однократно в сутки). Нельзя, конечно, забывать и о медико-экономических аспектах использования лекарственных средств, и в этом отношении превосходство Ингавирина ® над ингибиторами нейраминидазы неоспоримо.
Диагноз - грипп A/H1N1/California/04/2009- SW подтвержден 29.11.2009 г. методом ПЦР с назального смыва.
29.11.2009 г. назначен Ингавирин ® по 90 мг 1 раз в сутки курсом на 5 дней. Через 24 ч от начала лечения температура снизилась до субфебрильной, головная боль, боли в костях и мышцах практически исчезли. Слабость значительно уменьшилась. Заложенность носа и кашель на 3-и сутки лечения исчезли. Утром 02.12.2009 г. по окончании лекарственной терапии жалоб на состояние здоровья больной не предъявлял. Развития осложнений не отмечено и больной выписан на 6-е сутки пребывания в стационаре в удовлетворительном состоянии.
Заключая краткий анализ химиотерапевтических средств, используемых для лечения ОРВИ и гриппа, необходимо отметить, что, на наш взгляд, эффективная стратегия по борьбе с ОРВИ и гриппом предполагает комплексный подход к проблеме с использованием вакцинации для выработки специфического иммунитета, индукторов интерферона для мобилизации неспецифической системы защиты и, наконец, этиотропных химиопрепаратов для завершения процесса ингибирования репликации вируса с учетом актуальных штаммов вируса и их резистентности, а также медико-экономических составляющих.
Коронавирус и иммунитет: в чем опасность для здорового человека?
Большинство патогенных микроорганизмов, вызвавших недавние известные эпидемии с высоким уровнем летальности у людей, являются зоонозами, т.е. паразитируют в организме определённых видов животных. Многие из этих вирусов, включая Coronaviruses, нередко инициируют дисрегулированный (т.е. неправильный) иммунный ответ у человека. Следствие этого ‒ возникновение воспалительных реакций и повреждение тканей. Природный резервуар большинства патогенов ‒ летучие мыши. При этом рукокрылые – просто хозяева вируса и толерантны к нему.
Иммуносупрессия и коронавирус: высока ли вероятность летального исхода?
Вернемся к онкологическим пациентам, которые получают иммунокомпрометированное лечение, т.е. в результате терапии имеют угнетенный иммунитет. Если верить вышесказанному, им не грозит тяжелое течение коронавируса, поскольку у них слабый иммунный ответ.
В 21 веке человечество уже дважды сталкивалось с инфекциями, вызываемыми вирусами семейства Coronaviruses. Поэтому сейчас можно проанализировать опыт прошлых лет и узнать – входят ли пациенты с иммуносупрессией в группу риска тяжелого течения COVID-19.
В конце 2002 года произошла вспышка тяжелого острого респираторного синдрома, вызванная вирусом SARS Coronavirus (SARS-CoV). SARS характеризуется атипичной острой пневмонией. Эпидемия закончилась в июле 2003 года, оставив после себя в общей сложности 8096 инфицированных и 774 погибших (9,5%) в более чем 30 странах. Согласно данным ВОЗ летальность от SARS-CoV составила менее 1% у лиц в возрасте 24 лет и старше, 6% ‒ у лиц в возрасте 25-44 лет, 15% ‒ у лиц в возрасте 45-64 года и более 50% у лиц в возрасте 65 лет и старше. Факторами риска инфекции были признаны: контакт с больным, пожилой возраст, мужской пол и наличие сопутствующих заболеваний. В целом, у 48 детей до 12 лет были диагностированы минимальные симптомы инфекции (лихорадка, кашель, слизистые выделения из носа), ни один случай заражения ребенка не сопровождался дыхательными нарушениями и не потребовал искусственной вентиляции легких. Врачи были обеспокоены ситуацией с пациентами, находящимися на иммуносупрессивной терапии, ожидая самого худшего. Но ни одного летального исхода у этих больных зафиксировано не было.
Анализ опубликованных данных показывает, что иммуносупрессия у людей любого возраста не является фактором риска при тяжелых коронавирусных инфекциях. А отсутствие летальных исходов у пациентов после трансплантации печени и химиотерапии и имеющих глубокую миелосупрессию, доказывает постулат иммунотолерантности этих больных к семейству вирусов Coronaviruses.
Так нужно ли приостановить лечение рака во время пандемии коронавируса?
Во многих источниках, касающихся COVID-19 инфекции и онкологического статуса пациента, нет полной информации о факторах риска вирусного заражения. И, вероятнее всего, смерти связаны не с онкологическим заболеванием и его лечением, а именно, с возрастом и наличием сопутствующих хронических заболеваний у инфицированного.
Не откладывайте лечение рака из-за коронавируса
Предварительный опыт в Бергамо (где около 700 детям была выполнена трансплантация печени, 3 из них ‒ за последние два месяца, и все они находились на иммуносупрессивной терапии) показывает: ни у одного из больных не было клинической картины пневмонии, и это несмотря на то, что у трех детей были получены положительные тесты на SARS-CoV-2. Авторы предполагают, что, вероятнее всего, иммуносупрессированные дети являются просто носителями вируса.

На основании анализа вспышек коронавируса в прошлом и в настоящем можно сделать вывод, что пациенты, продолжающие иммуносупрессивную терапию, по сравнению с населением в целом не подвергаются повышенному риску тяжелой формы легочной инфекции COVID-19. У детей до 12 лет независимо от их иммунного статуса коронавирусная пневмония не развивается вовсе. Они просто являются носителями инфекции.
Автор статьи призывает не отменять и не откладывать жизненно важные методы противоопухолевого и другого иммуносупрессивного лечения как у детей, так и у взрослых.
- D’Antiga L. Coronaviruses and immunosuppressed patients. The facts during the third epidemic. Liver Transpl. 2020 Mar 20. doi: 10.1002/lt.25756.
- Henry B.M., Lippi G., Plebani M.. Laboratory abnormalities in children with novel coronavirus disease 2019. Clin Chem Lab Med. 2020 Mar 16. doi: 10.1515/cclm-2020-0272.
- Lai C.C., Liu Y.H., Wang C.Y., Wang Y.H., Hsueh S.C., Yen M.Y., Ko W.C., Hsueh P.R. Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths. J Microbiol Immunol Infect. 2020 Mar 4. pii: S1684-1182(20)30040-2. doi: 10.1016/j.jmii.2020.02.012.
- Li Y., Guo F., Cao Y., Li L., Guo Y. Insight into COVID-2019 for pediatricians. Pediatr Pulmonol. 2020 Mar 18. doi: 10.1002/ppul.24734.
- Liang W, Guan W, Chen R, Wang W, Li J, Xu K, Li C, Ai Q, Lu W, Liang H, Li S, He J. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020 Mar;21(3):335-337. doi: 10.1016/S1470-2045(20)30096-6.
- Lu X., Zhang L., Du H., Zhang J., Li Y.Y., Qu J., Zhang W., Wang Y., Bao S., Li Y., Wu C., Liu H., Liu D., Shao J., Peng X., Yang Y., Liu Z., Xiang Y., Zhang F., Silva R.M., Pinkerton K.E., Shen K., Xiao H., Xu S., Wong G.W.K. SARS-CoV-2 Infection in Children. N Engl J Med. 2020 Mar 18. doi: 10.1056/NEJMc2005073.
- Ludvigsson J.F. Systematic review of COVID-19 in children show milder cases and a better prognosis than adults. Acta Paediatr. 2020 Mar 23. doi: 10.1111/apa.15270.
- Zheng F., Liao C., Fan Q.H., Chen H.B., Zhao X.G., Xie Z.G., Li X.L., Chen C.X., Lu X.X., Liu Z.S., Lu W., Chen C.B., Jiao R., Zhang A.M., Wang J.T., Ding X.W., Zeng Y.G., Cheng L.P., Huang Q.F., Wu J., Luo X.C., Wang Z.J., Zhong Y.Y., Bai Y., Wu X.Y., Jin R.M. Clinical Characteristics of Children with Coronavirus Disease 2019 in Hubei, China. Curr Med Sci. 2020 Mar 24. doi: 10.1007/s11596-020-2172-6.


Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА ,
Заведующий детским онкологическим отделением, врач-детский онколог, ведущий научный сотрудник, профессор, главный внештатный детский специалист-онколог Комитета по здравоохранению Санкт-Петербурга
Читайте также:

