Какими свойствами обладает противовирусный иммунитет
Обновлено: 25.04.2024
Для цитирования: Чувиров Г.Н., Маркова Т.П. Актуальные вопросы противовирусной терапии. РМЖ. 2002;3:115.
ГНЦ Институт иммунологии ФУ МБиЭП при МЗ РФ
ГОУ Институт повышения квалификации ФУМБиЭП при МЗ РФ
В настоящее время вопросы противовирусной терапии сформировались в самостоятельный раздел знаний, представляющих большой интерес для врачей, сталкивающихся с распространенными вирусными инфекциями (грипп, герпетическая инфекция, гепатит, ВИЧ-инфекция и др.), количество которых постоянно растет.
К началу XXI века открыто и детально исследовано более 500 вирусов, вызывающих различные заболевания (грипп, цитомегаловирусная инфекция, энцефалит, корь, синдром хронической усталости и др.). В последние годы показана роль вирусов в этиологии системных и аутоиммунных заболеваний (системная красная волчанка, рассеянный склероз, аутоиммунный тиреоидит, склеродермия), онкологических заболеваний (лимфома Беркитта, рак гортани, назофарингеальная карцинома ) и аллергических заболеваний (отек Квинке, рецидивирующая крапивница) [1].
Для противовирусной терапии в настоящее время применяются: химиопрепараты (этиотропные средства), действующие непосредственно на вирусы; иммуномодуляторы, корригирующие нарушения иммунитета, возникающие вследствие вирусных инфекций; симптоматические средства, оказывающие воздействие на общие симптомы вирусных заболеваний (температура, болевой синдром, кашель); патогенетические средства, используемые при интоксикации, обезвоживании, аллергических реакциях 2.
Клинический опыт показывает, что наилучшие результаты в лечении вирусных заболеваний достигаются при использовании всего арсенала перечисленных выше средств. Однако на практике в лечении вирусных заболеваний наиболее часто используются патогенетические и симптоматические средства, тогда как химиопрепараты и иммуномодуляторы еще не заняли ведущего места в терапии вирусных инфекций [2,5].
Механизм их действия состоит в подавлении отдельных звеньев репродукции вирусов. Так, на внеклеточные вирионы оказывают действие алпизарин, левамизол, бонафтон, оксалин, теброфен; на стадию адсорбции вирионов на клетке-мишени и проникновение в клетку - ремантадин, анти-gp120, рекомбинантные молекулы CD4; на синтез вирусных нуклеиновых кислот – азидотимидин, видарабин, ганцикловир, идоксиуридин, цитарабин, фамцикловир; на стадию синтеза вирусных белков - интерфероны (ИФН) I типа и ингибиторы протеаз; на стадию выхода вирионов из клетки - ИФН I типа.
Арбидол обладает интерферон-индуцирующими свойствами, прямым противовирусным действием, иммуномодулирующим эффектом и антиоксидантной активностью. Механизм его антивирусного действия связан с ингибированием трансляции вирусспецифических белков в инфицированных клетках, в результате чего подавляется репродукция вирусов.
Арбидол активен в отношении вирусов гриппа А и В, повышает гуморальные и клеточные реакции иммунитета, устойчивость организма к инфекциям; повышает общее количество Т-лимфоцитов и Т-хелперов при их исходном снижении и практически не влияет на него у лиц с нормальным функционированием клеточного звена иммунитета. Под влиянием препарата увеличивается общее количество макрофагов с поглощенными бактериями, повышается фагоцитарное число.
Арбидол снижает риск заболевания гриппом и ОРВИ в 7,5 раз, предупреждает развитие постгриппозных осложнений, снижает частоту обострений хронических заболеваний.
В настоящее время установлен спектр антивирусной активности химиопрепаратов, используемых при лечении герпетической инфекции, ВИЧ-инфекции, гриппа, ОРВИ, парагриппа, гепатитов В, С, D, аденовирусной инфекции и ветряной оспы. Спектр вирусных заболеваний, при которых разработана и применяется эффективная противовирусная терапия, представлен в табл. 1.
К недостаткам химиопрепаратов относится узкий спектр действия и формирование резистентных штаммов вирусов. Например, часто встречаемая устойчивость к ацикловиру связана с модификацией структуры тимидинкиназы и мутацией генов, кодирующих структуры ДНК-полимеразы 4.
Интерфероны
Синтез ИФН является одной из первых защитных реакций организма на проникновение вирусов в организм, при этом ИФН предотвращает диссеминацию вирусной инфекции. Противовирусный иммунитет зависит от индивидуальных особенностей иммунной системы и конкретного вирусного агента. При острых вирусных инфекциях (оспа, грипп, полиомиелит и др.) после инфицирования клеток-мишеней они гибнут, что может привести к гибели организма. При латентных (хронических, медленных) инфекциях ДНК или РНК-вирусы персистируют в геноме клеток хозяина, не оказывая специфического воздействия. На активацию вирусной инфекции влияет множество факторов – возраст, характер питания, биоритмы, сезонность, психоэмоциональные воздействия и др. При этом довольно часто происходит мутация вирусного штамма, что приводит к снижению иммунологической резистентности и неэфективности противовирусной терапии [2, 3, 7].
ИФН впервые описаны более 40 лет назад. За эти годы накоплено большое количество данных о физико-химических и биологических свойствах, определено химическое строение основных типов и субтипов ИФН [8, 9]. Разработаны биотехнологические методы получения ИФН.
Официнальные препараты включают a -, b - и g -ИФН и подразделяются на рекомбинантные и природные. Механизм противовирусного действия альфа- и бета-ИФН заключается в подавлении синтеза белков вирусов и блокаде выхода вирионов из клетки. g -ИФН непосредственно воздействует на клетки иммунной системы (Т, ЕК-клетки, макрофаги, гранулоциты) и усиливает экспрессию антигенов главного комплекса гистосовместимости.
Наиболее широко в клинической практике используются природные ИФН:
a -ИФН (человеческий лейкоцитарный ИФН, лейкинферон),
b -ИФН (человеческий фибробластный ИФН, ферон),
g -ИФН (человеческий иммунный ИФН).
В последние годы разработаны рекомбинантные ИФН:
a -2А (реаферон, реальдирон, роферон А)
a -2В (интрон А, виферон)
b -ИФН (бетаферон)
g -ИФН (гаммаферон).
Спектр заболеваний, при которых показана терапия ИФН:
- ВИЧ-инфекция (интрон А, реальдирон, роферон А);
- гепатит В (роферон А, интрон А, виферон, берофор, гаммаферон, реальдирон);
- гепатит С (роферон А, интрон А, реальдирон);
- гепатит D (интрон А, реальдирон);
- герпетическая инфекция (роферон, интрон А, реальдирон, лейкинферон, берофор);
- аденовирусная инфекция (лейкинферон, бетаферон, реальдирон);
- ОРВИ (человеческий лейкоцитарный ИФН, лейкинферон);
- папилломавирусная инфекция (роферон, интрон А, гаммаферон, лейкинферон);
- рассеянный склероз (бетаферон, реальдирон);
- цитомегаловирусная инфекция (лейкинферон, реальдирон, интрон А, виферон).
- сердечно-сосудистая система (отеки, гипертонические кризы, аритмия),
- желудочно-кишечный тракт (тошнота, рвота, диарея, анорексия, боли в животе),
- центральная нервная система (головные боли, нарушения сна, депрессия, нейропатия, тремор мышц),
- мочевыводящая система (протеинурия, альбуминурия),
- кожа (зуд, гиперемия, выпадение волос),
В связи с побочными явлениями при назначении ИФН необходимо использовать симптоматическую терапию [2,4,8].
Индукторы выработки интерферона
Среди противовирусных препаратов особое место занимают индукторы выработки эндогенного ИФН, группа которых разнородна по составу. Выделяют синтетические препараты (амиксин, циклоферон, полудан, неовир, амплиген) и природные соединения (мегосин, кагоцел, ридостин, рогасин, саврац). Клинические испытания показали широкий диапазон их противовирусной и иммуномодулирующей активности. Механизм противовирусной активности полностью совпадает с воздействием экзогенных ИФН, при этом у индукторов выработки ИФН есть ряд преимуществ:
- не обладают антигенностью
- не дают симптомов передозировки
- вызывают продукцию ИФН в необходимых терапевтических дозах
- дешевле препаратов ИФН.
Эффективность индукторов выработки ИФН показана при ряде вирусных заболеваний:
амиксин - при герпетической инфекции, гриппе, ОРВИ, гепатитах, энцефалите;
кагоцел - при гриппе, ОРВИ, гепатитах;
неовир - при герпетической инфекции, ОРВИ;
полудан - при герпетической инфекции;
ридостин - при гриппе, ОРВИ, бешенстве;
рогасин - при гепатите А, В;
соврац - при ОРВИ, гепатите А, энтеровирусных инфекциях.
В последнее время в лечении вирусных инфекций используют иммуномодуляторы (ИМ), которые корригируют нарушения в иммунной системе. ИМ воздействуют на определенные клетки иммунной системы, часто вызывают каскад выработки цитокинов. Спектр ИМ постоянно расширяется, так как многие химические соединения обладают способностью воздействовать на различные звенья иммунной системы (химиопрепараты, ИФН и индукторы их выработки, витамины, гормоны, микроэлементы и др.) [9, 10]. Различают эндогенные (цитокины, ИФН, фактор некроза опухоли (ФНО), эритропоэтин, миелопептиды), экзогенные (препараты, полученные с использованием антигенов и фрагментов вирусов, бактерий, простейших - зимозан, продигиозан, липополисахариды, эндотоксины и др.) и синтетические высоко- и низкомолекулярные ИМ (полинуклеотиды, вазодилататоры, аналоги нуклеиновых кислот, адаптогены, производные флуоренов, адамантанов, имидазолы и др.). Многие ИМ не могут широко применяться в клинической практике из-за токсичности, побочных явлений.
В настоящее время используют более 50 ИМ, прошедших контролируемые клинические испытания и разрешенных к применению Фармкомитетом Минздрава РФ [11]. В табл. 2 приведены механизмы действия широко распространенных ИМ 10.
Большой интерес вызывает применение иммуноглобулинов в комплексном лечении вирусных инфекций. Наиболее широко используют противогерпетический иммуноглобулин и противоцитомегаловирусный иммуноглобулин (цитотект).
Таким образом, лечение вирусных инфекций является важной и достаточно сложной задачей современной медицины. Учитывая мутацию вирусов, влияние на иммунную систему человека целого ряда факторов, увеличение заболеваемости, социально-экономическую значимость и развитие тяжелых осложнений, необходим комплексный подход к лечению вирусных инфекций.
1. Ершов Ф.И. Антивирусные препараты. М., Медицина, 1998.
2. The Merck Manual of diagnosis and therapy.// Rahway N.Y., 1998.
3. Bartlett Y.G. Pocket book of Infectious diesease therapy. Wilkins and Williams, 1996.
4. Spickett G.Oxford Handbook of clinical Immunology.// Oxford University Press Inc.New York, 1999.
5. Лазарева Д.Н., Алехин Е.К. Стимуляторы иммунитета. М., Медицина, 1985.
6. Лекарственные препараты в России.// Справочник Видаль, 2000.
7. Ершов Ф.И. Система интерферона в норме и при патологии. М., Медицина, 1995.
8. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. М., Медицина, 1991.
9. ЕршовФ.И.. Новохатский А.Р. Интерфероны и его индукторы. М., Медицина.-1980.
10. Машковский М.Д. Лекарственные средства.М., Медицина, 1993.
11. Кетлинский С.А., Симбирцев А.С., Воробьев А.А. Эндогенные иммуномодуляторы.Санкт-Петербург, Гиппократ, 1992.
12. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. М., ВНИРО, 1995.
13. Чувиров Г.Н. Эффективность применения полиоксидония у больных с рецидивирующей герпетической инфекцией // В кн. Сб.трудов.Современные проблемы аллергологии, клинической иммунологии и иммунофармакологии. Тез.докладов. М., 2001, 2, 412.
Особенности иммунитета при вирусных инфекциях. Патогенез противовирусного иммунного ответа.
Эффективная иммунизация организма против вирусных инфекций тесно связана с их пато- и иммуногенезом. Поэтому рациональное проведение вакцинации, а также максимальная ее эффективность требуют изучения иммунологических и патогенетических основ инфекционного процесса.
Выздоровление от вирусной инфекции обеспечивают, по крайней мере, три феномена:
1) подавление репродукции вируса и нейтрализация инфекционности вирионов;
2) разрушение инфицированных клеток;
3) образование интерферона.
Иммунный цитолиз инфицированных вирусом клеток является существенным фактором в выздоровлении от вирусной инфекции, в основе которого лежат различные процессы, включающие Тц-клетки (антителозависимая, комплементзависимая цитотоксичность). Циркулирующие антитела играют важную роль в выздоровлении от многих генерализованных инфекций (пикорна-, тога-, флави-, парвовирусной и других инфекций). Менее важная роль Т-лимфоцитов связана с тем, что иммунодоминантные Тц-детерминанты часто находятся на консервативных белках, локализованных внутри вириона или на неструктурных вирусных белках, которые находятся только в инфицированных клетках.

При генерализованных инфекциях вирус могут нейтрализовать только те антитела, которые связываются с рецепторами поверхности вириона, которыми они прикрепляются к клетке и блокируют адсорбцию и проникновение вируса в клетку. Некоторые моноклональные антитела, не обладающие нейтрализующей активностью, могут способствовать выздоровлению — предположительно, благодаря антитело-зависимой клеточной цитотоксичности, комплемент-зависимому лизису антителами. В присутствии антител макрофаги могут поглощать и переваривать инфицированные вирусом клетки.
NK-клетки активируются интерфероном или непосредственно вирусными гликопротеинами. Они не обладают иммунологической специфичностью, но преимущественно лизируют клетки, инфицированные вирусом.
Ниже приведены основные примеры стратегии вирусов, направленные на преодоление или снижение иммунологического прессинга со стороны хозяина.
1. Репликация без цитопатогенного действия
Аренавирусы и хантавирусы, например, вызывают хронические инфекции у грызунов без гибели клеток, в которых они размножаются. Инфекция, как правило, не сопровождается заметными изменениями в организме. Ретровирусы также не вызывают изменений в клетках-мишенях, тканях и органах естественных хозяев.
2. Распространение от клетки к клетке путем сплавления мембран
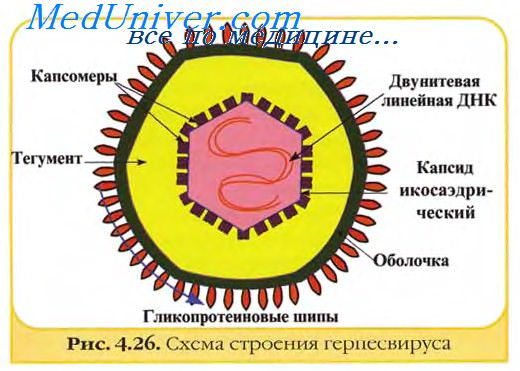
Лентивирусы, морбилливирусы и герпесвирусы (цитомегаловирусы) вызывают слияние клеток, обеспечивая передачу вирусного генома от клетки к клетке и избавляя его от влияния гуморальных иммунных механизмов хозяина.
3. Латентная непродуктивная инфекция непермиссивных клеток
Вирус может размножаться продуктивно в клетках одного типа и вызывать непродуктивную латентную инфекцию в клетках другого типа. Многие герпес-вирусы находятся в латентном состоянии в нервных ганглиях или В-лимфоцитах, но размножаются продуктивно и вызывают острые поражения эпителиальных клеткок слизистых. Пермиссивность клеток может зависеть от стадии дифференциации или активации. Например, папилломавирусы поражают базальные клетки эпителия в начале дифференцировки, но образуют инфекционные вирионы только в полностью дифференцированных клетках вблизи поверхности тела.
4. Частичная экспрессия вирусных генов
Латенция вирусов может поддерживаться ограниченной экспрессией генов, которая может убивать клетки. В течение латентной инфекции некоторые вирусы, такие как герпесвирусы, экспрессируют только ранние гены, которые необходимы для поддержания латенции. В течение реактивации, которую часто стимулирует иммуносупрессия и/или действие цитокинов или гормонов, полный вирусный геном транскрибируется снова. Эта стратегия в течение латентного состояния защищает вирус от всех иммунных механизмов организма.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Типы гуморального иммунного ответа при вирусной инфекции. Иммуноглобулин A.
Иммунная система организма на вирусные инфекции или иммунизацию вирусными вакцинами отвечает выработкой антител, обладающих специфичностью к различным вирусным компонентам и принадлежащих к разным классам иммуноглобулинов.
Важнейшая биологическая функция иммуноглобулинов - специфическое связывание с антигеном. Антитела против некоторых эпитопов на поверхности вирионов нейтрализуют инфекционность, они могут также действовать как опсонины, облегчая поглощение и разрушение макрофагами. Кроме того, антитела могут прикрепляться к вирусным антигенам на поверхности инфицированных клеток, вызывая их разрушение вследствие активации классического или альтернативного действия комплемента или с помощью активации Fc-рецепторсвязывающих клеток, таких как NK-клетки, полиморфноядерные лейкоциты и макрофаги (антителозависимая цитотоксичность).
Различают четыре основных класса антител: два мономера IgG и IgE и два полимера IgM и IgA. Все иммуноглобулины имеют подобную структуру, но широко варьируют по аминокислотной последовательности антигенсвязывающего сайта, который определяет их специфичность для данной антигенной детерминанты. N-концевая последовательность L- и Н-цепей образует антигенсвязывающий центр, то есть антидетерминанту. Чем больше антидетерминант на поверхности иммуноглобулина, тем выше его активность.
Авидность характеризует прочность связи антитела с соответствующим антигеном. Афинность - прочность связи между отдельными антидетерминантами и детерминантами.
IgG является основным классом антител в крови. Он состоит из двух Н- и L-цепей, каждая из которых содержит постоянные и вариабельные участки. Молекулы IgG содержат два идентичных антигенсвязывающих Fab-фрагмента и Fc-фрагмент, выполняющий эффекторные функции (связывание комплемента, прикрепление к фагоцитам и плацентарному или колостральному трансферу).
В результате системной вирусной инфекции IgG синтезируется в течение длительного периода и является главным фактором защиты от реинфекции. Субклассы IgG отличаются константной областью их V-цепей и, соответственно, биологическими свойствами, такими как фиксация комплемента и прикрепление к фагоцитам.
Первоначально антитела относятся к классу IgM, но соматические рекомбинации (транслокации) затем рождают класс, обусловленный связыванием V-генных сегментов различными постоянными участками Н-цепей. В изменении изотипов (переход изотипов на другой путь) важная роль принадлежит различным цитокинам. Таким образом, через несколько дней IgG , IgA и иногда IgE-антите-ла той же самой специфичности становятся доминантными в иммунном ответе.
Тц-клетки достигают своего пика обычно через неделю после инфекции, а антитела — через 2—3 недели. NK-клетки максимально активируются через два дня, а активность интерферона совпадает с пиком концентрации вируса.
Динамика гуморального иммунного ответа проявляется, в первую очередь, в смене синтеза антител различных классов. В начальной фазе иммунного ответа синтезируется преимущественно IgM с относительно слабым сродством к антигену (авидный класс антител). IgM является пентамером с 10 Fab-фрагментами. Синтез IgM сменяется синтезом IgG, а затем IgA. IgM-антитела находятся в большинстве случаев в плазме крови и лимфе, обладая способностью преципитировать, агглютинировать и лизировать антигены.
Устойчиво высокие титры антител могут отражать также персистенцию вирусной инфекции (например, вирусов герпеса, кори) или повторную стимуляцию вирусным антигеном, однако антитела к некоторым вирусам могут персистировать и без явных признаков заболевания. IgG -антитела содержатся в сыворотке крови в наиболее высокой концентрации (~12г/л), откуда они поступают в тканевую жидкость. В отличие от других иммуноглобулинов, у человека и приматов они способны проникать через плаценту и снабжать плод материнскими антителами. Период полураспада их равен 10-35 дням.
Иммуноглобулин A (IgA) является димером с 4 Fab-фрагментами. Проходя через эпителиальные клетки, IgA приобретает J-фрагмент (секреторный фрагмент), становясь секреторным slgA, который секретируется через эпителий респираторного, кишечного и урогенитального трактов. Секреторный IgA более устойчив к протеазам, чем другие иммуноглобулины, и является основным иммуноглобулином на слизистых поверхностях, в молозиве и молоке многих видов млекопитающих. Поэтому IgA-антитела играют важную роль в защите от инфекции респираторного, кишечного и урогенитального трактов. Иммунизация через слизистые при некоторых инфекциях является более эффективной, чем системное введение вакцины.
Секреторные антитела появляются на 4-7-й день после инфицирования и представлены в основном IgA, IgG и IgM. Они считаются менее специфичными, чем сывороточные. Динамика накопления антител в сыворотке крови и секретах практически одинакова.
В отличие от сывороточного IgA, большая часть которого является мономером, молекула секреторного IgA представляет собой димер. Мономерный IgA синтезируется плазматическими клетками костного мозга, периферических лимфатических узлов, селезенки и других органов. Димерные формы sIgA с соединительной j-цепью синтезируются лимфоидной тканью желудочно-кишечного, респираторного и урогенитального трактов.
Добавочный структурный компонент секреторного IgA, вероятно, функционирует как поверхностный рецептор клеток секреторного эпителия и придает устойчивость sIgA к действию протеаз. Биологическая функция sIgA состоит в основном в местной защите слизистых оболочек от инфекции. Формирование местных секреторных IgA на поверхности слизистых оболочек имеет особое значение для формирования устойчивости организма к вирусам, обычно проникающим через дыхательный, кишечный или урогенитальный эпителий. Для индукции секреторных IgA в кишечнике вирус должен вступить в контакт с лимфоидной тканью кишечника. После формирования местного ответа В-клетки памяти, образующие IgA, мигрируют в другие участки кишечника. Аналогичный механизм индукции IgA функционирует в респираторном тракте.
Система секреторного иммунитета функционирует и регулируется иначе, чем иммунная система в целом. Она может коррелировать с общей иммунной реакцией или быть независимой от нее. Кроме секреторного IgA, существенное значение для иммунитета слизистых оболочек имеют содержащиеся в секретах у человека IgM и IgG. IgM также представляет секреторный иммуноглобулин, однако он не так прочно, как sIgA, связывает секреторный компонент. В пищеварительном тракте IgM играет более важную роль, чем IgG, а в носоглотке - наоборот.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Читайте также:

