Какой анализ на вирус папилломы человека сдавать при эрозии шейки матки
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
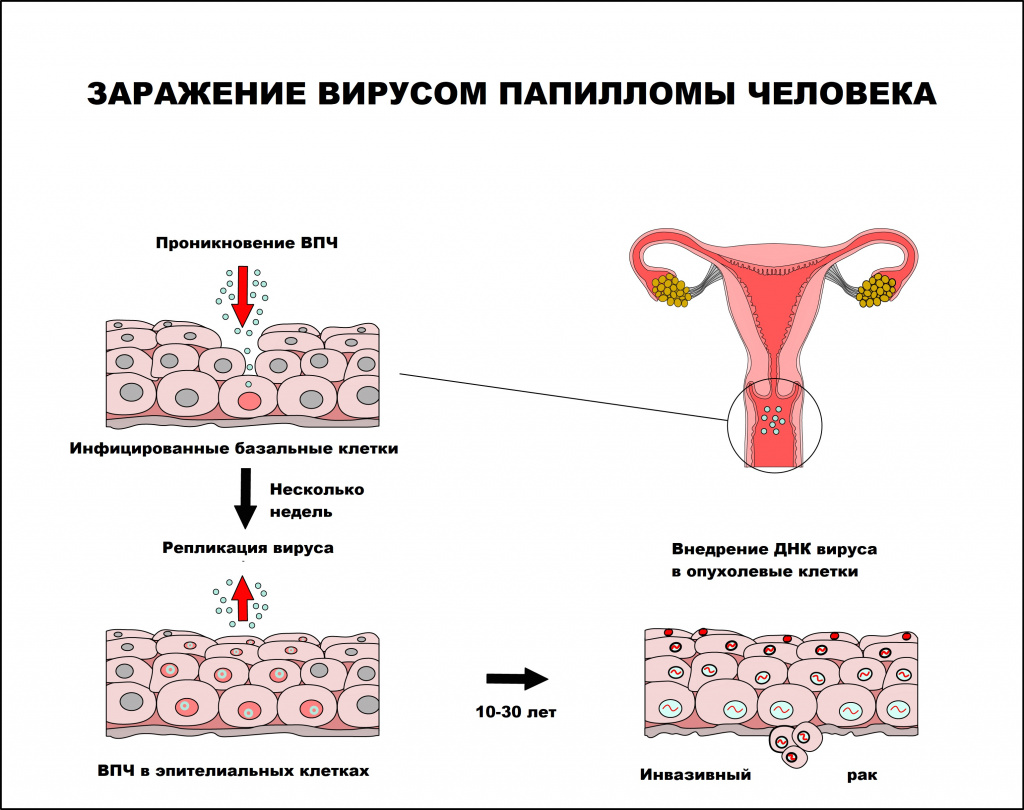
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.

Итак, если вы дочитали статью до этой части, вы наверняка почерпнули немало полезной информации, а самое главное – правдивой и современной, о вирусе папилломы человека, предраковых и раковых состояниях шейки матки и о пресловутой вакцине от рака шейки матки. Давайте подведем итоги выше сказанного, чтобы перейти к практическим рекомендациям, которыми могут воспользоваться как женщины, так и врачи, желающие повысить свой уровень знаний по этим вопросам.

Конечно, можно сделать и другие выводы, и каждый читатель наверняка сделает свои собственные выводы.
Мы подошли к вопросу, как на фоне этих многочисленных противоречивых фактов, этого панического страха перед раковыми заболеваниями, коммерческого влияния фармацевтических магнатов на современных ученых, врачей и многих других людей найти оптимальный план-стратегию по выявлению рака шейки матки? Я предлагаю вам алгоритм обследования и наблюдения женщин, который поддерживают многие прогрессивные врачи. Эти рекомендации могут кардинально отличаться от тех, которыми руководствуются ваши врачи. Однако они основаны на серьезном рациональном подходе с учетом имеющихся научных данных по вопросам ВПЧ-инфекции и рака шейки матки. Это ваше личное дело руководствоваться этими рекомендациями или пользоваться старыми, ибо ваше здоровье в ваших руках.
Прививаться или не прививаться от ВПЧ-инфекции?
Мое личное мнение, которое совпадает с мнением многих врачей, возраст в 9-12 лет не является рациональным, т.е. оптимальным, для проведения вакцинации. Во внимание также должно приниматься желание самого подростка быть привитым без манипулирования его решением через запугивание, что, если ребенок не будет вакцинирован, то у него обязательно возникнет рак. Это ответственность каждого родителя строить здоровые отношения со своими детьми и обучать их здоровому образу жизни, в том числе вопросам половых отношений и половой гигиены.
Женщинам до 30 лет, которые имеют половые отношения с одним постоянным партнером и у которых не обнаружен ВПЧ, вакцинация не обязательна и выбор должен оставаться всегда за женщиной. Манипулирование решением с использованием аргумента, что партнер женщины может изменять ей и впоследствии заразить ВПЧ, являются неэтичным.
Женщинам после 30 лет ВПЧ-вакцина не показана.
У женщин, у которых обнаружен ВПЧ 16 и/или ВЧП 18, прививание не будет эффективным в отношении защиты от предраковых и раковых состояний шейки матки. Защитный эффект может быть только от ВПЧ 6 и ВПЧ 11, если они ими не заражены. При наличии других типов ВПЧ применение вакцины также не эффективно.
Из-за отсутствия достоверных данных о продолжительности защитного действия ВПЧ вакцины, женщины и мужчины должны знать, что клинически эффект вакцины наблюдается только в течение 3-4 лет. Нужна ли дополнительная ревакцинация – убедительных данных по этому вопросу не существует.
Как и когда проводить скрининг на раковые заболевания?
Цитологическое исследование женщин должно начинаться с 21 года, независимо от того, в каком возрасте до этого женщина начала половую жизнь.
ВПЧ-тестирование является дополнительным методом скрининга и в комбинации с цитологическим исследованием позволяет выявить от 88 до 95% тяжелых дисплазий. Однако наличие ВПЧ не является показанием для дополнительного обследования и лечения при нормальных результатах цитологии.

Также, мало кто из врачей объясняет молодым перепуганным пациенткам, что хирургическое лечение шейки матки имеет немало осложнений. Что это за осложнения?
• бесплодие из-за стеноза цервикального канала, уменьшения выработки цервикальной слизи, функциональной неполноценности ШМ и вторичной трубной дисфункции вследствие восходящей инфекции;
• формирование рубцов ШМ и ее деформация;
• возникновение карциномы из-за неполного или неточного обследования;
• нарушение менструальной функции;
• обострение воспалительных заболеваний мочеполовой системы;
• преждевременные роды и преждевременный разрыв плодных оболочек (значительный риск этого осложнения наблюдается после ДЭК и криодеструкции, поэтому врач должен серьезно подходить к выбору лечения у женщин репродуктивного возраста, особенно нерожавших, у которых хирургическое лечение может быть отложено на определенный период времени).
Если вы прошли хирургическое лечение (по показаниям или без них), важно понимать, что на восстановление покровного эпителия шейки матки необходимо время. В течение всего периода выздоровления (минимум 4 нед) женщина не должна поднимать тяжести, пользоваться тампонами, спринцеваться, жить половой жизнью, так как все это провоцирует травматизацию с последующим кровотечением, инфекционные процессы ШМ. Нормальная гистологическая картина шеечного эпителия восстанавливается у 60% женщин через 6 недель после лечения, у 90% – через 10 недель. Цитологический мазок необходимо повторять не раньше чем через 3-4 месяца после лечения. Процесс заживления ШМ после оперативного лечения порой длится до 6 месяцев, поэтому раннее кольпоскопическое или цитологическое обследование иногда приводит к ложно-положительным результатам и необоснованному подозрению на наличие остаточных явлений цервикальной интраэпителиальной неоплазии.

Почему возник массовый психоз по отношению к вирусу папилломы человека? В 1999 году Др.Волбумерс с коллегами опубликовали статью о вирусе папилломы человека и его связи с возникновением рака шейки матки. Он предоставил данные гистологического исследования тканей шейки матки (ШМ) 932 женщин, страдающих раком шейки матки. У 99.8% этих женщин была обнаружена ДНК вируса папилломы человека. Именно эти проценты вызвали колоссальный ажиотаж среди врачей, в средствах массовой информации, а уже потом среди женщин всего мира. Однако в реальности степень вовлечения вируса папилломы человека в развитие рака ШМ ниже и составляет 75-80% случаев (в ряде публикаций до 90% случаев). Об этом мы поговорим чуть позже. Но на фоне такого открытия были сделаны очень ложные выводы, которые доминируют до сих пор: папиллома вирусная инфекция всегда, то есть в 99.8% случаев, приводит к раку шейки матки. Это неточное утверждение, и им нередко манипулируют, особенно по отношению к здоровью молодых женщин.
Теперь поговорим о вирусе папилломы человека. ВПЧ был обнаружен в 1984 году немецким ученым Харалдом цур Хаусеном, за что он получил в 2008 году Нобелевскую премию, благодаря появлению вакцины, предупреждающей развитие рака шейки матки и предраковых состояний. Вручили ученому только половину суммы премии (1.4 млн. долларов), потому что остальную часть вознаграждения отдали первооткрывателю ВИЧ, французскому вирусологу. Больше 10 лет со дня открытия ВПЧ ушло на поиск связи между этой инфекцией и раком шейки матки.
Вручение Нобелевской премии немецкому ученому повлекло серьезный мировой скандал о продажности комитета по вручению этой престижной награды, так как оказалось, что за выбором лауреатов стояла крупнейшая английская фармакологическая компания Астра-Зенека, имевшая колоссальные ставки в производстве новой вакцины от рака шейки матки и являющаяся спонсором Нобелевской организации-фонда. Пять членов комитета были платными консультантами для компании и получали большие гонорары от нее, в том числе в виде дорогостоящих, шикарных поездок заграницу. В расследование была вовлечена полиция, но Нобелевскому комитету удалось замять это дело, опять же не без помощи всемогущей фармакологической компании.
В природе существуют животные виды вируса папилломы, но на коже и слизистых человека обитают только человеческий вид этого вируса, поэтому его называют вирусом папилломы человека. Само название вируса говорит о том, что он вызывает рост бородавок (папиллом) и именно эта связь вируса с человеком известна давно – с момента его открытия.
Известно более 130 типов вируса папилломы человека. Большинство этих типов весьма безобидные и не приносят вреда человеческому телу. Все типы, которые вовлечены в возникновение генитальных бородавок и рака шейки матки, как и ряда других раков у мужчин и женщин, разделены на две основные группы – онкогенные типы низкого риска и онкогенные типы высокого риска. Больше 40 видов ВПЧ поражают аногенитальный тракт мужчин и женщин.

Помимо этой классификации существует классификация вирусов по ДНК-строению (чередованию определенных участков ДНК) на 5 классов: альфа, бета, гамма, дельта и мю. Альфа-вирусы инфицируют слизистые гениталий и ротоглоточной области и включают онкогенные типы, вызывающие рак шейки матки, поэтому изучены лучше и больше, чем другие представители ВПЧ.
Важно также знать, что выделено три вариации ВПЧ 16: Европейский (Е), Африканский (Af-1, Af-2) и Азиатский-Американский (Аа), а также три разновидности ВПЧ 18: Европейский (Е), Африканский (Af) и Азиатский-Америкоиндийский (AsAi). Забегая наперед в тему вакцинации от ВПЧ, у меня нередко возникает вопрос, на который я пока что не нашла удовлетворительного ответа: играет ли такая разновидность вирусов в создании ВПЧ-вакцины или нет? Если да, то насколько вакцина, созданная на основе одной разновидности вируса, будет эффективна в профилактике ВПЧ-инфекции в том регионе, где доминирует другой вариант вируса? Почему я задаю (фактически, сама себе) этот вопрос? Потому что такой же вопрос возникал у многих ученых, когда речь заходила о прививках против гриппа, при изготовлении которых использовались разные штаммы вирусов гриппа, но не специфичных для тех регионов, где потом продавались и внедрялись эти вакцины.
Как передаются ВПЧ? Только путем тесного телесного контакта (тело-к-телу или кожа-к-коже), что обычно происходит при половом акте, включая анальный и оральный секс. Вирус не передается через касание половых органов руками, а также через мастурбацию руками. Он также не передается через предметы интимной гигиены и сексуальные игрушки и приспособления.
Частота половых партнеров играет очень важную роль как фактор риска передачи вируса, поэтому с каждым новым партером риск заражения ВПЧ возрастает. Чем больше половых партнеров, тем выше риск заращения ВПЧ инфекцией, причем несколькими типами этого вируса. Нередко папиллома вирусную инфекцию относят к инфекциям, передающимся половым путем, потому что пик заражения ВПЧ вирусом выпадает на подростков и молодых людей, начавших и ведущих активную половую жизнь (70-80% инфицированных мужчин и женщин).
Около 10-12% женщин по всему миру заражены вирусом папилломы человека. Самая высокая частота инфицирования выпадает на страны Африки (24%), Восточной Европы (21.4%) и Латинской Америки (16.1%). Такие высокие показатели по сравнению со средне-статистическими мировыми показателями связаны с плохой гигиеной половых органов, низким уровнем использования презервативов и высоким уровнем беспорядочной половой жизни с частой сменой партнеров. До 30 лет более 70% женщин и мужчин были заражены ВПЧ хотя бы один раз в жизни, 45-50% женщин в возрасте 20-24 лет имеют ВПЧ-инфекцию. Чаще всего – это студенты училищ и высших учебных заведений. У 64% городских женщин-подростков в течение 2 лет от начала половой жизни находят ДНК вируса ВПЧ в выделениях. После первого полового акта инфекцией ВПЧ заражается почти одна треть женщин. После 30 лет уровень ВПЧ-инфекции кардинально понижается.

Многочисленные исследования показывают, что вирус папилломы человека исчезает и его ДНК невозможно определить во влагалищных выделениях у почти 60% женщин в течение 15 месяцев без негативных последствий для здоровья. Это важно запомнить, потому что это ключ к пониманию того, что вирус папилломы человека не так страшен, как о нем говорят многие люди, не имеющие абсолютно никаких современных знаний об этой инфекции.
Что важно помнить? Что у 90% женщин, зараженных ВПЧ, от инфекции не остается и следа в течение последующих 2 лет (чаще всего на очищение при отсутствии дисбактериоза влагалища и половых инфекций уходит три месяца). Только в 10% случаев инфекция может протекать дольше и тогда мы говорим о персистентной ВПЧ-инфекции. Но даже в таком состоянии изменения на слизистых шейки матки бывают не часто. Почему у большинства женщин происходит очищение организма от ВПЧ, а у небольшого количества инфекция продолжает прогрессировать, неизвестно. Другими словами, механизм возникновения предрака и рака шейки матки все же не изучен и не понятен. Очевидно, важную роль играет наличие факторов риска по образованию рака шейки матки, о которых мы поговорим позже, и агрессивность штаммов ВПЧ, что тоже является определенной поломкой-мутацией на уровне ДНК вируса, а также состояние защитных сил человеческого организма.
У 20% молодых девушек, никогда не имевших половых контактов через влагалище, находят ВПЧ во влагалищных выделениях и на вульве. Однако значение выявления ДНК вируса в развитии инфекционного процесса в таких случаях не выяснено до конца.
ВПЧ-инфекция также может быть вовлечена в развитие рака прямой кишки (точнее, ануса) и диагностируется приблизительно в 1.6 на 100 000 мужчин и женщин по всему миру. В 93% случаев находят ВПЧ 16 и 18. У бисексуальных мужчин и геев шанс развития анального рака в 17 раз выше, чем у гетеросексуальных мужчин.
Однако в отношении рака врачей и женщин интересует обнаружение интраэпителиального поражения высокой степени (тяжелой дисплазии), что есть предрак, и рака. 3-10% ДНК-положительных и 0,7% ДНК-отрицательных женщин имеют изменения в цитологическом мазке в виде умеренной и тяжелой дисплазий плоскоклеточного эпителия. Таким образом, на то огромное количество зараженных ВПЧ-женщин, показатели изменений в цитологическом мазке низкие. Другими словами, давайте все же не будем делать из мухи слона, пугая женщин развитием рака шейки матки у всех, у кого обнаружена эта инфекция.
Как диагностируется ВПЧ-инфекция? На современном этапе обследования существует три основных метода определения специфических типов ВПЧ в организме человека: (1) методы гибридизации, (2) методы полимеразной цепной реакции и (3) методы insitu гибридизации. У каждой группы методов есть свои преимущества и ограничения. Чаще всего используют метод полимеразной цепной реакции (ПЦР), которым определяют наличие ДНК вируса ВПЧ во влагалищных выделениях, то есть тип вируса. Методом гибридизации можно определить группы высокого и низкого риска, но не конкретный тип вируса. Если ваш врач ищет вирусы ВПЧ в крови или по анализу крови заявляет вам об инфицировании ВПЧ, гоните такого врача в шею.
Конечно, в сыворотке крови можно обнаружить антитела к ВПЧ, однако определяют их не с целью диагностики этой инфекции, а в экспериментальных целях, чтобы узнать, возникает ли иммунитет после перенесенной инфекции ВПЧ, а также как реагируют защитные силы организма на введение вакцины. Многих женщин, как и врачей, интересует вопрос: возникает ли длительная или пожизненная защита после того, как произошло заражение ВПЧ и организм очистился от вируса, или возможно повторное заражение одним и тем же типом ВПЧ? Как раз ответную защитную реакцию можно определить по уровню определенных антител в сыворотке крови, но результаты в этом направлении исследований пока что не утешительны. Очевидно, что женщины и мужичины могут заражаться ВПЧ несколько раз. Если снова находят один и тот же тип вируса у ДНК-отрицательного человека, который раньше имел ДНК-положительный результат, неизвестно, произошло ли повторное заражение или реактивация старой инфекции, которую в скрытом состоянии известными науке методами диагностики определить до этого не удавалось.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
Определение ДНК вируса папилломы человека: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Вирусы папилломы человека (ВПЧ) - это группа генетически разнообразных ДНК-содержащих вирусов, относящихся к семейству Papillomaviridae и поражающих эпителий кожных покровов и слизистых оболочек ротовой полости и аногенитальной зоны.
Инфицирование вирусом папилломы человека клинически может проявляться остроконечными кондиломами, папилломами или злокачественной трансформацией клеток. По данным, которые приводит Всемирная организация здравоохранения, 50-80% населения инфицировано ВПЧ, а 5-10% из них имеют клинические проявления заболевания.
Наследственный материал (геном) вируса папилломы человека заключен в белковую оболочку, состоящую из больших (L1) и малых (L2) структурных белков. В зависимости от строения генома L1 были выявлены и описаны различные типы вируса папилломы человека. К настоящему времени выявлено и описано более 200 генотипов вируса папилломы человека, около 45 из них могут инфицировать эпителиальный слой урогенитального тракта.
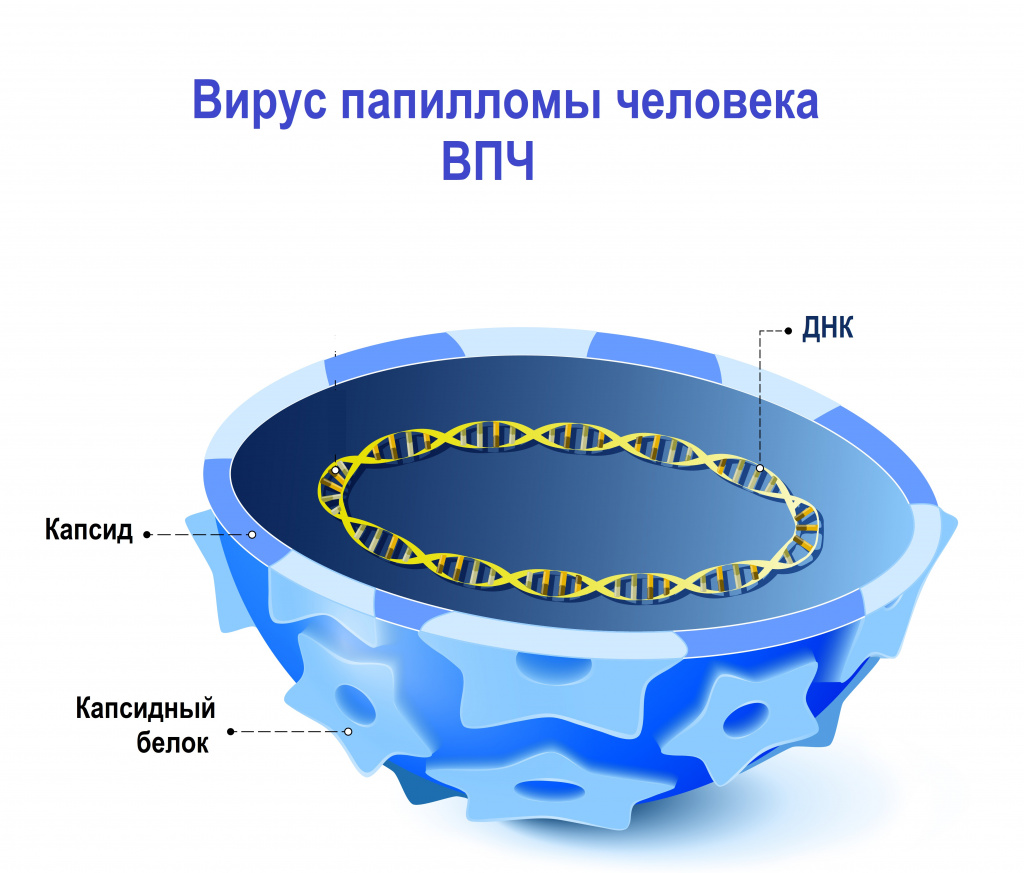
ВПЧ обладает тропностью (свойством поражать определенные органы и/или ткани) к коже и слизистым оболочкам. Источником возбудителя инфекции является больной человек или вирусоноситель.
Основной путь передачи возбудителя - половой (генитально-генитальный, мануально-генитальный, орально-генитальный), однако возможна передача и при соприкосновении (при кожном контакте). Кроме того, ВПЧ может передаваться от матери плоду во время родов.
Риск передачи при однократном половом контакте равен 80% - особенно у девушек, не достигших половой зрелости, из-за особенностей строения эпителия шейки матки в юном возрасте.
Факторы, способствующие инфицированию вирусом папилломы человека и развитию заболевания:
- раннее начало половой жизни;
- частая смена половых партнеров;
- сопутствующая урогенитальная инфекция и нарушение биоценоза влагалища;
- частые роды и аборты;
- иммунодефицитные состояния;
- генетическая предрасположенность и гормональные факторы.
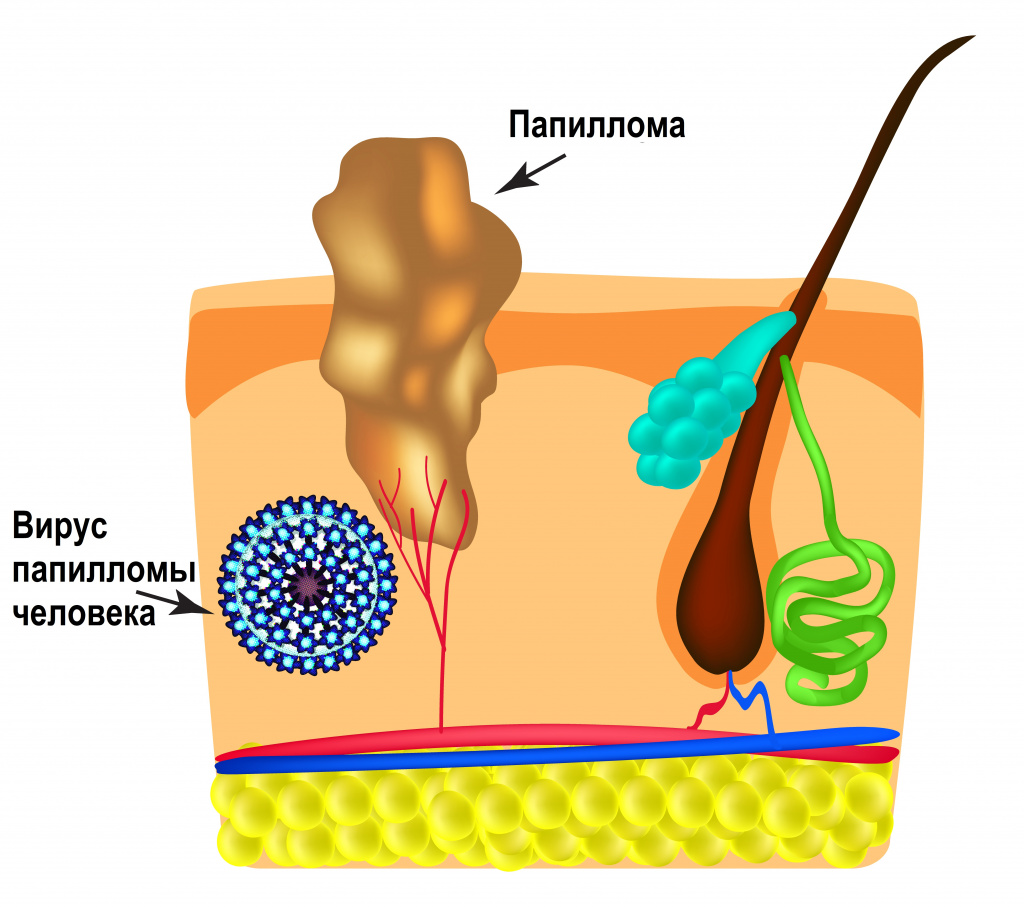
Интервал между инфицированием ВПЧ и инвазивным (проникающим) раком составляет около 10 лет или более.
Инвазивному раку предшествуют предраковые поражения шейки матки, вульвы, влагалища, анального канала, полового члена различной степени тяжести.
Вирус папилломы человека не проникает в кровь, поэтому инфекционный процесс протекает без развития воспалительной реакции.
Выделяют вирусы высокого онкогенного (или канцерогенного) риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого онкогенного риска (типы 6, 11, 42, 43, 44).
Типы ВПЧ низкого канцерогенного риска связаны с развитием остроконечных кондилом, папиллом и дисплазиями легкой степени. Типы ВПЧ высокого канцерогенного риска, наряду с остроконечными кондиломами и дисплазиями, также могут вызывать злокачественную трансформацию эпителия, приводя к развитию рака.
Например, высокоонкогенные типы ВПЧ 16 и 18 вызывают в 70% случаев рак шейки матки, в 80% рак вульвы и влагалища, в 92% анальный рак, в 95% рак ротовой полости, в 89% рак ротоглотки, в 63% рак полового члена. Генотипы ВПЧ 6 и 11 обуславливают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза.
Таким образом, дифференцированное определение ДНК вируса папилломы человека назначают в следующих случаях:
- для подтверждения ВПЧ при наличии папилломатозных разрастаний и изменений на слизистых оболочках половых органов;
- для скрининга (обследования лиц, не считающих себя больными) с целью выявления скрыто протекающего заболевания;
- для контроля эффективности проводимой терапии.
- с 21 года до 29 лет - не реже 1 раза в 3 года;
- с 30 до 69 лет - не реже 1 раза в 5 лет.
Высокая сексуальная активность предполагает проведение скрининга с18 лет.
Подготовка к процедуре
Обследование женщин целесообразно проводить в первую половину менструального цикла, но не ранее 5-го дня. Допустимо обследование во второй половине цикла, но не позднее, чем за 5 дней до предполагаемого начала менструации.
Накануне и в день обследования пациентке не рекомендуется спринцевать влагалище. Забор биоматериала не следует осуществлять ранее 24-48 часов после полового контакта, интравагинального УЗИ и кольпоскопии.
Соскоб из уретры проводят до или через 2-3 часа после мочеиспускания.
Мужчинам необходимо исключить половые контакты за 1–2 суток до взятия мазка (соскоба). Нельзя мочиться в течение 1,5-2 часов до процедуры.
Срок исполнения
До 2 рабочих дней, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может быть некорректным.
Дифференцированное определение ДНК ВПЧ (вируса папилломы человека, Humanpapillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) + КВМ
Синонимы: Анализ урогенитального соскоба на ВПЧ. HPV DNA, 21 Types, Scrape of Urogenital Epithelial Cells. Краткое описание исследования «Дифференцированное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39.
Исследуемый материал: соскоб эпителиальных клеток урогенитального тракта.
Форма представления результатов: количественный результат по каждому выявляемому показателю.
Единицы измерения: логарифм копий ДНК ВПЧ на 105 эпителиальных клеток (lg копий ДНК/105 эпит. клеток).
До проведения тестов по выявлению ДНК ВПЧ выполняется контроль взятия материала (КВМ). Если в пробе значение КВМ неудовлетворительное (менее 4 lg (10000) копий ДНК человека в пробе), исследование ДНК ВПЧ не проводится и рекомендуется повторное взятие биологического материала.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Расшифровка показателей
Количественный формат теста позволяет выявить вирус, оценить степень риска и возможное наличие предраковых изменений при высокой вирусной нагрузке.
Интерпретация положительного результата
В анализируемом образце биологического материала обнаруженная ДНК, специфичная для вируса папилломы человека исследуемых типов в выявленной концентрации, свидетельствует о наличии возбудителя.
Если абсолютное содержание ВПЧ превышает клинически значимое, напротив обнаруженного штамма вируса указывается его концентрация. Чем выше значение, тем выше риск развития болезней, вызываемых вирусом папилломы человека.
Рост вирусной нагрузки через 3, 6 и 9 мес. после проведенного лечения свидетельствует о возможности рецидива.
- генотипы низкого онкогенного риска: 6, 11, 44;
- генотипы высокого онкогенного риска: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82.
Выявление нескольких генотипов вируса предполагает менее благоприятный прогноз течения заболевания и более высокий риск персистенции.
При обнаружении 16 и 18 генотипов рекомендуется проводить кольпоскопическое обследование, не откладывая.
При выявлении других типов высокого риска назначают цитологическое обследование, а при его положительном результате - кольпоскопию.
Дополнительное обследование при отклонении от нормы
Врач интерпретирует результат анализа с учетом данных о пациенте и болезни, заключений осмотра, цитологического и гистологического исследований.
Гинеколог, уролог или проктолог может назначить дополнительные исследования:
-
цитологическое исследование биоматериала соскобов вульвы и влагалища, кроме шейки матки (окрашивание по Папаниколау, Рар-тест);
В цитологическом методе диагностики для окрашивания биологического материала используют несколько способов окраски. Применение определённого метода окрашивания позволяет решить специфические задачи. Каждый метод окрашивания имеет свои особенности, специфику, например, характер окрашивания ядра, ц.
Читайте также:

