Какой нужен микроскоп чтобы увидеть вирусы
Обновлено: 23.04.2024
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об авторе
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
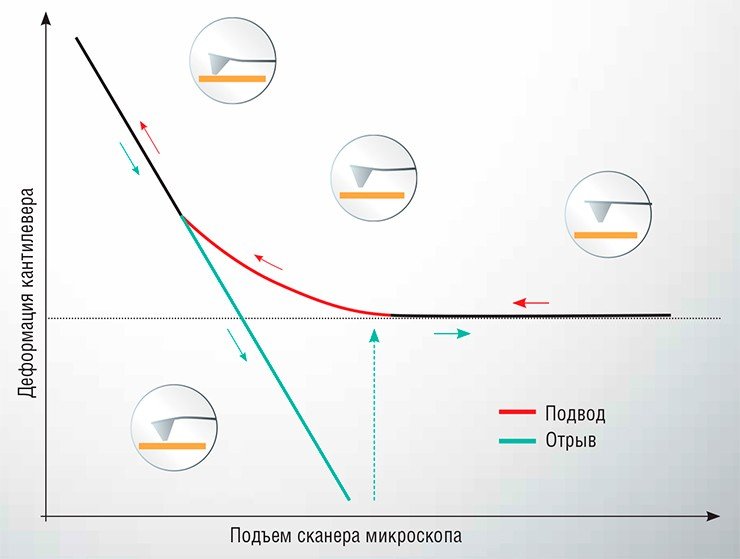
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.


На этом рисунке американского ученого и художника Дэвида Гудселла (David S. Goodsell) изображен попавший в легкие коронавирус SARS-CoV-2 — точнее, одна его вирусная частица, или вирион. Она могла проникнуть в легкие со вдохом в составе аэрозоля, выделившегося в воздух при чихании или кашле зараженного человека, или же из верхних дыхательных путей, если вирус осел и размножился сначала там (при этом активно передаваясь другим людям).
Самый заметный из белков коронавируса — S-белок (spike protein). Именно он отвечает за проникновение коронавируса в клетку. И именно благодаря шипам-пепломерам, образующим вокруг вирусной частицы ореол, под микроскопом напоминающий солнечную корону, коронавирусы получили свое название. (Впрочем, сам шип, образованный тремя S-белками, тоже похож на корону, только обычную, а не солечную. Но выяснилось это, конечно, позже.)


Диаметр вириона — 120–160 нм без учета шипов, длина шипа — 20 нм. SARS-CoV-2 почти на два порядка меньше клеток, которые он заражает.





В самом начале этой РНК (на 5'-конце, см. 5'-end) находятся молекулярные структуры, характерные для матричных РНК клетки. Поэтому клеточные системы синтеза белков — рибосомы — принимают РНК вируса за свою и собирают на ее матрице длинную цепь аминокислот, прочитывая при этом примерно две трети вирусного генома. Эта длинная цепь — полипротеин ORF1ab — разрезается на 16 неструктурных (т. е. не образующих вирион) белков. Среди них есть и клеточные ножницы — протеазы; они еще в составе общей цепи правильно сворачиваются и начинают работать. Именно они и нарезают цепь на отдельные белки — получается, что полипротеин режет себя сам.
Подробный рассказ о белках, кодируемых вирусом SARS-CoV-2, см. в популярной статье из газеты New York Times Bad News Wrapped in Protein: Inside the Coronavirus Genome. На схеме из этой статьи видно, как гены неструктурных, структурных и вспомогательных белков расположены на РНК вируса от ее начала (слева) к концу
Вирусные РНК-полимеразы часто ошибаются и вставляют в РНК не те нуклеотиды — то есть вносят мутации. Это помогает РНК-содержащим вирусам быстро эволюционировать, однако из-за большой частоты мутаций они не могут позволить себе иметь длинный геном и много белков — всё время что-то будет ломаться. Поэтому средняя длина вирусных РНК-геномов — всего 9000 нуклеотидов. Но коронавирусы — исключение: длина их геномов достигает 30 000 нуклеотидов. Это связывают с тем, что у коронавирусов есть уникальный для РНК-вирусов белок, способный отрезать только что прикрепленный нуклеотид от синтезируемой цепи, если он не комплементарен матрице. Это помогает снизить процент ошибок при синтезе новых молекул РНК.


Субгеномные РНК служат матрицей для производства четырех структурных белков (S, E, M и N) и еще нескольких вспомогательных, см. схему выше. Вспомогательные белки не входят в состав вириона. Некоторые из них взаимодействуют с иммунной системой организма или помогают готовым вирионам покинуть клетку, функции других пока не вполне ясны. Известно, что в лаборатории они не нужны вирусу для размножения, а в организме — просто необходимы.
С каждой субгеномной РНК транслируется только один или два белка, после чего трансляция останавливается (следующие белки транслируются уже со своих субгеномных РНК). Это позволяет вирусу четко регулировать количественное соотношение производимых белков: оно определяется вероятностями, с которыми РНК-полимераза перескакивает от их генов к началу генома.
Полные копии вирусной РНК запускают новые круги репликации вируса: с них считываются новые копии неструктурных белков, из которых опять собираются РНК-полимеразы. Они, в свою очередь, порождают новые копии вирусного генома и новые матричные субгеномные РНК, по которым рибосомы клетки синтезируют вирусные белки. Таким образом, в клетке накапливается всё необходимое для сборки новых вирусных частиц. Нам осталось понять, как они формируются и покидают клетку.

Жизненный цикл коронавируса SARS-CoV (у SARS-CoV-2 он такой же). Вирион проникает в клетку путем эндоцитоза; затем S-белок расщепляется, вследствие чего мембраны вируса и эндосомы сливаются и РНК выходит. Первые две трети генома транслируются в полипротеины (1ab или укороченный 1a). Они режутся (протеолиз) на неструктурные белки, из которых собирается вирусная РНК-полимераза (репликаза). С ее помощью формируются (транскрипция) копии РНК вируса и восемь видов субгеномной мРНК — шаблоны для генерации структурных и вспомогательных белков в просвете (ERGIC) между эндоплазматическим ретикулумом (ER) и аппаратом Гольджи. Вирионы собираются в цитоплазме и выходят из клетки путем экзоцитоза. Схема из статьи Компьютерные технологии против коронавируса: первые результаты (неадаптированная схема — в статье L. Du et al., 2009. The spike protein of SARS-CoV — a target for vaccine and therapeutic development)
Белки S, M и E — мембранные. Как и мембранные белки самой клетки, их синтезируют рибосомы, связанные с эндоплазматическим ретикулумом (ЭПР) — органеллой, представляющей собой совокупность мембранных полостей. С помощью специальных молекулярных комплексов белки внедряются в мембрану ЭПР прямо во время своего удлинения. Потом часть мембраны с новыми белками отпочковывается от ЭПР, получившийся транспортный пузырек отправляется к внешней клеточной мембране и впоследствии сливается с ней.

Как видите, мы имеем дело с очень интересным вирусом. Несмотря на это, хочется всем пожелать не знакомиться с ним лично!
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего — микроскопа. Одна из основных его характеристик — набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.

Детёныш улитки. Увеличение 40×
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10–20 до 900–1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.

Лист клевера. Увеличение 100×. Некоторые клетки содержат тёмно-красный пигмент

Лист земляники. Увеличение 40×
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве — конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых — методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу. При этом через оптически прозрачные детали препарата свет распространяется в объектив, а в непрозрачных он поглощается и рассеивается. На белом фоне получается тёмное изображение, отсюда и название метода. С тёмнопольным конденсором всё иначе. Световой пучок, выходящий из него, имеет форму конуса, лучи в объектив не попадают, а рассеиваются на непрозрачном препарате, в том числе и в направлении объектива. В итоге на тёмном фоне виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных малоконтрастных объектов. Поэтому, если вы планируете расширить набор методов наблюдения, стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсора тёмного поля, тёмнопольной диафрагмы, устройств фазового контраста, поляризаторов и т. п.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция — это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани — несколько слоёв клеток создают нечёткое сумбурное изображение.

Крыло жучка бибиониды. Увеличение 400×
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т. п.
Что смотреть
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного — например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10–15 минут, после чего промыть под струёй воды.

Кожица лука. Увеличение 1000×. Окраска йодом. На фотографии видно клеточное ядро

Кожица лука. Увеличение 1000×. Окраска азур-эозином. На фотографии в ядре заметно ядрышко
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5–10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.

Картофель. Синие пятна — зёрна крахмала. Увеличение 100×. Окраска йодом

Плёнка на спине таракана. Увеличение 400×

Чешуйки с крыльев моли. Увеличение 400×
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Крыло бабочки боярышницы. Увеличение 100×
Не менее интересный объект для наблюдения — кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.

Кожура сливы. Увеличение 1000×
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.

Хлоропласты в клетках травы. Увеличение 1000×
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей — мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.

Хлоропласты в клетках водоросли. Увеличение 1000×
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов — азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: эозинофил на фоне эритроцитов
Продолжая тему исследования крови, следует упомянуть камеру Горяева — устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: слева — моноцит, справа — лимфоцит
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
Словарик к статье
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
Везде, где есть жизнь, есть вирусы. Водная среда, занимающая бóльшую часть нашей планеты, в которой сосуществует огромное число различных организмов, создает прекрасные условия и для жизни вирусов. В водных экосистемах вирусы атакуют все живые организмы – от бактерий до китов. Оставим за рамками рассмотрения вирусы крупных организмов и останемся в микромире – в мире микроскопических организмов, которые являются основой пищевых цепей и, как выясняется, многих глобальных процессов
Первая информация о количестве вирусных частиц в водных экосистемах, потрясшая исследователей, была получена в 1989 г. (Bergh et al., 1989). Материал из проб морской воды был осажден центрифугированием прямо на сеточки с пленкой-подложкой и исследован в трансмиссионном (просвечивающем) электронном микроскопе. В одном миллилитре оказалось до 2,5 × 10 8 вирусных частиц, представленных в основном фагами с характерной морфологией (капсид-отросток, или голова-хвост), что в 10 3 —10 7 раз превышало концентрацию фагов, определенную путем традиционного высева проб на бактериальный газон (метод бляшек). Разница на порядки объясняется тем, что не все бактерии культивируются, и не все вирусы-фаги инфицируют именно бактерии.
Бактериофаги в глобальном круговороте
Во-первых, удаление из экосистемы части бактерий, уничтоженной фагами, уменьшает интенсивность перевода нерастворимого (взвешенного в водной толще и осаждающегося на дно) биогенного вещества (различных частиц, отмерших организмов и др.) – в растворенное (расщепленное, гидролизованное). Таким образом фаги нарушают классическую пищевую цепь. Этот процесс был назван вирусным шунтом (Wilheln, Suttle 1999). По оценкам авторов, через этот шунт может проходить до четверти первичной продукции углерода океана.
Количественная мультитрофическая модель, созданная авторским коллективом океанологов и математиков описывает влияние морских вирусов на микробиальные пищевые сети и процессы, проходящие в экосистемах. Согласно этой модели водные экосистемы, содержащие вирусы, будут иметь усиленный круговорот органического вещества, уменьшенный перенос этого вещества на более высокие трофические уровни и увеличенную валовую первичную продуктивность (Weitz et al., 2014). Авторы модели считают, что в оценках круговорота углерода и азота необходимо учитывать роль вирусов, так как они являются важной составляющей пищевых сетей и регулируют глобальные биогеохимические циклы.
Цианофаги – особый случай?
Цианобактерии (синезеленые водоросли), хотя и относятся к домену Bacteria, благодаря способности к фотосинтезу играют иную нежели гетеротрофные бактерии роль в водных экосистемах. Это одни из самых древних организмов. Они доминировали на ранних стадиях эволюции биосферы Земли и определяли биогеохимические циклы. Их бурное развитие вызвало изменение атмосферы, обогатило ее кислородом, что сделало возможным появление других организмов и направило эволюцию биосферы нашей планеты. Можно предположить, что цианофагов тогда еще не было.
Вирус морской диатомеи Chaetoceros debilis CdebDNAV – сохраняет инфекционность при широком диапазоне температур (от 20°С до -196°С) без добавления криопротекторов (Nagasaki, 2008).
Вирусы токсичной красной водоросли Heterosigma akashiwo сохраняют литическую активность в донных отложениях (Lawrence, 2002).
Цианофаги могут сохраняться в осадках до 100 лет (Suttle, 2000).
Гигантский вирус амеб Pithovirus sibericum – выделен из вечной мерзлоты возрастом 30 тыс. лет (Legendre et al., 2014)
И сегодня среди цианобактерий есть экстремофилы – виды, прекрасно существующие в горячих источниках, жарких пустынях, а также арктических и антарктических условиях. Если у таких видов есть цианофаги, то насколько они, эти цианофаги, уникальны?
За разнообразием – на Байкал!
В настоящее время согласно Международной классификации и таксономии вирусов (ICTV) бактериофаги, в зависимости от типа нуклеиновой кислоты разделяют на ДНК- и РНК-содержащие, которые, в свою очередь, разделяются на семейства по морфологическим признакам.
Исторически исследования водных бактериофагов связаны со сточными водами, где обнаруживаются колифаги, – бактериофаги кишечной палочки. Но на самом деле задача гораздо шире – обнаружить разнообразные фаги, поражающие другие бактерии, а не только Escherichia coli, или новые неизвестные фаги с возможными новыми свойствами. Практически одновременно с введением понятия вириопланктона в морской среде, были начаты исследования бактериофагов в воде озера Байкал. Сначала были выявлены фаги, поражающие присутствующую в воде кишечную палочку (Дрюккер, Масленников, 1998), а с 2002 г. для определения морфологии бактериофагов стали использовать трансмиссионную электронную микроскопию.
В Байкале за рекордно долгий для пресноводных водоемов период существования, несмотря на климатические катаклизмы (а, может, и благодаря им) сформировалась уникальная биота, с большим видовым богатством и высоким уровнем эндемизма практически во всех группах организмов. Как оказалось, из десяти известных семейств ДНК-содержащих бактериофагов в Байкале обитают морфологически разнообразные представители девяти из них (Myoviridae, Podoviridae, Siphoviridae, Fuselloviridae, Inoviridae, Microviridae, Tectiviridae, Leviviridae, Rudiviridae). Кроме того, обнаружено и несколько морфотипов неизвестного систематического положения (Дрюккер, Дутова, 2006, 2009). Таким образом, огромное биоразнообразие, характерное для флоры и фауны озера Байкал, распространяется и на фаги
Вирусы древнейших
Ферменты архей применяются в пищевой промышленности, так как могут работать при высоких температурах, а ДНК-полимераза археи Pyrococcus furiosus используется в ПЦР (полимеразной цепной реакции). Сами археи являются компонентом очистных сооружений, обеспечивая анаэробное разложение сточных вод; используются при обогащении руд ценных металлов. Ясно, что в промышленном производстве лизис архей вирусами – большая неприятность.
Структурные исследования вирусных капсидов показали, что бесхвостые икосаэдры, инфицирующие архей, бактерий и эукариот, имеют общего предка (Abrescia et al., 2012). Например, структурные сходства имеют белки оболочки нитчатых вирусов табачной мозаики, двух вирусов архей из рода Acidianus и вируса гепатита B. Несмотря на низкую гомологию аминокислотных последовательностей, белки вирусов архей могут иметь сходные элементы третичной структуры с вирусами других доменов (Dallas et al., 2014). А совсем недавно был описан нитевидный вирус гипертермофильной археи Pyrobaculum, который имеет уникальную среди ДНК-содержащих нитевидных вирусов структуру вириона. Его линейный геном заключен в трехслойный панцирь, состоящий из двух белковых слоев и дополнительной наружной оболочки. Вирион организован в виде суперспирали подобно вирусам Эбола и Марбург, но они являются РНК-содержащими (Rensen et al., 2016).
Каждую секунду в океане происходит 10 23 вирусных инфекций. Каждая инфекция имеет возможность для введения новой генетической информации в организм и в вирусное потомство, способствуя таким образом эволюции как сообществ хозяина, так и вирусов (Suttle, 2007). И хотя важность водных вирусов уже стала очевидной, на многие вопросы наука пока ответить не может.
Bergh Ø, Borsheim KY, Bratbak G, Heldal M. Abundance of viruses found in aquatic environments // Nature. 1989. V. 340. P. 467—468.
Hug L. A., Baker B. J., Anantharaman K. et al. A new view of the tree of life //Nature Microbiol. 2016. 11 Apr. N. 16048. DOI 110.1038.
Pietilä M. K., Demina T. A., Atanasova N. S., Oksanen H. M., Bamford D. H. Archaeal viruses and bacteriophages: comparisons and contrasts // Trends in Microbiology. 2014. V. 2. N. 6. P. 334—344.
Prangishvili D. The wonderful world of archaeal viruses // Annu. Rev. Microbiol. 2013. V. 67. P. 565–85.
Suttle C. A. Viruses in the sea // Nature. 2005. V. 437. P. 356—361.
Дрюккер В. В., Дутова Н. В. Бактериофаги как новое трофическое звено в экосистеме глубоководного озера Байкал // Докл. РАН. 2009. Т. 427, № 2. С. 277—281.
Автор благодарит Г. И. Филиппову (ЛИН СО РАН, Иркутск) за помощь в подготовке публикации
Читайте также:

