Капельницы для вич инфицированных
Обновлено: 24.04.2024
Е. Л. Голохваcтова, кандидат медицинских наук Городской центр по профилактике и борьбе со СПИДом, Москва Синдром приобретенного иммунодефицита (СПИД) важнейшая мировая медицинская, социальная и политическая проблема ХХ века. В 1981 г.
Городской центр по профилактике и борьбе со СПИДом, Москва
В настоящее время известны два типа вируса — ВИЧ-1 и ВИЧ-2, различающиеся по своим структурным и антигенным характеристикам. Имеются достоверные различия в течении заболевания, вызываемого этими вирусами. Течение инфекции, вызываемой ВИЧ-2, считается более продолжительным. Среди ВИЧ-1 и ВИЧ-2 выделяют большое число генетически различных групп. Как и все ретровирусы, вирус ВИЧ характеризуется высокой изменчивостью. Считается, что в организме человека по мере прогрессирования инфекции, от бессимптомной до манифестной, происходит эволюция вируса от менее вирулентного к более вирулентному варианту. ВИЧ нестоек во внешней среде, чувствителен к внешним воздействиям, практически полностью инактивируется при нагревании выше 56°С в течение 30 мин, погибает при кипячении через 1-3 мин, а также под воздействием дезинфицирующих средств (3%-ный раствор перекиси водорода, 5%-ный раствор лизола, 70%-ный — этилового спирта). Возможно его сохранение во внешней среде в жидкостях, содержащих вирус в высоких концентрациях, таких как кровь и сперма. Губительны для ВИЧ солнечное и искусственное УФ-излучение, а также все виды ионизирующего излучения. В крови, предназначенной для переливания, вирус живет годы, в замороженной сперме несколько месяцев. Появились данные о том, что ВИЧ теряет активность под воздействием защитных ферментов, содержащихся в слюне и поте. Передачи ВИЧ при укусах кровососущих насекомых не происходит.
ВИЧ-инфекция распространена географически повсеместно. Инфекция ВИЧ-1 — антропоноз. Животные в естественных условиях не заражаются ВИЧ-1. Источником ВИЧ-инфекции является ВИЧ-инфицированный человек на всех стадиях заболевания, как в период бессимптомного вирусоносительства, так и во время развернутых клинических проявлений болезни. Восприимчивость к ВИЧ у людей всеобщая. Причиной невосприимчивости к заражению ВИЧ могут быть специфические иммуноглобулины класса А, обнаруживаемые на слизистых оболочках половых органов.
Пути передачи ВИЧ-инфекции: половой, парентеральный, вертикальный. Половой путь передачи реализуется при гетеросексуальных и гомосексуальных половых контактах. Вероятность заражения повышается при воспалительных заболеваниях половых органов. Парентеральный путь инфицирования встречается в основном среди инъекционных наркоманов. Факторами передачи ВИЧ при этом могут быть общие шприцы и иглы, наркотик, в который добавляется кровь. Инфицирование возможно при переливании зараженной крови, ее препаратов, использовании загрязненных кровью медицинских инструментов, не прошедших соответствующую обработку. Факторами передачи вируса могут быть органы и ткани доноров, используемых для трансплантации. Если женщина заражена ВИЧ, то вероятность инфицирования плода составляет около 50%. Ребенок может инфицироваться до, во время и после родов. Контактно-бытовой и воздушно-капельный пути передачи при ВИЧ-инфекции не встречаются.
ВИЧ-инфекция характеризуется многолетним течением, клинически связанным с прогрессирующим снижением иммунитета и приводящим к развитию тяжелых форм оппортунистических заболеваний. До настоящего времени считалось, что в большинстве случаев ВИЧ-инфекция имеет единственный исход — гибель зараженного ВИЧ организма. Однако теория инфекционного процесса допускает существование как маловирулентных или дефектных штаммов ВИЧ, так и устойчивых к инфекции больных. Среднюю продолжительность жизни инфицированного человека оценивают сейчас в 12 лет, однако продолжительность болезни может быть связана с путями заражения, принадлежностью к различным группам населения, возрастом, расовыми особенностями и доступностью медицинской помощи.
Клиника. После инкубационного периода, продолжительностью от 2 недель до 6 и более месяцев, в 50-70% случаев наступает длящийся от нескольких дней до 2 месяцев период первичных клинических проявлений в виде лихорадочного состояния, которое может сопровождаться увеличением лимфоузлов, стоматитом, пятнистой сыпью, фарингитом, диареей, увеличением селезенки, иногда явлениями энцефалита. Во многих случаях может наблюдаться стертое или малосимптомное начало заболевания, однако у большинства зараженных ВИЧ к 6 месяцам от момента инфицирования появляются антитела к ВИЧ.
Ранние клинические проявления ВИЧ-инфекции, за исключением увеличения лимфоузлов, проходят, и затем в течение нескольких лет у зараженных лиц другие клинические признаки ВИЧ-инфекции не обнаруживаются. В этот период сохраняется активность ВИЧ и происходит медленное снижение количества CD4-клеток. Когда защитные силы организма достаточно ослабевают, у пациента начинают возникать разнообразные оппортунистические заболевания, выраженность которых в дальнейшем нарастает по мере снижения количества CD4-клеток. При значительном снижении количества этих клеток развивающиеся оппортунистические поражения приобретают угрожающий для жизни характер. При отсутствии адекватной терапии больной погибает.
Кроме соматических поражений, у больных ВИЧ-инфекцией развиваются нейропсихические изменения, связанные с известием о заражении вирусом, возникает целая группа стрессов, из-за которых нарушаются или прекращаются социальные и межличностные связи заразившихся, снижается уровень их самооценки, угнетается эмоциональный фон, практически меняется жизнь пациентов. Ни одно инфекционное заболевание до настоящего времени не сопровождалось такой выраженной стигматизацией, как ВИЧ-инфекция. Неблагоприятный прогноз заболевания, особенности передачи возбудителя, молодой возраст заразившихся — все эти факторы усугубляют социально-психологическую ситуацию пациентов. При заражении ВИЧ-2 заболевание прогрессирует несколько медленнее. Своевременно и правильно начатое лечение может на несколько лет увеличить продолжительность жизни инфицированных лиц, а также улучшить качество их жизни.
Течение ВИЧ-инфекции многие исследователи пытались отобразить с помощью клинических классификаций. В нашей стране принята следующая классификация ВИЧ-инфекции (В. И. Покровский, 1989).
I. Стадия инкубации.
II. Стадия первичных проявлений:
А — острая лихорадочная фаза; Б — бессимптомная фаза; В — персистирующая генерализованная лимфоаденопатия.
III. Стадия вторичных заболеваний:
А — потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы;
Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 месяца, волосатая лейкоплакия, туберкулез легких, повторные или стойкие бактериальные, грибковые, вирусные, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши;
В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии.
IV. Терминальная стадия.
Выделяют также три иммунологические категории в зависимости от уровня СД4-лимфоцитов:
1) более 0,5 х 109/л СД4-клеток в 1 мм 3 крови; 2) от 0,2 до 0,5 х 109/л в 1 мм 3 ; 3) менее 0,2 х 109/л в 1 мм 3 .
Таким образом, каждый больной может быть отнесен к той или иной категории по клиническим и иммунологическим критериям.
В данной классификации учитываются все проявления болезни от момента заражения до гибели больного, включая и те, которые, возможно, еще неизвестны.
- Нуклеозидные ингибиторы обратной транскриптазы вируса (зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абаковир).
- Ненуклеозидные ингибиторы обратной транскриптазы (ифавиренц, делавирдин, невирапин).
- Ингибиторы протеазы вируса (индинавир, саквинавир, ритонавир, нельфинавир).
Обратная транскриптаза и протеаза — это ферменты вируса, необходимые для его репликации. Соответственно подавление этих ферментов приводит к замедлению размножения ВИЧ. Наиболее эффективной считают комбинацию одного ингибитора протеазы (например, индинавира или ритонавира) и двух нуклеозидных ингибиторов обратной транскриптазы (зидовудина и диданозина, ставудина и диданозина, ставудина и ламивудина, диданозина и ламивудина, зидовудина и зальцитабина, зидовудина и ламивудина). Альтернативой ингибитору протеазы может быть новый ненуклеозидный ингибитор обратной транскриптазы — ифавиренц. Терапия двумя нуклеозидными ингибиторами обратной транскриптазы уступает по эффективности комбинации трех препаратов, а монотерапия любыми антиретровирусными средствами считается неэффективной (за исключением тех случаев, когда альтернативная терапия невозможна, или во время беременности с целью предупреждения перинатальной трансмиссии). Обсуждается возможность одновременного применения трех нуклеозидных ингибиторов обратной транскриптазы, например, абакавира, зидовудина и ламивудина. Однако, по мнению экспертов, в настоящее время все же предпочтительно использование препаратов разных классов. Все антиретровирусные средства следует назначать одновременно в максимальной дозе (исключение составляют ритонавир и невирапин, дозы которых могут быть увеличены). При клинических проявлениях ВИЧ-инфекции антиретровирусная терапия показана всем больным. Необходимо использовать наиболее мощную комбинацию препаратов, обеспечивающих максимальное подавление репликации вируса. Больным СПИД часто приходится назначать не только противовирусные средства, но и препараты для лечения оппортунистических инфекций. В таких случаях необходимо учитывать взаимодействие между ними, а также возможность возникновения сходных нежелательных эффектов. Например, рифампицин, который применяется при лечении активного туберкулеза, снижает уровень ингибиторов протеазы в крови. Последние, в свою очередь, нарушают метаболизм рифампицина. Мощная противовирусная терапия восстанавливает иммунную функцию больного. Усиление иммунологического и/или воспалительного ответа может привести к появлению новых симптомов у больных с субклиническими оппортунистическими инфекциями (например, ЦМВ). Целесообразно продолжить антиретровирусную терапию и провести адекватное лечение оппортунистической инфекции. Иногда по тем или иным причинам приходится прерывать антиретровирусную терапию. Достоверных сведений о том, на сколько дней, недель или месяцев можно без последствий отменить один препарат или всю комбинацию, нет. Если возникает необходимость в прерывании терапии на длительный срок, то теоретически лучше отменить все препараты, чем продолжать терапию одним или двумя антиретровирусными средствами. Такой подход позволяет свести к минимуму риск появления устойчивых штаммов вируса. Зачастую врачи сталкиваются с тем, что выбранная схема терапии не всегда дает достаточный вирусологический и иммунологический эффект, что вынуждает менять лечение. Наиболее важным критерием эффективности терапии является динамика вирусной нагрузки. Подтвержденное клинически значимое повышение концентрации РНК ВИЧ в плазме, которое нельзя объяснить интеркуррентной инфекцией или вакцинацией, указывает на неэффективность лечения (независимо от динамики числа CD4-клеток). При выборе новой схемы лечения необходимо учитывать причины ее изменения. Если терапия давала вирусологический эффект, но вызывала выраженные побочные реакции, то целесообразно отменить препарат, который был причиной нежелательных явлений, и назначить другое средство того же класса, но с иным профилем токсичности и переносимости. Если терапия привела к выраженному подавлению репликации вируса, но является неадекватной с современной точки зрения (например, два нуклеозидных ингибитора обратной транскриптазы или монотерапия), то возникает вопрос: продолжать проводимую терапию или добавить другие средства. Большинство экспертов полагают, что неадекватная терапия в конечном итоге окажется неэффективной, и считают вторую тактику целесообразной. При неэффективности первоначального лечения предпочтительно полностью заменить неадекватную схему. Особое беспокойство вызывает возможность перекрестной устойчивости к различным ингибиторам протеазы. Имеются свидетельства того, что штаммы вируса, которые приобрели резистентность к одному препарату группы, обладают пониженной чувствительностью или устойчивы к большинству или всем ингибиторам протеазы. В связи с этим многие эксперты считают целесообразным включать два ингибитора протеазы в новые схемы лечения. Антиретровирусная терапия у больных острой ВИЧ-инфекцией снижает вирусную нагрузку и благоприятно влияет на иммунную функцию, однако отдаленный клинический эффект подобной терапии изучен недостаточно. Многие эксперты считают целесообразным продолжать лечение неопределенно долгое время, т. к. после прекращения терапии виремия может появиться вновь или возрасти.
В настоящее время существует острая потребность в новых способах лечения, которые были бы эффективны для постоянно растущего числа ВИЧ-инфицированных пациентов, уже леченных вышеупомянутыми препаратами. Получены данные о новом классе противовирусных средств — это ингибитор фузии (препарат Т-20), который применялся в комбинации с традиционными препаратами. В отличие от других препаратов для лечения ВИЧ-инфекции, которые блокируют репликацию однажды попавшего в клетку человека вируса, Т-20 представляет собой пептид, препятствующий проникновению вируса в клетку.
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
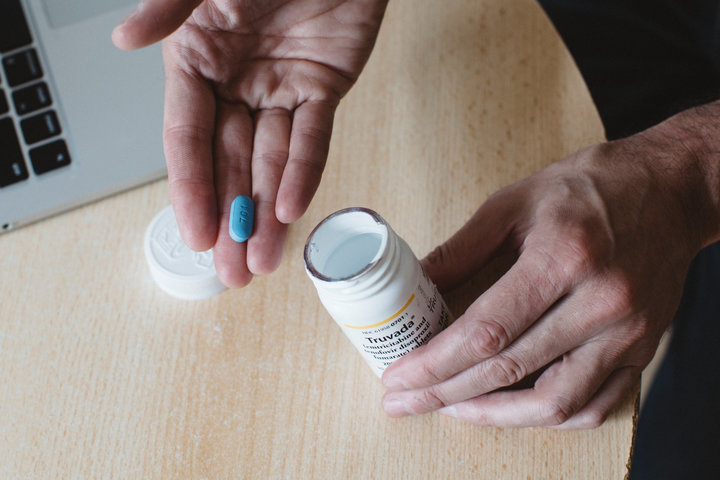
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
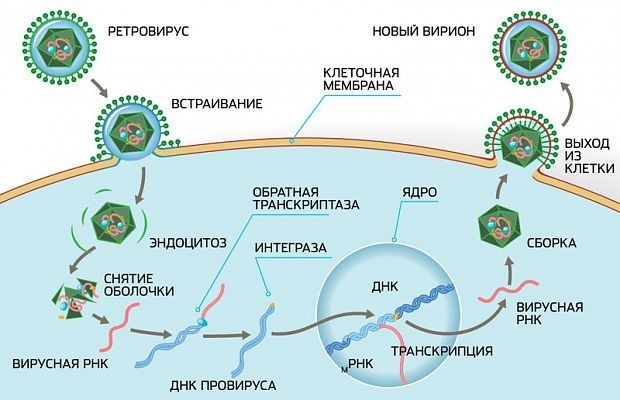
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
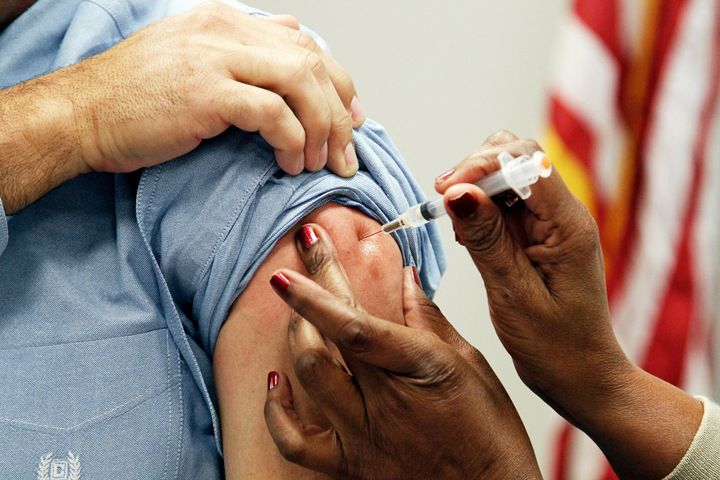
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
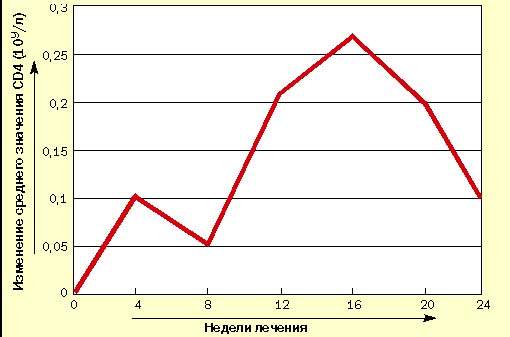 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Читайте также:

