Клетки которые убивают опухолевые и зараженные вирусом клетки
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
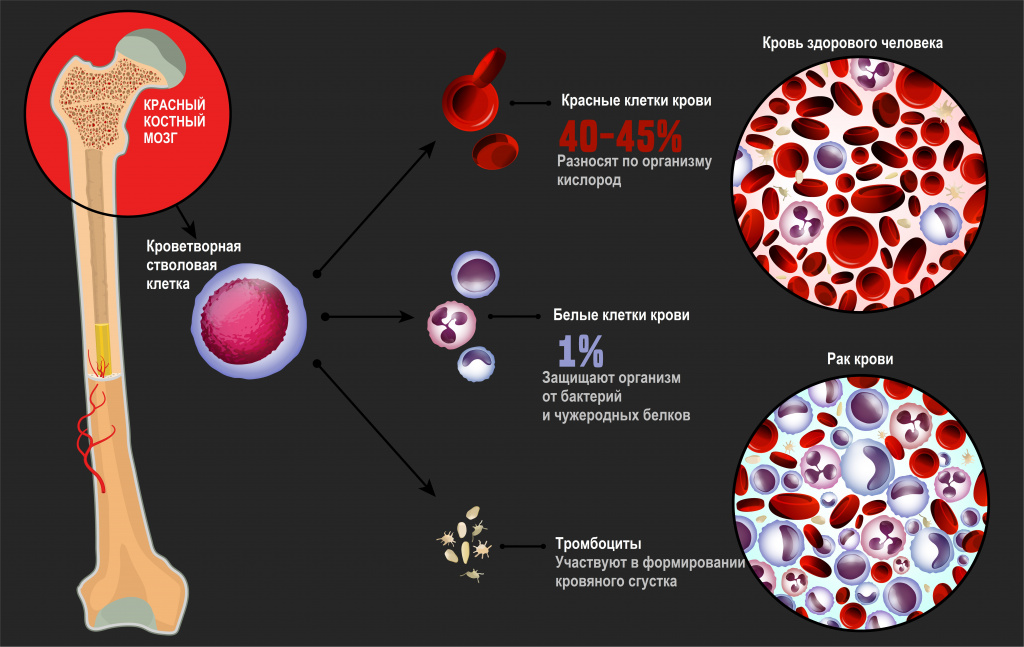
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.
Главный орган, где располагаются полипотентные стволовые клетки, - костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения - на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ - люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко - внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию - наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Аланинаминотрансфераза − внутриклеточный фермент, участвующий в метаболизме аминокислот. Тест используют в диагностике поражений печени, сердечной и скелетных мышц. Синонимы: Глутамат-пируват-трансаминаза; Глутамат-пируват-трансаминаза в сыворотке; СГПТ. Alanine aminotransferase; S.
Синонимы: Глутамино-щавелевоуксусная трансаминаза; Глутамат-оксалоацетат-трансаминаза сыворотки крови (СГОТ); L-аспартат 2-оксоглутарат аминотрансфераза; ГЩТ. Aspartateaminotransferase; Serum Glutamicoxaloacetic Transaminase; SGOT; GOT. Краткая характеристика определяемого вещества АсАТ .
Синонимы: Общий билирубин крови; Общий билирубин сыворотки. Totalbilirubin; TBIL. Краткая характеристика определяемого вещества Билирубин общий Билирубин – пигмент коричневато-желтого цвета, основное количество которого образуется в результате метаболизма гемовой части гемоглобина при дест.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазмы от клеток, пробу берут в специальную пробирку, содержащую ингибитор гликолиза (флюорид натрия). Синони.
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины. Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea. Краткая характеристика аналита Мочевина Мочевина является основным азотсодержащим продуктом катаболизма белков и аминокислот в организме человека. .
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat. Краткая характеристика определяемого вещества Креатинин Креатинин – низкомолекулярное азотсодержащее вещество, продукт метаболизма креа.
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок. Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР. Краткая характеристика определяемого вещества Общий белок Сыворотка крови (плазма крови, лишенная фибриногена) содержит множество белков, выполняющих разнообразны.
Синонимы: Анализ крови на ЛДГ; Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты. Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD. Краткая характеристика определяемого вещества Лактатдегидрогеназа ЛДГ – цитоплазматический.
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium. Краткая характеристика определяемого аналита Магний Магний, как и калий, содержится преимущественно внутри клеток. 1/3-1/2 всего магния организма .
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl. Краткая характеристика определяемых веществ (Калий, Натрий, Хлор) Калий (К+) Основной внутриклеточный катион. Кал.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме. Синонимы: Анализ крови на общий кальций; Общий кальций в сыворотке. Total blood calcium; Total calcium; Bl.
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
С целью исключения поражения почек выполняют общий анализ мочи.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
-
эхокардиография для оценки функционального состояния сердечной мышцы;
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии - это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта - наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.

Обзор
Клетки — натуральные киллеры — безжалостны к чужеродным элементам.
Автор
Редакторы
Впечатляющие успехи CAR-T лимфоцитов в лечении гемобластозов привлекли внимание медицинских специалистов и широкой общественности, но постоянно возникает вопрос: а можно ли и другие иммунные клетки поставить на борьбу с раком? В этой области сегодня нам много обещают так называемые естественные киллеры — клетки, способные преодолеть ограничения Т-клеточного лечения и стать новым словом в иммунотерапии онкологических заболеваний. Рассказываем о них в продолжении пецпроекта по генной и клеточной терапии.

Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
С тех пор адоптивный перенос иммунных клеток с противоопухолевой активностью показал эффективность в лечении некоторых рефрактерных и рецидивирующих форм гематологических онкозаболеваний [4], [5]. Публикация первых таких успехов вызвала большой ажиотаж в публичном поле и интерес крупных фармацевтических компаний, — а за ней последовал шквал клинических исследований, что привело к регуляторному одобрению CAR-T клеточного лечения в 2017 году [2].
Так что, несмотря на все преимущества, ученые волей-неволей рассматривают иммунные клетки, способные заменить (или дополнить) сегодняшнюю Т-клеточную терапию. NK-клетки здесь особо интересны: есть надежда, что они могут лучше лечить при некоторых показаниях, и при этом более безопасны, относительно просты в производстве и недороги. Что же сделало их такими особенными?
NK-клетки: кто они?

Рисунок 1. Какие они, прирожденные убийцы?
MHC, совместимость тканей и естественные киллеры
Презентация антигенов и уничтожение опухолей

NK-клетки vs. T-клетки
То есть, полученных от донора; в отличие от аутологичных — полученных от пациента.
Дело в том, что генная модификация может быть полезна и NK-клеткам — для придания дополнительной специфичности и эффективности. Об этом мы поговорим ниже.
В то же время для Т-клеток как раз метод их производства имеет серьезные ограничения, включая наработку требуемого количества клеточного материала. Например, у пациента с иммуносупрессией после пройденного лечения первой линии (химиотерапией) может быть просто недостаточно таких клеток для проведения аутологичной терапии. Ну и это просто долго, дорого и технологически сложно, что делает такое лечение экономически не очень эффективным, а значит, труднодоступным для возмещения затрат системами здравоохранения [18].
С другой стороны, NK-клетки, как немодифицированные, так и измененные генной инженерией, уже показывают многообещающие результаты в ранних клинических исследованиях без существенных нежелательных явлений, зачастую сопровождающих Т-клеточное лечение. Речь о следующих опасных феноменах:
Биология естественных киллеров
Человеческие NK-клетки широко распространены в лимфоидных и нелимфоидных тканях, таких как кровь, ткани печени, матки и селезенки. Они весьма разнородны — отличаются функционалом, стадиями созревания и экспрессией рецепторов [21]. По рецепторам их и классифицируют: по отсутствию CD3 (маркера Т-клеток) и наличию CD56-поверхностных маркеров, причем по уровню экспрессии последнего их дополнительно подразделяют на CD56 bright CD16 dim/− и CD56 dim CD16 + . Представителей первой группы считают менее зрелыми (и при этом мощными продуцентами цитокинов), а второй, напротив, более зрелыми (и мало секретирующими цитокины), но обладающими наибольшей цитотоксичностью.
Приблизительно 90% циркулирующих NK-клеток считаются цитотоксическими популяциями CD56 dim CD16 + , при этом их рецептор FcγRIII (CD16) способен связываться с Fc-участком иммуноглобулина G, что важно для антителосвязанной цитотоксичности (об этом далее). У этих клеток много гранул с гранзимом и перфорином, которые они могут высвобождать, а также продуцировать цитокины (такие как фактор некроза опухоли α, TNF-α и интерферон γ, IFN-γ) — уже после распознавания ими клеток-мишеней.
Меньшая популяция CD56 bright CD16 dim/− играет преимущественно иммунорегуляторную роль, определяемую по секреции различных цитокинов (тех же TNF-α и IFN-γ), а также хемокинов . Секреция этих молекул, в свою очередь, провоцируется стимуляцией NK-клеток различными интерлейкинами , что работает как само по себе, так и может быть усилено сигналами от активирующих рецепторов. Причем такая реакция NK-клеток занимает всего несколько минут, в отличие от Т-клеток, которым требуется больше времени [22].
Это цитокины, такие как RANTES и MIP-1α/β, помогающие лейкоцитам мигрировать в ткани.
Это цитокины, играющие важную роль в процессах воспаления (и не только), такие как IL-2, IL-12, IL-15, IL-18 и IL-21. В основном они управляют развитием и жизненным циклом лейкоцитов [23], [24].
Зачем NK-клетки выделяют цитокины и хемокины?
Уничтожение аномальных клеток
NK-клетки убивают своих жертв в первую очередь литическими гранулами (granule-mediated cytotoxicity), но могут переключаться и на другой метод — опосредованный рецепторами смерти апоптоз [28]. В этом случае связывание рецепторов смерти с их лигандами на клетках-мишенях — такими как TRAIL и FasL — инициирует апоптоз путем активации каспаз-8 и −10 (рис. 4) [12].

Рисунок 4. Пути передачи сигналов, участвующих в апоптозе. Цитотоксичность, опосредованная рецептором смерти, может реализовываться путем связывания рецепторов смерти NK-клеток с их лигандами TRAIL и FasL (см. внизу рисунка слева) — они обычно экспрессируются опухолевыми клетками, — после чего активируется каспазный сигнальный каскад, приводящий к апоптозу.

Рисунок 5. Механизмы цитотоксичности NK-клеток.
Так или иначе, в медицинских целях нужно использовать превосходные цитотоксическую и цитокин/хемокин продуцирующую способности NK-клеток. Именно поэтому важно добиваться совершенствования этих способностей, производя лекарства на основе NK-клеток (об этом мы и поговорим ниже).
Рецепторы NK-клеток и их активация
| Рецептор | Лиганды |
|---|---|
| NK-активирующие рецепторы | |
| NKG2D | Стресс-индуцируемые белки MICA и MICB [32], а также ULBP1-6 |
| DNAM1 | PVR(CD155), нектин-2 (CD112) |
| NKp30 (NCR3) [33] | pp65, B7-H6, galectin-3, BAG6, и другие [34] |
| NKp44 (NCR2) | PDGF-DD, 21spe-MLL5, PCNA, и другие [35] |
| NKp46 (NCR1) | Complement factor P, viral HA, HS GAGs, (DBL)-1a domain of Plasmodium falciparum erythrocyte membrane protein-1, vimentin |
| CD16 (FcγRIII) | Fc фрагмент антител |
| NK-ингибирующие рецепторы | |
| CD94/NKG2A | HLA-E |
| KIR2DL1 | HLA-C, группы 2 |
| KIR2DL2/3 | HLA-C, группы 1 |
| KIR3DL1 | HLA-Bw4 |
| KIR3DL2 | HLA-A3, A11 |

Рисунок 6. Основные активирующие, ко-активирующие и ингибирующие рецепторы на поверхности NK-клеток.
По этим рецепторам NK-клетки можно делить на дополнительные — помимо указанных выше — подтипы. Они могут отличаться пролиферативным потенциалом (способностью к делению), чувствительностью к апоптозу и восприимчивостью к трансдукции (инфицированию) вирусными частицами [36]. Сегодня исследования в этой области продолжаются, а получаемые знания в будущем могут позволить создать более эффективную иммунотерапию NK-клетками [36].
Не NK едиными: NKT-клетки

Источники и производство NK-клеток
Клинические испытания показали: нужно использовать высокие дозы NK и многократные инфузии. Это позволяет преодолевать ингибирующее действие лигандов стресса в плазме пациентов с нейробластомой, ограничивающее эффективность терапии [22], [26]. Исходно в клинических исследованиях NK-клетки вводили в дозе 10 6 –10 9 клеток/кг, но недавно ее увеличили уже до 10 10 клеток/кг без видимого вреда для пациентов.
Потребности в NK-клетках растут, но поскольку их всего лишь 10–20% от всех лимфоцитов, много от одного донора не выделишь. А значит, нужно искусственно стимулировать NK-киллеров на размножение ex vivo, а попутно — дополнительно активировать и улучшать их функционал [22], [26].
Производство естественных клеток-киллеров для иммунотерапии
Успешное размножение NK, достаточное для клинического использования, зависит от ряда факторов, определяющих не только количество таких клеток, но и их качество (рис. 8).

Источники NK-клеток
Существуют различные источники NK: периферическая и пуповинная кровь, костный мозг, человеческие эмбриональные стволовые клетки, NK из индуцированных плюрипотентных стволовых клеток (ИПСК-NK) и NK-клеточные линии. И хотя аутологичные и аллогенные NK-клетки как будто безопасны, найти наилучший их источник — задача нетривиальная.
Однако, как это часто бывает, преимущества и недостатки идут рука об руку, и линии NK-92 здесь не стали исключением — у них часто пропадают CD16 и важные активирующие рецепторы, снижая цитотоксический потенциал этих клеток. Так выходит, что из-за короткого срока жизни они не успевают оказать свой терапевтический эффект. Кроме того, есть опасения, что эти клетки могут и сами вызвать онкогенез [18].
В последние годы все более интересно получать NK из ИПСК, — ведь такой источник способен обойти многие ограничения клеточной терапии. Эти клетки обладают плюсами NK-92 (неограниченный рост, отсутствие необходимости в донорах, готовность к использованию (off-the-shelf), однородность популяций) и лишены некоторых их минусов (например, необходимости облучения перед использованием). Но есть у них и прорывные достоинства.
Преимущества ИПСК как источника NK
В целом такие клетки прекрасно подходят для генетических модификаций, и пока они находятся в плюрипотентной стадии, их можно неограниченно размножать. Другое важное преимущество — выбор курса дифференцировки для формирования фенотипа и функциональности конечного продукта. Например, усиление сигнального пути Wnt ингибитором GSK3b запускает гемопоэз, приводящий к более высокой продукции провоспалительных цитокинов в итоговых NK, в то время как альтернативный путь, напротив, приводит к более цитотоксическому фенотипу. Благодаря выбору типа дифференцировки можно даже создавать органоспецифические фенотипы, повышая тем самым лечебный эффект этих клеток [12].
Совокупность преимуществ и немногие недостатки ИПСК, очевидно, делают такой источник одним из лучших. Убедиться в этом можно, сравнив основные характеристики различных источников в табл. 2 и на рис. 9.
- Относительно легкое получение
- Хорошо размножаются in vivo
- Хорошие данные по применению в клинических условиях
- Гетерогенные популяции клеток
- Сложности с генетической модификацией
- Ограничения в дозировании
- Содержит высокий процент NK-клеток
- Доступны для криоконсервации
- Гетерогенные популяции клеток
- Хорошо охарактеризованные гомогенные популяции клеток
- Могут быть легко генетически модифицированы
- Нет ограничений в дозировании
- Опухолевые клетки, требующие облучения перед инфузией
- Потеря важных рецепторов, например, CD16
- Ограниченная экспансия in vivo
- Хорошо охарактеризованные гомогенные популяции клеток
- Позволяют избежать проблем, связанных с донорскими клетками (выбор подходящего донора, контаминация донорского материала)
- Потенциал для углубленных доклинических испытаний
- Хорошо охарактеризованный генетический профиль
- Простота генетической модификации на стадии ИПСК
- Нет ограничений в дозировании
- Потенциал для самых разных улучшений путем инжиниринга
- Не нужно облучать — имеют хорошую выживаемость in vivo
- Можно использовать готовыми (off-the-shelf) для лечения самых разных онкозаболеваний
- Более сложное производство

Рисунок 9. Источники и производство NK-клеточных продуктов.
- NK92-клеточные линии широко применялись в качестве источника NK, ведь они неограниченно размножаются in vitro и легко переносят заморозку/оттаивание. Однако как злокачественные клетки (полученные из NK-клеток лимфомы), NK92 даже после генетической инженерии с целью внедрения CAR должны подвергаться летальному облучению перед инфузией пациентам.
- Первичные NK-клетки могут быть выделены напрямую из периферической или пуповинной крови здоровых доноров, затем они могут быть активированы, генетически изменены с внедрением в них вирусными векторами (например, лентивирусом или ретровирусом) CAR, — после чего размножены в особой среде, содержащей цитокины (и соответствующей требованиям GMP для клинического применения).
- NK-клетки могут быть также дифференцированы из CD34 + гемопоэтических предшественников с использованием коктейля из цитокинов при культивировании. Полученные в итоге NK модифицируют рецептором CAR и размножают in vitro перед инфузией.
- Недавно привлекательным источником NK-клеток стали ИПСК — во многом благодаря неограниченной способности к делению. ИПСК можно превратить в предшественники CD34 + и затем в NK-клетки, а если внедрить в ИПСК CAR — то и в CAR-NK-клетки. Так что в этом случае можно достаточно простым и элегантным (но при этом высокотехнологичным) способом получать готовые к применению (off-the-shelf) CAR-NK-клеточные продукты.
NK в клинике: основные стратегии
Это такая трансплантация, при которой из-за невозможности найти близко совпадающего по HLA-комплексам донора клетки для адоптивного переноса берут у людей, совпадающих по этим маркерам лишь частично. Обычно это близкие родственники: например, у родителей с их детьми всегда 50% соответствие по HLA. У братьев и сестер эти антигенные комплексы тоже могут совпадать наполовину, — но тут уже шансы такого соответствия 1 к 2. Такая технология считается продвинутой во многом потому, что пока еще относительно нова, и услугу эту могут предложить далеко не все медицинские центры.
Кстати, терапия NK-клетками может применяться и в сочетании с традиционными терапевтическими протоколами (химиотерапией, например), что также может помочь ей более эффективно лечить онкологические болезни (рис. 10) [40].


Рисунок 11. Фундаментальные основы инжиниринга трех поколений CAR-NK-клеток. Сам по себе CAR для NK чем-то похож на аналогичный для Т-клеток, но в нем могут быть и отличия. Например, подобно клеткам CAR-T , в NK этот рецептор имеет три основные части: внеклеточную (антиген-детектирующий домен), состоящую из одноцепочечного вариабельного фрагмента (scFv) для нацеливания на специфический опухолевый антиген; трансмембранную; и внутриклеточную (сигнальный домен). Первое поколение CAR-NK-клеток имело в качестве сигнального домена только CD3-ζ (дзета) цепь. В дальнейшем исследования показали, что добавление одного или двух ко-стимуляторных доменов улучшает потенциал и цитотоксичность CAR-NK-клеток. Поэтому второе поколение, помимо первичной CD3-ζ цепи, имеет также CD-28 (или даже комбинацию данного домена с дополнительной сигнальной молекулой 4-1BB). CAR третьего поколения может включать активирующий рецептор (NKG2D), который может быть собран так, чтобы содержать сигнальные молекулы: CD3-ζ и DAP10/12. Было обнаружено, что CD3-ζ имеет лучшие сигнальные свойства, чем DAP10, при этом DAP12, видимо, может активировать NK-клетки даже еще лучше, чем CD3-ζ и DAP10. Так или иначе, вся эта конструкция работает: связывание антигена с рецептором NK-клеток или получение такими клетками сигналов от активирующих рецепторов (таких как NKG2D) приводит к передаче сигнала внутрь клетки, за этим следует активация NK, высвобождение литических ферментов, продукция цитокинов, а также их размножение и включение в защитный противоопухолевый ответ и других иммунных клеток.
Какое будущее ждет прирожденных убийц?
Но ученые не были бы учеными, если бы пользовались только тем, что создала природа и никак не пытались бы все это улучшить. В области NK-лечения активно пробуют комбинированную терапию с использованием антител, а также подход CAR-NK. Он уже демонстрирует обнадеживающие результаты в уничтожении различных злокачественных новообразований — как гематологических, так и солидных.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Иммунная система способна бороться с раком своими силами. Главное, чтобы на поверхности активно размножающихся болезнетворных клеток оказались специальные молекулы, которые привлекают клеточных убийц.
Недоверчивые убийцы
Иммунная система человека состоит из сложного комплекса белков, клеток, тканей и органов, которые обеспечивают безопасность организма на разных этапах взаимодействия с внешней средой. Одни составляющие защищают организм от инфекций, другие — от внутренних сбоев.
Детектор рака
Предполагается, что NK находят опухоль с помощью рецептора NKG2D, который распознает многочисленные комплементарные участки (лиганды) на поверхности активно размножающихся больных клеток. Молекулярные остовы, на которые реагируют рецепторы NKG2D, присутствуют и на здоровых клетках. Однако на поверхности клеток рака их особенно много. По всей видимости, именно они привлекают клетки NK. За прошедшее десятилетие учёные выяснили, что опухоли с большим количеством лигандов к рецептору NKG2D погибают из-за чрезмерной атаки киллеров. Блокировка и дефицит рецептора NKG2D напротив, способствует росту и процветанию различных форм рака. Предположительно, судьба опухоли зависит от наличия в организме NK, а также есть ли на поверхности раковых клеток достаточное количество молекулярных остовов, которые привлекут их внимание киллера. Исследователи надеются, что рано или поздно знания о детекторе и уничтожителе рака позволят разработать препараты, которые либо спровоцируют иммунную систему на точечную атаку, либо заменят её.
Иммунитет против рака
Биологи попробовали остановить экспериментальный онкогенез, но пришли к выводу, что сделать это можно лишь превентивно. Так, NK, введённые в организм безлимфоцитных мышей за четыре дня до инъекции опухолевых клеток, полностью останавливали онкогенез. Зато опухолевые клетки, которым никто не помешал в самом начале болезнетворного пути, полностью игнорировали запоздалое появление киллеров. Такими экспериментами учёные ещё раз подтвердили предположение о том, что именно NK противостоят раку.
Исследователи уверены, что результаты экспериментов, опубликованные в статье Intravital Imaging Reveals Distinct Dynamics for Natural Killer and CD8+ T Cellsduring Tumor Regression в журнале Cell, помогут разобраться с противораковым иммунитетом и разработать принципиально новые точечные препараты, которые заставят организм самостоятельно бороться с недугом.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
по теме

Мнение
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.

по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Читайте также:

