Клинические рекомендации гепатит у детей что это
Обновлено: 19.04.2024
Аутоиммунный гепатит (АИГ) – прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характеризующееся наличием перипортального гепатита, гипергаммаглобулинемии, печеночно-ассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию.
Классификация
• Аутоиммунный гепатит 1-го типа, высокой степени активности с внепеченочными проявлениями (аутоиммунный тиреоидит).
АИГ 1-го типа характеризуется наличием в сыворотке антинуклеарных (antinuclear antibodies, ANA) и/или антигладкомышечных антител (smooth muscle antibody, SMA) в титре ≥1:80 у взрослых и ≥1:20 у детей. На долю этого типа, представляющего собой классический вариант болезни, приходится более 90% всех случаев АИГ. АИГ 1-го типа встречается в любом возрасте, но чаще от 10 до 20 лет или от 45 до 70 лет.
При АИГ 2-го типа в сыворотке определяются антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек типа 1 (anti-LKM 1). АИГ 2-го типа составляет около 3-4% всех случаев АИГ, большую часть больных составляют дети от 2 до 14 лет. Заболевание может протекать тяжело, вплоть до развития фульминантного гепатита и быстрым прогрессированием до стадии цирроза. Возможно сочетание АИГ 2-го типа с инсулинзависимым диабетом, витилиго и тиреоидитом. АИГ 2-го типа более резистентен к иммуносупрессивной терапии; отмена препаратов обычно ведет к рецидиву.
Выделение АИГ 3-го типа большинством специалистов не поддерживается, так как его серологический маркер антитела к растворимому печеночному антигену (анти-SLA) встречается как при АИГ 1-го типа, так и при АИГ 2-го типа [1, 2,3,4,5,6].
Этиология и патогенез
Эпидемиология
АИГ рассматривается как относительно редкая болезнь: его распространенность в Европе и США составляет 3-17 случаев на 100 000 населения, а ежегодная заболеваемость – 0,1-1,9 случаев на 100 000.
В России в структуре хронических гепатитов у детей доля АИГ составляет 2,0%. Девочки и женщины составляют 75% больных.
Диагностика
• отсутствие в анамнезе недавнего приема гепатотоксичных препаратов [1,2,3,4,9,10, 12].
• При проведении клинического осмотра рекомендуется включать: измерение роста и массы тела, температуры тела; состояния сердечно-сосудистой системы; выявление иктеричности кожи и склер, телеангиэктазий; гепато- или спленомегалии [1,2,3,6]. У ряда больных определяется пальпаторная болезненность в правом подреберье
Комментарии: Аутоиммунный гепатит характеризуется широким спектром клинических проявлений: от бессимптомного до тяжелого, с наличием или без внепеченочных проявлений, которые могут касаться почти всех органов и систем.
АИГ у детей в 50-65% характеризуется внезапным началом и проявлением клинических симптомов, сходных с симптомами острого вирусного гепатита (резкая слабость, тошнота, анорексия, выраженная желтуха, иногда лихорадка).
В ряде случаев заболевание развивается незаметно с астеновегетативных проявлений, артралгий, миалгий, болей в области правого подреберья, незначительной желтухи. Иной вариант начала болезни – появление лихорадки с внепеченочными проявлениями (аутоиммунный тиреоидит, язвенный колит, гемолитическая анемия, идиопатическая тромбоцитопения, сахарный диабет, целиакия, гломерулонефрит и др.). Желтуха при этом варианте течения появляется позже. Заболевание непрерывно прогрессирует и не имеет самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических показателей не происходит. [4,9,10, 12, 20].
• Уровень щелочной фосфатазы обычно нормальный или слегка повышен, может быть повышена активность гаммаглютамилтранспептидазы (ГГТ).
Комментарии: у большинства больных с АИГ в сыворотке крови обнаруживают антинуклеарные (ANA) и/или антигладкомышечные антитела (SMA) - при АИГ 1-го типа или антитела к микросомам клеток печени и почек (anti-LKM 1) - при АИГ 2-го типа. Серонегативность по антимитохондриальным антителам (AMA).
Пациентов с клинической картиной АИГ серонегативных по ANA, SMA, anti-LKM 1 необходимо протестировать на наличие других аутоантител: anti-SLA, anti-LC1, pANCA и др.
Комментарии: Клинический анализ крови больных с АИГ может выявить повышение СОЭ (часто значительное), умеренно выраженную тромбоцитопению, реже – лейкопению; анемию.
Комментарии: УЗИ печени и селезенки позволяют выявить увеличение печени и реже селезенки, признаки портальной гипертензии и цирроза печени.
• Рекомендовано проведение эзофагогастродуоденоскопии при наличии соответствующих жалоб или признаков портальной гипертензии [3,5,6].
• Рекомендуется проведение биопсии печени, дающей возможность определения степени активности воспалительного процесса и стадии заболевания, а также исключения других нозологических форм.
Комментарии: Гистологическая картина при АИГ характеризуется наличием перипортального или перисептального гепатита: лимфоплазмоцитарная инфильтрация в сочетании или без лобулярного компонента и порто-портальных или порто-центральных ступенчатых некрозов, часто с образованием розеток печеночных клеток и узловой регенерации.
Необходимо отметить, что специфических гистологических признаков АИГ не существует, и отсутствие плазмоцитарной инфильтрации не исключает диагноз. Портальные повреждения обычно не затрагивают желчные протоки, гранулемы встречаются редко. Иногда встречаются центролобулярные (в 3-й зоне ацинуса) повреждения. При всех формах заболевания присутствует выраженный в той или иной степени фиброз.
• Скрининговое обследование на АИГ не проводится ввиду относительной редкости заболевания и отсутствия надежных скрининговых маркеров. Вместе с тем АИГ рекомендуется включать в круг дифференциального диагноза в случаях любого (острого или хронического) гепатита неуточненной этиологии, а также известной этиологии при атипичном течении, принимая во внимание возможность развития перекрестных синдромов.
Лечение
• В связи с оотсутствием возможности проведения этиотропного лечения рекомендуется проводить патогенетическую иммуносупрессивную терапию, основой которой в настоящее время являются глюкокортикостероиды (ГКС). [2,3,5,6, 10, 12].
Комментарии: Препаратами выбора служат преднизолонж,вк или метилпреднизолонж,вк; применение последнего может быть сопряжено с меньшими побочными эффектами ввиду практически отсутствующей минералокортикоидной активности. С целью повышения эффективности иммуносупрессии и уменьшения дозы и, соответственно, побочного действия кортикостероидов, к терапии нередко добавляется азатиопринж,вк, представляющий собой производное 6-меркаптопурина и обладающий антипролиферативной активностью.
• Рекомендуется иммуносупрессивную терапию у детей начинать сразу после постановки диагноза АИГ, вне зависимости от клинической симптоматики
- монотерапия преднизолономж,вк в высокой начальной дозе 60 мг/сут с быстрым снижением в течение 1 месяца до 20 мг/сут.
- комбинированная терапия включает назначение преднизолона в дозе 30 мг/сут и азатиопринаж,вк в дозе 50 мг/сут с быстрым снижением дозы преднизолона на 10 мг/сут после первой недели и на 5 мг/сут после второй недели терапии до поддерживающей дозы 10 мг/сут
Комментарии: Целью лечения является достижение полной ремиссии не только на биохимическом, но и на морфологическом уровне. При этом уменьшение выраженности морфологических признаков активности запаздывает по сравнению с клиническими данными и лабораторными показателями. По данным литературы, полное исчезновение биохимических, серологических и гистологических признаков заболевания, позволяющее ставить вопрос об отмене препаратов, наблюдается лишь у 30% пациентов.
Возможность отмены иммуносупрессоров рассматривается у пациентов не ранее, чем через 24 мес после достижения биохимической ремиссии. Перед отменой терапии целесообразно выполнение биопсии печени для констатации отсутствия некровоспалительных изменений. Учитывая высокую частоту рецидива заболевания, обязательно динамическое наблюдение за пациентом с исследованием биохимических показателей (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)) 1 раз в 3 мес, иммунологических (γ-глобулинов, IgG) – 1 раз в 6 мес.
Рецидив констатируется по повышению активности аминотрансфераз, с клинической симптоматикой либо без нее, во время лечения, в период снижения доз иммуносупрессоров или на фоне полной отмены препаратов. По обобщенным литературным данным, рецидив наблюдается у 50% пациентов в течение 6 мес после прекращения терапии и у 80% через 3 года. Рецидив АИГ требует возвращения к инициирующим дозам преднизолона и азатиоприна, с последующим снижением доз до поддерживающих.
Первичная резистентность к иммуносупрессивной терапии, встречается у 5-14% больных с подтвержденным диагнозом АИГ. Эту небольшую группу пациентов можно четко выделить уже через 2 недели после начала лечения: показатели печеночных проб у них не улучшаются, а субъективное самочувствие остается прежним или даже ухудшается, что требует тщательного пересмотра первоначального диагноза для исключения других причин острого или хронического гепатита. Если диагноз АИГ подтверждается, такой пациент рассматривается в качестве кандидата на альтернативные методы терапии, либо, в случае неуклонного прогрессирования, на трансплантацию печени.
• Отсутствие достаточного эффекта или плохая переносимость преднизолона и азатиоприна дает основание попытаться назначить другие иммуносупрессоры.
Рекомендуется терапия с применением циклоспоринаж, будесонидаж,вк, такролимусаж, циклофосфамидаж,вк при АИГ, в том числе и у детей.
Комментарии: Циклоспорин А является селективным блокатором Т-клеточного звена иммунного ответа посредством репрессии гена, кодирующего интерлейкин 2. Применялся у пациентов с АИГ в дозировке 2,5-5 мг/кг/сут. Была продемонстрирована индукция стойкой ремиссии АИГ на фоне лечения циклоспорином как у детей, так и взрослых. В некоторых случаях комбинировался с преднизоном и азатиоприном. Применение представляет собой возможную терапевтическую альтернативу при АИГ, резистентном к другим препаратам. Назначение циклоспорина может рассматриваться и в тех случаях, когда речь идет о предупреждении задержки роста у детей и подростков [8].
Синтетический глюкокортикостероид будесонид характеризуется активным печеночным метаболизмом, высокой аффинностью к глюкокортикоидным рецепторам и низкой частотой системных побочных эффектов. При пероральном приеме препарат на 90% задерживается печенью, где в высоких концентрациях воздействует на патогенные лимфоциты. Исследования продемонстрировали неоднозначные результаты относительно частоты достижения ремиссии АИГ. По-видимому, основное преимущество будесонида перед преднизолоном заключается в возможности длительной поддерживающей терапии у больных на доцирротической стадии с рано проявляющимся побочным действием системных стероидов.
Такролимус - макролидное лактоновое соединение, имеющее аналогичный циклоспорину механизм действия, но более выраженный и опосредованный связыванием с другим иммунофиллином. Пилотные исследования продемонстрировали возможность достижения биохимической ремиссии на фоне длительного применения такролимуса, в том числе у стероидорезистентных больных АИГ. Дозировка – 0,05-0,1 мг/кг/сут. Из нежелательных явлений чаще всего отмечается умеренное повышение креатинина и азота мочевины.
Циклофосфамид назначается вместе с преднизолоном в дозе 1–1,5 мг/кг/сут, как правило, у пациентов с непереносимостью азатиоприна. У некоторых больных возможен альтернирующий прием (50 мг через день). Длительное лечение нежелательно ввиду риска гематологических побочных эффектов.
• В связи с наличием в настоящее время реальной возможности проведения трансплантации печени у детей рекомендуется стремиться к наиболее ранней диагностике АИГ и своевременному выявлению показаний к проведению трансплантации печени у детей с признаками цирроза печени (ЦП), печеночно- клеточной декомпенсацией и развитием гепатоцеллюлярной карциномы
Комментарии: Обычно основанием для включения в лист ожидания служит появление признаков декомпенсации цирроза или кровотечение из варикозно расширенных вен пищевода. Однако явная резистентность к проводимой терапии и неуклонное прогрессирование заболевания позволяют рассматривать в качестве кандидатов на пересадку печени больных на доцирротической стадии. В этих случаях показания определяются как множественными рецидивами на фоне применения стандартных и альтернативных схем медикаментозной иммуносупрессии, так и выраженными побочными эффектами стероидной и цитостатической терапии: остеопорозом, артериальной гипертензией, изъязвлениями пищеварительного тракта, диабетом, лейкопенией. В качестве признаков угрожающей печеночной недостаточности рассматриваются нарастающая гипербилирубинемия и мультилобулярные некрозы в биоптате.
Прогноз трансплантации благоприятный: 5-летняя выживаемость превышает 90%. Вместе с тем следует учитывать возможность рецидива, частота которого составляет в среднем 10-35%. В то же время посттрансплантационная иммуносупрессия, в первую очередь ГКС, не только предотвращают отторжение, но и позволяют купировать рецидив.
Прогноз
АИГ без проведения необходимого лечения имеет плохой прогноз: 5-летняя выживаемость у таких больных составляет 50%, 10-летняя - 10%. В то же время, своевременное применение современных схем иммуносупрессии позволяет контролировать течение заболевания.
Факторами риска неблагоприятного течения являются: поздняя диагностика, высокая активность воспаления, позднее начало лечения, детский возраст, а также генотип HLA DR3. Менее благоприятен прогноз у пациентов с АИГ 2-го типа. У них заболевание характеризуется более быстрым прогрессированием с исходом в цирроз печени, а эффективность иммуносупрессивной терапии значительно ниже.
Профилактика
Первичная профилактика не разработана, вторичная заключается в ранней диагностике, диспансерном наблюдении больных и длительной иммуносупрессивной терапии.
Диагностика и подбор иммуносупрессивной терапии осуществляется в специализированном стационаре, в котором имеются специалисты (гастроэнтеролог, гепатолог) с опытом ведения данной категории пациентов.
Дальнейшее наблюдение ребенка с АИГ включает: регулярное контрольное обследование с оценкой эффективности проводимой терапии в стационаре/дневном стационаре не менее 2 раз в год (средняя длительность пребывания в зависимости от тяжести состояния может составить от 14 до 28 дней).
При достижении ремиссии больной АИГ подлежит наблюдению педиатром, гастроэнтерологом (гепатологом) не реже 1 раза в три месяца на протяжении 2 лет с обязательным определением лабораторных и серологических маркеров активности процесса; в дальнейшем – наблюдение специалистами и лабораторный контроль с частотой в 6-12 месяцев (по показаниям).
В период обострения врачебное наблюдение и лабораторное обследование проводится не реже 1 раза в 10 дней; по показаниям ребенка госпитализируют для коррекции терапии и стабилизации состояния.
Аутоиммунный гепатит (АИГ) – прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характеризующееся наличием перипортального гепатита, гипергаммаглобулинемии, печеночно-ассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию.
Классификация
• Аутоиммунный гепатит 1-го типа, высокой степени активности с внепеченочными проявлениями (аутоиммунный тиреоидит).
АИГ 1-го типа характеризуется наличием в сыворотке антинуклеарных (antinuclear antibodies, ANA) и/или антигладкомышечных антител (smooth muscle antibody, SMA) в титре ≥1:80 у взрослых и ≥1:20 у детей. На долю этого типа, представляющего собой классический вариант болезни, приходится более 90% всех случаев АИГ. АИГ 1-го типа встречается в любом возрасте, но чаще от 10 до 20 лет или от 45 до 70 лет.
При АИГ 2-го типа в сыворотке определяются антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек типа 1 (anti-LKM 1). АИГ 2-го типа составляет около 3-4% всех случаев АИГ, большую часть больных составляют дети от 2 до 14 лет. Заболевание может протекать тяжело, вплоть до развития фульминантного гепатита и быстрым прогрессированием до стадии цирроза. Возможно сочетание АИГ 2-го типа с инсулинзависимым диабетом, витилиго и тиреоидитом. АИГ 2-го типа более резистентен к иммуносупрессивной терапии; отмена препаратов обычно ведет к рецидиву.
Выделение АИГ 3-го типа большинством специалистов не поддерживается, так как его серологический маркер антитела к растворимому печеночному антигену (анти-SLA) встречается как при АИГ 1-го типа, так и при АИГ 2-го типа [1, 2,3,4,5,6].
Этиология и патогенез
Эпидемиология
АИГ рассматривается как относительно редкая болезнь: его распространенность в Европе и США составляет 3-17 случаев на 100 000 населения, а ежегодная заболеваемость – 0,1-1,9 случаев на 100 000.
В России в структуре хронических гепатитов у детей доля АИГ составляет 2,0%. Девочки и женщины составляют 75% больных.
Диагностика
• отсутствие в анамнезе недавнего приема гепатотоксичных препаратов [1,2,3,4,9,10, 12].
• При проведении клинического осмотра рекомендуется включать: измерение роста и массы тела, температуры тела; состояния сердечно-сосудистой системы; выявление иктеричности кожи и склер, телеангиэктазий; гепато- или спленомегалии [1,2,3,6]. У ряда больных определяется пальпаторная болезненность в правом подреберье
Комментарии: Аутоиммунный гепатит характеризуется широким спектром клинических проявлений: от бессимптомного до тяжелого, с наличием или без внепеченочных проявлений, которые могут касаться почти всех органов и систем.
АИГ у детей в 50-65% характеризуется внезапным началом и проявлением клинических симптомов, сходных с симптомами острого вирусного гепатита (резкая слабость, тошнота, анорексия, выраженная желтуха, иногда лихорадка).
В ряде случаев заболевание развивается незаметно с астеновегетативных проявлений, артралгий, миалгий, болей в области правого подреберья, незначительной желтухи. Иной вариант начала болезни – появление лихорадки с внепеченочными проявлениями (аутоиммунный тиреоидит, язвенный колит, гемолитическая анемия, идиопатическая тромбоцитопения, сахарный диабет, целиакия, гломерулонефрит и др.). Желтуха при этом варианте течения появляется позже. Заболевание непрерывно прогрессирует и не имеет самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических показателей не происходит. [4,9,10, 12, 20].
• Уровень щелочной фосфатазы обычно нормальный или слегка повышен, может быть повышена активность гаммаглютамилтранспептидазы (ГГТ).
Комментарии: у большинства больных с АИГ в сыворотке крови обнаруживают антинуклеарные (ANA) и/или антигладкомышечные антитела (SMA) - при АИГ 1-го типа или антитела к микросомам клеток печени и почек (anti-LKM 1) - при АИГ 2-го типа. Серонегативность по антимитохондриальным антителам (AMA).
Пациентов с клинической картиной АИГ серонегативных по ANA, SMA, anti-LKM 1 необходимо протестировать на наличие других аутоантител: anti-SLA, anti-LC1, pANCA и др.
Комментарии: Клинический анализ крови больных с АИГ может выявить повышение СОЭ (часто значительное), умеренно выраженную тромбоцитопению, реже – лейкопению; анемию.
Комментарии: УЗИ печени и селезенки позволяют выявить увеличение печени и реже селезенки, признаки портальной гипертензии и цирроза печени.
• Рекомендовано проведение эзофагогастродуоденоскопии при наличии соответствующих жалоб или признаков портальной гипертензии [3,5,6].
• Рекомендуется проведение биопсии печени, дающей возможность определения степени активности воспалительного процесса и стадии заболевания, а также исключения других нозологических форм.
Комментарии: Гистологическая картина при АИГ характеризуется наличием перипортального или перисептального гепатита: лимфоплазмоцитарная инфильтрация в сочетании или без лобулярного компонента и порто-портальных или порто-центральных ступенчатых некрозов, часто с образованием розеток печеночных клеток и узловой регенерации.
Необходимо отметить, что специфических гистологических признаков АИГ не существует, и отсутствие плазмоцитарной инфильтрации не исключает диагноз. Портальные повреждения обычно не затрагивают желчные протоки, гранулемы встречаются редко. Иногда встречаются центролобулярные (в 3-й зоне ацинуса) повреждения. При всех формах заболевания присутствует выраженный в той или иной степени фиброз.
• Скрининговое обследование на АИГ не проводится ввиду относительной редкости заболевания и отсутствия надежных скрининговых маркеров. Вместе с тем АИГ рекомендуется включать в круг дифференциального диагноза в случаях любого (острого или хронического) гепатита неуточненной этиологии, а также известной этиологии при атипичном течении, принимая во внимание возможность развития перекрестных синдромов.
Лечение
• В связи с оотсутствием возможности проведения этиотропного лечения рекомендуется проводить патогенетическую иммуносупрессивную терапию, основой которой в настоящее время являются глюкокортикостероиды (ГКС). [2,3,5,6, 10, 12].
Комментарии: Препаратами выбора служат преднизолонж,вк или метилпреднизолонж,вк; применение последнего может быть сопряжено с меньшими побочными эффектами ввиду практически отсутствующей минералокортикоидной активности. С целью повышения эффективности иммуносупрессии и уменьшения дозы и, соответственно, побочного действия кортикостероидов, к терапии нередко добавляется азатиопринж,вк, представляющий собой производное 6-меркаптопурина и обладающий антипролиферативной активностью.
• Рекомендуется иммуносупрессивную терапию у детей начинать сразу после постановки диагноза АИГ, вне зависимости от клинической симптоматики
- монотерапия преднизолономж,вк в высокой начальной дозе 60 мг/сут с быстрым снижением в течение 1 месяца до 20 мг/сут.
- комбинированная терапия включает назначение преднизолона в дозе 30 мг/сут и азатиопринаж,вк в дозе 50 мг/сут с быстрым снижением дозы преднизолона на 10 мг/сут после первой недели и на 5 мг/сут после второй недели терапии до поддерживающей дозы 10 мг/сут
Комментарии: Целью лечения является достижение полной ремиссии не только на биохимическом, но и на морфологическом уровне. При этом уменьшение выраженности морфологических признаков активности запаздывает по сравнению с клиническими данными и лабораторными показателями. По данным литературы, полное исчезновение биохимических, серологических и гистологических признаков заболевания, позволяющее ставить вопрос об отмене препаратов, наблюдается лишь у 30% пациентов.
Возможность отмены иммуносупрессоров рассматривается у пациентов не ранее, чем через 24 мес после достижения биохимической ремиссии. Перед отменой терапии целесообразно выполнение биопсии печени для констатации отсутствия некровоспалительных изменений. Учитывая высокую частоту рецидива заболевания, обязательно динамическое наблюдение за пациентом с исследованием биохимических показателей (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)) 1 раз в 3 мес, иммунологических (γ-глобулинов, IgG) – 1 раз в 6 мес.
Рецидив констатируется по повышению активности аминотрансфераз, с клинической симптоматикой либо без нее, во время лечения, в период снижения доз иммуносупрессоров или на фоне полной отмены препаратов. По обобщенным литературным данным, рецидив наблюдается у 50% пациентов в течение 6 мес после прекращения терапии и у 80% через 3 года. Рецидив АИГ требует возвращения к инициирующим дозам преднизолона и азатиоприна, с последующим снижением доз до поддерживающих.
Первичная резистентность к иммуносупрессивной терапии, встречается у 5-14% больных с подтвержденным диагнозом АИГ. Эту небольшую группу пациентов можно четко выделить уже через 2 недели после начала лечения: показатели печеночных проб у них не улучшаются, а субъективное самочувствие остается прежним или даже ухудшается, что требует тщательного пересмотра первоначального диагноза для исключения других причин острого или хронического гепатита. Если диагноз АИГ подтверждается, такой пациент рассматривается в качестве кандидата на альтернативные методы терапии, либо, в случае неуклонного прогрессирования, на трансплантацию печени.
• Отсутствие достаточного эффекта или плохая переносимость преднизолона и азатиоприна дает основание попытаться назначить другие иммуносупрессоры.
Рекомендуется терапия с применением циклоспоринаж, будесонидаж,вк, такролимусаж, циклофосфамидаж,вк при АИГ, в том числе и у детей.
Комментарии: Циклоспорин А является селективным блокатором Т-клеточного звена иммунного ответа посредством репрессии гена, кодирующего интерлейкин 2. Применялся у пациентов с АИГ в дозировке 2,5-5 мг/кг/сут. Была продемонстрирована индукция стойкой ремиссии АИГ на фоне лечения циклоспорином как у детей, так и взрослых. В некоторых случаях комбинировался с преднизоном и азатиоприном. Применение представляет собой возможную терапевтическую альтернативу при АИГ, резистентном к другим препаратам. Назначение циклоспорина может рассматриваться и в тех случаях, когда речь идет о предупреждении задержки роста у детей и подростков [8].
Синтетический глюкокортикостероид будесонид характеризуется активным печеночным метаболизмом, высокой аффинностью к глюкокортикоидным рецепторам и низкой частотой системных побочных эффектов. При пероральном приеме препарат на 90% задерживается печенью, где в высоких концентрациях воздействует на патогенные лимфоциты. Исследования продемонстрировали неоднозначные результаты относительно частоты достижения ремиссии АИГ. По-видимому, основное преимущество будесонида перед преднизолоном заключается в возможности длительной поддерживающей терапии у больных на доцирротической стадии с рано проявляющимся побочным действием системных стероидов.
Такролимус - макролидное лактоновое соединение, имеющее аналогичный циклоспорину механизм действия, но более выраженный и опосредованный связыванием с другим иммунофиллином. Пилотные исследования продемонстрировали возможность достижения биохимической ремиссии на фоне длительного применения такролимуса, в том числе у стероидорезистентных больных АИГ. Дозировка – 0,05-0,1 мг/кг/сут. Из нежелательных явлений чаще всего отмечается умеренное повышение креатинина и азота мочевины.
Циклофосфамид назначается вместе с преднизолоном в дозе 1–1,5 мг/кг/сут, как правило, у пациентов с непереносимостью азатиоприна. У некоторых больных возможен альтернирующий прием (50 мг через день). Длительное лечение нежелательно ввиду риска гематологических побочных эффектов.
• В связи с наличием в настоящее время реальной возможности проведения трансплантации печени у детей рекомендуется стремиться к наиболее ранней диагностике АИГ и своевременному выявлению показаний к проведению трансплантации печени у детей с признаками цирроза печени (ЦП), печеночно- клеточной декомпенсацией и развитием гепатоцеллюлярной карциномы
Комментарии: Обычно основанием для включения в лист ожидания служит появление признаков декомпенсации цирроза или кровотечение из варикозно расширенных вен пищевода. Однако явная резистентность к проводимой терапии и неуклонное прогрессирование заболевания позволяют рассматривать в качестве кандидатов на пересадку печени больных на доцирротической стадии. В этих случаях показания определяются как множественными рецидивами на фоне применения стандартных и альтернативных схем медикаментозной иммуносупрессии, так и выраженными побочными эффектами стероидной и цитостатической терапии: остеопорозом, артериальной гипертензией, изъязвлениями пищеварительного тракта, диабетом, лейкопенией. В качестве признаков угрожающей печеночной недостаточности рассматриваются нарастающая гипербилирубинемия и мультилобулярные некрозы в биоптате.
Прогноз трансплантации благоприятный: 5-летняя выживаемость превышает 90%. Вместе с тем следует учитывать возможность рецидива, частота которого составляет в среднем 10-35%. В то же время посттрансплантационная иммуносупрессия, в первую очередь ГКС, не только предотвращают отторжение, но и позволяют купировать рецидив.
Прогноз
АИГ без проведения необходимого лечения имеет плохой прогноз: 5-летняя выживаемость у таких больных составляет 50%, 10-летняя - 10%. В то же время, своевременное применение современных схем иммуносупрессии позволяет контролировать течение заболевания.
Факторами риска неблагоприятного течения являются: поздняя диагностика, высокая активность воспаления, позднее начало лечения, детский возраст, а также генотип HLA DR3. Менее благоприятен прогноз у пациентов с АИГ 2-го типа. У них заболевание характеризуется более быстрым прогрессированием с исходом в цирроз печени, а эффективность иммуносупрессивной терапии значительно ниже.
Профилактика
Первичная профилактика не разработана, вторичная заключается в ранней диагностике, диспансерном наблюдении больных и длительной иммуносупрессивной терапии.
Диагностика и подбор иммуносупрессивной терапии осуществляется в специализированном стационаре, в котором имеются специалисты (гастроэнтеролог, гепатолог) с опытом ведения данной категории пациентов.
Дальнейшее наблюдение ребенка с АИГ включает: регулярное контрольное обследование с оценкой эффективности проводимой терапии в стационаре/дневном стационаре не менее 2 раз в год (средняя длительность пребывания в зависимости от тяжести состояния может составить от 14 до 28 дней).
При достижении ремиссии больной АИГ подлежит наблюдению педиатром, гастроэнтерологом (гепатологом) не реже 1 раза в три месяца на протяжении 2 лет с обязательным определением лабораторных и серологических маркеров активности процесса; в дальнейшем – наблюдение специалистами и лабораторный контроль с частотой в 6-12 месяцев (по показаниям).
В период обострения врачебное наблюдение и лабораторное обследование проводится не реже 1 раза в 10 дней; по показаниям ребенка госпитализируют для коррекции терапии и стабилизации состояния.
Оглавление
Список сокращений
Анти-core – Антитела к ядерному белку вируса гепатита С
Анти-HCV – Антитела к вирусу гепатита С (суммарные)
Анти-NS3, -NS4, -NS5 – Антитела к неструктурным белкам NS3, NS4, NS5
ВОЗ – Всемирная организация здравоохранения
ДЖВП – Дискинезия желчевыводящих путей
ЖКТ – Желудочно-кишечный тракт
МЗ РФ – Министерство здравоохранения Российской Федерации
МКБ-10 – Международная классификация болезней, травм, и состояний, влияющих на здоровье 10-го пересмотра
ОКОНХ – Общероссийский классификатор отраслей народного хозяйства
ОК ПМУ – Отраслевой классификатор "Простые медицинские услуги"
ОМС – Обязательное медицинское страхование граждан
ПМУ – Простая медицинская услуга
РНК – Рибонуклеиновая кислота
ФЗ – Федеральный закон
ХГС – Хронический гепатит С
ЩФ – Щелочная фосфатаза
Ig M, G – Иммуноглобулины класса М, G
Термины и определения
Заболевание – возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Инструментальная диагностика – диагностика с использованием для обследования больного различных приборов, аппаратов и инструментов.
Исходы заболеваний – медицинские и биологические последствия заболевания.
Качество медицинской помощи – совокупность характеристик, отражающих своевременность оказания медицинской помощи, правильность выбора методов профилактики, диагностики, лечения и реабилитации при оказании медицинской помощи, степень достижения запланированного результата.
Клинические рекомендации (протокол лечения) оказания медицинской помощи детям – нормативный документ системы стандартизации в здравоохранении, определяющий требования к выполнению медицинской помощи больному при определенном заболевании, с определенным синдромом или при определенной клинической ситуации.
Клиническая ситуация – случай, требующий регламентации медицинской помощи вне зависимости от заболевания или синдрома.
Лабораторная диагностика – совокупность методов, направленных на анализ исследуемого материала с помощью различного специального оборудования.
Медицинское вмешательство – выполняемые медицинским работником по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, исследовательскую, диагностическую, лечебную, реабилитационную направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности.
Медицинская услуга – медицинское вмешательство или комплекс медицинских вмешательств, направленных на профилактику, диагностику и лечение заболеваний, медицинскую реабилитацию и имеющих самостоятельное законченное значение.
Нозологическая форма – совокупность клинических, лабораторных и инструментальных диагностических признаков, позволяющих идентифицировать заболевание (отравление, травму, физиологическое состояние) и отнести его к группе состояний с общей этиологией и патогенезом, клиническими проявлениями, общими подходами к лечению и коррекции состояния.
Осложнение заболевания – присоединение к заболеванию синдрома нарушения физиологического процесса; - нарушение целостности органа или его стенки; - кровотечение; - развившаяся острая или хроническая недостаточность функции органа или системы органов.
Основное заболевание – заболевание, которое само по себе или в связи с осложнениями вызывает первоочередную необходимость оказания медицинской помощи в связи с наибольшей угрозой работоспособности, жизни и здоровью, либо приводит к инвалидности, либо становится причиной смерти.
Пациент – физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния.
Последствия (результаты) – исходы заболеваний, социальные, экономические результаты применения медицинских технологий.
Симптом – любой признак болезни, доступный для определения независимо от метода, который для этого применялся.
Синдром – состояние, развивающееся как следствие заболевания и определяющееся совокупностью клинических, лабораторных, инструментальных диагностических признаков, позволяющих идентифицировать его и отнести к группе состояний с различной этиологией, но общим патогенезом, клиническими проявлениями, общими подходами к лечению, зависящих, вместе с тем, и от заболеваний, лежащих в основе синдрома.
Состояние – изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи.
Сопутствующее заболевание – заболевание, которое не имеет причинно-следственной связи с основным заболеванием, уступает ему в степени необходимости оказания медицинской помощи, влияния на работоспособность, опасности для жизни и здоровья и не является причиной смерти.
Тяжесть заболевания или состояния – критерий, определяющий степень поражения органов и (или) систем организма человека либо нарушения их функций, обусловленные заболеванием или состоянием либо их осложнением.
Уровень достоверности доказательств – отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Функция органа, ткани, клетки или группы клеток – составляющее физиологический процесс свойство, реализующее специфическое для соответствующей структурной единицы организма действие.
1. Краткая информация
1.1 Определение
Острый вирусный гепатит С (ВГС) – инфекционное заболевание, вызываемое РНК-содержащим вирусом гепатита С (HСV), с парентеральным механизмом передачи, в клинически выраженных случаях проявляющееся симптомами острого поражения печени и интоксикацией (с желтухой и без нее), имеющее преимущественно хроническое течение с частым развитием цирроза печени и гепатоцеллюлярной карциномы.
1.2 Этиология и патогенез
Этиология
Вирус гепатита С (HCV) был открыт в 1989 г. Houghton с соавторами. HCV содержит однонитевую РНК и относится к семейству Flaviviridae, представляя в нем третий, самостоятельный род Hepacivirus. Геном HСV кодирует структурные и неструктурные белки. К структурным белкам относятся С-core protein и гликопротеины оболочки Е1 и Е2, к неструктурным — комплекс белков, имеющих определенную ферментативную активность (NS-3— NS-5). К каждому из структурных и неструктурных белков вируса вырабатываются антитела, которые не обладают вируснейтрализующим свойством. Особенностью HСV является способность к быстрой замене нуклеотидов, что приводит к образованию большого числа генотипов, субтипов и мутантных штаммов. Выделяют 7 генотипов вируса и более 90 субтипов. Такая вариабельность генома вируса приводит к изменениям в строении антигенных детерминант, которые определяют выработку специфических антител, не способных элиминировать вирус из организма и препятствующих созданию эффективной вакцины против гепатита C.
HСV, по сравнению с вирусами HАV и HВV, малоустойчив во внешней среде и к действию физических и химических факторов. Он чувствителен к хлороформу, формалину, действию УФО, при температуре 60 о С инактивируется через 30мин, а при кипячении (100 о С) – в течение 2 мин. [1, 12, 13].
Патогенез
Вирус попадает в организм восприимчивого человека вместе с инфицированной кровью. Непременным условием развития инфекционного процесса является проникновение HСV в гепатоциты, где и происходит его репликация и взаимодействие с иммунной системой. Взаимодействие организма с HCV– иммунопатологический процесс. Поражение гепатоцитов обусловлено включением клеточных и гуморальных реакций иммунной системы, направленных в конечном счете на удаление HCV. На элиминацию HCV работают клеточные цитотоксические реакции, опосредованные различными классами клеток-эффекторов. Нарушение баланса продукции цитокинов Th1/Th2 клетками играет важнейшую роль в развитии различных форм HCV-инфекции. Усиленная продукция IL-4 и IL-10 ингибирует функцию Th1, угнетает продукцию IFN-? и IL-2, способствуя хроническому течению болезни. Возможно, сам вирус оказывает модулирующее действие на иммунный ответ и ускользает от него. НСV способен подавлять активацию СD4+, нарушая взаимодействие антигенпрезентирующих клеток и Т-лф. Возможность репликации вируса в иммунопривилегированных местах (клетках иммунной системы, тканях головного мозга) делает его недоступным для ЦТЛ. Гуморальный ответ при ВГС выражен слабее.
Кроме прямого цитопатического действия, ведущими механизмами повреждения печени являются иммунный цитолиз, апоптоз, а также аутоиммунный механизм, с которым связана высокая частота внепеченочных проявлений при НСV-инфекции (васкулит, гломерулонефрит, периферическая нейропатия, узелковый периартериит, артриты, синдром Шегрена). В генезе этих заболеваний лежат иммуноклеточные и иммунокомплексные процессы. Поэтому HCV-инфекцию возможно рассматривать как мультисистемное заболевание. Немаловажная роль отводится и иммуногенетическим факторам. Об этом свидетельствуют различия в частоте выявления ХГС в разных этнических группах, проживающих на одной территории, и то, что благоприятный исход острого ГС чаще регистрируется у больных с генотипом HLA класса ІІ [2, 10, 16].
1.3 Эпидемиология
Источником инфекции являются лица, инфицированные НСV и находящихся в инкубационном периоде (14-180 дней), больные бессимптомной острой или хронической формой ГС. Ведущее эпидемиологическое значение имеют искусственные пути передачи возбудителя, которые реализуются при проведении немедицинских и медицинских манипуляций, сопровождающихся повреждением кожи или слизистых оболочек, а также манипуляций, связанных с риском их повреждения. К немедицинским манипуляциям относят: инъекционное введение наркотических средств (наибольший риск), нанесение татуировок, пирсинга, ритуальные обряды, проведение косметических, маникюрных, педикюрных и других процедур с использованием контаминированных НСV инструментов. К основным медицинским манипуляциям, при которых возможно инфицирование НСV, относятся переливание крови или ее компонентов, пересадка органов или тканей, процедуры гемодиализа (высокий риск), а также различные парентеральные вмешательства.
Большое внимание исследователей направлено на изучение реализации естественных путей передачи HСV. Основным фактором передачи возбудителя является кровь или ее компоненты, в меньшей степени – другие биологические жидкости человека (сперма, вагинальный секрет, слезная жидкость, слюна и др.). Установлено, что инфицирующая доза HСV на 2–3 порядка выше, чем при ГВ; соответственно, вероятность инфицирования при контакте ниже. Однако большинство авторов указывают на возможность инфицирования ГС при гетеро- и гомосексуальных половых контактах – риск заражения среди постоянных гетеросексуальных партнеров, один из которых болен ХГС, составляет 1,5% (при отсутствии других факторов риска). К настоящему времени накоплено достаточно информации и о передаче ГС при бытовом общении в семье. По данным ВОЗ, вероятность инфицирования в семье может достигать 7%.
Передача вируса от инфицированной матери к ребенку возможна во время беременности и родов (риск 1-5%). Но вероятность инфицирования новорожденного значительно возрастает при высоких концентрациях НСV в сыворотке крови матери (7-12%), а также при наличии у нее ВИЧ-инфекции (14-16%). Исследования последних лет показали, что грудное вскармливание не влияет на частоту инфицирования детей [1, 10, 12].
По данным ВОЗ, около 150 млн. человек в мире инфицировано HCV, в странах Западной Европы, США на долю ГС приходиться 75-95% посттрансфузионных гепатитов. Среди больных, получавших в комплексном лечении инфузии крови, наиболее высокая инфицированность HCV регистрируется у больных гемофилией – в 45-80 %.
В России острый ГС у детей обнаруживается редко и составляет 0,55 случаев на 100 тыс. детского населения. В структуре всех острых гепатитов доля детей, больных острым ГС, в России составляет 1-2%. Среди них преобладают больные с безжелтушными формами ГС, соотношение желтушных и безжелтушных форм в детском возрасте составляет 1:10-15. Это в полной мере относится и к новорожденным, инфицированным ГС перинатально. В 90-95% случаев заболевание в раннем детском возрасте протекает в безжелтушной, субклинической и инаппарантной формах. Затяжной процесс может возникать на любом этапе болезни – и в желтушном, и в восстановительном периоде.
Одной из частых форм болезни является бессимптомная, с самого начала заболевания протекающая с умеренной гиперферментемией, сохраняющейся в дальнейшем в течение нескольких лет, то усиливаясь, то ослабевая. По данным всех исследователей частота хронизации HCV-инфекции высокая от 40-56% до 81% и более [13, 14, 17].
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
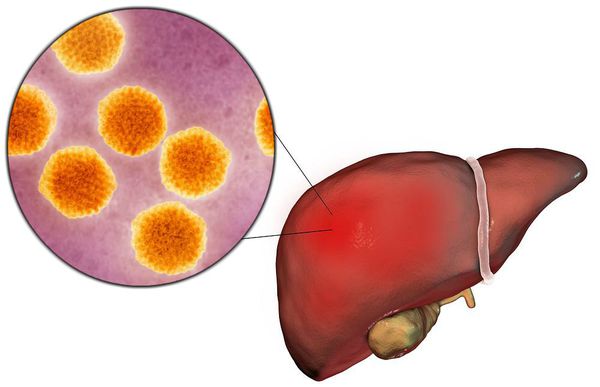
Этиология
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
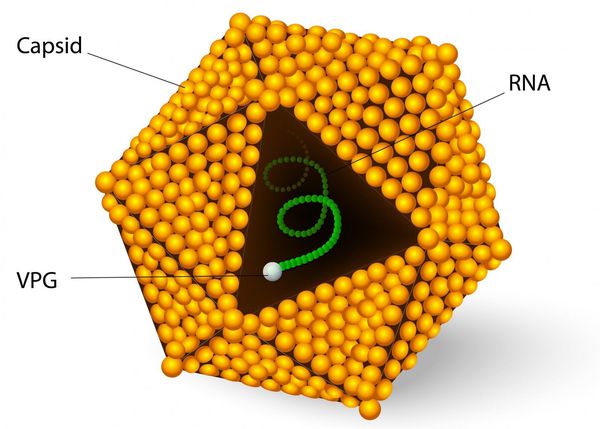
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
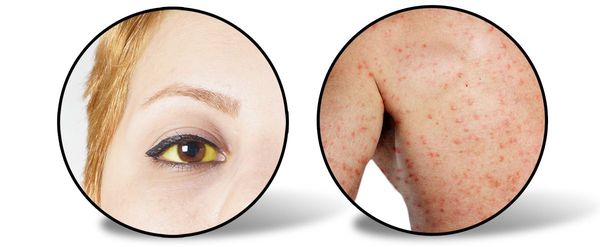
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
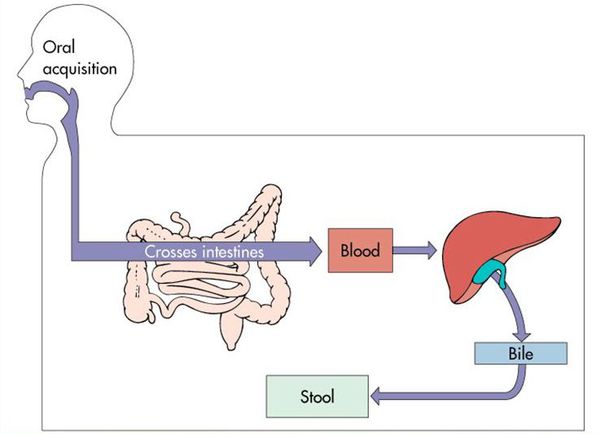
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
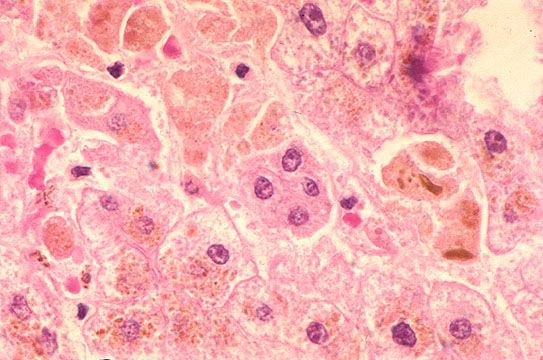
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
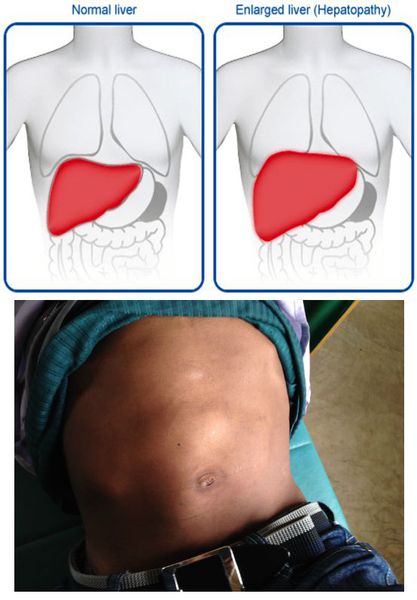
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
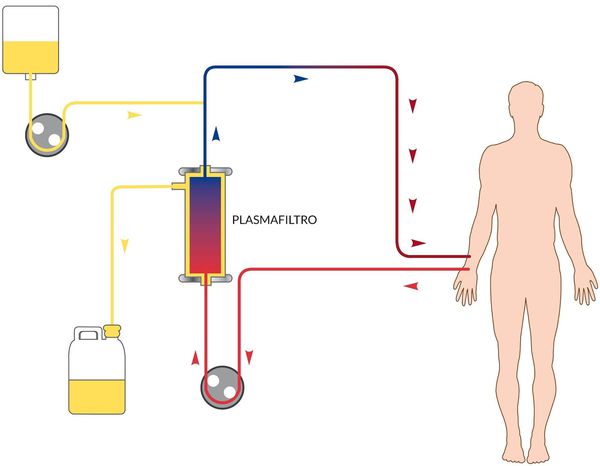
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.
Читайте также:

