Клиренс вируса что это
Обновлено: 18.04.2024
Скорость клубочковой фильтрации ( СКФ ). Механизмы ауторегуляции. Феномен Остроумова — Бейлиса. Клиренс инулина.
Основной количественной характеристикой процесса фильтрации является скорость клубочковой фильтрации (СКФ). СКФ —это объем ультрафильтрата или первичной мочи, образующийся в почках за единицу времени. Эта величина зависит от нескольких факторов: 1) от объема крови, точнее плазмы, проходящей через корковое вещество почек в единицу времени, т. е. почечного плазмотока, составляющего в среднем у здорового человека массой 70 кг около 600 мл/мин; 2) фильтрационного давления, обеспечивающего сам процесс фильтрации; 3) фильтрационной поверхности, которая равна примерно 2—3 % от общей поверхности капилляров клубочка (1,6 м2) и может изменяться при сокращении подоцитов и мезан-гиальных клеток; 4) массы действующих нефронов, т. е. числа клубочков, осуществляющих процесс фильтрации в определенный промежуток времени.
В физиологических условиях СКФ поддерживается на довольно постоянном уровне (несмотря на изменения системного артериального давления) за счет механизмов ауторегуляции.
К их числу относятся:
1) миогенная ауторегуляция тонуса приносящих артериол по принципу феномена Остроумова— Бейлиса;
2) канальцево-клубочковая обратная связь, приводящая к изменению соотношения тонуса приносящих и выносящих артериол клубочка. Вовлечение в регуляцию механизма обратной связи обусловлено изменением доставки с фильтратом в область плотного пятна (macula densa) ионов натрия и хлора, что ведет к изменению продукции в ЮГА гуморальных регуляторов: аденозина (суживающий афферентные артериолы фактор), NO (дилатирующий артериолы фактор), ренина и ангиотензина-П, кининов и простагландинов (рис. 14.6);
3) изменения числа функционирующих нефронов. Первые два механизма поддерживают постоянство кровотока в клубочках и фильтрационное давление, гуморальные регуляторы могут менять площадь фильтрационной поверхности и функции подоцитов, третий механизм определяет конечный эффект ауторегуляции СКФ в органе, что в итоге обеспечивает постоянство объема образуемой первичной мочи.
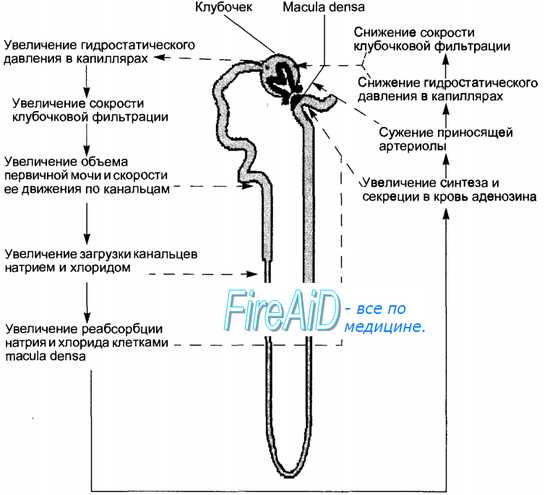
Рис. 14.6. Канальцево-клубочковая обратная связь как механизм ауторегуляции клубочковой фильтрации. Сплошные стрелки указывают последовательность реакций, штриховые стрелки — участки нефрона, где происходит соответствующий процесс. В качестве примера приведен случай первичного повышения гидростатического давления в капиллярах клубочка при расширении приносящей артериолы. В результате повышенного гидростатического давления растут скорость клубочковой фильтрации, объем образующейся первичной мочи и скорость ее продвижения по канальцам. При повышенной скорости тока мочи в проксимальных канальцах не успевает реабсорбироваться должная часть профильтровавшихся натрия и хлорида, соответственно, увеличивается загрузка дистальных отделов канальцев натрием и хлоридом и их реабсорбция клетками macula densa. Последние увеличивают синтез и секрецию в кровь аденозина, побуждают юкстагломерулярные клетки к активации синтеза и секреции ренина. Поступающий в кровь аденозин, равно как и образующийся в ней под влиянием ренина ангиотензин, вызывают сужение приносящей артериолы клубочка, снижение гидростатического давления и восстановление скорости клубочковой фильтрации.
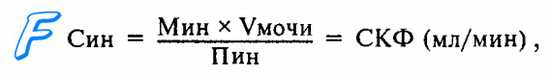
Поскольку инулин в организме отсутствует, для определения СКФ его необходимо капельно вводить в кровоток, создавая постоянную концентрацию. Это затрудняет исследование, поэтому в клинике обычно используют эндогенное вещество креатинин, концентрация которого в крови довольно стабильна.
Сравнивая клиренс инулина с клиренсом других веществ, определяют процессы, участвующие в выделении этих веществ с мочой. Если клиренс определенного вещества равен клиренсу инулина, значит вещество выделяется почками только путем фильтрации в клубочках. Если клиренс вещества больше клиренса инулина, следовательно, вещество выделяется не только за счет фильтрации, но и секрецией эпителием канальцев. Если клиренс вещества меньше, чем у инулина,— вещество после фильтрации реабсорбируется в канальцах.
В норме СКФ составляет у мужчин около 125 мл/мин, а у женщин — 110 мл/мин. В сутки образуется около 180 л первичной мочи, а за 25 мин фильтруется примерно 3 л плазмы крови, т. е. весь циркулирующий ее объем. За сутки этот объем плазмы крови фильтруется, т. е. очищается, примерно 60 раз. Так как объем конечной мочи составляет около 1,5 л в сутки, очевидно, что из объема первичной мочи за это время всасывается в канальцах обратно в кровь примерно 178,5 л жидкости.
Клиренс в медицине (англ. clearance) — скорость очищения плазмы крови, других сред или тканей организма от какого-либо вещества в процессе его биотрансформации, перераспределения в организме и (или) выделения из организма.
В сложившейся терминологии очищение плазмы от какого-либо вещества обозначают как Клиренс. данного вещества, напр. Клиренс инулина, Клиренс креатинина. В формулах К. обозначают символом С, рядом с к-рым сокращенно обозначают вещество, напр. Cin — К. инулина. В зависимости от того, роль какого органа в очищении плазмы изучается, говорят о почечном К., печеночном К. и т. д. Существует также понятие общего, или тотального плазматического К. (Стр), величина к-рого характеризует скорость очищения плазмы от вещества независимо от механизмов очищения (выделение экскреторными органами, биотрансформация с потерей исходных свойств и др.). Определив одновременно общий плазматический К. и интенсивность очищения от данного вещества почкой или печенью, рассчитывают роль этих органов в общем плазматическом К. Так была показана, напр., ведущая роль почек в очищении плазмы от пенициллина, инулина, парааминогиппурата (ПАГ) и ведущая роль печени в К. бромсульфофталеина и бенгальского розового.
Для определения общего плазматического К. индикаторное вещество однократно инъецируют в вену и через определенные интервалы времени собирают несколько проб крови для изучения динамики концентрации введенного вещества в плазме. Падение концентрации в крови некоторых веществ, напр. ПАГ, происходит по экспоненте (за равные промежутки времени концентрация снижается на одинаковую относительную часть исходной величины), других веществ, напр, бромсульфофталеина, этанола, цитембена,— в виде линейной зависимости (концентрация уменьшается на одинаковую абсолютную величину за равные интервалы времени), а некоторые вещества имеют кривую снижения концентрации в крови в виде неправильной функции. В зависимости от характера падения концентрации вещества в плазме крови для расчета К. используют различные формулы.
Тотальный плазматический Клиренс рассчитывают по формуле
где I — количество введенного в кровь вещества, S — площадь под кривой концентрации вещества в плазме (по оси ординат) за время исследования (на оси абсцисс). При экспоненциальном характере кривой концентрации, чтобы не определять площадь под ней, используют формулу
где Р0 — исходная концентрация в плазме в мг/мл, Т1/2 — время (в минутах или в часах) уменьшения концентрации вещества в плазме в 2 раза, I — количество введенного вещества.
Роль отдельных органов в К. какого-либо вещества может быть установлена по различию концентраций этого вещества в плазме притекающей к органу и оттекающей от него крови. Об этой разнице можно судить также по различию концентраций вещества в плазме и в выделяемых жидкостях (для экскреторных органов). К. вещества, обусловленный выделительной функцией, определяется по общей формуле
где V — объем секрета (экскрета), полученный за единицу времени (обычно в мл/мин), К — концентрация вещества, т. е. количество в 1 мл секрета (напр., мочи, желчи), P — концентрация вещества в плазме. Методически существенно, что для определения общего плазматического К. производят однократную инъекцию вещества; для измерения органного, в частности почечного, К. предпочтительна непрерывная инфузии, чтобы поддерживать концентрацию тест-вещества в плазме на постоянном уровне.
Клиническое значение клиренс-тестов
Наиболее широкое применение и развитие клиренс-тесты получили в изучении почечных функций. С помощью клиренс-тестов определяют почечный плазмоток, клубочковую фильтрацию, реабсорбцию и секрецию (см. Почки). При этом используют различия в почечном К. разных веществ. Определение почечного плазмотока основано на измерении К. кардиотраста, ПАГ, или гиппурона, от которых плазма крови полностью очищается при однократном прохождении через корковое вещество почки. Для измерения клубочковой фильтрации определяют К. веществ, которые фильтруются, но не секретируются и не реабсорбируются (инулин, тиосульфат натрия, полиэтиленгликоль 1000, маннитол). Полученный результат приводят к стандартной поверхности тела (1,73 м 2 ). К. инулина у человека равен 127, а клиренс ПАГ — 624 мл/мин на 1,73 м 2 . Поскольку длительная инфузии в вену р-ров инулина и других веществ, используемых для определения клубочковой фильтрации, сложна, в клинике вполне удовлетворительные результаты дает ее измерение по К. эндогенного креатинина. Когда вещество выделяется только почкой, то можно определить его К. без взятия мочи, если скорость введения вещества регулируется так, чтобы концентрация его в плазме поддерживалась на постоянном уровне, тогда количество вводимого вещества равно его К.
Поскольку определение почечного К. связано с исследованием концентрации тест-вещества в моче, то нельзя не учитывать транспорт воды в почках, а также их способность не только экскретировать, но и удерживать некоторые вещества в организме. В последнем случае концентрация вещества в моче будет меньше, чем в плазме крови. Чтобы определить, происходит ли экскреция почкой данного вещества, пользуются расчетом К. по формуле
где U — концентрация вещества в моче. Для веществ, концентрация которых в моче ниже, чем в плазме, полученная величина К. будет отрицательной; это укажет на то, что вещество удерживается в плазме, а выделяется избыток воды. Понятие о положительном и отрицательном К. важно для характеристики осмо- и ионорегулирующей функции почек.
Применение в качестве тест-веществ радиоактивных изотопов существенно расширило возможности клиренс-тестов в клин, практике и повысило их клин, значимость. По кривой спада радиоактивности над сердцем определяют эффективный почечный плазмоток и кровоток. Вещества, К. которых используется для определения клубочковой фильтрации, но имеющие в молекуле радиоактивные изотопы (инулин- 131 I, ЭДТА- 51 Cr, ЭДТА- 169 Yb), позволяют производить исследование без сбора мочи, что дает возможность определить клубочковую фильтрацию при низком диурезе. Изотопная ренография позволяет оценивать функц, состояние почек при различных их заболеваниях, эвакуаторную функцию верхних мочевых путей; ее используют для наблюдения за состоянием и функцией трансплантированной почки (см. Ренография радиоизотопная).
Клиренс-тесты в гепатологии применяют для изучения поглотительновыделительной функции печени (см.). При этом в организм вводят вещества, поглощаемые печенью и выделяемые с желчью (билирубин, бромсульфалеин, азорубин-S, бенгальский розовый, вофавердин, уевердин и др.). Чаще используют бромсульфофталеиновую пробу (см.) и вофавердиновую пробу (см.).
Для определения печеночного паренхиматозного К. применяют бенгальский розовый, меченный 131I, который обладает выраженной гепатотропностью. Кривые К. обрабатывают при помощи экспоненциального уравнения, вычисляя полупериод элиминации, время максимального уровня излучения над печенью и время появления препарата в Кишечнике. При заболеваниях печени скорость и степень поглощения и степень поглощения и экскреции краски уменьшаются: при поражении полигональных клеток в большей мере страдает процесс поглощения, а при воспалении, и особенно нарушении проходимости желчных путей,— экскреторная функция. Особенно важно сопоставление показателей очищения от препарата крови и печени. В случае препятствия оттоку желчи наблюдается нормальное или малоизмененное убывание препарата из крови при замедленном выведении его из печени; одновременное нарушение поглощения бенгальского розового позволяет предполагать поражение паренхимы. С помощью клиренс-тестов представляется возможным выявление безжелтушных форм вирусного гепатита, прогностическая оценка восстановительного периода после острого вирусного гепатита, степени поражения и динамики процесса при хронических заболеваниях печени.
Для изучения регионарного кровотока используют метод так наз. тканевого клиренса — скорости элиминации изотопов 133Xe, 85Kr, альбумина, меченного 131I и др. из исследуемой ткани (органа), в к-рой создано депо препарата.
Перспектива применения клиренс-тестов в клин, исследованиях неуклонно расширяется. С их помощью изучают обмен ряда веществ, напр. альбумина, длительность жизни эритроцитов, продукцию билирубина, биол, цикл гормонов, скорость потребления профакторов и факторов свертывающей и противосвертывающей системы крови.
Определение плазматического К. находит применение при изучении фармакокинетики лекарственных препаратов, для изучения всасывания лекарств из желудочно-кишечного тракта, распределения их в организме, роли различных органов в их выделении или разрушении. Кроме того, по Клиренсу судят об эффективности очищения организма от эндогенных и экзогенных веществ при использовании таких методов лечения, как гемодиализ (см.), перитонеальный диализ (см.), гемосорбция (см. ), лимфосорбция (см.), плазмаферез (см.), обменное замещение крови.
Библиография: Гехмосорбция, под ред. Ю. М. Лопухина, М., 1977; Графнеттерова Й. и др. Значение плазматического клиренса в изучении кинетики антибиотиков, Антибиотики, т. 5, № 3, с. 56, 1960; Лопухин Ю. М. и Молоденков М. Н. Гемосорбция, М., 1978; Основы гепатологии, под ред. А. Ф. Блюгера, с. 116, Рига, 1975; Шюк О. Функциональное исследование почек, пер. с чешек., Прага, 1975, библиогр.; Ярошевский А. Я. Клиническая нефрология, Л., 1971; Koushanpour E. Renal physiology, Philadelphia, 1976.
Данные, приведенные в статье, были получены в исследовании оригинального препарата энтекавира (Бараклюд ® ). Применение несертифицированных противовирусных средств может угрожать вашему здоровью, привести к возникновению мутантных штаммов вируса гепатита В и неэффективности дальнейшей терапии.
На примере клинического наблюдения, анализа литературы и собственных данных представлен опыт многопрофильной клиники в изучении клинической картины, течения, прогноза и лечения узелкового полиартериита, ассоциированного с инфекцией вируса гепатита В.
Ключевые слова: узелковый полиартериит, вирус гепатита В, энтекавир.
D.T. Abdurakhmanov, T.P. Rozina, P.I. Novikov
Hbv-associated Polyarteritis Nodosa
E.M. Tareyev Clinic of Nephrology, Internal and Occupational Diseases, University Clinical Hospital Three, I.M. Sechenov First Moscow State Medical University, Ministry of Health and Social Development of Russia
The authors present the experience of the multidisciplinary clinic in studying the clinical picture, course, prognosis, and treatment of polyarteritis nodosa associated with hepatitis B virus infection, by using the clinical observation as an example and analyzing the data available in the literature and their findings.
Key words: polyarteritis nodosa, hepatitis B virus, entecavir.
Гепатит В остается одной из наиболее актуальных проблем современной медицины, что связано с его большим распространением в мире (около 400 млн хронически инфицированных) и возможным неблагоприятным исходом (более чем у трети больных развиваются цирроз печени и гепатоцеллюлярная карцинома) [1, 2]. Одним из важных открытий последнего времени является установление факта внепеченочной репликации HBV, что способствовало более полному пониманию патогенеза системных проявлений HBV-инфекции и рассмотрению вирусного гепатита не только как инфекционного заболевания печени, но и как системной генерализованной вирусной инфекции. Приоритет в изучении системных проявлений HBV-инфекции не только в России, но и в мире принадлежит сотрудникам клиники им. Е.М. Тареева ФГБУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздравсоцразвития России, которые описали целый ряд разнообразных вне-печеночных поражений при хроническом гепатите В, среди которых часто встречаются суставной синдром, кожная пурпура, мембранозный нефрит, узелковый полиартериит, синдром Шегрена, реже — полимиозит, миокардит, иммунные цитопении, лимфопролиферативные заболевания [3—9].
Среди внепеченочных проявлений HBV-инфекции особое внимание ввиду тяжести и часто неблагоприятного прогноза привлекает узелковый полиартериит (УП), который представляет собой системный некротизирующий васкулит артерий среднего и мелкого калибра. УП встречается в среднем у 0,4—2% больных с HBV-инфекцией и рассматривается как основной пример доказательства этиологической роли HBV в развитии других нозологических форм, кроме болезней печени.
Среди больных УП преобладают мужчины, пик заболеваемости наблюдается в возрасте 20—40 лет.
Патогенез вирус-индуцированного УП традиционно связывают с отложением и/или образованием в сосудистой стенке иммунных комплексов, содержащих антигены HBV. Предполагается, что УП является своеобразной тяжелой формой продромального периода острого гепатита В, приобретающей самостоятельное нозологическое значение и способной становиться причиной смерти больного еще до развития клинически значимого поражения печени.
УП, ассоциированный с HBV-инфекцией, характеризуется весьма тяжелым течением. Его важнейшими клиническими проявлениями являются быстро прогрессирующая потеря массы тела с нередким развитием далеко зашедшей кахексии, а также лихорадка, астения, артралгии и миалгии. Более специфическим, однако сравнительно редким признаком является поражение кожи и подкожной клетчатки с развитием характерных болезненных узелков (в основе которых лежат аневризмы подкожных артерий и которые дали название всей болезни). Типично поражение периферической нервной системы, возникающее у подавляющего большинства больных, - множественный асимметричный мононеврит с преобладанием моторных нарушений. Среди висцеральных поражений наиболее частым является поражение почек - ишемическая нефропатия с тяжелой артериальной гипертензией, нередко злокачественной, осложненной кровоизлияниями в сетчатку глаза и развитием слепоты, а также острой левожелу-дочковой недостаточностью. Часто наблюдается быстро прогрессирующее нарушение азотвыде-лительной функции почек. Как правило, проте-инурия бывает незначительной и нефротический синдром не развивается, хотя в отдельных случаях все же отмечалось появление массивной проте-инурии, генез которой, даже в редких случаях, когда проводилось морфологическое исследование почечной ткани, оставался не ясен. Поражение желудочно-кишечного тракта проявляется, как правило, абдоминалгиями, в основе которых лежат ишемический энтерит и колит. Возможны перфорации кишечной стенки и другие хирургические осложнения. В части случаев наблюдается поражение сердца, связанное с артериальной гипертензи-ей и/или коронариитом. Более редкими, но весьма характерными проявлениями болезни у мужчин являются орхит и эпидидимит.
Основными причинами смерти больных УП бывают осложнения злокачественной артериальной гипертензии, в первую очередь острые нарушения мозгового кровообращения и острая левожелудочковая недостаточность, а также прогрессирующая почечная недостаточность, мультивисцеральные поражения и хирургические осложнения ишемического энтерита и колита. В ряде случаев причиной смерти может быть острый коронарный синдром, в том числе инфаркт миокарда как осложнение коронариита.
Особенностью клинического течения HBV-ассоциированного УП является крайне редкое поражение легких, которое, между тем, весьма типично для этого заболевания в отсутствие HBV-инфекции. В то же время при наличии HBV-инфекции чаще возникают инфаркты почек и злокачественная артериальная гипертензия. Болезнь развивается всегда остро или подостро, не позднее 6 мес с момента возникновения инфекции, первично хронические варианты течения не характерны. Первыми, как правило, появляются неспецифические признаки: похудение, лихорадка, астения, миалгии и артралгии. В течение следующих нескольких недель присоединяются множественный асимметричный неврит и/или характерные висцеральные поражения.
По данным французских исследователей, для HBV-ассоциированного УП характерна достоверно более высокая смертность больных в течение первого года болезни. В последующие годы показатели выживаемости в группе больных с HBV-инфекцией также оставались хуже, чем в группе больных УП без HBV-инфекции, однако различия утрачивали статистическую достоверность. По данным клиники им. Е.М. Тареева, уровень 5-летней выживаемости у больных с HBs-антигенемией составляет 28%, при отсутствии инфицирования — 55%.
Замечено, что, несмотря на наличие маркеров репликации у большинства больных в период развернутых клинических проявлений, поражение печени представлено гепатитом низкой степени активности, с минимально выраженным лобуляр-ным компонентом, а у небольшого числа пациентов — картиной острого гепатита. В дальнейшем активность васкулита уменьшается и на первый план в клинической картине заболевания выходит поражение печени. Таким образом, краткосрочный прогноз болезни определяется тяжестью висцерального васкулита, а долгосрочный прогноз и исход зависят от сохранения репликации вируса и наличия прогрессирующего поражения печени.
В диагностике УП могут помочь классификационные критерии Американской ревматологической ассоциации, которые были предложены в 1994 г. (табл. 1) [12].
Вирусный гепатит В является значительной проблемой у пациентов с гематологическими неопластическими заболеваниями, получающими химиотерапию. При оценке и лечении гематологических заболеваний важна идентификация пациентов с риском наличия вирусного гепатита. Серологический скрининг всех пациентов помимо тестирования поверхностного антигена гепатита В (HВsAg) должен включать тестирование антител к поверхностному антигену — anti-HBs, антител к core-антигену — anti-HBc. Современная терапия HBV-инфекции направлена на супрессию вируса. Для предупреждения HBV вирусной реактивации всем HВsAg-позитивным пациентам должна быть инициирована профилактика аналогами нуклеозидов.
Maintenance of viral hepatitis B in hematological patients
Viral hepatitis has become a significant problem in patients with hematological malignancies receiving chemotherapy. In the assessment and treatment of hematological diseases important identification of patients at risk the availability of viral hepatitis. Serologic screening for all patients should include anti-HCV, hepatitis B surface antigen (HBsAg), hepatitis B surface antibody (anti-HBs), and hepatitis B core antibody (anti-HBc) testing. Current therapies for hepatitis B (HBV) virus infection are aimed at viral suppression. In order to prevent HBV reactivation of the virus to all HBsAg-positive patients should be initiated prophylaxis with nucleoside analogues.
Печеночная дисфункция представляет собой частое осложнение химиотерапии у пациентов с гематологическими заболеваниями. Важнейшими причинами подобной дисфункции обычно являются вирусы, такие как HBV, HCV, а также вирусы герпетического ряда. Однако было показано, что тяжелые печеночные расстройства, включая фульминантные формы гепатитов, этиологически ассоциированы преимущественно с HBV по причине либо реактивации, либо усиления вирусной репликации. Вирусные гепатиты являются одной из наиболее распространенных во всем мире проблем, с возрастающим распространением у пациентов с гематологической патологией. Вопрос о том, вторична ли эта гематологическая патология относительно возникшей новой инфекции, либо это следствие реактивации латентного вируса, все еще не расшифрован [1]. Лечение вирусного гепатита В за последние 20 лет значительно продвинулось в связи с лучшим пониманием кинетики и молекулярной биологии этого вируса. К сожалению, проекция относительно бремени заболеваний, ассоциированных с вирусными гепатитами в будущем, в следующие два десятилетия потрясает с преобладанием случаев циррозов, гепатоцеллюлярной карциномы (ГЦК), а также необходимостью проведения трансплантации печени [2].Продолжающиеся усилия по развитию новых стратегий лечения являются жизненно необходимыми. Эти усилия, в конечном итоге, преследуют цель совершенствования вариантов ведения пациентов и минимизации летальности, ассоциированной с вирусными гепатитами.
Естественное течение HBV-инфекции. Около 2 миллиардов в популяции во всем мире имели признаки экспозиции HBV, а также установлено, что около 300-400 миллионов имеют хроническую HBV-инфекцию [3]. Кроме того, приблизительно 5-10% пациентов с острой HBV-инфекцией имеют прогрессию до хронической инфекции [4]. Сероконверссия от острой HBV-инфекции с наличием поверхностного антигена (HВsAg) к антителам (anti-HBs) позволят полагать о клиренсе вируса. Однако посредством новых высокочувствительных методов ДНК ВГВ определялась в печени и сыворотке крови в течение длительного периода времени, вплоть до 30 лет с момента завершения острой HBV-инфекции [5]. Таким образом, представляется важным состояние персистенции вируса, невзирая на отсутствие детекции вируса в сыворотке крови пациентов.
Наиболее распространенные пути передачи вируса: вертикальный (от инфицированной матери к ребенку) в течение первого года жизни, семейная экспозиция, сексуальный путь передачи, внутривенное использование лекарственных препаратов, трансфузия контаминированной крови, а также использование инфицированных игл. Лица с иммунной супрессией наиболее подвержены формированию хронической HBV-инфекции вследствие острого гепатита В. К счастью, за последние 2 десятилетия повсеместно отмечается снижение заболеваемости в силу доступности эффективной вакцинации против вирусного гепатита В [6]. Тем не менее HBV-инфекция все еще остается лидирующей причиной хронических гепатитов, циррозов печени, ГЦК, печеночной недостаточности и декомпенсации заболеваний печени [1].
Группы с предшествующей HBV экспозицией, находящиеся в риске по реактивации
- ХроническаяHBV-инфекция: пациенты с развившимся повышением сывороточного уровня ДНК ВГВ и активностью заболевания в течение химиотерапии
- Неактивные носители: HВsAg-позитивные пациенты и ДНК ВГВ-негативные с трансформацией в фазу активной репликации в течение химиотерапии
- Иммунитет или клиренс вируса: пациенты с признаками иммунитета против HBV, в результате паст-экспозиции (HВsAg-негативные, аnti-HBc-позитивные и anti-HBs-позитивные), с реактивацией и продукцией HВsAg и ДНК ВГВ
Реактивация у HВsAg (+) позитивных пациентов. Реактивация HBV является распространенным проявлением у HBV инфицированных пациентов с позитивным HВsAg, получающих химиотерапию, либо после кортикостероидной терапии 16. Время реактивация у HВsAg позитивных пациентов варьирует, однако наиболее часто отмечается в течение первых двух месяцев, в сравнении с наиболее поздним периодом у anti-HBs-позитивных [12]. Исходы у данной популяции отличаются от исследования к исследованию. В некоторых представленных случаях реактивация HBV-инфекции полностью разрешилась, в то время как в других случаях реализовалась в фульминантную печеночную недостаточность. К счастью, с использованием упреждающей терапии аналогами нуклеозидов у данной группы пациентов частота случаев HBV реактивации значительно снизились [1, 17-19]. Использование антивирусных лекарственных средств будет подробно обсуждено в данном обзоре.
Причины презентации аnti-HBc + , в отсутствие HВsAg или anti-HBs
- Фаза окна острого гепатита В: эти лица при тестировании должны быть позитивны на аnti-HBcIgM
- Иммунитет относительно предшествующей инфекции: снижение аnti-HBs до неопределяемого уровня, однако амнестический ответ может наблюдаться после одной дозы HBV вакцины
- Ложно позитивный тест: у лиц из регионов с низким уровнем распространения HBV и отсутствием факторов риска по HBV-инфекции
- ХроническаяHBV-инфекция: снижение HBsAg до неопределяемого уровня, однако ДНК-ВГВ продолжает определяется в очень низких уровнях (часто только в печени). Типично среди лиц из регионов с высоким уровнем распространения HBV-инфекции, а также для пациентов с наличием вируса ВИЧ и пациентов с HCV-инфекцией
Манифестация. Клиническая картина HBV реактивации значимо вариабельна. Некоторые пациенты могут иметь нетяжелый острый гепатит, однако может случиться прогрессия до тяжелых и фатальных печеночных расстройств. Примерно у 50% HBV-носителей (HBsAg позитивные пациенты), подвергшихся химиотерапии, может развиться определенное повышение печеночных трансаминаз, однако только у 10% разовьется синдром желтухи. Тем не менее, частота фатальности среди пациентов с желтушными вариантами гепатитов и реактивацией HBV может достигать 40% [11]. В наибольшем риске осложнений от реактивации находятся те пациенты, у которых имеются признаки продвинутого печеночного фиброза печени, поскольку они имеют высокую вероятность развития печеночной декомпенсации. Кроме того, более тяжелое течение гепатитов отмечалось у пациентов с pre-core мутантными вариантами HBV после трансплантации костного мозга, а также развитие фиброзирующих холестатических гепатитов [27].
Рекомендации по ведению. В силу установленной заболеваемости и летальности ассоциированной с реактивацией HBV-инфекции у пациентов после химиотерапии и/или трансплантации очевидна необходимость эффективного режима с целью снижения числа гепатитов и их осложнений. Нуклеозид(отид)ные аналоги широко признанные препараты для профилактики HBV-реактивации; в нескольких проспективных исследованиях была оценена эффективность аналогов нуклеозидов в предупреждении реактивации HBV у пациентов, подвергшихся химиотерапии [28]. В этих исследованиях пациенты, получавшие ламивудин, имели значимое снижение показателя реактивации HBV-инфекции, а также улучшение показателя выживаемости от гепатита. В дополнение к эффективному контролю вирусной репликации, профилактика ламивудином, также предотвращала развитие острого гепатита и способствовала завершению курса химиотерапии в рекомендованном дозовом режиме большему количеству пациентов [11]. Недавнее UCLA исследование проводилось с целью оценки эффективности и затрат профилактической стратегии ламивудином в сравнении со стратегией строгого наблюдения и лечения ламивудином только категории пациентов с признаками случившейся во время химиотерапии реактивации. Анализ результатов данного исследования продемонстрировал превосходство показателя затраты/эффективность для ламивудина в качестве профилактического средства (снижение числа и тяжести случаев HBV реактивации) в сравнении с группой без профилактики [29]. Мета-анализ некоторых (указанных) групп показал, что профилактика ламивудином эффективна в снижении реактивации, а также в снижении показателя летальности до 70% у пролеченных пациентов. Данные исследования показали эффективность профилактической терапии у 3 пациентов, которые нуждались в лечении для предотвращения у них реактивации [19]. Эти два исследования подтвердили концепцию, что упреждающая профилактика ламивудином у пациентов, получающих цитотоксические препараты, способна предотвратить HBV реактивацию и избежать отсрочки или преждевременного прекращения химиотерапии.
Оптимальная длительность применения аналогов нуклеозидов/нуклеотидов в качестве превентивной терапии не установлена. Пока в большинстве исследований терапия продолжалась как минимум 4-8 недель после завершения химиотерапии; согласно практическим рекомендациям Американской ассоциации по изучению заболеваний печени (AASLD), терапию аналогами нуклеозидов/нуклеотидов в качестве превентивной терапии необходимо продолжать, как минимум до 6 месяцев после завершения химиотерапии [21]. Это было подтверждено проспективным рандомизированным исследованием, в котором пациенты получали длительный курс терапии, эффективно и безопасно снизивший случаи реактивации [30]. Однако для пациентов c активной HBV реактивацией терапия должна быть продолжена для достижения указанных точек, как и у имунокомпетентных пациентов.
К сожалению, одним из главных ограничений ламивудина является высокая частота резистентности к лечению, которая наблюдается у активно реплицирующих пациентов (до 24% в течение 1-го года и до 60% к третьему году лечения) и способствует развитию манифестации HBV-гепатита до завершения лечения [31].
Другие аналоги нуклеозидов/нуклеотидов, включая адефовир, энтекавир, телбивудин и тенофовир также являются препаратами выбора при лечении хронической HBV-инфекции. Имеется очень ограниченное количество данных относительно указанных препаратов и их использования для профилактики реактивации у данной категории пациентов. Однако они имеют очень привлекательный профиль и могут рассматриваться в качестве средств профилактики реактивации HBV у данных пациентов [32]. Относительно недавние исследования комбинированной терапии ламивудином и адефовиром показали хорошую эффективность в контроле вирусной репликации, а также хороший профиль переносимости, что позволило проводить длительную анти-онкологическую химиотерапию [33]. Монотерапия адефовиром также с успехом была использована у пациентов с ламивудиновой резистентностью после проведенной аллогенетической трансплантации клеток костного мозга [34]. Несмотря на то, что большинство имеющихся данных исследований поддерживают ламивудин в качестве препарата для профилактики реактивации HBV, другие нуклеозидные/нуклеотидные аналоги, такие как телбивудин, энтекавир, адефовир и тенофовир, также могут быть альтернативой в силу сопоставимой, либо более высокой антивирусной активности в сравнении с ламивудином, а также в связи с более низкой частотой развития резистентности [35]. AASLD рекомендует разную продолжительность профилактической терапии в зависимости от исходного уровня ДНК HBV [28]. Практические моменты представлены ниже.
Таким образом, всем пациентам, нуждающимся в проведении химиотерапии или трансплантации костного мозга, должен быть проведен скрининг на HBV-инфекцию до инициации иммуносупрессивной терапии. Так, HBsAg позитивные пациенты должны получать соответствующую профилактику реактивации аналогами нуклеозидов/нуклеотидов во время химиотерапии, а также как минимум 6 месяцев после завершения химиотерапии. При определении длительности профилактической терапии, также должен учитываться исходный уровень ДНК HBV.
Среди доступных данных пока нет должной ясности относительно HBsAg негативных пациентов при позитивности у них тестов на аnti-HBc/Anti-HBs. Профилактическая стратегия, либо строгое наблюдение с целенаправленной терапией, только для тех, у кого установлена развившаяся HBV реактивация, являются оправданным выбором у данной категории пациентов.
Практические выводы и рекомендации
В.Б. Тетова, Н.М. Беляева, М.Ю. Кесаева
Российская медицинская академия последипломного образования
Тетова Вера Борисовна — кандидат медицинских наук, доцент кафедры инфекционных болезней
Пути введения лекарств. Клиренс лекарственных препаратов
Болюсное внутривенное (в/в) введение препаратов приводит к максимальной их концентрации в конце введения; затем с течением времени концентрация препарата в плазме снижается. Наиболее простой пример этого действия — моноэкспоненциальное снижение во времени. Важным параметром для описания такого снижения является период полу-выведения (Т1/2) — время, за которое выводится 50% препарата. После двух периодов полувыведения элиминируется 75% препарата, после трех периодов — 87,5% и т.д.
В некоторых случаях снижение концентрации препарата после его болюсного в/в введения является мультиэкспоненциальным. Общепринятое объяснение этому — лекарственный препарат не только элиминируется, но также подвергается более быстрому распределению в периферических тканях. Элиминация препарата характеризуется периодом полувыведения, а период полураспределения может быть получен из кривых.
Измерение концентрации лекарства в плазме сразу после болюсного в/в введения можно использовать для определения объема распределения препарата. Когда снижение концентрации в плазме является мультиэкспоненциальным, возможно наличие сложных объемов распределения. Эти объемы распределения полезны для корректировки дозы препарата в случае болезни, однако редко абсолютно соотносятся с каким-либо физическим объемом, таким как плазма или общий водный обьем. На самом деле у препаратов, которые сильно связаны с тканями (например, некоторые антидепрессанты), обьем распределения может превосходить общий обьем тела на порядок.
Препараты могут поступать в организм и другим путем, например per OS, сублингвально, чрескожно или внутримышечно (в/м). При таких способах введения существуют два отличия от в/в пути введения. Во-первых, концентрация в плазме четко указывает на фазу нарастания, в то время как препарат медленно поступает в плазму. Во-вторых, общее количество препарата, поступающего в системный кровоток, может быть меньше, чем при в/в введении. Относительное количество препарата, поступающее при любом пути введения, сравнимое с такой же дозой препарата, введенной в/в, называют биодоступностыо. Биодоступность может быть снижена, если препарат метаболизируется до поступления в кровоток или из-за того, что препарат не всасывается из места введения.
Клиренс — это наиболее распространенный показатель измерения элиминации препарата. Клиренс можно рассматривать как объем, очищенный от препарата за определенный период времени.

Клиренс может быть органоспецифичным (например, почечный, печеночный) или всего организма (клиренс — показатель скорости очищения плазмы крови, других сред или тканей организма, т.е. объем плазмы, полностью очищающийся от данного вещества за единицу времени).
В других случаях действие лекарственных препаратов соответствует определенной их концентрации в плазме, но с задержкой, чему есть несколько возможных объяснений. Во-первых, для достижения лекарственного эффекта требуется образование активных метаболитов. Во-вторых, необходимо время для преобразования эффекта на молекулярном уровне в конечную физиологическую точку, например, ингибирование синтеза витамин К-зависимых свертывающих факторов варфарином в результате приводит к повышению MHO, но развитие этого действия происходит при падении уровней факторов свертывания. В-третьих, для развития лекарственного эффекта иногда требуется проникновение препарата внутрь клетки или в другие участки тканей.
Одним из барьеров для такого проникновения является изменчивость в специфическом усвоении препарата и утечка транспортных белков, которые контролируют концентрацию препарата в клетке. Различия в проникновении в ткани также часто вызывает отсрочка во времени от момента введения амиодарона до развития его эффектов, тем не менее точные механизмы этого феномена остаются неясными, и транспорт препарата может быть с этим не связан.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

