Кровообращение при гепатите с
Обновлено: 19.04.2024
Вирус гепатита С (HCV) представляет собой небольшой вирус, покрытый липидной оболочкой, содержащей одноцепочечную РНК. HCV относится к флавивирусам, роду семейства тогавирусов. Между 5' и 3' терминальными участками генома вируса располагаются структурные и неструктурные гены (рис. 1). 6 Структурные гены (С - core, Е1, Е2) кодируют ядерный и оболочечные гликопротеиды, в то время как неструктурные гены (NS2, NS3, NS4, NS5) - ферменты, участвующие в репликации вируса. Внутри генома имеются вариабельные и гипервариабельные участки, 6, 7 и в зависимости от их строения выделяют по крайней мере 6 различных генотипов HCV (возможно, их 12 или больше). 5, 8, 9 Генотипы вируса, по-видимому, различаются по иммуногенности, географическому распределению и, вероятно, влияют на течение HCV-инфекции и результаты лечения (см. также "Зависимость тяжести течения от генотипа HCV", "Ответ на лечение ИФН альфа-2b, влияние генотипа HCV"). 5, 7, 8 Вариабельность генома также может снижать чувствительность имеющихся диагностикумов для тестирования донорской крови и осложнять разработку вакцин против вируса. 10 (В настоящее время все усилия направлены на разработку вакцин на основе core региона, являющегося относительно стабильным участком у всех генотипов). 11, 12
Разные генотипы могут выявляться на протяжении инфекции у одного и того же больного. 13, 14 Исходя из этого было предположено, что наличие более вариабельных участков генома может отражать стратегию ускользания вируса от механизмов защиты хозяина. 5, 13, 15 По мнению других исследователей, данный феномен не имеет значения для репликации вируса. 13
Рис. 1 Организация генома HCV (По Van der Poel и соавт., 6 воспроизведено с разрешения)
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ HCV-ИНФЕКЦИИ
Anti-HCV и HCV РНК
По мере расширения представлений о структуре HCV методы выявления вируса становятся все более чувствительными. В настоящее время нет тест-систем для прямого определения антигенов HCV и больные тестируются на антитела к вирусу (anti-HCV). Скрининговым тестом обычно является иммуноферментный анализ (ELISA) (описан ниже). Положительные результаты контролируются более чувствительными методами рекомбинантного иммуноблоттинга (RIBA). По возможности необходимо исследование HCV РНК (с помощью полимеразной цепной реакции или метода амплификации разветвленной ДНК) для подтверждения наличия или отсутствия вируса в сыворотке.
Скрининговые тесты. Первые тест-системы для выявления anti-HCV основывались на обнаружении антител к вирусному антигену c 100 (anti-c100) с помощью ELISA первого поколения (табл. 1). 16 Однако anti-c100 могут появляться через много лет после инфицирования HCV; при этом наблюдается высокая частота ложноположительных результатов в популяциях низкого риска (таких как доноры), 14, 17-20 при исследовании длительно хранившихся образцов крови и у больных с гипергаммаглобулинемией. 21-23
Второе поколение тест-систем ELISA является более чувствительным, позволяя обнаруживать антитела к другим вирусным белкам, включая с22 и с33 (табл. 1). 24-26 Антитела к данным антигенам обнаруживаются чаще, чем anti-c100, и появляются в более ранние сроки. Они могут использоваться в диагностике как острой, так и хронической HCV-инфекции. 26-28
Третье поколение тест-систем ELISA сейчас широко используется для скрининга донорской крови, является более чувствительным и специфичным по сравнению с тест-системами ELISA предыдущих поколений 29-30 и дает почти 100% гарантию предотвращения заражения реципиентов донорской крови. Однако антитела могут быть не обнаружены у больных, инфицированных менее 6 месяцев назад, и у больных с иммуносупрессией. Возможны ложноположительные результаты (часто среди доноров). В связи с этим положительные результаты ELISA должны подтверждаться дополнительными тестами.
Табл. 1 Методы выявления антител к вирусу гепатита С (anti-HCV)
| Метод | Выявляемые антитела (кодирующий ген) |
| Скрининговые тесты | |
| I поколения ELISA | anti-c100 (NS4) |
| II поколения ELISA | anti-c22(C), anti-c33+anti-c100[anti-c200] (NS3/NS4) |
| II поколения ELISA | (С, NS3, NS4, NS5) |
| Дополнительные тесты | |
| I поколения RIBA | anti-c100 (NS4), anti-5-1-1 (белки NS3/NS4 регионов) |
| II поколения RIBA | anti-c22(C) ,anti-c33 (NS3), anti-c100 (NS4), anti-5-1-1 (NS3/NS4) |
| II поколения RIBA | (С, NS3, NS4, NS5) |
*Полимеразная цепная реакция (ПЦР), позволяющая выявить, клонировать и определить последовательность генома вируса, имеет наибольшую чувствительность из принятых тестов, позволяя определять РНК вируса даже при низком уровне виремии. ПЦР пока не доступна для широкого применения, имеет ограничения, связанные с возможностью загрязнения и количественным определением; в то же время амплификация вирусного генома дает большое преимущество в выявлении низких концентраций вируса и различий в нуклеотидной последовательности между разными генотипами. Количественное определение HCV РНК стало возможным благодаря адаптированию ПЦР с использованием метода серийных разведений или коамплификации РНК. 5 Новейший метод количественного определения основан на амплификации разветвленной ДНК (bDNA, Chiron). 36-39 Данный метод, выявляющий линейную корреляцию между тест-сигналом и титром вируса (более 3-4 log), более прост в исполнении, 40 но менее чувствителен, 5, 37 чем ПЦР. Результаты исследования могут различаться в зависимости от генотипа вируса. 38 Указанные тесты имеют важное значение при установлении связи титра HCV РНК с инфекциозностью, уровнем аминотрансфераз, тяжестью заболевания и ответом на противовирусную терапию.
HCV РНК. Тест-системы для прямого определения антигенов HCV в сыворотке еще не разработаны, и в настоящее время HCV РНК является лучшим маркером виремии, инфекциозности и активности болезни (см. "Хронический гепатит С. Биохимические показатели, сывороточные маркеры HCV"). Тестирование на HCV РНК проводится в основном в специализированных центрах, однако недавно появились коммерческие наборы для ПЦР. 32 Выявление HCV РНК с помощью ПЦР может подтвердить наличие виремии при отрицательных результатах исследования anti-HCV методами ELISA и RIBA. HCV РНК появляется в крови гораздо раньше других маркеров, обнаруживаясь спустя несколько дней после инфицирования. 33, 34 Следует, однако, отметить, что при циркуляции вируса в низких, подпороговых концентрациях HCV РНК может периодически не определяться. Поэтому суждение об отсутствии виремии на основании единичного отрицательного результата ПЦР не является окончательным.
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Ключевые слова: хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
V.V. Makashova 1,2 , H.G. Omarova 1 , O.N. Hohlova 1 , T.N. Lukashenko 3
1 Central Research Institute of Epidemiology, Moscow
2 Clinical Hospital for the Infectious Diseases, Moscow
3 Outpatient Clinic № 5, Moscow
The article presents a clinical case of a patient with a diagnosis of liver cirrhosis of Child-Pugh class B in the outcome of chronic hepatitis C, treated with interferon and ribavirin for 18 months. In the course of antiviral therapy, RNA of the hepatitis C virus became negative after 8 weeks and remained steadily negative for 2 years. Subsequently, on the background of stress, 3 months after the end of treatment, a relapse of chronic hepatitis C appeared with moderate biochemical and virological activity. 6 months after the relapse, a liver cancer was suspected during an ultrasound examination and histological confirmation was obtained. After a few months, hemorrhage from esophageal varicose veins dilatation (EVVD) occurred in the patient, and after another 1 month, there was repeated hemorrhage from EVVD. The patient was monitored and treated in the intensive care department. Ascites, bilateral pneumonia, fever, leukocytosis appeared. The patient’s condition progressively worsened and with increasing psychomotor agitation, progressive respiratory and cardiovascular insufficiency, biological death was recorded.
There was a divergence of diagnoses, category II. The cause of the fatal outcome was purulent intoxication, as a result of ulcers perforation of the esophagus, purulent mediastinitis with pleural empyema on the left.
Актуальность
Клиническое наблюдение
Пациент Т., 1948 г. р., 22.01.2009 г. обратился в поликлинику к инфекционисту в связи с лейкопенией (до 3,2×10 9 /л), тромбоцитопенией (60–120×10 9 ). Со слов пациента, антитела к HCV впервые выявлены в 1998 г. Не обследовался, не лечился. Впервые обследовался в поликлинике ФСБ № 5 в 2009 г., выявлена РНК HCV+, 1в генотип, вирусная нагрузка — 1,3×10 6 коп/мл.
Жалобы на периодически возникающую слабость и утомляемость.
Перенесенные заболевания: 1972 г. — аппендэктомия, 1992 г. — острый вирусный гепатит А, 1995 г. — оперирован по поводу синдрома Меллори — Вейса. В это же время были гемотрансфузии. 1996 г. — грыжесечение, 1997 г. — повторное грыжесечение, 2004 г. — язвенная болезнь 12-перстной кишки, 2005 г. — правостороннее воспаление легких, хронический бронхит, 2007 г. — повторная пневмония, 2007 г. — сильное кровотечение при удалении зубов, гипертоническая болезнь, сахарный диабет 2-го типа.
Аллергоанамнез — не отягощен.
Наследственность: у отца — цирроз печени алкогольного генеза, у матери — инсульт, у брата — хронический вирусный гепатит В.
Вредные привычки: не курит, алкоголь употреблял часто, но немного (со слов), крепкие напитки (виски, коньяк).
Объективно при осмотре: сосудистые звездочки в области грудной клетки, умеренная пальмарная эритема, иктеричность склер. Печень пальпаторно и перкуторно увеличена — выступает на 4–5 см ниже реберной дуги, селезенка не пальпируется.
Рост — 173 см, вес — 80 кг.
Динамика основных показателей общего и биохимического анализов крови, данные ПЦР-диагностики представлены в таблице 1.
Заключение
Подводя итог всей истории болезни пациента Т., 63 лет, можно констатировать, что имел место ЦП, класс В по Чайлд — Пью в исходе ХГС, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК HCV стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2 лет. В последующем на фоне стресса — через 3 мес. после окончания лечения возник рецидив ХГС с умеренной биохимической и вирусологической активностью. С февраля по май 2012 г. проводилось обследование по поводу подозрения на рак печени. Было получено гистологическое подтверждение в институте им. Герцена — развитие ГЦК в 5–6 сегментах печени. В августе 2012 г., после поездки в Крым у больного возникли острый простатит, уретрит, по поводу чего получал антибактериальную терапию. В конце августа — кровотечение из ВРВП с последующим их лигированием в ГКБ № 57. Повторное кровотечение из ВРВП возникло в октябре с дальнейшей госпитализацией в ЦКВГ, где дважды повторилось, несмотря на проводимую терапию. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Для исключения острого панкреатита была выполнена диагностическая лапароскопия, при которой патологии выявлено не было. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности 26.10.2012 г. была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II.
Проанализировав историю болезни, считаем справедливым заметить, что пациент по записи в истории болезни поступил в состоянии средней тяжести. Скорее всего, тяжесть состояния была недооценена: не учитывался длительный анамнез заболевания, повторные кровотечения из ВРВП, наличие ГЦР. В госпитале не было проведено лигирование вен пищевода, и мы считаем, что больного в первые же дни после поступления необходимо было переводить в специализированное отделение для проведения этой манипуляции и, возможно, пересадки печени.
Трудно оценить адекватность терапии, т. к. в посмертном эпикризе не указано лечение.
В клиническом посмертном эпикризе даже нет упоминания о наличии ГЦР, только упомянута гемангиома 4 сегмента печени, несмотря на то, что пациент предоставил все выписки предыдущих исследований.
При патологоанатомическом вскрытии отсутствуют данные о послойном исследовании ткани печени и наличии ГЦР, а также гистологическом исследовании на наличие опухоли.
Очень важно и крайне необходимо обсуждать все эти вопросы для исключения дальнейших ошибок в ведении и лечении таких сложных пациентов.
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
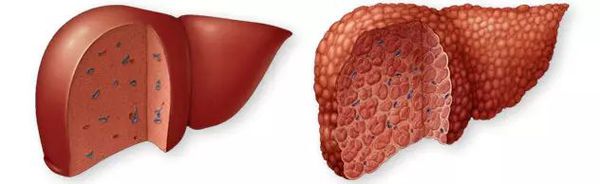
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
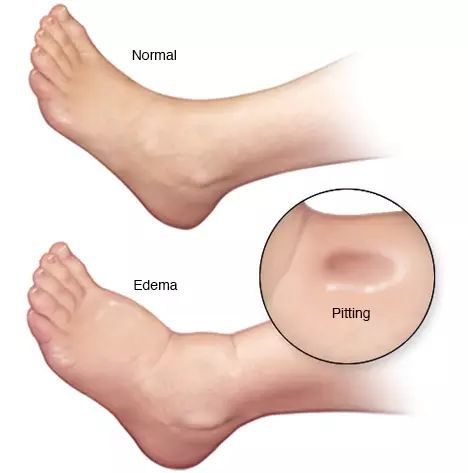
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
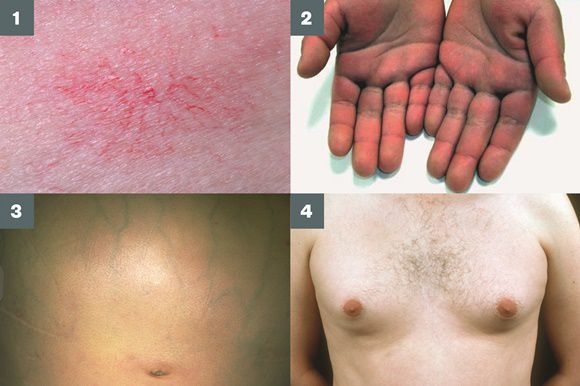
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Б.H. Левитан, Б.А. Гринберг
Levitan В.N., Grinberg B.A.
Астраханская медицинская академия, г. Астрахань
strakhan Medical Academy, Astrakhan
У 43 больных хроническим гепатитом (ХГ) и 71 больного циррозом печени (ЦП) проведены импульсная допплерография и цветовое допплеровское картирование (дуплексный допплер) сосудов портальной системы на ультразвуковом сканере "Logic 500" (США). Обнаружены значительные нарушения допплерографических показателей венозного и артериального кровотока, выраженные в наибольшей степени у больных ЦП. Анализ характера изменений показателей допплерографии позволил выделить пять типов портального кровотока при ЦП: 1) нормокинетический (13% больных) без существенных изменений портального кровотока; 2) гиперкинетический с преимущественным увеличением параметров линейной скорости кровотока в воротной вене (ВВ) при незначительном нарастании ее диаметра (12%); 3) гиперкинетический с преимущественным увеличением диаметра ВВ (20% больных). Конгестивный индекс был увеличен. Объемный кровоток в ВВ возрастал, главным образом, за счет ее расширения. Линейная скорость кровотока по ВВ при этом была незначительно сниженной или оставалась неизмененной; 4) гипокинетический (40% больных), при котором значительно снижалась линейная скорость кровотока в ВВ без увеличения ее диаметра, что приводило к уменьшению объемного кровотока в ВВ; 5) псевдонормокинетический (15% больных), при котором объемный кровоток в ВВ оставался в нормальных пределах, а конгестивный индекс был значительно повышен; существенно снижалась линейная скорость кровотока в ВВ при увеличении ее диаметра. Полученные данные открывают дополнительные возможности диагностики и лечения больных ХГ и ЦП.
Forty-three patients with chronic hepatitis (СП) and 71 patients with liver cirrhosis (LC) were provided pulse Doppler and Color Doppler Imaging (duplex Doppler) of the portal vessels using an ultrasound "Logic 500" scanner (USA). Noticeable disorders in the Doppler parameters of the venous and arterial blood flow were discovered. They were pronounced in LC patients to the largest extent. Analysis of the character of changes in the Doppler parameters made it possible to distinguish five types of the portal blood flow in LC: 1) normokinetic (13% of patients) without appreciable changes in the portal blood flow; 2) hyperkinetic with a predominant increase in the parameters of the linear blood flow velocity in the portal vein (PV) at a negligible enlargement of its diameter (12% of patients); 3) hyperkinetic with a predominant enlargement of PV diameter (20% of patients). The congestive index was increased. The volume blood flow in the PV rose mainly because of its enlargement. The linear velocity of PV blood flow was lowered insignificantly or remained unchanged; 4) hypokinetic (40% of patients) marked by an appreciable decrease in the linear velocity of PV blood flow without PV diameter enlargement, which led to the reduction of the volume blood flow in the PV; 5) pseudonormokinetic (15% of patients): in this case the volume blood flow in the PV remained within normal whereas the congestive index was substantially higher; the linear velocity of the blood flow in the PV dropped substantially at its diameter enlargement. The data obtained have contributed much to the diagnosis and treatment of patients suffering from CH and LC. ("Визуализация в клинике", 2001, 18: 16-20)
Ключевые слова: хронический гепатит, цирроз печени, портальный кровоток, допплерография.
Key words: chronic hepetitis, liver cirrhosis, portal blood flow, Doppler.
Хронические диффузные заболевания печени (ХДЗП) занимают одно из ведущих мест среди заболеваний желудочно-кишечного тракта, что связано с их широким распространением, тяжестью течения и часто неблагоприятным исходом [1, 7]. В последние годы среди неинвазивных методов диагностики ХДЗП и портальной гипертензии важное место отводится ультразвуковым исследованиям [2-5, 8, 9]. Данные мировой литературы свидетельствуют, что дуплексное сканирование сосудов портальной системы в сочетании с цветовым допплеровским картированием является золотым стандартом для выявления нарушений портального кровотока при заболеваниях печени [10].
Однако до настоящего времени в литературе сохраняются противоречивые данные о параметрах кровотока в сосудах портальной системы при ХДЗП. Не выделены основные типы портальной гемодинамики при циррозах печени.
Целью работы явились изучение допплерографических особенностей портального кровотока у больных хроническим гепатитом (ХГ) и циррозом печени (ЦП), выделение и характеристика основных типов портального кровотока у больных ЦП.
Материал и методы
Обследовано 114 больных ХДЗП - 80 мужчин (70%) и 34 женщины (30%) - в возрасте от 16 до 74 лет. Диагноз ХГ и ЦП устанавливался на основании жалоб, анамнеза, физикальных данных, общелабораторных, биохимических и вирусологических исследований, а также результатов сканирования печени, ультразвуковой томографии, спленопортографии, рентгеноскопии пищевода и желудка, фиброгастродуоденоскопии; у 38% больных диагноз был подтвержден при лапароскопии с прицельной биопсией и морфологическим изучением ткани печени. В качестве контрольной группы обследовано 22 практически здоровых пациента.
Комплексное ультразвуковое исследование выполнялось строго натощак на ультразвуковом сканере "Logic-500" (США) конвексным датчиком частотой 3,5 МГц по методике Г.И. Кунцевич и соавт. [4] и включало ультразвуковое исследование в реальном масштабе времени в В-режиме, импульсную допплерографию и цветовое допплеровское картирование сосудов брюшной полости.
При исследовании оценивали ультразвуковые свойства печени и селезенки (контуры, структура, размеры). При импульсной допплерографии и цветовом допплеровском картировании сосудов брюшной полости изучались воротная и селезеночная вены, общая печеночная и селезеночная артерии. В каждом сосуде измеряли диаметр (D), определяли максимальную систолическую скорость кровотока (Vmах), конечно-диастолическую скорость кровотока (Vmin), максимальную линейную скорость кровотока, усредненную по времени (ТАМХ); рассчитывали объемную скорость кровотока (Q).
Для воротной вены рассчитывали конгестивный индекс (СI) по формуле:
СI = пиR 2 / ТАМХ, где
R - радиус сосуда (см), ТАМХ - максимальная линейная скорость кровотока, усредненная по времени (см/с).
Для интегральной оценки соотношения кровотока в воротной и селезеночной венах нами предложен воротно-селезеночный венозный индекс (ВСВИ), который рассчитывали по формуле:
BCBH = Qвв / Qcв, где
Qвв - объемная скорость кровотока в воротной вене (мл/мин), Qсв - объемная скорость кровотока в селезеночной вене (мл/мин).
Для оценки кровотока в артериальных сосудаx рассчитывали пульсационный индекс (РI) и индекс периферического сопротивления (RI). Для интегральной оценки соотношения артериального и венозного кровотока в печени рассчитывали индекс артериальной перфузии (ИАП) по формуле:
ИАП = Qопа / (Qопа + Qвв), где
Qoпa - объемная скорость кровотока в общей печеночной артерии (мл/мин), Qвв - объемная скорость кровотока в воротной вене (мл/мин).
Для оценки соотношения параметров кровотока в воротной вене и общей печеночной артерии нами предложен печеночный сосудистый индекс (ПСИ), который рассчитывали по формуле:
ПСИ = ТАМХвв / РIопа, где
ТАМХвв - максимальная линейная скорость кровотока в воротной вене, усредненная по времени (см/с), РIопа - пульсационный индекс в общей печеночной артерии. Для оценки соотношения параметров кровотока в селезеночных сосудах (вене и артерии) нами предложен селезеночный сосудистый индекс (ССИ), который рассчитывали по формуле:
ССИ = ТАМХсв / РIса, где
ТАМХсв - максимальная линейная скорость кровотока в селезеночной вене, усредненная по времени (см/с), PIca - пульсационный индекс в селезеночной артерии.
Результаты и их обсуждение
С целью изучения состояния портального кровотокa при ХДЗП все обследованные больные были разделены на две группы. В первую группу вошел 71 больной ЦП; во вторую - 43 больных ХГ (методы диагностики изложены выше). Контролем служили исследования 22 практически здоровых лиц.
Данные о параметрах кровотока в венах и артериях портальной системы приведены в табл. 1 и 2.
У больных второй группы, по сравнению с контролем, выявлено снижение Vmах в воротной вене, a также увеличение СI, диаметра селезеночной вены и Q в селезеночной вене. Таким образом, уже у больных ХГ развивались изменения портальной гемодинамики: некоторое снижение линейной скорости кровотока в воротной вене, незначительное увеличение диаметра селезеночной вены и объемной скорости кровотока в ней.
У больных ЦП происходила значительная перестройка гемодинамики в венах воротной системы, выражавшаяся в увеличении диаметра воротной и селезеночной вен, а также в снижении показателей линейной скорости кровотока в воротной вене. При этом объемная скорость кровотока в ней сохранялась в нормальных пределах. В то же время у этой категории больных происходило увеличение объемного кровотока в селезеночной вене, т. е. перераспределение кровотока в венах воротной системы в направлении селезенки.
Таблица 1. Параметры кровотока в венах воротной системы у больных ХДЗП
| Показатель | ЦП | ХГ | Контроль | Р | P1 | Р2 |
| Dbb (мм) | 13,4+/-0,3 | 11,3+/-0,3 | 10,4+/-0,5 | >0,05 | ||
| Vmах вв (см/с) | 20,9+/-1,1 | 27,6+/-1,7 | 34,4+/-2,0 | |||
| Vmin вв (см/с) | 14,8+/-0,9 | 21,4+/-1,9 | 22,4+/-1,7 | >0,05 | ||
| ТАМХвв (см/с) | 17,9+/-1,2 | 25,4+/-1,9 | 28,3+/-1,7 | >0,05 | ||
| Qвв (мл/м) | 1360+/-90 | 1509+/-95 | 1430+/-118 | >0,05 | >0,05 | >0,05 |
| СI | 0,087+/-0,007 | 0,043+/-0,003 | 0,034+/-0,002 | |||
| Dcв (мм) | 11,0+/-0,4 | 8,5+/-0,3 | 6,8+/-0,25 | |||
| Vmах cв (см/с) | 19,6+/-0,8 | 22,0+/-1,3 | 20,8+/-2,1 | >0,05 | >0,05 | >0,05 |
| Vmin cв (см/с) | 14,0+/-0,7 | 15,4+/-1,1 | 13,3+/-1,3 | >0,05 | >0,05 | >0,05 |
| ТАМХсв (см/с) | 16,8+/-1,0 | 19,0+/-1,3 | 17,3+/-1,5 | >0,05 | >0,05 | >0,05 |
| Qcв (мл/м) | 673+/-54 | 588+/-37 | 365+/-48 | >0,05 | ||
| ВСВИ | 1,9+/-0,2 | 2,6+/-0,2 | 3,1+/-0,4 | >0,05 |
Как следует из табл. 2, у больных хроническим гепатитом диаметр общей печеночной артерии был достоверно больше, чем в контроле. Подобная тенденция имелась и в первой группе больных, однако в этом случае различия с контрольной группой были недостоверными. Выявлена тенденция к увеличению объемной скорости кровотока в общей печеночной артерии у больных первой и второй групп, по сравнению с контролем, однако различия оказались недостоверными. РI и RI в общей печеночной артерии у больных второй группы были достоверно выше, чем в контроле. Аналогичная тенденция наблюдалась и у больных циррозом печени, однако выявленные различия были недостоверными. В то же время ИАП у больных циррозом печени был достоверно выше, чем в контроле, что указывает на увеличение доли артериальной перфузии в общем кровоснабжении печени у данной группы больных. ПСИ у больных циррозом печени был достоверно ниже, чем у больных хроническим гепатитом и в контроле.
Таблица 2. Параметры артериального кровотока у больных ХДЗП
| Показатель | ЦП | ХГ | Контроль | Р | P1 | Р2 |
| Doпa (мм) | 5,4+/-0,2 | 5,3+/-0,1 | 5,0+/-0,1 | >0,05 | >0,05 | |
| Vmах (см/с) | 110+/-4 | 101+/-7 | 105+/-4 | >0,05 | >0,05 | >0,05 |
| Vmin (см/с) | 30+/-1 | 31+/-2 | 31+/-2 | >0,05 | >0,05 | >0,05 |
| TAMX (см/с) | 59+/-3 | 55+/-4 | 56+/-3 | >0,05 | >0,05 | >0,05 |
| Qoпa (мл/м) | 764+/-49 | 751+/-48 | 680+/-44 | >0,05 | >0,05 | >0,05 |
| РIопа | 1,47+/-0,05 | 1,57+/-0,08 | 1,36+/-0,06 | >0,05 | >0,05 | |
| RIoпa | 0,73+/-0,01 | 0,74+/-0,01 | 0,71+/-0,01 | >0,05 | >0,05 | |
| ИАП | 0,40+/-0,025 | 0,34+/-0,02 | 0,32+/-0,02 | >0,05 | >0,05 | |
| ПСИ | 12,8+/-0,9 | 17,8+/-2,3 | 20,7+/-1,8 | >0,05 | ||
| Dca (мм) | 5,8+/-0,2 | 5,5+/-0,2 | 5,8+/-0,1 | >0,05 | >0,05 | >0,05 |
| Vmax (см/с) | 76+/-4 | 78+/-5 | 77+/-6 | >0,05 | >0,05 | >0,05 |
| Vmin (см/с) | 26+/-2 | 33+/-3 | 31+/-2 | >0,05 | >0,05 | >0,05 |
| TAMX (см/с) | 47+/-3 | 51+/-4 | 48+/-3 | >0,05 | >0,05 | >0,05 |
| Qca (мл/м) | 710+/-71 | 735+/-51 | 769+/-64 | >0,05 | >0,05 | >0,05 |
| PIca | 1,17+/-0,06 | 1,02+/-0,08 | 0,93+/-0,04 | >0,05 | >0,05 | |
| RIca | 0,66+/-0,02 | 0,60+/-0,02 | 0,59+/-0,02 | >0,05 | ||
| ССИ | 14,8+/-1,4 | 21,3+/-2,8 | 18,9+/-1,2 | >0,05 |
Таким образом, у больных циррозом печени наибольшие изменения кровотока имели место в системе воротной вены, а гемодинамика в артериях брюшной полости (общая печеночная и селезеночная) страдала в значительно меньшей степени. Проведенное комплексное многокомпонентное исследование венозного и артериального кровотока позволило выявить разнонаправленные тенденции в портальной гемодинамике у больных циррозом печени. При анализе характера печеночно-воротного кровообращения на основании сопоставления показателей объемной и линейной скоростей кровотока, диаметра воротной вены, а также конгестивного, воротно-селезеночного венозного индексов и индекса артериальной перфузии печени, нами были условно выделены пять типов портальной гемодинамики.
Первый - нормокинетический тип - отмечен у 13% наблюдаемых больных циррозом печени. У них не было выявлено существенных изменений портальной гемодинамики; диаметр воротной вены, линейная и объемная скорости кровотока оставались в пределах нормальных значений. Кровоток в селезеночной вене и в общей печеночной артерии не изменялся. Не было обнаружено существенных изменений конгестивного, воротно-селезеночного венозного индексов, а также индекса артериальной перфузии. При клинической оценке этой группы больных установлено, что к ней относились преимущественно больные циррозом печени класса А по Child в стадии компенсации; явные клинические признаки портальной гипертензии у них отсутствовали.
Представленное деление изменений портальной гемодинамики на различные типы демонстрирует разнонаправленность изменений печеночного кровотока при циррозе печени, зависящую от стадии и тяжести заболевания, наличия признаков портальной гипертензии и открывает дальнейшие перспективы для дифференцированной терапии.
Литература
1. Гастроэнтерология (справочник). Под ред. Ивашкина В.Т. и Рапопорта С.И. М., Русский врач, 1998, 95 с.
2. Гринберг Б.А. Состояние портального кровотока при хронических диффузных заболеваниях печени. Автореф дисс. канд. мед. наук, Астрахань, 1999, 24 с.
3. Камалов Ю.P., Северов М.В., Олейникова Е.Б. Значение ультразвукового исследования вен портальной системы для выявления синдрома портальной гипертензии у больных циррозом печени, 1-й Съезд Ассоциации специалистов ультразвуковой диагностики в медицине. Тезисы докладов, М., 1991, с. 96.
4. Кунцевич Г.И., Скуба Н.Д., Белолапотко Е.А. Роль комплексного ультразвукового исследования в дифференциальной диагностике очаговых образований печени. Методические рекомендации, М., 1997, 23 с.
5. Кунцевич Г.И., Белолапотко Е.А. Цветное допплеровское картирование и импульсная допплерография абдоминальных сосудов. В кн: Ультразвуковая допплеровская диагностика сосудистых заболеваний. Под ред. Никитина Ю.М. и Труханова А.И. М., 1998, с. 297-329.
6. Ли Голдмен. Количественные аспекты клинического мышления. Внутренние болезни (под ред. Е. Браунвальда, К.Дж. Иссельбахера, Р.Г. Петерсдорфа и др.). М., Медицина, 1993, с. 36-50.
7. Хазанов А.И., Джанашия А.Е., Некрасова Н.Н. Причины смерти и смертность при заболеваниях органов пищеварения в Российской Федерации и европейских странах. Росс. журн. гастроэнтерол., гепатол., 1996, 3 (6), с. 14-19.
8. Bolondi L, Gaiani S., Barbara L. Doppler flowmetry - clinical applications in portal hypertensive patients. Portal hypertension (clinical and physiological aspects). Springer Verlag, 1991, Ch.13, p. 161-182.
9. Koslin D.B., Berland L.L. Duplex Doppler examination of the liver and portal venous system. J. Clin. Ultrasound, 1987, 15: 675-686.
10. Seitz К., Wermke W., Haag К. Sonography in Portal Hypertension and TIPS. Freiburg, 1998, 64.
Читайте также:

