Кто создал вирус папилломы человека
Обновлено: 24.04.2024
Как охотники готовятся к охоте — изучают следы, устанавливают кормушки, размещают загонщиков, ставят стрелков на линию огня, выпускают собак — так же и иммунологи, чтобы избавить организм от вируса, поэтапно готовят и направляют процесс активации иммунной системы. Первое действие — определить мишень.
Мишень — белок вируса
Вирус папилломы, попав в клетки кожи, проявляет себя как двуликий Янус. Его геном может находиться в двух формах: или встроиться в хромосому клетки, или существовать в виде свободной молекулы — ДНК-эписомы. Если он встроился в клеточную хромосому, то при наличии предрасполагающих факторов происходит реализация программы его генома и вирус начинает размножаться. Пораженный участок превращается в папиллому, или бородавку. Причем порой это случается не на руке или ноге, а на слизистой оболочке в самых интимных местах человеческого тела. И если вирус принадлежит к особому подтипу, то лет через десять пораженные клетки, возможно, трансформируются в раковую опухоль.
Для своей успешной жизни вирус должен заставить клетку синтезировать несколько полезных ему белков. В частности, вирусу папилломы нужен белок L1, который идет на строительство оболочки новых вирусных частиц, а также белки Е6 и Е7 — они делают зараженную клетку бессмертной, это онкогенные белки.
Бороться с вирусом можно несколькими принципиально разными способами. Первый — запретить ему связываться с клетками-мишенями, второй — не дать ему в них размножаться, третий — уничтожать больные клетки вместе с вирусом. Поскольку в случае с вирусом папилломы больные клетки не содержат его в традиционном понимании — ведь после попадания в клетку от него остается одна ДНК, которая и задает синтез тех самых опасных белков, — запретить размножение нельзя. Поэтому в руках медиков остаются первый и третий способы, то есть профилактическая вакцина и терапевтическая. Недавно появился еще один — применение коротких, так называемых молчащих РНК, которые принуждают замолкнуть вирусные гены. Но движение по этому пути еще в самом начале.
Ситуация осложняется тем, что у каждого вида млекопитающих имеются свои вирусы папилломы, которые не живут в тканях других видов, а в культуре клеток вирус человека размножается чрезвычайно неохотно. В результате поиск вакцины приходится вести на мышах, а потом надеяться, что эти результаты удастся воспроизвести при испытаниях с участием добровольцев.
Большим успехом в борьбе с вирусом папилломы оказалось открытие в 1991 году интересного феномена, сделанное Чжоу Цзянем и Яном Фрэйзером, работавшими в брисбенском госпитале им. принцессы Александры, Австралия (Яна Фрэйзера в ноябре 2008 года наградили за эту работу итало-швейцарской премией фонда Бальцана в размере 1 млн швейцарских франков. — Примеч. ред.). Они обнаружили, что белки L1 самопроизвольно собираются в вирусоподобные частицы (ВПЧ) даже если внутри них нет никакого генетического материала. Такие белки очень просто и в больших количествах можно синтезировать с помощью дрожжей, встроив в них нужный ген. Из дрожжей они выходят уже в виде готовых частиц, причем их иммунногенные свойства такие же, как и у настоящего вируса. Если ВПЧ ввести в организм, то в нем начнут вырабатываться защитные антитела. Во многих экспериментах такая защита доказала свою надежность, и спустя одиннадцать лет после открытия большой эксперимент с участием 1533 добровольцев показал, что подобная вакцина от вируса папилломы человека подтипа 16 (HPV16), во-первых, вполне безопасна, а во-вторых, обеспечивает полную защиту организма. Этот результат важен еще потому, что именно на подтипы 16 вместе с 18, 31 и 45 приходится 80% всех случаев опухолевого перерождения пораженной вирусом ткани, прежде всего рака шейки матки. За оставшиеся 20% ответственны еще 13 разновидностей этого вируса. За шесть лет, прошедшие с начала эксперимента с участием добровольцев, действие вакцины не ослабло — ни одного случая заражения вирусом среди них зафиксировано не было.
Пептидные пули
Однако это все — профилактические вакцины, причем пока неизвестно, сколь быстро иммунная система забудет о той информации, которую она получила в момент прививки. Поэтому огромный интерес вызывает терапевтическая вакцина, которая уничтожает уже зараженные клетки.
Для ее создания иммунологи надеются использовать столь яркий след вируса, как те самые два белка, Е6 и Е7. Они обязательно должны быть на поверхности заболевших клеток, и, стало быть, задача состоит в том, чтобы научить клетки-киллеры находить эти следы.
Многие лаборатории в мире соревнуются на этом поприще, ведь цена победы очень велика. Для возбуждения иммунного ответа применяют и сами Е-белки, и их пептидные фрагменты (Т-эпитопы), и химерные конструкции из Е- и L-белков. (Напомним, что вещества, которые возбуждают иммунный ответ, называются антигенами.) Для усиления ответа в вакцину добавляют цитокины, белки теплового шока и другие стимулирующие элементы.
Непременный компонент вакцины — вектор, который обеспечивают доставку антигенов — Е-белков или их пептидных фрагментов — в специальные клетки иммунной системы (макрофаги, дендритные клетки), после чего те начинают вырабатывать особые белки цитокины и давать инструкции клеткам-киллерам, что им, собственно, надо уничтожать. Векторами для антигенов папилломавируса в разных опытах служили вирус осповакцины, аденовирус, альфавирус, бактерии. Надо отметить, что дендритные клетки — самые активные партнеры для возбуждения сильного иммунного ответа, поэтому желательно, чтобы антигены попадали именно в них.
Вот почему большое внимание уделяют химерным конструкциям на основе белков теплового шока, то есть содержащим и Е-белок, и белок-усилитель иммунного ответа. Белок теплового шока имеет сродство к дендритным клеткам. Именно таким методом в модельных экспериментах удалось уже при однократной иммунизации зафиксировать уменьшение размера опухоли. Сейчас несколько кандидатов в терапевтические вакцины находятся на различных проверочных стадиях, но в отличие от профилактических вакцин пока ни одна из них не дала приемлемой эффективности. Возникает мысль, что успеха можно достичь, совершенствуя все части вакцины: пептидные фрагменты, которые наиболее правильно повторяют Т-эпитопы Е-белка, вектор для направленной доставки вакцины в дендритную клетку, стимулятор иммунного ответа, а также носитель вакцины, на котором все это держится.
Параллельно в ГОСНИИГенетики был налажен синтез в дрожжах белков L1 трех типов (с одним из них была проблема), который собирался в правильные вирусоподобные частицы и правильно реагировал с антипептидными антителами и референс-моноклональными антителами.
Ответы на разные пептиды сильно отличались, и эти эксперименты позволили выявить наиболее эффективные фрагменты как белка L1, так и Е7. Окончательная проверка показала, что если в качестве носителя-адъюванта к этим пептидам использовать гемоцианин улитки или специальный иммуностимулятор ПМ, то реакция иммунной системы будет наиболее сильной. Самое главное, что при этом вырабатывается сильный иммунный ответ к L1, а также активируются популяции специфических клеток-киллеров, так называемые цитотоксические Т-клетки CD8 + . Именно они должны уничтожать зараженные клетки. Фактически, полученные данные дают основание считать, что нам удалось создать отдельные компоненты прототипа комбинированной вакцины, профилактической и терапевтической. Пока это еще не вакцина, препарат надо испытывать на приемлемой биологической модели, например на мышах с перевиваемой опухолью, вызываемой онкогенным белком Е7. Причем полученные вакцинные препараты скорее ориентированы на профилактику, поскольку уже доказано, что белок L1 генерирует сильный защитный ответ даже в отсутствие адъюванта.
Пептиды — слабые иммуногены, в этом мы убедились, сделав конъюгат одного пептида из белка Е7 со стандартным адъювантом Фрейнда. Активировать Т-клетки таким путем непросто, и, вероятно, нужно менять тактику. Прежде всего для этого требуется обеспечить целевую доставку пептидных антигенов из Е-белка в дендритные клетки, чтобы достичь специфической и сильной активации киллерных CD8 + лимфоцитов.
И тогда мы решили применить новый подход: использовать как усилитель доставки фуллерены, высокая клеточно-проникающая способность которых хорошо известна, и добавить вектор, который бы направлял их в дендритные клетки. Для этого пришлось заняться работой, не имеющей прямого отношения к созданию вакцины: определить иммуногенность фуллерена и их производных с аминокислотами и пептидами, а также их способность проникать внутрь клеток. И здесь мы получили очень интересные результаты.
Фуллерен и жизнь
Проблема токсичности фуллеренов и прочих наночастиц давно уже стала весьма актуальной. Сразу же за открытием фуллеренов среди ученых распространилась идея, что эти молекулы могут пригодиться в качестве средства для транспортировки лекарственных препаратов. Сейчас синтезированы сотни соединений фуллеренов, многие из них проявляют биологическую активность, однако до создания коммерческих препаратов дело не дошло. Возможно, потому, что у них нет особых преимуществ по сравнению с нефуллереновыми аналогами, а возможно — из-за недостаточно глубокого понимания механизмов метаболизма фуллеренов и их взаимодействия с живыми клетками.
Однако из-за развития нанотехнологий практически неизбежно возникают условия для загрязнения окружающей среды этими весьма стойкими соединениями, масштаб производства которых возрастает. Пора решать вопрос об опасности или безопасности фуллеренов в том числе и об иммунологической безопасности. Прежде всего речь идет о способности фуллеренов вызывать иммунный ответ, например аллергию.
Безразличный фуллерен
В своих опытах мы использовали кристаллический фуллерен, называемый фуллеритом, наносуспензию гидратированого фуллерена Андриевского, а также соединения фуллерена со всевозможными аминокислотами, пептидами и белками. При этом аминокислоты присоединялись непосредственно к шарику фуллерена. Способ получения таких производных разработали еще в 1994 году в ИНЭОС РАН им. А. Н. Несмеянова. Там же в содружестве с Институтом проблем химической физики РАН был создан еще один функциональный фуллерен, который очень быстро пришивается к пептидам и белкам, содержащим аминокислоту цистеин. Для чего нужно было получать столь сложные соединения?
Дело в том, что еще 12 лет назад мы уже пытались вызвать у мышей специфический иммунный ответ на чистые фуллерены и их аминокислотные производные и нисколько не преуспели в этом деле. Однако в 1998 году появились сведения, что одной американской группе удалось-таки добиться иммунного ответа на фуллерен в присутствии сильного иммуностимулятора. В своих опытах мы как раз и хотели проверить этот результат, а в качестве иммуностимуляторов взяли известные аллергены вроде яичного и сывороточного альбумина. Однако результат оказался тем же: никакого специфического ответа на собственно фуллерен замечено не было. Зато мы обнаружили хорошо выраженную реакцию на аминокислоты, пришитые к фуллерену. (На чистые аминокислоты ответ вообще не развивается, организм к ним толерантен.)
Отсутствие иммунной реакции на фуллерен можно объяснить следующим образом. Теоретически в водной среде молекулы гидрофобного фуллерена не могут существовать в одиночном состоянии, а собираются в кластеры из десятков, а то и сотен молекул. Попав в живой организм, эти кластеры должны взаимодействовать с гидрофобными компонентами среды и электронодонорными молекулами — белками, жирами или аминами. В результате углеродная сфера может быть полностью закрыта этими молекулами, и тогда она не способна связываться с рецептором В-лимфоцита, который дает сигнал на развитие иммунного ответа. Впрочем, само по себе наличие у В-клеток специфического рецептора на фуллерен вызывает серьезные сомнения. Фуллерены как искусственные молекулы получены совсем недавно, в 1991 году, и в процессе эволюции организмы с ним не могли контактировать, следовательно, вряд ли существуют клеточные клоны, распознающие такие молекулы. Как показали работы по созданию углеродных эндопротезов еще в 1979 году, антитела к другим формам углерода — графиту и алмазу получить невозможно. Хотя известен такой фермент, как протеаза ВИЧ, чей активный центр имеет гидрофобную полость: фуллерен (с гидрофильной подвеской) хорошо ее заполняет и тем самым блокирует активность вируса. Но рецепторы на В-лимфоците для улавливания чужеземцев располагаются снаружи, то есть обращены в водную среду, имеют гидрофильную природу и вряд ли будут захватывать фуллерен.
Как нож в масло
Если фуллерен не вызывает иммунного ответа, то может ли он как-то повредить клетку? Ответ на этот вопрос дает серия опытов, проведенная нами с эритроцитами, тромбоцитами человека и симбиосомами — продуктами симбиоза бобовых растений с азотфиксирующими бактериями рода Rhizobium. О том, что фуллерен проник внутрь симбиосомы можно судить по заряду ее мембраны. В присутствии АТФ и ионов магния она способны генерировать на внутренней стороне своей мембраны положительный заряд. Фуллерены с пришитыми аминокислотами пролином или аминокапоновой кислотой — отрицательно заряжены. Попав внутрь симбиосомы, они нейтрализуют заряд на мембране, что можно зафиксировать спектральными методами, используя специальные зонды. Как оказалось, процесс этот весьма быстрый: при добавлении раствора с производными фуллерена, мембрана клетки моментально теряла накопленный ею потенциал.
Фуллерен с другой кислотой, аргинином, наоборот, приобретает положительный заряд, и поэтому его влияние на симбиосому заметить не удалось. Зато оно проявилось на эритроцитах, мембрану которых заряжали отрицательно с помощью валиномицина (из клетки при этом выходит K + ): при добавлении C60-Arg происходила быстрая разрядка потенциала.
Изменение потенциала мембраны оказалось не единственным эффектом. Есть такой флуоресцентный краситель — акридин оранжевый. Он меняет свое свечение при изменении кислотности среды. С его помощью удалось дополнительно подтвердить, что аминокислотные производные фуллеренов в самом деле легко проникают внутрь клеток и меняют кислотность среды.
Мы подтвердили также, что фуллерены легко проникают в разные типы клеток. Например, в тромбоцитах много кальция, поэтому изучать транспорт фуллерена можно с помощью другого красителя, хлортетрациклина, свечение которого зависит от концентрации ионов кальция: если фуллерен с ним взаимодействует, то гасит это свечение. Так оно и вышло: при добавлении к тромбоцитам, нагруженным хлортетрациклином, фуллеренов, в том числе и фуллерена Андриевского, наблюдалось тушение флуоресценции. Правда, оказалось, что фуллерен Андриевского входит в клетку в сто раз медленнее, чем с аминокислотными производными.
Итак, установлено, что фуллерен благодаря своей гидрофобности достаточно свободно проходит сквозь липидную мембрану клетки. Отсюда появляется идея, которая уже у многих на слуху: фуллерен с закрепленным пептидом может протащить его внутрь клетки. А это значит: он может служить отличным средством доставки пептидов в дендритные клетки иммунной системы.
Чтобы проверить этот предположение, мы, во-первых, присоединили к фуллерену найденные на предыдущем этапе пептиды белка Е7, вызывающие наибольший иммунный ответ. Во-вторых, синтезировали носитель для вакцины на основе сополимера винилпирролидона и малеинового ангидрида, к которому были присоединены цепочки жирных кислот. К этим гидрофобным хвостам за счет ван-дер-ваальсовых связей и цеплялись молекулы фуллеренов с пептидами. Результат оказался очень неплохим уже в первом эксперименте. Препарат действительно вел себя, как и положено терапевтической вакцине, генерировал специфические Т-клетки и антитела. Но пока что нам не удалось детально проследить механизм его действия. К сожалению, из-за прекращения финансирования эту работу пришлось прервать. Хотя мы и не теряем надежды на продолжение, но время упущено, а зарубежные исследователи не стоят на месте.
Papillomaviruses are a very diverse group of viruses that infect human skin and mucosal cells, which serve as a barrier between the environment and a human being. Most representatives of this group do not cause any symptoms, but highly pathogenic types may cause cancer. Ancient literature contains the first known mention of skin warts. The first classification of warts was introduced by Roman physician Aulus Cornelius Celsus in 25 AD [7], and the assumption that warts may be transmitted via infection originated even earlier. However, the viral nature of papillomas was not demonstrated until the beginning of the twentieth century(reviewed in 4). The first papillomavirus was isolated in 1933 by the American virologist Richard Shope [8], who also isolated an influenza virus [9].
History and prevalence of HPV
The evolutionary history of papillomaviruses seems to coincide with the origin of higher-order vertebrates, amniotes(including reptiles, birds, and mammals) [10]. Mammalian skin structure appears to make them the most suitable hosts for the papillomaviruses [11], and — today — papillomaviruses are widespread in mammals and rarely found in birds. The relationship between papillomaviruses and similar groups of DNA-viruses, such as polyomaviruses, is not well-demonstrated at the present time [12].
There are more than a hundred types of papillomaviruses that can infect humans. These are collectively referred to as human papilloma viruses or HPV and are divided into high-risk(HR) and low-risk(LR) types by their carcinogenic properties.
HPV are transmitted through direct skin-to-skin contact, and approximately 30 types are transmitted sexually. LR HPV are much more common than HR HPV among humans and often do not cause any symptoms. In fact, only 18 types of HPV pose a cancer risk, mostly for anogenital cancers.
Current research suggests that LR HPVs produce more virions and infect more human hosts whereas HR types are less virulent but more difficult for the immune system to neutralize [13 and 14]. The most dangerous HR HPV types are also the most widespread, HPV16(reference strain) and HPV18, and the main cause of skin warts(especially in the anogenital zone) are HPV types 6 and 11 [15]. These and several other types of HPV attract serious attention [16] [17].
Structure and biology of the virus
Human papilloma virus particles lack a lipid envelope and are relatively small, with a diameter of only about 30 nm. In comparison, the human immunodeficiency virus (HIV) and influenza virus virions are enveloped by a lipid bilayer derived from the host cell and are approximately four times larger. The papillomavirus genome consists of double-stranded DNA decorated and packed by histones of the host cell. It encodes two types of proteins, early (E) proteins and late (L) proteins: early HPV proteins maintain regulatory functions (and are responsible for oncotransformation of the host cell in the case of HR types), and late proteins form the capsid of the virion.
The life cycle of HPV is bound to the life cycle of its host cells, keratinocytes, and HPV can only be cultivated in special organotypic raft cultures containing a population of cells at different developmental stages — similar to the skin of a living organism.
Keratinocytes are the main cells of epidermis, the outermost layer of the skin. Actively dividing young keratinocytes are found near the basal membrane that separates the epidermis from other layers of the skin and move towards the skin surface during maturation. Viral particles infect non-differentiated cells, and new virions are produced inside the keratinocytes during the terminal stage of differentiation [18,19 and 20].
The HPV early proteins are responsible for maintaining a proper amount of viral DNA inside the host cell nucleus. However, they also coordinate the expression of viral genes. Proteins E1 and E2 form a complex with viral DNA, which recruits the cell replication systems. Proteins E6 and E7 are responsible for the carcinogenic effect in HR HPV types. E6 is able to bind to the tumor suppressor p53 and promote its ubiquitination and degradation [21]. Protein E7 binds several cell proteins and tumor suppressors, including theretinoblastoma protein. The activity of the E6 and E7 proteins leads to uncontrolled cell division [22 and 18].
Late proteins of HPV form the viral capsid and mediate packaging of DNA into the virion. The pentamer-forming L1 protein is the major component of the HPV capsid [23], and the L2 protein is a minor constituent. The HPV capsid looks roughly spherical, but, in fact, it has a icosahedral symmetry with the triangulation number that equals 7. Rather than a structure based on pentamers mixed with hexamers(like that of the soccer ball), the HPV capsid is composed of 72 L1 pentamers of two different types — 60 hexavalent pentamers and 12 pentavalent pentamers(reviewed in 2, chapter 3). Remarkably, the fold of HPV L1 proteins is similar to that of human nucleoplasmins, the proteins that regulate the assembly of nucleosomes [24]. Whether they share a common ancestor or whether their similarity is the result of convergent evolution is not yet clear. Perhaps the interaction between L1 and nucleosomes on viral DNA is crucial for the encapsidation of the HPV genetic material.
One monomer of L2 is associated with each L1 pentamer of the HPV virion [4], and current research suggests that L2 is crucial for DNA recruitment to the viral particle. Some hypothesize that L2 — as well as L1 — may interact not with viral DNA but rather with its histones [4]. To date, however, much of the process through which HPV DNA is packed inside the virion remains unknown. One facet of the process that is known may make HPV an important tool in human gene therapy: any segment of DNA less than 8 kb long may be packed inside the capsid [link], which enables the development and use of HPV-based transformation vectors. Interestingly, human cyclophilin participates in HPV capsid unpacking, a mechanism that has also been demonstrated for HIV [25].
HPV vaccines
A growing interest in HPV research can be partially — if not wholly — attributed to discovery of the relationship between HPV and cancer and the subsequent Nobel Prize in Physiology or Medicine(2008) awarded for this work. German scientist Harald zur Hausen has shown that nearly all cases of cervical cancer are the result of HPV infection [1]. Vaccines against HPV are currently being actively developed and introduced, and the main targets for such vaccines include the most dangerous and common HPV types: HPV6, HPV11, HPV16, HPV18.
‘Current vaccines against human papillomaviruses(HPVs) are a triumph of applied structural virology. However, the current vaccines, which use recombinant virus-like particles composed of the L1 major capsid protein, do not protect against all disease-causing HPV types. Fortunately, a new generation of HPV vaccines targeting conserved ‘Achilles’ heel’ epitopes present in the L2 minor capsid protein promise to offer broad protection against all HPVs, including all types that cause cancer, as well as types that cause benign skin warts(for which the papillomavirus family is named). Current knowledge about the structure, dynamics, and function of L2 during the infectious entry process is very limited. This structural information is desperately needed to inform the development of pan-protective HPV vaccines."
— Dr. Christopher Buck from the U.S. National Cancer Institute
zur Hausen’s discovery was made possible by his use of the HeLa cell culture, the most common culture of human cells. This cell line originates from cervical tumor cells biopsied in 1951 from an American patient, Henrietta Lacks [26]. Armed with Lacks’ original biopsy results, zur Hausen was able to demonstrate that she had been infected by more than one species of HPV18. The story of HeLa, HPV, and the Nobel Prize is well-described in Rebecca Skloot’s book"The Immortal Life of Henrietta Lacks".
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
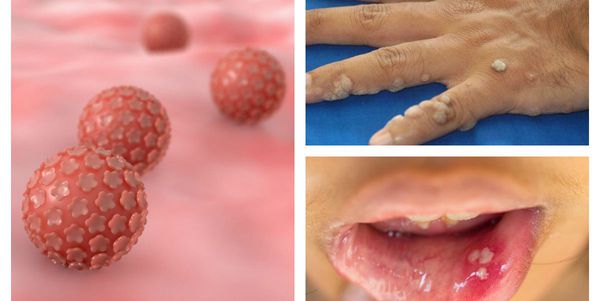
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
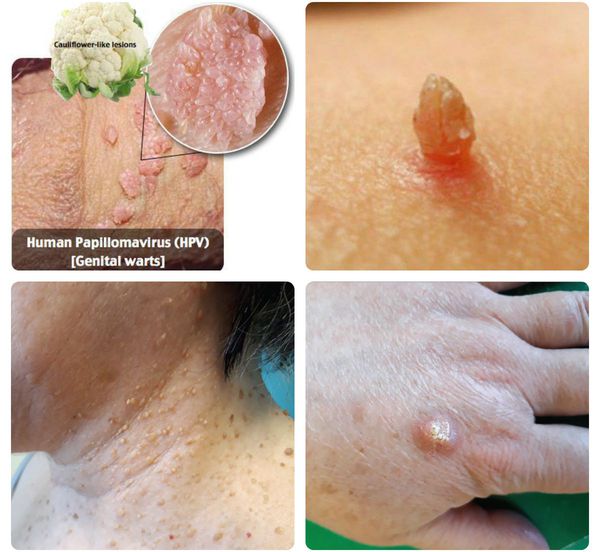
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
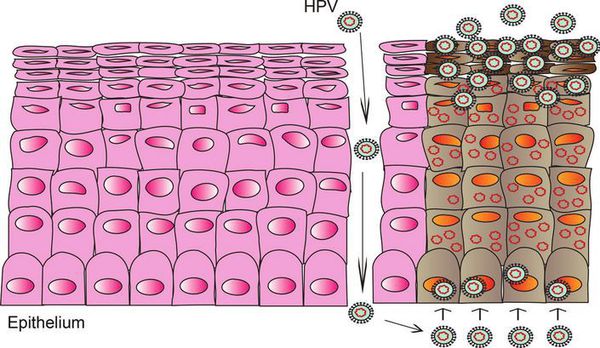
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
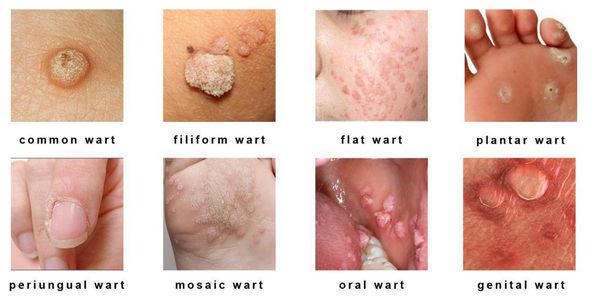
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
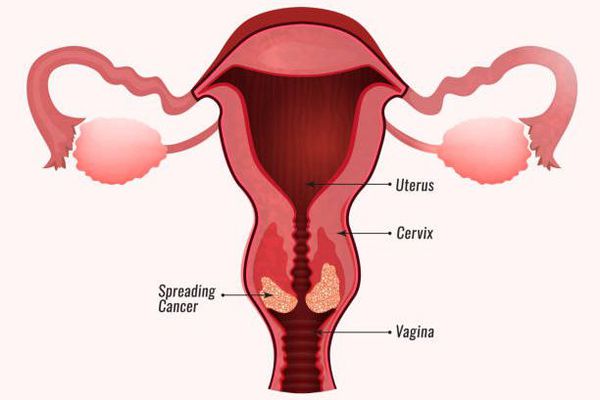
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
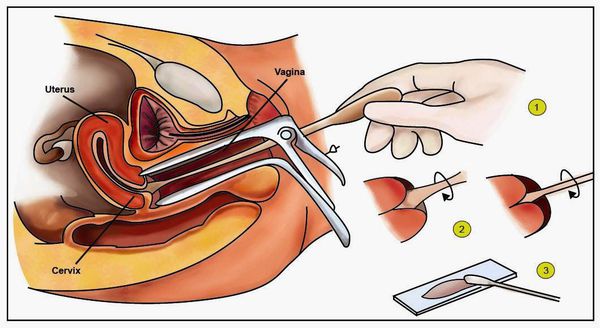
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
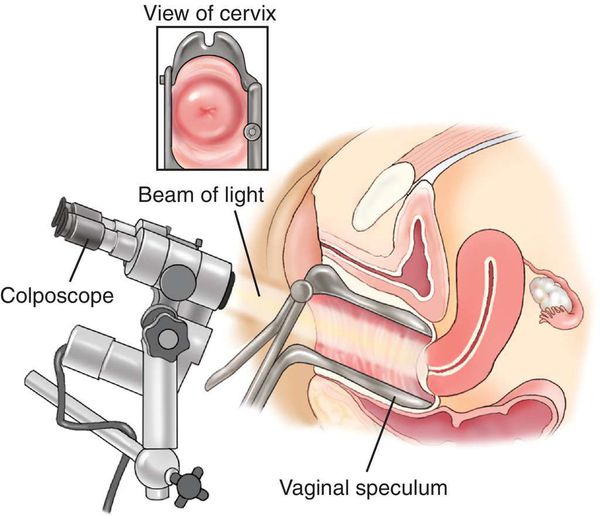
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
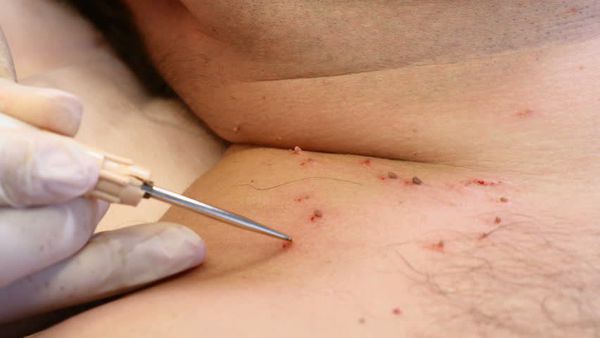
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.

Новость
Вирусы — неотъемлемый компонент живой природы, однако бороться с ними — дело благородное. По крайней мере, в случае ВПЧ и ВИЧ.
Автор
Редакторы
6 октября 2008 года Нобелевский комитет присудил Нобелевскую премию в области физиологии и медицины Гарольду цур Хаузену за открытие того, что вирус папилломы может вызывать рак шейки матки, и Франсуазе Барре-Синусси и Люку Монтанье за открытие вируса иммунодефицита человека.
Лауреаты
Гарольд цур Хаузен (Harald zur Hausen), родился в 1936 г. в Германии, на настоящий момент гражданин Германии, доктор медицины в Университете Дюссельдорфа. Заслуженный профессор и бывший заведующий и директор по науке Немецкого ракового центра в Гейдельберге.
Франсуаза Барре-Синусси (Françoise Barré-Sinoussi), родилась в 1947 г. во Франции, на настоящий момент гражданка Франции, кандидат наук (PhD) в области вирусологии. Профессор и директор подразделения ретровирусных инфекций Института Пастера в Париже. Кстати, Франсуаза стала восьмой женщиной в истории, удостоенной Нобелевской премии.
Люк Монтанье (Luc Montagnier), родился в 1932 г. во Франции, на настоящий момент гражданин Франции, кандидат наук (PhD) в области вирусологии. Почётный профессор и директор Мирового сообщества по изучению и предотвращению СПИДа в Париже.
Открытие вирусной природы рака шейки матки
Вопреки существовавшим в 1970-х представлениям о природе раковых заболеваний, Гарольд цур Хаузен (Harald zur Hausen) постулировал, что развитие рака шейки матки (по крайней мере, в некоторых случаях) связано с папилломавирусом человека (ВПЧ). Он предположил, что если опухолевые клетки содержат онкогенный вирус, то их геном должен включать и вирусную ДНК. Следовательно, активность вирусных генов, инициирующих злокачественный рост, может быть обнаружена при помощи специальных ДНК-тестов, ориентированных на вирусный генетический материал. Цур Хаузен более десяти лет продвигал свою идею и занимался поиском различных типов ВПЧ-инфекции, что затруднялось, в частности, тем обстоятельством, что вирусная ДНК лишь частично внедрялась в хромосомы хозяина (человека). В 1983 году ему удалось обнаружить ДНК папилломавируса в биопсии рака шейки матки, и это событие можно считать открытием онкогенного вируса ВПЧ-16. Годом позже он клонировал ДНК ВПЧ-16 и ВПЧ-18 в пациентах, больных раком шейки матки. Эти типы вируса обнаруживаются примерно в 70% случаях рака шейки матки.

Рисунок 1. Вирус папилломы человека (ВПЧ). ВПЧ содержит двуцепочечную кольцевую молекулу ДНК, заключённую в капсид. Всего известно >100 видов ВПЧ. ВПЧ-16 и ВПЧ-18 являются причиной 70% случаев рака шейки матки.
Значение исследований вируса папилломы
Исследования Гарольда цур Хаузена в области ВПЧ-инфекции легли в основу понимания механизмов канцерогенеза, индуцированного вирусом папилломы. Впоследствии были разработаны вакцины, которые более чем в 95% случаев позволяют предотвратить инфекцию вирусами ВПЧ-16 и ВПЧ-18. Это лечение позволит сократить объем хирургического вмешательства и в целом снизить угрозу, представляемую раком шейки матки.
Открытие ВИЧа
В 1981-м появились медицинские описания новой формы синдрома иммунодефицита. Франсуаза Барре-Синусси (Françoise Barré-Sinoussi) и Люк Монтанье (Luc Montagnier) выделили и исследовали культуры лимфатических клеток людей, которым был поставлен диагноз начальной формы приобретённого иммунодефицита. В этих культурах им удалось обнаружить следы работы фермента обратной транскриптазы — прямого свидетельства инфекции ретровирусом и его репликации в заражённых клетках. Кроме того, они обнаружили непосредственно ретровирусные частицы, отпочковывающиеся от заражённых клеток. Выделенный вирус — получивший название вируса иммунодефицита человека (ВИЧ) — заражал и убивал лимфоциты как здоровых, так и больных людей, а также реагировал с антителами инфицированных пациентов. По сравнению с уже известными на тот момент канцерогенными вирусами, ВИЧ не вызывал неконтролируемой пролиферации клеток; вместо этого он использовал активацию клеточного метаболизма Т-лимфоцитов для собственного размножения. Этот факт позволил объяснить причину приобретённого иммунодефицита, поскольку Т-клетки выполняют очень важную роль в иммунной защите. К 1984 году Барре-Синусси и Монтанье уже имели несколько образцов нового человеческого ретровируса (который они отнесли к подгруппе лентивирусов), полученных из пациентов, заразившихся половым путём, при переливании крови или больных от рождения (в случае, когда инфекция передаётся от матери к ребёнку). Значение проделанной ими работы трудно переоценить, учитывая почти повсеместное распространение ВИЧа и эпидемию СПИДа, охватившую почти 1% населения Земли.

Значение исследований вируса иммунодефицита
ВИЧ стал причиной глобальной пандемии. Никогда прежде медицина и наука не реагировали на угрозу так же быстро, идентифицируя причину нового заболевания и предлагая методики лечения. Пусть не совершенные, на сегодня они обеспечивают практически такую же среднюю продолжительность жизни пациентов, как и у здоровых людей. Многочисленные разработки в области вирусологии этой инфекции всё-таки позволяют надеяться, что однажды человечество сможет полностью победить вирус иммунодефицита.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]

ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);

- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).

В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.

Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:

- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.

- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.

- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.

Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.

Читайте также:

