Кто впервые описал вирус табачной мозаики
Обновлено: 18.04.2024
Часть первая. Санкт-Петербург
История Дмитрия Иосифовича Ивановского — великого ученого, которого называют первооткрывателем вирусов, началась на Петровской улице в Санкт-Петербурге. Эта улица в Северной столице существует до сих пор. В 1870 году в доме 13 на Петровской поселилась семья Ивановских — мать и пятеро детей. Мария Ивановская переехала в столицу из села Низы Петербургской губернии (сейчас это деревня в Новгородской области) после гибели мужа — небогатого чиновника. Главной задачей матери было достойное образование детей. Жили очень бедно, на пенсию вдовы.
Главными в семье Ивановских были учеба и книги. Дети усердно занимались, чтобы выбиться в люди.
Задумка бедной, но дальновидной вдовы удалась: все ее дети успешно окончили гимназию и многого добились. Старший сын, Николай, стал ветеринаром. Младший — Дмитрий — окончил престижную Ларинскую гимназию и поступил в Санкт-Петербургский университет, в то время — самый престижный вуз страны.
Бедное детство, усердная учеба и конкуренция с детьми из более обеспеченных семей в гимназии повлияли на характер Дмитрия. Ивановский вырос амбициозным, но замкнутым и скромным. Так ученого описывают в книгах советского времени его ученики и современники. В какой-то степени эти черты характера повлияли на его дальнейшую судьбу.
В Санкт-Петербургском университете конца XX века работали лучшие русские ученые, общественные деятели, писатели и художники: Дмитрий Менделеев, Иван Павлов, Климент Тимирязев, Петр Столыпин, Михаил Врубель и многие другие. Это было время сложной общественной ситуации в стране и жесткой цензуры, но одновременно — расцвет российской науки. Российская наука двигалась вслед за международным трендом: именно в 70–80-х годах XIX века в мире начала активно развиваться микробиология, публиковались работы Луи Пастера и Роберта Коха.
Однокурсником и близким другом Ивановского был родной брат Ленина, Александр Ульянов, которого казнят в 1887 году за покушение на императора Александра III.
Часть вторая. Табачная мозаика
После учебы Ивановский остался работать в университете, и, когда ему было всего 28 лет, ученому поручили важную практическую задачу. В южных регионах страны плантации табака страдали от странной болезни, уничтожающей урожай. В те годы эта отрасль была важной частью экономики. Ивановский вместе с другими учеными Санкт-Петербургского университета отправился в экспедицию на юг: в Бессарабию, Крым и в другие регионы.

Вирус табачной мозаики под микроскопом
Фото: Clemson University
Отобрав образцы листьев табака на южных плантациях, Ивановский решил поставить эксперимент, который уже проводили в научной группе Луи Пастера. Ученый использовал фильтр Шамберлена — это колба или пробирка с мелкопористым керамическим фильтром внутри. Через фильтр Ивановский пропускал сок из листьев табака, зараженного болезнью. Задумка была в том, что на фильтре с очень мелкими порами должны были задерживаться бактерии — возбудители болезни. Затем бактерии с фильтра можно было извлечь и изучить с помощью микроскопа.
Но, к удивлению Ивановского, после многочисленных экспериментов с соком табачных листьев на фильтрах никаких бактерий не оказалось. Более того, профильтрованный сок сохранял заразность.
Из-за скептического принятия работы в научных кругах и сомнений в себе Ивановский отложил дальнейшую работу по теме и продолжил заниматься ботаникой. Так как мозаичная болезнь табака была проблемой не только в России, владельцы табачных плантаций финансировали исследования во всем мире. В 1898 году знаменитый голландский микробиолог Мартин Бейеринк повторил опыты Ивановского с соком табачных листьев, не зная о работе ученого из Санкт-Петербурга.

Мартин Бейеринк
Фото: Wikimedia Commons
Часть третья. В мире развивается новая наука
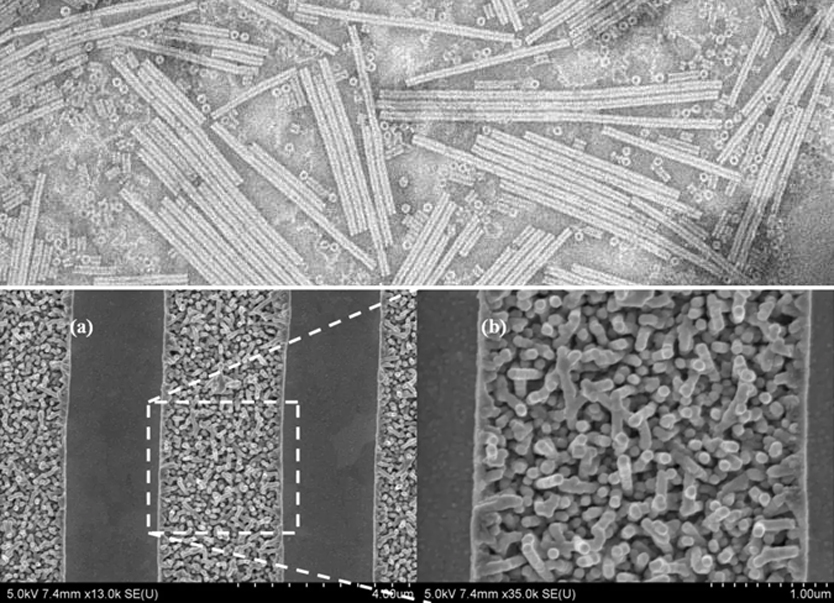
Фото: Wikimedia Commons; University of Maryland
Впервые увидеть вирус и получить его фото ученые смогли только в 1939 году — когда появился электронный микроскоп. Но Ивановский до этого момента не дожил, в его времена были только световые микроскопы, разрешение которых не позволяло рассмотреть вирусы.
Первым вирусом, электронные фотографии которого удалось получить, был вирус табачной мозаики, — тот самый, который открыл Ивановский.
Часть четвертая. Все пошло не так
К сожалению, судьба Ивановского сложилась не так прекрасно, как могла бы у ученого, внесшего огромный вклад в науку. При жизни он не получил признания и даже не искал его.
В 1901 году Ивановский был вынужден покинуть Санкт-Петербургский университет по не очень понятным причинам. Вместе с женой исследователь уехал в Варшаву, где его приняли на позицию профессора в Варшавском императорском университете. Там Ивановский работал до 1915 года и создал лабораторию по физиологии растений и профильную библиотеку. В период жизни в Варшаве в семье ученого случилась трагедия — от туберкулеза погиб единственный сын.
Когда началась Первая мировая война и Ивановским пришлось эвакуироваться из Варшавы в Ростов, Дмитрий Иосифович уже сильно постарел и был совсем седым. Эвакуация университета из Варшавы происходила в спешке: на сборы оборудования и книг сотрудникам дали один день.

Здание Южного федерального университета, Ростов-на-Дону
Фото: Валерий Матыцин / ТАСС
В Ростове-на-Дону Ивановскому пришлось начинать все с нуля и восстанавливать свою лабораторию на новом месте — в доме на Большой Садовой улице, где сейчас находится здание Южного федерального университета.

Ученого не стало в 1920 году: в разных источниках указаны разные версии смерти: заражение испанским гриппом или болезнь печени. Жена Ивановского погибла во время гражданской войны от голода.
Хотя жизнь Ивановского и его семьи закончилась трагически, открытие вирусов помогло понять природу многих болезней и научиться их лечить. Это был созидательный труд, который объединил все человечество и помог спасти миллионы жизней.
Структура вируса табачной мозаики
Вирус поражал культурные растения, хотя начал он это делать явно раньше, чем те стали таковыми. Но тут у его жертв появился новый защитник — человек. За тысячелетия Homo напал на его след, но остановился в недоумении, не видя того, кто этот след оставляет. Нетрудно быть незаметным, имея 300 нанометров в длину!
Майер пропускал сок через фильтровальную бумагу, капал им на чашки, чтобы выделить и вырастить патогенные бактерии, но все было тщетно. Частицы были так малы, что удержать легко ускользающего сквозь поры бумаги виновника было практически невозможно — разве что белок мог быть так мал. Разочарованный, он решил, что белок не может размножаться сам, и не смог найти настоящее объяснение.
Адольф Майер (фотография 1875 года)
В конце XIX века поисками занялся русский ученый Дмитрий Ивановский. Он подошел к делу обстоятельнее, приготовив фарфоровые фильтры, которые использовались для выделения бактерий. Ничто крупнее бактерии не могло просочиться сквозь такие поры. Но и они не могли задержать вирус табачной мозаики. Много раз перепроверив фильтр и не найдя там ни трещин, ни другого брака, Ивановский понял, что частицы слишком малы. Он предположил, что это могла быть очень маленькая бактерия, которая почему-то не хочет культивироваться в лаборатории.
Вирус табачной мозаики
В 1935 году вирус табачной мозаики кристаллизовал Уэнделл Стенли. Но вирус продолжал заражать листья табака и после этого, как ни в чем не бывало. Накапливались подтверждения, что ни одна известная бактерия так себя не ведет. Стенли увидел, что объект, вызывающий заражение, состоит почти полностью из белка, и решил, что перед ним фермент, который катализирует собственное размножение. За первую кристаллизацию вируса он получил Нобелевскую премию по химии в 1946 году.
В 1939 году вирус табачной мозаики впервые удалось увидеть в электронный микроскоп, изобретенный восемью годами ранее. Так виновник неурожайности табака потихоньку раскрыл свою личность, но не все его секреты так легко поддались ученым.
Строение вируса смогли разгадать только позже, с помощью кристаллографии. А поскольку одним из самых талантливых кристаллографов середины XX века была Розалинда Франклин, благодаря данным которой Уотсон и Крик смогли понять структуру ДНК, вирусу табачной мозаики повезло, что она решила связать с ним годы изысканий. Она предсказала его внутреннюю пустоту, а позже поняла и то, что его РНК была одноцепочечной.
Параллельно с ней работала и другая группа: Ханс Френкель-Конрат и Робли Уильямс из Беркли. В том же 1955 году они смогли показать, что в вирусе ничего нет, кроме РНК и белка. Они вплотную подошли к пониманию того, как вирусы размножаются, превращая клетку в фабрику своих деталей, которые сами собираются воедино. В 1960 году Френкель-Конрат и Уильямс секвенировали состояющую из 158 аминокислот последовательность вируса — самую длинную из известных на тот момент.
Так небольшой вирус, случайно найденный в соке растений, стал удобным объектом для изучения и обрел всемирную славу, превратившись в ключ к пониманию размножения и структуры всего своего царства. Для этого, как оказалось, не нужно быть выдающимся и сложным — ему достаточно было быть доступным для получения и вызывать большие проблемы у культивирующих табак агрономов, чтобы привлечь их внимание.
Содержание

Схематическая модель TMV: 1. нуклеиновая кислота ( РНК ), 2. капсомерный белок ( протомер ), 3. капсид.
Вирус табачной мозаики имеет палочковидный вид. Его капсид состоит из 2130 молекул белка оболочки (см. Изображение слева) и одной молекулы геномной однонитевой РНК, длиной 6400 оснований. Белок оболочки самособирается в стержнеобразную спиральную структуру (16,3 белка на виток спирали) вокруг РНК, которая образует структуру петли шпильки (см. Электронную микрофотографию выше). Белковый мономер состоит из 158 аминокислот, которые собраны в четыре основные альфа-спирали, которые соединены заметной петлей, проксимальной к оси вириона. Вирионы имеют длину ~ 300 нм и диаметр ~ 18 нм. [12] На отрицательно окрашенных электронных микрофотографиях виден отчетливый внутренний канал радиусом ~ 2 нм. РНК расположена в радиусе ~ 4 нм и защищена от действия клеточных ферментов белком оболочки. [13] Рентгеновская волокнистая структура интактного вируса была изучена на основе карты электронной плотности с разрешением 3,6 Å. [14] Внутри спирали капсида, около ядра, находится скрученная молекула РНК, которая состоит из 6,395 ± 10 нуклеотидов. [15] [16]

Генома ВТМ состоит из 6,3-6,5 кб одноцепочечной (сс) РНК . 3'-конец имеет тРНК- подобную структуру, а 5'-конец имеет метилированный нуклеотидный кэп. (m7G5'pppG). [17] Геном кодирует 4 открытые рамки считывания (ORF), две из которых продуцируют один белок из-за рибосомного считывания протекающего стоп-кодона UAG . Эти 4 гена кодируют репликазу (с доменами метилтрансферазы [MT] и РНК-геликазы [Hel]), РНК-зависимую РНК-полимеразу , так называемый белок движения (MP) и белок капсида (CP). [18]
TMV - термостабильный вирус. На высушенном листе он может выдерживать температуру до 50 ° C (120 градусов по Фаренгейту) в течение 30 минут. [19]
TMV не имеет четко выраженной перезимовочной структуры. Скорее, он будет перезимовать в инфицированных стеблях и листьях табака в почве, на поверхности зараженных семян (TMV может выжить даже в зараженных табачных изделиях в течение многих лет). При прямом контакте с растениями-хозяевами через его векторы (обычно это насекомые, такие как тли и цикадки ), TMV проходит через процесс заражения, а затем через процесс репликации.
После своего размножения через плазмодесмы проникает в соседние клетки . Инфекция распространяется путем прямого контакта с соседними клетками. Для беспрепятственного проникновения ВТМ производит белок движения 30 кДа, называемый P30, который увеличивает плазмодесмы. TMV, скорее всего, перемещается от клетки к клетке в виде комплекса РНК, P30 и реплицируемых белков.
Он также может распространяться через флоэму, перемещаясь по растению на большие расстояния. Более того, TMV может передаваться от одного растения к другому при прямом контакте. Хотя TMV не имеет определенных векторов передачи, вирус может легко передаваться от инфицированных хозяев к здоровым растениям при контакте с людьми.
После проникновения в организм хозяина посредством механической инокуляции TMV расщепляется, чтобы высвободить свою вирусную [+] цепь РНК. Когда происходит снятие покрытия, ген MetHel: Pol транслируется с образованием кэпирующего фермента MetHel и РНК-полимеразы. Затем вирусный геном будет далее реплицироваться с образованием множества мРНК через промежуточную [-] РНК, примированную тРНК HIS на [+] РНК 3 'конце. Полученные мРНК кодируют несколько белков, включая белок оболочки и РНК-зависимую РНК-полимеразу (RdRp), а также белок движения. Таким образом, TMV может реплицировать собственный геном.


TMV известен как один из самых стабильных вирусов. У него очень широкий диапазон выживания. Пока окружающая температура остается ниже примерно 40 градусов по Цельсию , TMV может поддерживать свою стабильную форму. Все, что ему нужно, - это хозяин, чтобы заразить. В случае необходимости теплицы и ботанические сады обеспечат наиболее благоприятные условия для распространения TMV из-за высокой плотности возможных хозяев и постоянной температуры в течение всего года.
Одним из распространенных методов борьбы с TMV является санитария , которая включает удаление инфицированных растений и мытье рук между посадками. Следует также использовать севооборот , чтобы избежать заражения почвы / семенных гряд в течение как минимум двух лет. Что касается любого заболевания растений, можно также посоветовать поиск устойчивых штаммов против TMV. Кроме того, может применяться метод перекрестной защиты, при котором более сильный штамм инфекции TMV подавляется путем инфицирования растения-хозяина мягким штаммом TMV, аналогично эффекту вакцины .
За последние десять лет было разработано применение генной инженерии к геному растения-хозяина, чтобы позволить растению-хозяину производить белок оболочки TMV в своих клетках. Было высказано предположение, что геном TMV будет быстро повторно покрыт при попадании в клетку-хозяин, таким образом, он предотвращает инициацию репликации TMV. Позже было обнаружено, что механизм, который защищает хозяина от встраивания вирусного генома, заключается в подавлении генов . [25]
TMV ингибируется продуктом миксомицетной слизистой плесени Physarum polycephalum . Как табак, так и бобы P. vulgaris и V. sinensis почти не страдали in vitro от TMV при обработке экстрактом P. polycephalum . [24]

Большое количество литературы о TMV и его выборе для многих новаторских исследований в области структурной биологии (включая дифракцию рентгеновских лучей ), сборки и разборки вирусов и т. Д., В основном, обусловлены большими объемами, которые могут быть получены, а также тем фактом, что он не заражает животных. После выращивания нескольких зараженных растений табака в теплице и нескольких простых лабораторных процедур ученый может легко произвести несколько граммов вируса.
Вирусы растений могут использоваться для создания вирусных векторов , инструментов, обычно используемых молекулярными биологами для доставки генетического материала в клетки растений ; они также являются источниками биоматериалов и нанотехнологических устройств. [27] [28] Вирусные векторы на основе TMV включают векторы технологий экспрессии растений magnICON® и TRBO. [28] [29] Благодаря своей цилиндрической форме, высокому соотношению сторон, самосборной природе и способности включать в свою оболочку металлические покрытия ( никель и кобальт ), TMV является идеальным кандидатом для включения в электроды батареи . [30] Добавление TMV к электроду батареи увеличивает реактивную площадь поверхности на порядок, что приводит к увеличению емкости батареи до шести раз по сравнению с плоской геометрией электрода. [30] [31]
СОДЕРЖАНИЕ

Схематическая модель TMV: 1. нуклеиновая кислота ( РНК ), 2. капсомерный белок ( протомер ), 3. капсид.
Вирус табачной мозаики имеет палочковидный вид. Его капсид состоит из 2130 молекул белка оболочки (см. Изображение слева) и одной молекулы геномной однонитевой РНК, длиной 6400 оснований. Белок оболочки самособирается в стержнеобразную спиральную структуру (16,3 белка на виток спирали) вокруг РНК, которая образует структуру петли шпильки (см. Электронную микрофотографию выше). Белковый мономер состоит из 158 аминокислот, которые собраны в четыре основных альфа-спирали, которые соединены заметной петлей, проксимальной к оси вириона. Вирионы имеют длину ~ 300 нм и диаметр ~ 18 нм. [12] На отрицательно окрашенных электронных микрофотографиях виден отчетливый внутренний канал радиусом ~ 2 нм. РНК расположена в радиусе ~ 4 нм и защищена от действия клеточных ферментов белком оболочки. [13] Рентгеновская волокнистая структура интактного вируса была изучена на основе карты электронной плотности с разрешением 3,6 Å. [14] Внутри спирали капсида, рядом с ядром, находится скрученная молекула РНК, состоящая из 6,395 ± 10 нуклеотидов. [15] [16]

Генома ВТМ состоит из 6,3-6,5 кб одноцепочечной (сс) РНК . 3'-конец имеет структуру, подобную тРНК , а 5'-конец имеет метилированный нуклеотидный кэп. (m7G5'pppG). [17] Геном кодирует 4 открытые рамки считывания (ORF), две из которых продуцируют один белок из-за рибосомного считывания протекающего стоп-кодона UAG . Эти 4 гена кодируют репликазу (с доменами метилтрансферазы [MT] и РНК-геликазы [Hel]), РНК-зависимую РНК-полимеразу , так называемый белок движения (MP) и белок капсида (CP). [18]
TMV - термостабильный вирус. На высушенном листе он может выдерживать температуру до 50 ° C (120 градусов по Фаренгейту) в течение 30 минут. [19]
ВТМ не имеет отчетливой структуры перезимовки . Скорее, он будет перезимовать в инфицированных стеблях и листьях табака в почве, на поверхности зараженных семян (TMV может выжить даже в зараженных табачных изделиях в течение многих лет, поэтому курильщики могут случайно передать его прикосновением, но не через дым сам). [21] [22] При прямом контакте с растениями-хозяевами через его векторы (обычно это насекомые, такие как тля и цикадка ), TMV проходит через процесс заражения, а затем через процесс репликации.
После своего размножения через плазмодесмы проникает в соседние клетки . Инфекция распространяется при прямом контакте с соседними клетками. Для беспрепятственного проникновения TMV производит белок движения 30 кДа, называемый P30, который увеличивает плазмодесмы. TMV, скорее всего, перемещается от клетки к клетке в виде комплекса РНК, P30 и реплицируемых белков.
Он также может распространяться через флоэму, перемещаясь по растению на большие расстояния. Более того, TMV может передаваться от одного растения к другому при прямом контакте. Хотя TMV не имеет определенных векторов передачи, вирус может легко передаваться от инфицированных хозяев к здоровым растениям при контакте с людьми.
После проникновения в организм хозяина посредством механической инокуляции TMV расщепляется и высвобождает цепь вирусной [+] РНК. Когда происходит отслаивание, ген MetHel: Pol транслируется с образованием кэпирующего фермента MetHel и РНК-полимеразы. Затем вирусный геном будет далее реплицироваться с образованием множества мРНК через промежуточный [-] РНК, примированный тРНК HIS на [+] РНК 3 'конце. Полученные мРНК кодируют несколько белков, включая белок оболочки и РНК-зависимую РНК-полимеразу (RdRp), а также белок движения. Таким образом, TMV может реплицировать собственный геном.


TMV известен как один из самых стабильных вирусов. У него очень широкий диапазон выживания. Пока окружающая температура остается ниже примерно 40 градусов по Цельсию , TMV может поддерживать свою стабильную форму. Все, что ему нужно, - это хозяин, чтобы заразить. В случае необходимости теплицы и ботанические сады обеспечат наиболее благоприятные условия для распространения TMV из-за высокой плотности населения возможных хозяев и постоянной температуры в течение всего года.
Одним из распространенных методов борьбы с TMV является санитария , которая включает удаление инфицированных растений и мытье рук между посадками. Следует также использовать севооборот , чтобы избежать заражения почвы / семенных гряд в течение как минимум двух лет. Как и в случае любого заболевания растений, можно также посоветовать поиски устойчивых штаммов против TMV. Кроме того, может применяться метод перекрестной защиты, при котором более сильный штамм инфекции TMV ингибируется путем инфицирования растения-хозяина мягким штаммом TMV, аналогично эффекту вакцины .
За последние десять лет было разработано применение генной инженерии к геному растения-хозяина, чтобы позволить растению-хозяину продуцировать белок оболочки TMV в своих клетках. Было высказано предположение, что геном TMV будет быстро повторно покрыт при попадании в клетку-хозяин, таким образом, он предотвращает инициацию репликации TMV. Позже было обнаружено, что механизм, который защищает хозяина от встраивания вирусного генома, заключается в подавлении генов . [27]
TMV ингибируется продуктом миксомицетной слизистой плесени Physarum polycephalum . Как табак, так и бобы P. vulgaris и V. sinensis почти не страдали in vitro от TMV при обработке экстрактом P. polycephalum . [26]

Большое количество литературы о ВТМ и его выборе для многих новаторских исследований в области структурной биологии (включая дифракцию рентгеновских лучей ), сборки и разборки вирусов и т. Д. В основном обусловлены большими количествами, которые могут быть получены, а также тем, что он не заражает животных. После выращивания нескольких зараженных растений табака в теплице и нескольких простых лабораторных процедур ученый может легко произвести несколько граммов вируса.
Вирусы растений можно использовать для создания вирусных векторов , инструментов, обычно используемых молекулярными биологами для доставки генетического материала в клетки растений ; они также являются источниками биоматериалов и нанотехнологических устройств. [29] [30] Вирусные векторы на основе TMV включают векторы технологий экспрессии растений magnICON® и TRBO. [30] [31] Благодаря своей цилиндрической форме, высокому соотношению сторон, самосборной природе и способности включать в свою оболочку металлические покрытия ( никель и кобальт ), TMV является идеальным кандидатом для встраивания в электроды батареи . [32] Добавление TMV к электроду батареи увеличивает реактивную площадь поверхности на порядок, что приводит к увеличению емкости батареи до шести раз по сравнению с плоской геометрией электрода. [32] [33]

В отличие от бактерий, которых ещё в 1676 году описал основатель научной микроскопии Антони ван Левенгук, вирусы в световой микроскоп видны не были. А электронный создали лишь спустя 40 лет после открытия вирусов. Как же их вообще удалось заметить? Благодаря табаку, точнее, его болезни, которая была страшной проблемой для фермеров.
В современный световой микроскоп крупные вирусы увидеть можно. Они выглядят так же, как выглядели бактерии для Левенгука. Просто точки. Но бактерии при этом активно двигаются.
Некротические пятна на листьях табака резко снижали урожай, а главное, из таких листьев не получалось сделать сигары. Производители с подобным положением дел мириться не могли и спонсировали исследования патологии. В 1886 году немецкий агроном Адольф Майер доказал, что "мозаичное заболевание табака", как он окрестил эту напасть, легко передаётся с соком растения, а значит, тут замешан инфекционный агент. Поскольку прогревание при 80 ºС обеззараживало исходный биоматериал (Пастер, напомним, уже изобрёл пастеризацию), Майер решил, что возбудитель болезни - бактерия.
._4_t_310x206.jpg)
Российского ботаника Дмитрия Ивановского болезнь табака волновала ничуть не в меньшей степени. Полагая, что этот недуг вызывают бактерии, Ивановский планировал осадить их на специальном фильтре, поры которого меньше этих организмов. Такая процедура позволяла полностью удалить из раствора все известные патогены. Но экстракт заражённых листьев сохранял инфекционные свойства и после фильтрации!
Этот парадокс, описанный Ивановским в работе 1892 года, стал отправной точкой в развитии вирусологии. При этом сам учёный думал, что сквозь его фильтр прошли мельчайшие бактерии либо выделяемые ими токсины, то есть вписывал своё открытие в рамки существующего знания. Впрочем, это частности. Приоритет Ивановского в открытии вирусов не оспаривается.
Спустя 6 лет голландский микробиолог Мартин Бейеринк, не зная поначалу о работе Ивановского, провёл серию аналогичных экспериментов. То, что патоген проходит сквозь бактериальный фильтр и не может, подобно бактериям, размножаться в питательной среде, привело Бейеринка к выводу, что перед ним новый, неизвестный науке инфекционный агент. Учёный окрестил его "вирусом" (от лат. virus - яд), повторно введя это слово в научный оборот: прежде оно использовалось для обозначения всего агрессивного и токсичного.
Вирус табачной мозаики стал нашим проводником в абсолютно новую область биологии - вирусологию. И в знак признания особых заслуг перед человечеством был первым среди вирусов исследован на электронном микроскопе.
Вирус табачной мозаики до сих пор любим вирусологами: на его основе легко делать вакцины. Одну из них - от COVID-19 - сейчас разрабатывают на биологическом факультете МГУ имени М.В. Ломоносова.
Что мы знаем сегодня
Вирусы присутствуют во всех земных экосистемах и поражают все типы организмов: от животных до бактерий с археями. При этом учёные до сих пор спорят, являются ли вирусы живыми существами. Серьёзные аргументы есть и за, и против.
Конечно да! У вирусов есть геном, они эволюционируют и способны размножаться, создавая собственные копии путём самосборки.
Решительно нет! У них неклеточное строение, а именно этот признак считается фундаментальным свойством живых организмов. А ещё у них нет собственного обмена веществ - для синтеза молекул, как и для размножения, им необходима клетка-хозяин.
Впрочем, большинство учёных склонны рассматривать этот спор как чисто схоластический.
2. Как устроены вирусы
Самая суть: Вирус - это генетическая инструкция в белковом контейнере. Расшифровать строение вирусов удалось, превращая их в кристаллы.
История открытия
К началу 1930-х годов всё ещё оставалось непонятным, что такое вирус и как он устроен. И по-прежнему не было микроскопа, в который его можно было бы разглядеть. В числе прочих высказывалась гипотеза, что вирус - это белок. А структуру белков в то время изучали, преобразуя их в кристаллы. Если бы вирус удалось кристаллизовать, то его строение можно было бы изучать методами, разработанными для исследования кристаллов.

В 1932 году Уэнделл Мередит Стэнли отжал сок из тонны больных листьев табака и воздействовал на него разными реагентами. После трёх лет опытов он получил белок, которого не было в здоровых листьях. Стэнли растворил его в воде и поставил в холодильник. Наутро вместо раствора он обнаружил игольчатые кристаллы с шелковистым блеском. Стэнли растворил их в воде и натёр полученным раствором здоровые листья табака. Через некоторое время они заболели. Эти опыты открыли учёным путь к получению и изучению чистых препаратов вируса, а самому Стэнли принесли Нобелевскую премию.
Структуру вируса расшифровала Розалинд Франклин - та самая "леди ДНК", которая впервые получила чёткую рентгенограмму структуры ДНК и умерла за четыре года до вручения Нобелевки за это невероятно важное открытие. Рассматривая вирус табачной мозаики в рентгеновских лучах, Розалинд поняла, что он представляет собой белковый контейнер, к внутренним стенкам которого прикреплена спираль РНК.
Что мы знаем сегодня
Постепенно накопились данные, позволившие разработать классификации вирусов. Выяснилось, что вирусы различаются по типу молекул ДНК или РНК, на которых записана их генетическая программа. Другое различие - по форме белкового контейнера, который называется капсид. Бывают спиральные, продолговатые, почти шарообразные капсиды и капсиды сложной комплексной формы. Многие капсиды имеют ось симметрии пятого порядка, при вращении вокруг которой пять раз совпадают со своим первоначальным положением (как у морской звезды).
У некоторых вирусов капсид заключён в дополнительную оболочку, суперкапсид, которая состоит из слоя липидов и специфичных вирусных белков. Последние часто формируют выросты-шипы - ту самую "корону" коронавируса. Вирусы с такой оболочкой называют "одетыми", а без неё - "голыми".
Необходимость кристаллизовать вирусы для их изучения отпала лишь недавно с появлением атомных силовых микроскопов и лазеров, генерирующих сверхкороткие импульсы.
3. Кто такие фаги
Самая суть: Большая часть вирусов - "пожиратели бактерий", хоть никого и не жрут. Фаг может убить бактерию, а может сделать из неё зомби. Для нас это хорошо.
История открытия
В конце XIX века британский бактериолог Эрнест Ханкин, сражавшийся с холерой в Индии, изучал воды рек Ганг и Джамна, которые местные жители считали целебными. Ханкин, энтузиаст кипячения воды и теории Пастера о том, что болезни вызываются микроорганизмами, а не миазмами (вредоносными испарениями - так думали врачи ещё в середине XIX века), обнаружил, что суеверные индусы правы: какой-то неопознанный объект непонятным образом обеззараживает воду священных рек без всякого кипячения.
Лишь спустя двадцать лет неопознанному объекту придумали название: Феликс Д'Эрелль из Института Пастера предложил называть этих существ "бактериофагами", в переводе с греческого - "пожирателями бактерий". Он пришёл к выводу, что бактериофаги - вирусы, паразитирующие на бактериях.

Сейчас их нередко зовут просто фагами. Эти вирусы прикрепляются к стенкам бактерий и впрыскивают в них свой генетический материал. Попав внутрь, генетическая программа вируса запускает производство новых вирусов. В итоге одни ферменты бактерии создают копии вирусного генома, другие - строят по вшитым в него инструкциям белки, третьи - собирают мириады клонов. Порабощённая фагом бактерия превращается в фабрику по созданию его клонов, которые могут выходить наружу вместе с метаболитами или "взрывать" бактериальную клетку. Так или иначе полчища клонов освобождаются и отправляются заражать всё новые бактерии.
Для бактерии встреча с фагами не всегда заканчивается печально: бактериофаги бывают вирулентными и умеренными. Если клетке не повезёт и она повстречает вирулентного фага, то погибнет (у биологов этот процесс называется лизисом). Фаг использует такую клетку как ясли для своего потомства. Умеренные фаги обычно более дружелюбны. Они делают из бактерии зомби: она переходит в особую форму - профаг, когда вирус интегрируется в геном клетки и сосуществует с ней. Это сожительство может стать симбиозом, в котором бактерия приобретёт новые качества и эволюционирует.
Способность вирусов уничтожать вредоносные бактерии привлекла к ним внимание учёных. Впервые фагов, этих цепных собак биологов, натравили на стафилококк ещё в 1921 году. Их активно изучали в Советском Союзе. Основоположник этого направления грузинский микробиолог Георгий Элиава был учеником Феликса Д'Эрелля. По его инициативе в 30-е годы был создан Институт исследования бактериофагов в Грузии, а позднее фаготерапия в СССР получила одобрение на самом высоком уровне. Были разработаны стрептококковый, сальмонеллёзный, синегнойный, протейный и другие фаги.
Западные учёные отнеслись к фагам с меньшим энтузиазмом. Фаги очень чувствительные и в неподходящих условиях внешней среды теряют супергеройские способности. А тут как раз открыли и успешно применили первый антибиотик, и о фагах надолго позабыли.
Что мы знаем сегодня
В 2005 году биологи из Университета Сан-Диего показали, что вирусы - самые распространённые биологические объекты на планете, и больше всего среди них именно бактериофагов.
Всего на данный момент описано более 6 тысяч видов вирусов, но учёные предполагают, что их миллионы.
4. Как создали первую вакцину
Самая суть: Вакцинация - одно из величайших изобретений человечества, благодаря которому многие смертельные заболевания остались в истории. Но почему слово "вакцина" происходит от слова "корова"?
История открытия
Главное событие в истории вакцинации произошло в конце XVIII века, когда английский врач Эдвард Дженнер использовал коровью оспу для предотвращения оспы натуральной - одного из самых страшных заболеваний в истории, смертность от которого тогда достигала полутора миллионов человек в год.
Коровья оспа передавалась дояркам, протекала легко и оставляла на руках маленькие шрамы. Сельские жители хорошо знали, что переболевшие коровьей оспой не болеют человеческой, и эта закономерность стала отправной точкой для исследований Дженнера.

Предотвращение распространения Variola vera - натуральной оспы - главное событие в истории вакцинации Фото: iStock
Хотя идея была не нова: ещё в Х веке врачи придумали вариоляцию - прививку оспенного гноя от заболевшего к здоровому. На Востоке вдыхали растёртые в порошок корочки, образующиеся на местах пузырьков при оспе. Из Китая и Индии эта практика расходилась по миру вместе с путешественниками и торговцами. А в Европу XVIII века вариоляция пришла из Османской империи: её привезла леди Мэри Уортли-Монтегю - писательница, путешественница и жена британского посла. Так что самому Дженнеру оспу привили ещё в детстве. Вариоляция действительно снижала смертность в целом, но была небезопасна для конкретного человека: в 2% случаев она приводила к смерти и иногда сама вызывала эпидемии.

Но вернёмся к коровам. Предположив близкое родство вирусов коровьей и натуральной оспы, Дженнер решился на публичный эксперимент. 14 мая 1796 года он привил коровью оспу здоровому восьмилетнему мальчику, внеся экстракт из пузырьков в ранки на руках. Мальчик переболел лёгкой формой оспы, а введённый через месяц вирус настоящей оспы на него не подействовал. Дженнер повторил попытку заражения через 5 месяцев и через 5 лет, но результат оставался тем же: прививка коровьей оспы защищала мальчика от оспы натуральной.
Дженнеру потребовались годы, чтобы убедить коллег-врачей в необходимости вакцинации, - и эпидемии оспы в Европе наконец были остановлены. Идеи Дженнера развивал великий Луи Пастер: он ввёл термин "вакцина" (от латинского vacca - корова), описал научную сторону вакцинации, создал вакцины против сибирской язвы, бешенства, куриной холеры и убедил мир, что прививки необходимы для предотвращения многих болезней.
Что мы знаем сегодня
В 1980 году Всемирная организация здравоохранения объявила о полном устранении натуральной оспы. Это первое заболевание, которое победили с помощью массовой вакцинации.
После прививки в организме вырабатывается такой же иммунитет, как после перенесённого заболевания. При этом даже не нужно встречаться с живым патогеном. Обычно в вакцинах содержится его часть, например поверхностный белок, или сам вирус, но ослабленный или убитый. Такой агент, его называют антигеном, учит иммунную систему распознавать его как врага и уничтожать в будущем. В следующий раз, когда в организм попадёт настоящий вирус или бактерия, специфичные антитела - иммунные белки - "подсветят" его для клеток иммунной системы, которые тут же мобилизуются и уничтожат патоген.
Сейчас существует более сотни вакцин, защищающих от 40 вирусных и бактериальных заболеваний. Иммунизация спасает миллионы жизней, поэтому наши дети не умирают от столбняка, поцарапавшись на улице.
Современные вакцины, прошедшие все стадии клинических испытаний, безопасны - они могут вызвать сильную иммунную реакцию у некоторых людей, но никак не тяжёлую форму болезни с летальным исходом или тем более эпидемию.
5. Как вирусы поселились в нашей ДНК
Самая суть: В геноме человека затаились древние вирусы. Они составляют более 8% нашей ДНК. И мы им многим обязаны.
История открытия
В 1960-х годах учёные поняли, что некоторые вирусы могут вызывать рак. Одним из них был вирус птичьего лейкоза, угрожавший всему птицеводству. Вирусологи выяснили, что он относится к группе так называемых ретровирусов, внедряющих свой генетический материал в ДНК клетки-носителя. Такая ДНК будет производить новые копии вируса, но если вирус по ошибке встроился не в то место ДНК, клетка может стать раковой и начать делиться. Вирус птичьего лейкоза оказался очень странным ретровирусом. Учёные находили его белки в крови совершенно здоровых куриц.
Робин Вайс, вирусолог из Университета Вашингтона, первым понял, что вирус мог интегрироваться в ДНК курицы, стать её неотъемлемой и уже неопасной частью. Вайс и его коллеги обнаружили этот вирус в ДНК многих пород кур. Отправившись в джунгли Малайзии, они изловили банкивскую джунглевую курицу, ближайшую дикую родственницу домашней, - она несла в ДНК тот же вирус! Когда-то давно иммунная система куры-предка сумела подавить вирус, и, обезвреженный, он стал передаваться по наследству. Учёные назвали такие вирусы эндогенными, то есть производимыми самим организмом.
Вскоре выяснилось, что эндогенных ретровирусов полно в геномах всех групп позвоночных. А в 1980 году их обнаружили и у человека.
Что мы знаем сегодня
Согласно данным исследователей из Мичиганского университета, на долю эндогенных ретровирусов приходится более 8% нашего генома. При этом обнаружены далеко не все вирусные последовательности, которые осели в геноме человека. Искать их сложно: они встречаются у одного и отсутствуют у другого.
Некоторые эндогенные вирусы остаются опасными, но большинство уже неспособно запустить вирусную программу и захватить мир. До недавнего времени их считали "генетическим мусором". Но оказалось, что порой интеграция вирусов в ДНК ведёт к появлению полезных генетических программ. Например, многие участки ДНК, которые регулируют активность генов, участвующих во врождённом иммунитете, являются ретровирусами. А недавно российские учёные обнаружили у человека эндогенный ретровирус, регулирующий работу мозга и отсутствующий у других приматов, - получается, мы обязаны вирусам какими-то важнейшими своими особенностями! Правда, этот же вирус, возможно, привёл к возникновению шизофрении.
Друзья или враги нам эндогенные ретровирусы, сказать сложно, потому что нет уже деления на нас и них, - мы соединились в одно существо.
Читайте также:

