Курс повышения иммунитета от герпеса и бородавок
Обновлено: 24.04.2024
Именно эти виды герпеса ответственны за появление высыпаний – на коже лица, губах, слизистой оболочке полости рта, а также они являются причиной и генитального герпеса. Нужно отметить, что если раньше вирус герпеса ВПГ-2 – ассоциировался только с развитием генитального герпеса, то сейчас он также вызывает и герпес на лице, губах и слизистой оболочке рта – примерно у 10% пациентов. Герпес типа ВПГ-2 более патогенен (чем ВПГ-1), и у таких пациентов всегда наблюдаются – как более тяжелые клинические проявления, так и более высокая частота рецидивов.
Герпес: фото
Вирус простого герпеса клинически проявляется образованием группы скученных пузырьков, располагающихся на воспаленном основании (коже или слизистой оболочке). Пузырьки сначала заполнены прозрачным содержимым, которое достаточно быстро становится мутным. Если у вас появился герпес – лечение обязательно нужно начать до момента вскрытия герпетических пузырьков. В противном случае не только мазь от герпеса, но и самые лучшие таблетки от герпеса – уже не позволят хоть как-то заметно ускорить заживление.
Как выглядит герпес –
Вирус герпеса (как происходит заражение) –
Изначально дети рождаются с иммунитетом к вирусу герпеса – благодаря антителам, которые достаются каждому ребенку от матери (еще в период беременности). Однако постепенно количество антител уменьшается, и обычно в период от 6 месяцев до 3 лет максимум – у ребенка развивается первичная герпетическая инфекция. Обычно она протекает в виде первичного герпетического гингивостоматита. И в дальнейшем вирус герпеса сохраняется в организме на всю жизнь, периодически обостряясь.
Как передается герпес –
Лучшее средство от герпеса – это безусловно его профилактика, но ниже мы также расскажем и о специальных мазях и таблетках. Вы должны знать, что контактный путь является основным для передачи герпетической инфекции; более редким является воздушно-капельный путь передачи. Контактный путь передачи означает, что заражение вирусом герпеса происходит:
Наиболее заразными являются люди, имеющие клинические проявления герпеса – речь идет о целых или только что вскрывшихся герпетических пузырьках. Имейте в виду, что риск заражения не исчезает после образования корочек, а только чуть-чуть уменьшается. Современные исследования показывают, что заражение герпесом возможно даже от клинически полностью здорового человека.
Важно: у примерно 10% людей – вирус герпеса постоянно определяется в слюне (даже на фоне полного отсутствия у них каких-либо симптомов герпеса).
Из-за чего происходят рецидивы герпеса –
Под воздействием определенных пусковых факторов вирус активируется, вновь продвигается по нервным стволам к поверхностям кожи и/или слизистых оболочек – где и вызывает образование герпетических пузырьков (везикул). Рецидивы могут повторяться 1 или 2 раза в год, но иногда и намного чаще, что в конечном итоге зависит от состояния вашего иммунитета и нервной системы.
Факторы, которые вызывают рецидив герпеса –
- контакт с человеком, имеющим клинические проявления герпеса,
- снижение иммунитета на фоне гриппа или ОРВИ,
- иммунодефицитные состояния,
- переохлаждение, обезвоживание,
- физическая усталость и эмоциональный стресс,
- порезы и царапины кожи, например, после бритья,
- после визита к стоматологу (из-за того, что при длительном широком открывании рта происходит образование трещин в уголках рта),
- после инвазивных косметологических процедур,
- в период менструаций у женщин,
- длительное пребывание на солнце.
Симптомы герпеса –
Лабиальный герпес: фото
В зависимости от объема поражения кожи и тяжести клинических проявлений могут быть назначены либо крем для кожи с противовирусным действием, либо крем в комбинации с таблетированными противовирусными препаратами. Подробный обзор препаратов для лечения вы можете увидеть в конце статьи.
У детей герпетическому стоматиту очень часто сопутствует еще и гингивит. В этом случае (помимо множественных пузырьков и эрозий на каком-то участке слизистой оболочки полости рта) – можно увидеть ярко-красные воспаленные десны.
Общие симптомы герпеса –
первичная герпетическая инфекция может протекать с симптомами, похожими на грипп или ОРВИ (повышенная температура, мышечные боли и даже увеличение подчелюстных лимфатических узлов). Но такие острые симптомы наблюдаются только у 10% от всех заболевших. При повторных вспышках общее состояние организма обычно не нарушается.
Чем лечить герпес у взрослых (лекарства) –
Но, чтобы лечение герпеса было максимально эффективным – вы должны строго соблюдать следующие правила:
Терапия герпеса покажет хорошую эффективность, если она начата не позже 12 часов с момента появления первых герпетических высыпаний. Имейте в виду, что чем позже будет начато лечение – тем меньше будет эффективность даже самых лучших лекарств от герпеса.
Максимальную эффективность покажет терапия, которая начата еще в продромальном периоде (т.е. когда собственно герпетические пузырьки еще не появились, но пациент уже ощущает зуд, жжение или распирание тканей в этой области). Если лечение начинается в этот период, то количество и размер образовавшихся в дальнейшем герпетических пузырьков будет значительно меньшим, и в этом случае полное заживление может быть достигнуто всего за 4-5 дней.
Помните, что если вы начнете лечение позже 48 часов, либо уже после вскрытия герпетических пузырьков – такая терапия заметно не повлияет на скорость выздоровления (заживление очагов). Однако у пациентов с тяжело протекающими и частыми рецидивами – такая терапия может позволить избежать осложнений.
1. Выбираем мазь от герпеса –
Крем Зовиракс: оригинальный препарат ацикловира
Крем или мазь от герпеса с ацикловиром следует наносить на очаг поражения и кожу вокруг него – минимум 5 раз в день (но лучше каждые 2 часа пока вы не спите). Продолжительность терапии обычно составляет 5 дней, но в случае тяжелого герпетического поражения – длительность применения может быть увеличена до 7-10 дней. Нужно отметить, что форма в виде крема более предпочтительна перед мазью, т.к. из мазевой субстанции активные вещества значительно хуже проникают в кожу.
Стоит обращать внимание и на состав, например, эффективной концентрацией ацикловира является именно 5% (хотя в аптеках можно встретить и средства с 3% концентрацией). Кроме того, в составе желательно должны быть пропиленгликоль и/или цетомакрогол, которые увеличивают проникновение молекул ацикловира сквозь поверхностные слои кожи. Это важно, т.к. сам по себе ацикловир достаточно плохо проникает через эпидермис кожи и образующиеся корочки.
Лучшее средство от герпеса с ацикловиром –
На сегодняшний день лучший препарат для наружного применения от герпеса – это крем Зовиракс Дуо-Актив, который содержит комбинацию 5% ацикловира и 1% гидрокортизона. Ацикловир блокирует размножение вируса, а гидрокортизон уменьшает воспаление и отек. При этом, если применение крема начинается еще до появления герпетических пузырьков, то гидрокортизон иногда позволяет вообще предупредить их образование. Но если пузырьки и образуются, то их количество и размер будут меньшим, что уже само по себе позволит заметно ускорить заживление.
Недостатки препаратов на основе ацикловира –
ацикловир является устаревшим препаратом, но в принципе он неплохо работает у большинства пациентов (с некоторыми исключениями). Например, у пациентов с хорошим иммунитетом устойчивость вируса герпеса к ацикловиру встречается – в среднем всего в 3% случаев, что достаточно мало. Однако проблему составляют пациенты с ослабленным иммунитетом + частыми курсами применения ацикловира в прошлом – в таких группах пациентов устойчивость к ацикловиру может наблюдаться уже от 10 до 27% случаев.
Кроме того, молекулы ацикловира имеют очень низкую тропность к вирусу герпеса, что означает, что ацикловир обычно просто не находит какой-то процент вирусных частиц в клетках (к примеру у препаратов на основе пенцикловира/ фамцикловира – тропность в вирусу намного выше). Кроме того, молекулы ацикловира имеют свойство плохо проникать сквозь кожу, а также сквозь образующиеся корочки (к месту размножения вируса). Чтобы хоть как-то уменьшить эту проблему – часть производителей добавляют в состав наружных средств с ацикловиром пропиленгликоль и цетомакрогол.
Альтернативные наружные средства от герпеса –
Выше мы уже сказали, что у пациентов с ослабленным иммунитетом часто развивается устойчивость вируса герпеса к ацикловиру. Что делать таким пациентам? Международные рекомендации в этом случае говорят о необходимости применения курсов фамцикловира в таблетках – это такие препараты как Фавирокс или Фамвир. Таблетированные препараты на основе валацикловира (при подозрении на резистентность к ацикловиру) – применять не имеет смысла, т.к. валацикловир является предшественником ацикловира. Последнее означает, что при наличии устойчивости к ацикловиру – устойчивость будет и к валацикловиру.
Крем Девирс от герпеса –
К сожалению, клинических исследований эффективности местных средств на основе рибавирина – очень мало, и все они, на наш взгляд, имеют достаточно слабую степень доказательности. Знакомясь с исследованиями, мы обратили внимание на то, что этот препарат очень редко применялся в исследованиях в форме монотерапии (обычно его комбинировали – либо с пероральным рибавирином, либо с пероральным ацикловиром), что уже говорит о достаточно слабой эффективности крема. Поэтому наша редакция не может рекомендовать этот препарат для широкого применения – особенно для лечения герпеса губ и небольших поражений на лице. Но препарат вполне может использоваться в составе комплексной терапии, например, при генитальном герпесе.
Выбираем таблетки от герпеса –
Герпес лечение у взрослых: препараты в таблетках
- Ацикловир,
- Валацикловир,
- Фамцикловир.
1. Ацикловир в таблетках по 200 и 400 мг –
Таблетированный ацикловир обладает теми же недостатками, что и кремы: низкая тропность к вирусу (т.е. молекулы ацикловира плохо находят вирусные частицы); у пациентов с плохим иммунитетом + частыми курсами применения ацикловира в прошлом – в 10-27% случаев вирус герпеса может быть устойчив к ацикловиру; плюс низкая биодоступность при пероральном приеме. Плюсы – нет противопоказаний по возрасту, доступная цена, достаточно мало побочных эффектов.
Примеры препаратов с ацикловиром –

Ацикловир в таблетках безусловно работает, особенно если речь идет о пациентах с хорошим иммунитетом и редкими рецидивами герпеса. Если у вас ослабленный иммунитет, если слишком часто принимали ацикловир в прошлом, если вы решили начать принимать препарат более чем 24-48 часов с момента появления герпетических высыпаний – ацикловир не будет особенно эффективен. В этом случае вам лучше сразу начать принимать препарат Фамцикловир, который лучше работает даже при более поздних сроках начала терапии, а также у пациентов с иммунодефицитными состояниями.
Схема применения –
если смотреть официальную инструкцию, то стандартной схемой у взрослых и детей старше 2 лет – является прием ацикловира по 200 мг 5 раз в день (в течение 5 дней). Однократная дозировка 400 мг в официальной инструкции рекомендуется – либо только при тяжелом течении герпетической инфекции, либо у пациентов с ослабленным иммунитетом. Однако, большинство клинических исследований (источник) показывает, что дозировка 200 мг практически не влияет – ни на длительность симптомов, ни на время заживления герпеса.
Исследования показали, что эффективной однократной дозировкой является только 400 мг (соответственно, 5 раз в день, в течение 5 дней). У детей младше 2 лет дозировка уменьшается ровно в 2 раза – от взрослой дозировки. При тяжелом течении герпетической инфекции – прием препарата может быть продлен до 7-10 дней. Кстати, за рубежом, при хроническом рецидивирующем герпесе ацикловир в настоящий момент практически не применяют, отдавая предпочтение валацикловиру и фамцикловиру.
2. Таблетки Валацикловир (Валтрекс) –
Выше мы уже говорили, что таблетированный ацикловир имеет слабую биодоступность, т.е. всего около 10-20% от его количества всасывается в кишечнике, что затрудняет достижение высоких концентраций ацикловира в тканях. Эту проблему решает Валацикловир, имеющий биодоступность уже на уровне 50%. Валацикловир является предшественником ацикловира (т.е. он превращается в ацикловир, уже попав в кровь). Прием таблеток с валацикловиром позволяет создать такую концентрацию ацикловира в тканях, которую возможно достичь традиционным ацикловиром – только путем внутривенных инфузий последнего.
Схема приема –
существует короткая 1-дневная схема лечения. Клинические исследования показали, что прием высоких дозировок препарата в течение 1 дня – было наиболее эффективным для лечения герпеса на губах и коже лица, а также герпетического стоматита. В этом случае схема приема – по 2000 мг 2 раза в день, с интервалом 12 часов (всего 1 день). Но следует учесть, что такая короткая схема будет эффективной – только если лечение начинается не позже 12 часов с момента появления герпетических высыпаний, а также у пациентов с удовлетворительным или хорошим иммунитетом.
Если с момента появления высыпаний прошло больше 12 часов, а также если у вас ослабленный иммунитет – оптимально использовать стандартную схему лечения по 500 мг 2 раза в день, в течение 3-5 дней (при тяжелой форме герпетической инфекции – до 10 дней). При выборе препарата имейте в виду, что при устойчивости вашего вируса герпеса к ацикловиру – прием валацикловира у вас также будет неэффективен.
3. Таблетки Фамцикловир (Фавирокс, Фамвир) –
Преимущество препаратов фамцикловира типа Фавирокса – быстрый противовирусный эффект благодаря максимальной биодоступности (для фамцикловира она составляет около 74%, например, у валацикловира она всего 54%, а у ацикловира только 10-20%). Поэтому упаковки из трех таблеток по 500 мг – достаточно для короткого 1-дневного курса терапии для купирования проявлений герпеса на губе. Подробности о такой схеме применения – читайте ниже.

Схема применения фамцикловира –
существует короткая 1-дневная схема лечения: либо однократно принять 1500 мг, либо по 750 мг 2 раза в день (с 12 часовым интервалом между приемами) – наш опыт говорит о том, что второй вариант все-таки лучше. Такая 1-дневная схема эффективна только при условии, что вы начали прием препарата до 12 часов с момента появления герпетических высыпаний, а также при нормальном состоянии иммунитета у пациента. При ослабленном иммунитете, и/или если лечение начато позже 12 часов с момента появления герпетических высыпаний – нужно использовать стандартную схему применения.
Стандартная схема согласно инструкции – это по 250 мг 2 раза в день, в течение 5 дней (однако при тяжелой форме герпетической инфекции – прием может быть продлен до 7-10 дней). Тут хочется добавить, что многочисленные клинические исследования показывают слабую эффективность такой стандартной схемы – особенно у пациентов с плохим состоянием иммунной системы. Исследования показали, что эффективность терапии значительно возрастает при назначении фамцикловира в более высоких дозировках. У пациентов с хорошим иммунитетом более эффективной будет схема – по 500 мг 2 раза в день (в течение 5 дней). У пациентов с ослабленным иммунитетом – по 500 мг 3 раза в день (в течение 7 дней).
Важно : еще раз обращаем ваше внимание на то, что короткие 1-дневные схемы лечения герпеса у взрослых (герпеса на губах и кожи вокруг рта, на лице) – хорошо работают только при выполнении следующих условий. Во-первых – только если вы начинаете принимать препараты не позже 12 часов с момента появления герпетических высыпаний. Во-вторых – если у вас удовлетворительное или хорошее состояние иммунитета. Если лечение начато позже 12 часов с момента появления высыпаний, а также у пациентов с ослабленным иммунитетом – короткие 1-дневные курсы терапии обычно неэффективны. Тут уже нужна стандартная схема приема.
Важно : если с момента появления первых высыпаний прошло больше 12 часов (и тем более, если больше 24 или 48 часов) – лучше сделать выбор в пользу фамцикловира, т.к. последний лучше работает при более поздних сроках начала терапии герпетической инфекции.
Лечение иммуномодуляторами, профилактика герпеса –
Если у вас высокая частота рецидивов герпеса, либо пусть редкие, но тяжело протекающие вспышки – вам очень важно заняться профилактикой вспышек герпеса. И дело тут не только в том, что тяжелое течение герпетической инфекции и/или ее частые рецидивы – сами по себе свидетельствуют о проблемах с вашим иммунитетом. Дело в том, что вирус герпеса обладает иммуносупрессивным действием на всю систему иммунитета – и на клеточное, и на гуморальное звено иммунитета.
Это означает, что иммунная система под воздействием вируса герпеса – будет продолжать ослабевать, что приведет к дальнейшему увеличению частоты рецидивов и тяжести вспышек. На данный момент существуют следующие направления профилактики вспышек вируса простого герпеса (ВПГ-1, ВПГ-2), но выбирать тот или иной метод – вы должны только после консультации врача. Всем пациентам с частотой вспышек более 6-ти в течение года необходимо сделать анализ на количество специфических антител IgG и IgM к вирусу простого герпеса, а также получить консультацию врача-иммунолога и сделать иммунограмму (в которой оценивается субпопуляционный состав клеток, NK-активность, а также уровни α- и γ-интерферонов).
Важно : прием иммуномодуляторов показан не только для профилактики рецидивов герпетической инфекции – у часто и/или тяжело болеющих герпесом пациентов. Иммуномодуляторы должны использоваться в составе базовой терапии герпетических инфекций (в дополнение к терапии противовирусными препаратами) – у пациентов с ослабленным иммунитетом.
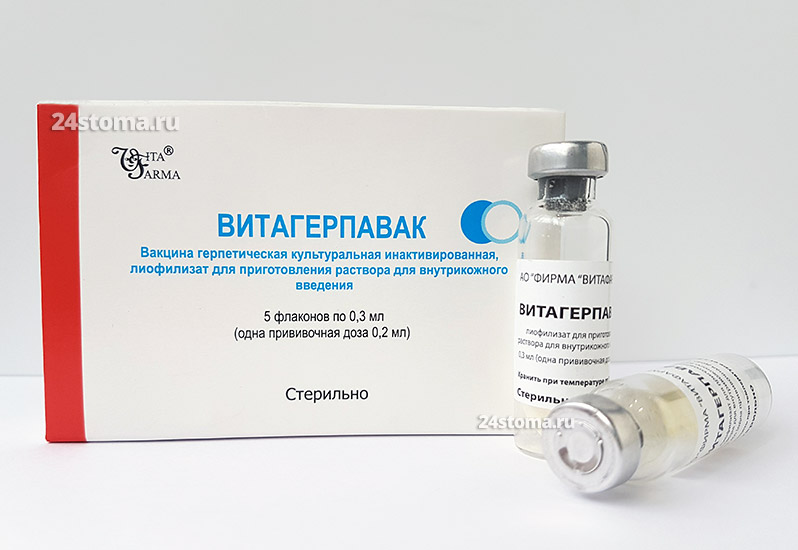
Прививка от герпеса (вакцина Витагерпавак) –
Прививка от герпеса (Вакцина Витагерпавак) –
Источники:
М.А.Гомберг, д.м.н., профессор, А.М.Соловьев, к.м.н., доцент, МГМСУ, Москва
В последнее время папилломавирусная инфекция привлекает особое внимание в связи с ролью этой группы вирусов в развитии рака. В 2008 г. Нобелевской премией по медицине было отмечено доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки. По Handley J.M., et al. (1994), к ВПЧ-поражениям относят: клинические формы — аногенитальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений на фоне обнаружения ДНК ВПЧ).
Лечение аногенитальных ВПЧ-поражений, согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией — CDC, Европейских рекомендациях, рекомендациях ВОЗ, и в том числе в рекомендациях РОДВ, приведен именно такой подход.
Роль вирусов папилломы человека (ВПЧ) в развитии множества доброкачественных и злокачественных новообразований кожи и слизистых оболочек не вызывает сомнений. Полагают, что все 500тыс. случаев рака шейки матки, ежегодно диагностируемые в мире, вызваны генитальной ВПЧ-инфекцией (Bulletin Word Health Organization, 2007).
В различных клинических рекомендациях и протоколах подробно описываются методы лечения именно клинических проявлений ВПЧ, но обходится стороной вопрос так называемого вирусоносительства или бессимптомного выделения вируса. Причем вопросу тактики врача при бессимптомном выделении вируса у пациента ВПЧ уделяется мало внимания не только в практических рекомендациях, но и в научно-исследовательской литературе.
Мы предлагаем свой подход к этой проблеме.
Прежде всего мы исходим из того, что наш долг — ставить во главу угла интересы пациента. Если он встревожен наличием ВПЧ и желает избавиться от этой инфекции, мы должны постараться успокоить его и обсудить все имеющиеся в настоящее время возможности лечения. В противном случае нам будет трудно рассчитывать на доверие с его стороны.
Мы считаем, что такое обсуждение должно состоять из 3 частей.
1. Информирование пациента относительно характера течения и последствий инфекции.
2. Методы профилактики рака шейки матки (при выявлении вируса у женщин).
3. Возможности воздействия на ВПЧ с целью его элиминации.
1. ИНФОРМИРОВАНИЕ ПАЦИЕНТА
При первом же визите необходимо рассказать человеку о возможных рисках, связанных с инфицированием ВПЧ. Однако консультирование нужно проводить очень осторожно, чтобы не спровоцировать у человека развитие психоневроза и канцерофобии.
Пациент с выявленным ВПЧ должен знать о своей потенциальной заразности для неинфицированных лиц, поэтому ему надо рекомендовать использовать презерватив при половых контактах и обязательно информировать своего полового партнера о вирусоносительстве.
Следует проинформировать пациентов о том, что возможно самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
2. ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ (ПРИ ВЫЯВЛЕНИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА У ЖЕНЩИН)
Всем женщинам, инфицированным ВПЧ, следует провести кольпоскопическое исследование, в том числе с окраской раствором Люголя или раствором уксусной кислоты, а также цитологические тесты по Папаниколау. Периодичность обследований обсуждается с гинекологом в зависимости от степени онкогенности выявленных вирусов и результатов кольпоскопии и цитологии. Цитологические исследования следует проводить не реже, чем 1 раз в 6 месяцев. Для женщин старше 26 лет этот подход является практически единственным способом профилактики рака шейки матки.
Имеются публикации об эффективности российского препарата индинол для профилактики рака шейки матки у женщин, инфицированных ВПЧ. Однако контролированных плацебо-исследований не проводилось.
3.ВОЗДЕЙСТВИЕ НА ВПЧ
Наиболее дискуссионным является вопрос о воздействии на выделение вируса, поэтому остановимся на нем подробнее. Врач, безусловно, должен информировать пациента о том, что в настоящее время нет методов, позволяющих достоверно и с высокой степенью вероятности устранить вирус из организма.
Необходимость проведения лечебных мероприятий обсуждается индивидуально с каждым пациентом. Желательно, чтобы врач принимал решение о проведении лечения с целью устранения ВПЧ в отсутствие клинических проявлений только после подписания пациентом информированного согласия, во избежание возможных последующих недоразумений.
Теоретически, учитывая локализацию вируса в эпителиальных клетках и то, что происходит постоянное слущивание эпителия, можно предположить, что ВПЧ может исчезнуть вместе со старыми эпителиальными клетками. Видимо, именно этим объясняются случаи самопроизвольного исчезновения ВПЧ. Между тем очевидно, что элиминации ВПЧ из организма с гораздо большей эффективностью можно добиться при активизации противовирусного иммунитета, ингибирующего размножение ВПЧ и его внедрение в другие клетки. Доказать возможность достижения такого результата на практике можно только путем проведения соответствующих специальных исследований.
Потенциально возможны 3 способа инфицирования: от матери к ребенку (трансплацентарно; во время родов, в том числе путем кесарева сечения; возможно — через слюну или грудное молоко), посредством передачи вируса воздушно-капельным или контактно-бытовым путями. Cчитается, что ВПЧ-инфекция передается в основном половым путем, что объясняет ее широкую распространенность среди сексуально активного населения. В частности, в США ежегодно диагностируют 6,2 млн новых случаев генитальной ВПЧ-инфекции (Steinbrook R., 2006).
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность. Этого можно достичь как неспецифическими, так и специфическими методами.
К неспецифическим относят различные способы укрепления защитных сил организма, так называемый здоровый образ жизни: правильное питание, профилактический прием витаминов, биологически активных добавок.
Отдельный вопрос — проведение гомеопатического лечения. Но поскольку об этих способах часто упоминается в научно-популярной литературе, в рамках данной статьи мы их комментировать не будем.
Установлено, что при применении интерферонов снижается количество вирусной ДНК (по данным ПЦР) у пациентов в очагах поражения [Arany I., et al., 1995].
Интерферон применяют местно и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона [Keay S., et al, 1988] при наличии клинических проявлений, а при лечении больных с субклиническими очагами ВПЧ-инфекции и цервикальных неоплазиях (ЦИН) были получены обнадеживающие результаты [Gross G., 1996].
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение 4 недель в качестве монотерапии у 11—100% пациентов наблюдается полное исчезновение бородавок [Gross G., et al., 1986; Zwiorek L., et al., 1989], что свидетельствует о возможном ингибирующем влиянии препаратов интерферонов на ВПЧ.
При системном применении интерферонов побочными эффектами обычно являются гриппоподобные состояния, выраженность которых зависит от полученной дозы [Handley, et al., 1994]. Эти побочные явления можно ослабить приемом нестероидных противовоспалительных препаратов.
Считается возможным самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
На российском рынке представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — генферон, виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т.д. Предпочтительнее назначать рекомбинантные, а не человеческие интерфероны.
При назначении интерферонов надо учитывать не только частые побочные реакции, но и то, что их введение может подавлять синтез собственных эндогенных интерферонов. Поэтому в отсутствие клинических проявлений интерфероны применяют только в том случае, когда о целесообразности такого назначения свидетельствуют результы исследования иммунного статуса. Следует также отметить и высокую стоимость качественных препаратов интерферона.
Воздействовать на противовирусный иммунитет можно с помощью индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые, согласно инструкции производителя или рекомендациям исследователей, можно применять для комбинированного лечения аногенитальных бородавок (в сочетании с различными деструктивными методами). На основании этого их можно рекомендовать для противовирусной терапии при отсутствии клинических проявлений.
Гепон — синтетический олигопептид, состоящий из 14 аминокислотных остатков, относится к группе иммуномодуляторов. Препарат показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами. Гепон оказывает иммунофармакологическое и противовирусное действие:
У больных с ослабленной иммунной системой гепон:
Так, например, после удаления очагов ВПЧ-поражений любым деструктивным методом, аппликации гепона (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снизить уровень рецидивирования. Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю [Соловьев А.М., 2003].
Изопринозин (инозин пранобекс) — противовирусное средство с иммуномодулирующими свойствами. Препарат, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках, нормализует дефицит или дисфункцию клеточного иммунитета. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного γ-интерферона и уменьшает продукцию интерлейкина-4 в организме. Изопринозин усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Кроме этого, он оказывает прямое противовирусное действие, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной и-РНК. Одним из показаний для применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
Для женщин старше 26 лет цитологическое исследование слизистой шейки матки, проводимое 2 раза в год, является практически единственным способом профилактики рака шейки матки.
В литературе описаны различные схемы и результаты применения изопринозина.
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству на протяжении 14—28 дней для пациентов с низкой степенью риска или 5 дней в неделю последовательно в течение 1—2 недель в месяц в течение 3 мес для пациентов с высокой степенью риска.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [Davidson-Parker J., et al., 1988]. Препарат назначали по 1 г 3 раза в сутки в течение 14—28 дней.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия у женщин с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени после проведения курсов лечения изопринозином. Препарат назначали по 1 грамму 3 раза в сутки в течение 5 дней, 3 курса с интервалом в 1 месяц. В исследовании, проведенном Sun Kuie Tay (1996), показаны аналогичные результаты — улучшение морфологической картины эпителия вульвы. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, тогда как в группе, принимавшей плацебо, только у 16,7%. О прекращении выделения ВПЧ у 65,6% больных после проведения комбинированной терапии (изопринозин + деструкция очагов) ЦИН низкой степени сообщает Прилепская В.Н. (2007). При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали за 7—10 дней до проведения деструкции по 1 г 3 раза в сутки в течение 5 дней. В исследовании Шевниной И.В. (2009) показаны похожие результаты — прекращение выделения ВПЧ у 77% больных при комбинированной терапии женщин с ЦИН и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 г 3 раза в сутки в течение 20 дней.
Для решения поднятой в этой статье проблемы интересным является факт прекращения обнаружения ВПЧ из очагов поражения в ходе проводимой комбинированной терапии с применением иммуномакса. При проведении вирусологического обследования пациентов до лечения в среднем у 70% выявлялся ВПЧ в очагах поражения. После проведенного комбинированного лечения в ходе контрольного наблюдения у 45% больных было отмечено прекращение выделения ВПЧ [Перламутров Ю.Н. и соавт., 2003]. Полученные результаты свидетельствуют, что проведение терапии иммуномаксом влияет на противовирусный иммунитет и приводит к прекращению не только рецидивов, но и выделения ВПЧ из очагов поражения. В связи с этим в перспективе иммуномакс можно будет использовать не только для лечения остроконечных кондилом, но и для предотвращения вирусовыделения у больных без клинических проявлений инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ
Панавир — растительный полисахарид, полученный из растения Solanum tuberosum, относится к классу высокомолекулярных гексозных гликозидов сложного строения с молекулярной массой 1000 кД. В настоящее время в России он является одним из самых популярных препаратов, использующихся для противовирусной терапии. Причем лечение папилломавирусной инфекции является лишь одним из показаний к его применению.
После однократной инъекции панавира в 2,7—3 раза повышается уровень лейкоцитарного интерферона, что соответствует воздействию терапевтических доз интерферона [Колобухина и соавт., 2005].
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность.
Со степенью распространенности неопластического процесса связывают эффективность препарата в отношении прекращения вирусовыделения [Иванян А.Н. и соавт., 2004]. Так, после проведения комплексного лечения у пациенток с 1-й степенью распространенности процесса вирус не выявлялся в 90,5%, при 2-й степени — в 71,1%, при 3-й степени — в 39,6%, при 4-й степени — в 9,4% случаев. Достоверное снижение вирусной нагрузки с 398,2 RLU до 176,2 RLU (p<0,05) через 1 месяц после окончания монотерапии панавиром ВПЧ-инфекции отмечает Мелехова Н.Ю. (2005).
Продолжаются исследования противовирусной активности панавира с целью установления мишени, объясняющей его высокую противовирусную активность, а также по расширению показаний к его применению. Но уже сейчас можно говорить о том, что он является одним из наиболее перспективных противовирусных агентов с доказанным иммуномодулирующим действием.
В этой статьей мы начали дискуссию о целесообразности попытки устранения папилломавирусной инфекции при отсутствии ее клинических проявлений. Существующие рекомендации по наблюдению таких пациентов могут не удовлетворить тех из них, которые хотели бы получить квалифицированную помощь в устранении этой инфекции. Поэтому мы предлагаем 3-х этапную тактику ведения таких больных: консультирование, цитологический контроль у женщин и использование противовирусных препаратов с иммуномодулирующим действием.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
Первый стол регулярно отпускает местные противовирусные и иммуномодулирующие препараты, показанные для лечения герпетической и/или папилломавирусной инфекции (ВПЧ). Обе инфекции принадлежат к числу самых распространенных в мире патологий, передающихся половым путем. Как качественно и деликатно консультировать клиентов с этими болезнями, какие советовать противовирусные лекарственные средства при ВПЧ, какие от герпеса и на что обращать внимание — читайте в нашей статье.
ВПГ и ВПЧ: сходства и отличия
Прежде всего, важно понимать, что вирус простого герпеса (ВПГ) и вирус папилломы человека (ВПЧ), провоцирующие герпетическую и папилломавирусную инфекции соответственно, кардинально отличаются друг от друга.
- Выраженной элиминации вирусов из организма
- Повышению эффективности противовирусной терапии
- Сокращению периода высыпаний и ускорению процессов регенерации
- Увеличению продолжительности ремиссии
У взрослых и подростков старше 12 лет в комплексной терапии:
Суппозитории — 5 дней по 1 суппозиторию, затем по одному через день. Курс — 2 упаковки суппозиториев.

Таблетки подъязычные — 10 дней по 1 таблетке 4 раза в день. Затем продолжить прием через сутки в течение 10 дней по 4 таблетки в день.

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Несмотря на то, что специфического лечения ВПГ не существует, ряд препаратов может облегчить состояние при обострениях. Согласно отечественным и западным рекомендациям, с этой целью применяют пероральные противовирусные средства от герпеса на основе ацикловира и валацикловира. Однако в России также рекомендована местная терапия, не включенная в западные стандарты. За границей такие методы в рекомендациях отсутствуют ввиду их меньшей активности по сравнению с таблетками [3].
Несколько по‑другому обстоит ситуация с папилломавирусной инфекцией (ВПЧ). Она считается самым распространенным в мире заболеванием, передаваемым половым путем [4]. В какой‑то момент жизни ВПЧ заражается большинство взрослых людей, однако в 90 % случаев в течение двух лет после заражения происходит естественная элиминация вируса. В противном случае инфицированный становится пожизненным носителем.
К сожалению, лекарства от вируса папилломы человека не существует, так же как и в случае с вирусом простого герпеса. Однако первый, в отличие от второго, может быть смертельно опасен: ВПЧ 16‑го и 18‑го типов ассоциированы со злокачественными новообразованиями — в частности, с раком шейки матки и некоторыми другими опухолями. Единственное эффективное на сегодня медикаментозное лечение папилломавирусной инфекции заключается в эрадикации кондилом, которые являются проявлениями клинической и субклинической форм инфекции. С этой целью при лечении вируса папилломы человека применяют ряд местных противовирусных препаратов, доказавших активность в исследованиях. В то же время в отечественной практике врачи назначают и ЛС, имеющие сомнительную доказательную базу. Рассмотрим их преимущества и недостатки более детально.
Локальные иммуномодуляторы при ВПЧ и ВПГ
+ Высокий профиль безопасности.
! Целесообразность применения местных форм ацикловира при генитальном герпесе подвергается серьезным сомнениям ввиду недостаточной активности, что подтверждено в западных рекомендациях [3].Препараты интерферона альфа-2b, как моно-, так и комбинированные, отпускаются как по рецепту, так и без — в зависимости от указания на правила отпуска в инструкции конкретного препарата. Важно обратить внимание посетителя на то, что препараты от ВПЧ первой линии лечения — пероральные формы ацикловира и валацикловира — должен выписать врач, поэтому нужно посоветовать незамедлительно обратиться за консультацией к доктору.
Синтетические противовирусные местные препараты
Эту группу ЛС можно условно разделить на средства, применяемые при генитальной герпетической инфекции, и противовирусные препараты, назначаемые для лечения папиллом и кондилом, связанных с папилломавирусной инфекцией.
Местные препараты при генитальном герпесе
Тромантадин
Противовирусный препарат от герпеса, производное адамантана (подобно известным противовирусным римантадину и амантадину). Ингибирует прикрепление вируса к поверхности клеточной мембраны, препятствуя проникновению возбудителя внутрь клетки. Предотвращает слияние клеток и затрудняет распространение вируса за счет изменения синтеза гликопротеинов [5]. Выпускается в форме геля для наружного применения, который можно наносить на слизистые оболочки при обострении ВПГ-инфекции [5].
Отпуск: без рецепта.
! Есть данные о развитии контактной аллергической реакции при использовании препарата [7].
Иммуномодулятор, способный регулировать активность клеток врожденного и приобретенного иммунитета, в том числе макрофаги, нейтрофилы и натуральные киллеры. При этом этот противовирусный препарат против герпеса повышает устойчивость организма к бактериальным, вирусным и грибковым инфекциям, сокращая их частоту, выраженность и длительность (5). Кроме того, препарат нормализует образование антител и регулирует выработку интерферонов, а также блокирует избыточный синтез провоспалительных цитокинов и снижает уровень оксидантного стресса (5).
Отпуск: Без рецепта
+ Высокий профиль безопасности (5).
Азоксимера бромид
Российский препарат, предположительно, проявляющий иммуностимулирующий эффект. По данным инструкции [5], напрямую влияет на фагоциты и естественные киллеры, стимулирует образование антител и синтез интерферона, проявляет антиоксидантные и детоксикационные свойства. В отечественной практике применяется при широком спектре заболеваний — от гриппа до злокачественных новообразований.
Вагинальные суппозитории азоксимера бромида применяются для профилактики рецидивов генитального герпеса.
Отпуск: без рецепта.
! Суппозитории азоксимера бромида не показаны для лечения активной формы герпеса!
Местные противовирусные препараты для лечения ВПЧ (папилломавируса)
Некоторые топические противовирусные препараты, активные в отношении папилломавирусов, в отличие от ряда препаратов, помогающих от вируса герпеса, имеют прочную доказательную базу и применяются во всем мире для лечения проявлений ВПЧ — в частности, кондилом.
Имихимод
Модификатор иммунного ответа, не оказывающий противовирусного действия. Активность проявляет за счет способности индуцировать выработку интерферона-альфа и других цитокинов. Показан для лечения остроконечных кондилом в урогенитальной зоне [5].
Отпуск: по рецепту.
+ Прочная доказательная база. Препарат определенно снижает вирусную нагрузку. Доказано, что применение крема имихимода 5 %-ного 3 раза в неделю на ночь на протяжении 16 недель эффективно и безопасно для лечения кондилом. Частота рецидивов оценивается как низкая [8]. Имихимод рекомендован для лечения генитальных кондилом авторитетным американским регулятором FDA [8].
! При нанесении имихимода более чем в 10 % случаев наблюдаются зуд и боль [5], о чем следует предупредить покупателя.
Местные противовирусные средства растительного происхождения
Аммония глицирризинат
Активный компонент препарата — активированную глицирризиновую кислоту — получают из корня солодки. Оказывает комплексное иммуностимулирующее, противовирусное, противовоспалительное, противозудное действие. Глицирризиновая кислота прерывает репликацию ряда ДНК и РНК вирусов, в том числе вируса простого герпеса, папилломы человека, цитомегаловируса [5].
Показана в качестве препарата для лечения папилломавирусной инфекции и вируса простого герпеса, в том числе и при инфицировании вирусами онкогенного типа. Выпускается в форме спрея, который распыляют на слизистые оболочки и пораженные участки кожи.
Отпуск: без рецепта.
+ Имеет широкий спектр показаний, среди которых профилактика и лечение кандидозного вульвовагинита, дискомфорт в области половых органов. Может применяться при беременности и кормлении грудью; хорошо переносится.
Подофиллотоксин
Активный компонент подофиллина, производного растительных экстрактов, выделяемых из корневищ с корнями подофилла щитовидного — растения семейства барбарисовых. Обладает выраженными противоопухолевыми и противовирусными свойствами, оказывает цитотоксическое действие. При наружном применении прижигает и мумифицирует кондиломы. Применяется в качестве препарата для местного лечения от вируса папилломы человека. Выпускается в форме раствора для обработки остроконечных кондилом [8].
Отпуск: по рецепту.
+ Доказанный эффект. По данным исследований, 0,5 %-ный раствор подофиллотоксина уменьшает число аногенитальных бородавок с 6,3 до 1,1, разрушая около 70 % образований [8].
! Необходимо соблюдать осторожность при применении — попадание на здоровую кожу может приводить к изъязвлению. Местные реакции при применении, аллергические реакции. Первостольник, отпуская этот противовирусный препарат от папиллом и кондилом, должен обратить внимание клиента на эту особенность и напомнить, что ЛС следует хранить в недоступном для детей месте.
Тетрагидроксиглюкопиранозилксантен
Российский препарат. Активный компонент выделяют из растения копеечника альпийского или копеечника желтеющего.
Согласно инструкции, обладает противовирусной активностью в отношении ВПГ-1 и ВПГ-2, а также цитомегаловируса и некоторых других ДНК-содержащих вирусов. Кроме того, предположительно, препарат активирует клеточный и гуморальный иммунитет, ингибирует рост ряда бактерий и патогенных простейших, в том числе трихомонад, а также оказывает умеренное противовоспалительное действие. Применяют в форме мази в составе комбинированного лечения острых и рецидивирующих форм герпеса, в том числе генитального [5].
Отпуск: без рецепта.
+ Благоприятный профиль безопасности, возможность применять в составе комплексного лечения.
Полисахариды побегов Solanum tuberosum
Рецептурный российский препарат, активный компонент получают из побегов паслена клубненосного. По данным инструкции, проявляет противовирусный эффект в отношении ВПГ-1 и ВПГ-2, способствует индукции интерферонов и повышает иммунный ответ [5]. Следует заметить, что фармакокинетические свойства препарата не изучались. Вагинальные суппозитории применяются в комплексной терапии генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. Побочные эффекты проявляются редко.
Десмодиума канадского травы экстракт
Противовирусный препарат от герпеса растительного происхождения, созданный из сухого экстракта травы десмодиума канадского. По данным инструкции, проявляет противовирусную активность в отношении вирусов герпеса, стимулирует выработку интерферона [5]. Мазь показана для применения при острых и рецидивирующих формах герпеса, в том числе урогенитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности — побочные эффекты не выявлены.
Гипорамина экстракт
Российская разработка на основе экстракта листьев облепихи. По данным инструкции, активен в отношении вирусов простого герпеса, цитомегаловирусов и некоторых других [5]. Мазь, содержащая экстракт гипорамин, показана для лечения и профилактики эпизодов герпеса, в том числе и генитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности; возможность использовать во время беременности и лактации (после консультации с врачом).
Мелиссы лекарственной листьев экстракт
По данным инструкции, проявляет противовирусную активность в отношении ВПГ, оказывает противовоспалительное действие [5]. Крем, содержащий экстракт листьев мелиссы, применяют при поражениях слизистых и кожи, в том числе и в урогенитальной зоне.
Отпуск: без рецепта.
+ Высокий профиль безопасности.
В заключение хочется еще раз подчеркнуть: широкий ассортимент позволяет первостольникам предлагать разные ЛС при запросах на местные средства для лечения проявлений ВПГ или лекарства от ВПЧ. Но при этом не следует забывать о необходимости рекомендовать посетителю обратиться к врачу, ведь именно доктор должен назначить препараты первой линии и подобрать при необходимости комплексную схему лечения папилломавирусной инфекции.
Читайте также:

