Лечение генетических заболеваний вирусами
Обновлено: 23.04.2024
Трансфекция клеток
Методы генной терапии
Существует два основных подхода, различающиеся природой клеток-мишеней: 1. Фетальная, при которой чужеродную ДНК вводят в зиготу (оплодотворённую яйцеклетку) или эмбрион на ранней стадии развития; при этом ожидается, что введённый материал попадёт во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению). В нашей стране она фактически запрещена ; 2. Соматическая, при которой генетический материал вводят уже родившемуся в неполовые клетки и он не передаётся половым клеткам. Генная терапия in vivo основана на прямом введении клонированных (размноженных) и определенным образом упакованных последовательностей ДНК в определённые ткани больного. Особенно перспективным для лечения генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения лёгочных заболеваний (муковисцидоз, рак лёгких). Разработке программы генной терапии предшествует много этапов. Это и тщательный анализ тканеспецифической экспрессии соответствующего гена (т. е., синтеза на матрице гена какого-то белка в определённой ткани), и идентификация первичного биохимического дефекта, и исследование структуры, функции и внутриклеточного распределения его белкового продукта, а также биохимический анализ патологического процесса. Все эти данные учитываются при составлении соответствующего медицинского протокола.
Прямая доставка и клеточные носители терапевтических генов
Судьба гена после его попадания в клетку
Заключение
Обзор данных позволяет прийти к заключению, что, несмотря на усилия многих лабораторий мира, все уже известные и испытанные in vivoи in vitro векторные системы далеки от совершенства . Если проблема доставки чужеродной ДНК in vitro практически решена, а ее доставка в клетки-мишени разных тканей in vivo успешно решается (главным образом путем создания конструкций, несущих рецепторные белки, в том числе и антигены, специфичные для тех или иных тканей), то другие характеристики существующих векторных систем – стабильность интеграции, регулируемая экспрессия, безопасность – все еще нуждаются в серьезных доработках. Прежде всего, это касается стабильности интеграции. До настоящего времени интеграция в геном достигалась только при использовании ретровирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем либо путем создания достаточно стабильных эписомных векторов (то есть ДНК-структур, способных к длительному пребыванию внутри ядер). В последнее время особое внимание уделяется созданию векторов на базе искусственных хромосом млекопитающих. Благодаря наличию основных структурных элементов обычных хромосом такие мини-хромосомы длительно удерживаются в клетках и способны нести полноразмерные (геномные) гены и их естественные регуляторные элементы, которые необходимы для правильной работы гена, в нужной ткани и в должное время. Генная и клеточная терапия открывает блестящие перспективы для восстановления утраченных клеток и тканей и генно-инженерного конструирования органов, что, несомненно, существенно расширит арсенал методов для медико-биологических исследований и создаст новые возможности для сохранения и продления жизни человека .
Управление по контролю качества пищевых продуктов и медикаментов США (FDA) 24 мая 2019 года одобрило использование генно-терапевтического препарата Zolgensma для лечения спинальной мышечной атрофии 1-го типа у детей в возрасте до двух лет. Рассказываем, что такое генная терапия и почему она может стать лекарством будущего.
Генно-терапевтический подход к лечению наследственных заболеваний разрабатывается уже 40 лет. Основная технология генной терапии основана на замещении гена с мутацией правильно функционирующей копией этого гена. Но есть еще две стратегии: выключение неправильно работающего гена и введение нового гена, который поможет организму победить заболевание.
Надо подчеркнуть принципиальное отличие генной терапии от редактирования генома, которое сейчас тоже активно разрабатывается для лечения наследственных заболеваний. Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента.
Для доставки генная терапия использует различные вирусы, которые транспортируют ген специфично в определённый орган. Вирусы - внутриклеточные паразиты, они встраивают свою генетическую информацию в ДНК клетки и таким образом заставляют клетку делать копии вирусной ДНК. Это оказалось очень полезным свойством для генной терапии. Перед использованием вирусы делают безвредными, чтобы они не могли вызывать заболевание, но могли доставить ген в клетки.
В зависимости от цели генная терапия бывает соматической и фетальной. В первом случае вирус с геном вводят в клетки тела, во втором – в эмбрион на ранней стадии развития. В результате фетальной генной терапии генетический материал попадает во все клетки и может быть передан детям.
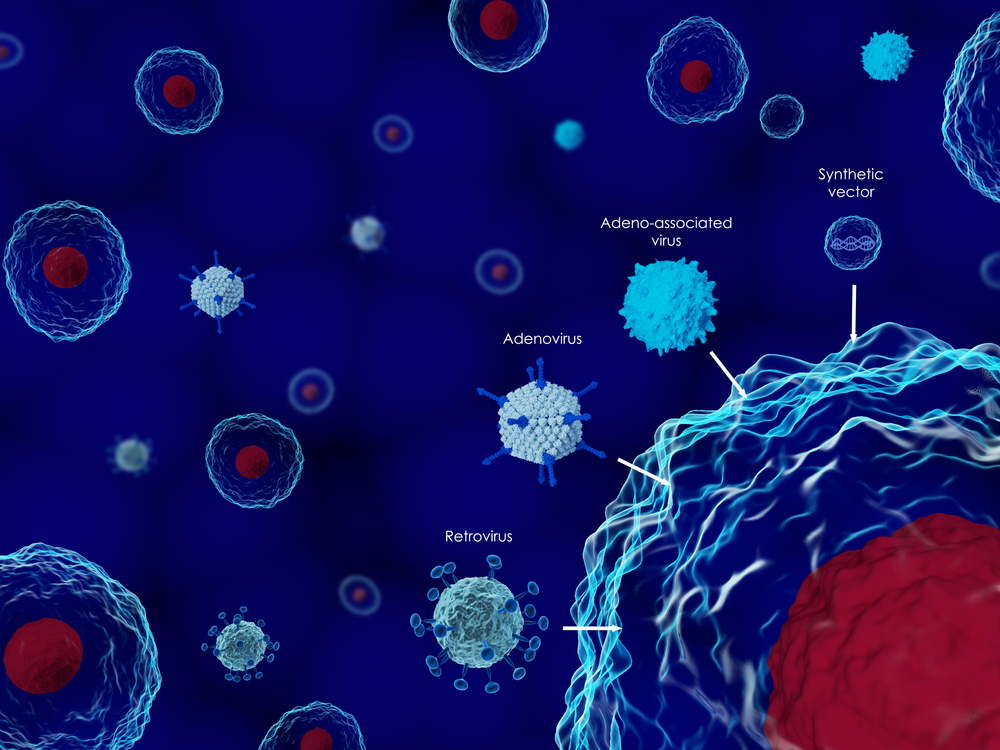
В ходе клинических испытаний препарат Zolgensma показал хорошие результаты у пациентов со спинальной мышечной атрофией: из 21 пациентов 19 смогли начать двигать головой и самостоятельно сидеть.
Спинальная мышечная атрофия - наследственное заболевание, к развитию которого приводят мутации в гене SMN1. При этом заболевании из-за нарушения работы нервных клеток спинного мозга развивается слабость мышц и их атрофия. Дети теряют способность ходить, а по мере развития заболевания - самостоятельно дышать. Более 90% случаев заболевания заканчиваются смертью детей до 2-х лет.
Препараты генной терапии могут стать эффективным средством лечения многих наследственных заболеваний, для которых не существовало лечения до этого. Так, в ближайшее время ожидает одобрения международного регулятора еще один новый генно-терапевтический препарат для лечения талассемии и серповидноклеточной анемии. Оба этих заболевания связаны с мутациями, результатом которых является синтез неправильно работающего гемоглобина – белка, переносящего кислород в крови.
Прежде всего, препараты генной терапии разрабатываются для заболеваний, причиной которых является одна в мутация в одном гене. Таких болезней 10 000. В связи с большими затратами на разработку генно-терапевтических препаратов, они очень дорогие. Но постепенно отработка технологии позволит значительно снизить стоимость таких лекарств и сделать их доступными большинству пациентов.
Для цитирования: Наумов Д.А. Генотерапия злокачественных новообразований. Состояние проблемы. РМЖ. 2012;1:9.
Реферат. В статье рассматриваются всесторонние вопросы таргетной терапии злокачественных опухолей – нового направления в лекарственном лечении онкологических заболеваний.
Ключевые слова: таргетная терапия, генотерапия рака, онкогены.
Литература
1. Киселев С.Л. Современная генная терапия: что это такое и каковы ее перспективы?// Практическая онкология. 2003. Т. 4, № 3. С. 170.
2. Примроуз С., Тваймен Р. Геномика. Роль в медицине. М.: БИНОМ. Лаборатория знаний, 2008.
3. Ram Z., Culver K.W., Oshiro E.M., Viola J.J., DeVroom H.L., Otto E., Long Z., Chiang Y., McGarrity G.J., Muul L.M., Katz D., Blaese R.M., Oldfield E.H.
4. Tai C.K., Wang W.J., Chen T.C., Kasahara N. Single–shot, multicycle suicide gene therapy by replication–competent retrovirus vectors achieves long–term survival benefit in experimental glioma // Mol. Ther. 2005. Vol. 12(5). P.842–851.
5. Rein D.T., Breidenbach M., Curiel D.T. Current developments in adenovirus–based cancer gene therapy // Future Oncol. 2006. Vol. 2(1). P.137–143.
6. Flotte T.R. Gene Therapy Progress and Prospects: Recombinant adeno–associated virus (rAAV) vectors // Gene Ther. 2004. Vol. 11(10). P. 805–810.
7. Urabe M., Nakakura T., Xin K.Q. et al. Scalable generation of high–titer recombinant adeno–associated virus type 5 in insect cells // J. Virol. 2006. Vol. 80(4). P.1874–1885.
8. Harland J., Dunn P., Cameron E. et al. The herpes simplex virus (HSV) protein ICP34.5 is a virion component that forms a DNA–binding complex with proliferating cell nuclear antigen and HSV replication proteins // J. Neurovirol. 2003. Vol. 9(4). P.477–488.
9. Derubertis B.G., Stiles B.M., Bhargava A. et al. Cytokine–secreting herpes viral mutants effectively treat tumor in a murine metastatic colorectal liver model by oncolytic and T–cell–dependent mechanisms // Cancer. Gene. Ther. 2007, in press.
10. McIntosh D.P., Tan X.Y., Oh P., Schnitzer J.E. Targeting endothelium and its dynamic caveolae for tissue–specific transcytosis in vivo: a pathway to overcome cell barriers to drug and gene delivery // Proc. Natl. Acad. Sci. USA. 2002. Vol. 99. P.1996–2001.
11. Li J., Le L.P., Sibley D.A. Genetic incorporation of HSV–1 thymidine kinase into the adenovirus protein ix for functioal display on the virion // Virol. 2005. Vol. 338. P.247–258.
12. Pankhurst Q.A., Connolly J., Jones S.K., Dobson J. Applications of magnetic nanoparticles in biomedicine // J. Phys. D. Appl. Phys. 2003. Vol. 36.R167–R181.
13. Roth J.A., Nguyen D., Lawrence D.D., Kemp BL et al. Retrovirus–mediated wild–type p53 gene transfer to tumors of patients with lung cancer // Nat. Med. 1996. Vol. 2. P.985–991.
14. Schuler M., Rochlitz C., Horowitz J.A. et al. A phase I study of adenovirus–mediated wild–type p53 gene transfer in patients with advanced nonsmall cell lung cancer // Hum. Gene Ther. 1998. Vol. 9(14). P.2075–2082.
15. Gahery–Segard H., Molinier–Frenkel V., Le Boulaire C. et al. Phase 1 trial of recombinant adenovirus gene transfer in lung cancer. Longitudinal study of the immune responses to transgene and viral products // J. Clin. Invest. 1997. Vol. 100. P.2218–2226.
16. Nemunaitis J., Swisher S.G., Timmons T. et al. Adenovirus–mediated p53 gene transfer in sequence with cisplatin to tumors of patients with non–smallcell lung cancer // J. Clin. Oncol. 2000. Vol.18. P.609–622.
17. Hwang H.C., Smythe W.R., Elshami A.A. et al. Gene therapy using adenovirus carrying the herpes simplex thymidine kinase gene to treat in vitro models of human malignant mesothelioma and lung cancer // Am. J. Respir. Cell. Mol. Biol. 1995. Vol. 13. P.7–16.
18. Metharom P., Ellem K., Schmidt C., Wei M.Q. Lentiviral vectormediated tyrosinase–related protein–2 gene transfer to dentritic cells for the therapy of melanoma // Hum. Gene Ther. 2001. Vol. 12(18). P.2203–2213.
19. Zhang M., Zhang X., Bai C.X. et al. Inhibition of epidermal growth factor receptor (EGFR) by RNA interference in A549 cells // Acta Pharmacol. Sin. 2004. Vol. 25(1). P.61–67.
20. Theys J., Landuyt A.W., Nuyts S. et al. Clostridium as a tumor–specific delivery system of therapeutic proteins // Cancer. Detect. Prev. 2001. Vol. 25(6). P.548–557.
21. Van Mellaert L., Barbe S., Anne J. Clostridium spores as antitumour agents // Trends Microbiol. 2006. Vol. 14(4). P.190–196.
22. Theys J., Pennington O., Dubois L. et al. Repeated cycles of Clostridium–directed enzyme prodrug therapy result in sustained antitumour effects in vivo // Br. J. Cancer. 2006. Vol.95(9). P.1212–1219.
23. Folkman J. What is the evidence that tumors are angiogenesis dependent? // J. Natl. Cancer. Inst.1990. Vol. 82. P.4–6.
24. Vaupel P., Mayer A. Hypoxia in cancer: significance and impact on clinical outcome // Cancer. Metastasis Rev. in press. 2007, Apr 18.
25. Hay J.G. The potential impact of hypoxia on the success of oncolytic virotherapy // Curr. Opin. Mol. Ther. 2005. Vol. 7(4). P. 353–358.
26. Xu L., Frederik P., Pirollo K.F. et al. Self–assembly of a virus–mimicking nanostructure system for efficient tumor–targeted gene delivery. // Hum. Gene Ther. 2002. Vol. 10;13(3). P.469–481.
История

Гистологический препарат головного мозга, на котором видны микрополости


Как уже было сказано выше, основы знаний о прионах заложил Стенли Прузинер. Немного из его биографии. Родился в США в 1942 году. Его предки - эмигранты из российской империи, еврейского происхождения, вынужденные покинуть страну из-за еврейских погромов. Сам Стенли Прузинер в 1968 г. закончил Университет Пенсильвании и работал ординатором-неврологом в Медицинской школе Калифорнийского университета (Сан-Франциско). В 1970 впервые встретился с болезнью Крейтцфельдта — Якоба. У пациента, находившегося на лечении у Прузинера, никак не выявлялся возбудитель. Плотно занявшись этим исследованием, невролог обратился к трудам другого врача – Сиггурдсона, выявившего определенные закономерности у непонятных на тот момент болезней.
Такими закономерностями стали:
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- неизбежность смертельного исхода.
Что же такое прионы и каков их механизм действия на организм (современные представления)?
На самом деле в организме человека и многих других живых существ есть белки PrPC. По-русски – нормальная форма прионных белков (открыты были после исследований Сиггурдсона, поэтому такая странность в название). Известна его длина, последовательность аминокислот, вторичная структура. Важно знать, что конечная структура состоит из трёх α-спиралей и двухцепочечного антипараллельного β-листа. Обладают интересным свойством, а именно осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга. Тем не менее, функции PrP исследованы недостаточно.

(a) норма (b) патология
Считается, что прионное заболевание может быть приобретено 3 путями: в случае прямого заражения, наследственно или спорадически (спонтанно) или их комбинациями. Спорадическая (то есть спонтанная) прионная болезнь возникает в популяции у случайной особи. Таков, например, классический вариант болезни Крейтцфельдта — Якоба. Существуют две основные гипотезы относительно спонтанного появления прионных болезней. Согласно первой из них спонтанное изменение происходит в самом доселе нормальном белке в мозге, то есть имеет место посттрансляционная модификация. Альтернативная гипотеза гласит, что одна или несколько клеток организма в какой-то момент претерпевают соматическую мутацию (то есть, не передающуюся наследственно) и начинают производить дефектный белок PrPSc. Как бы то ни было, конкретный механизм спонтанного возникновения прионных болезней неизвестен. Вторая – заражение. По данным современных исследований, основной путь приобретения прионных заболеваний — поедание заражённой пищи. Считается, что прионы могут оставаться в окружающей среде в останках мёртвых животных, а также присутствуют в моче, слюне и других жидкостях и тканях тела (кровь, ликвор). Из-за этого заражение прионами может произойти и в ходе пользования нестерильными хирургическими инструментами. Это усложняет стерилизацию хирургических инструментов или устройств на скотобойне. Прионы в большинстве своём устойчивы к протеазам, высокой температуре, радиации и хранению в формалине, хотя эти меры и снижают их способность к заражению. Эффективная дезинфекция против прионов должна включать гидролиз или повреждение/разрушение их третичной структуры. Это можно достичь обработкой хлорной известью, гидроксидом натрия и сильнокислыми моющими веществами. Пребывание в течение 18 минут при температуре 134 °C в герметичном паровом автоклаве не может деактивировать прионы. В качестве основного современного метода для деактивации и денатурации прионов в настоящее время изучается озоновая стерилизация. Ренатурация полностью денатурированного приона до инфективного состояния зафиксирована не была, однако для частично денатурированных прионов в некоторых искусственных условиях это возможно. Еще стоит помнить, что эти белки могут долго сохраняться в почве за счёт связывания с глиной и другими почвенными минералами. Не впадайте в паранойю, но теоретически они могут быть повсюду. В 2011 году было сообщено об открытии прионов, передающихся по воздуху в частицах аэрозоля (то есть воздушно-капельным путём). Также в 2011 году было опубликовано предварительное доказательство того, что прионы могут передаваться с получаемым из мочи человеческим менопаузальным гонадотропином, применяемым для лечения бесплодия. Теоретически с помощью всего одного больного животного с прионной болезнью, можно уничтожать целые нации и страны, просто добавляя его костную муку в кормовые добавки и продавая их в нужное государство. Сходная ситуация произошла в конце 80-х годов в Британии (эпидемия коровьего бешенства). Тогда, скорее всего по незнанию (а не по злому умыслу) произошел вышеуказанный процесс, унесший жизни около 200 человек (на 2009 год) и 179 тыс. голов крупного рогатого скота.

Клиника
Поговорим о болезнях и клинических проявлениях. Теоретически может возникать у всех живых существ, обладающих PrPc Вот некоторые примеры. У овец и коз, как это уже говорилось выше, главное проявление - это скрейпи. Для коров характерно коровье бешенство (губчатая энцефалопатия крупного рогатого скота) У норок- Трансмиссивная энцефалопатия норок. И так далее. Зафиксированы проявления заболеваний у кошек, диких парнокопытных, страусов. Но нас интересуют болезни человека.
Болезнь Крейтцфельдта — Якоба. Код по МКБ-10 A81.0; F02.1. Код А соответствует инфекционным болезням (А81 – инфекционные болезни нервной системы). Код F – психические расстройства, F02 – деменции.

Темно зеленый распространение К-Я
Светло зеленый - коровьего бешенства
Основные клинические критерии для постановки диагноза:
Выделяют несколько клинических форм:
Спонтанная — классическая (sCJD) Согласно современным представлениям (прионной теории), прионы при этой форме заболевания возникают в мозге спонтанно, без какой-либо видимой внешней причины. Болезнь обычно поражает людей в возрасте старше 50 лет и проявляется с вероятностью 1-2 случая на миллион жителей. Вначале проявляется в форме кратких потерь памяти, изменениями настроения, потерей интереса к происходящему вокруг. Далее симптомы деменции прогрессируют со всеми вытекающими последствиями.
Наследственная (fCJD) Болезнь возникает в семьях, где наследуется повреждение гена для прионового белка. Дефектный прионовый белок является намного более подверженным спонтанному превращению в прион. Признаки и ход болезни подобны классической форме.
Ятрогенная (1CJD) Болезнь обусловлена непреднамеренным внесением прионов в тело пациента при медицинском вмешательстве. Источником прионов ранее были некоторые лекарства, инструменты или мозговые оболочки, которые забирались у мертвых людей и использовались для закрытия раны при операциях на мозге. Признаки и ход болезни подобны классической форме. Новый вариант (nvCJD) Болезнь появилась впервые в 1995 году в Великобритании и с того момента от нее умерло не более 100 человек. Вероятнее всего, что они заразились мясными продуктами, содержащими бычьи прионы.
- психические расстройства и сенсорные нарушения,
- характерны глобальные когнитивные нарушения и атаксия.
- описано несколько случаев заболевания, дебютировавшего с корковой слепоты (вариант Heidenhain).
- эписиндром представлен также миоклоническими припадками.
- мозжечковая симптоматика выявляется в 100 %.
- Пациент страдает от всё более тяжёлой бессонницы, панических атак и фобий. Эта стадия длится в среднем 4 месяца.
- Панические атаки становятся серьёзной проблемой, и к ним присоединяются галлюцинации. Эта стадия длится в среднем 5 месяцев.
- Полная неспособность спать, сопровождаемая быстрой потерей веса. Эта стадия длится в среднем 3 месяца.
- Пациент перестаёт говорить и не реагирует на окружающее. Это последняя стадия болезни, длящаяся в среднем 6 месяцев, после чего пациент умирает.
Куру, почти не встречается в настоящее время, в связи с искоренением каннибализма. Интересно, что в 2009 году американские учёные сделали неожиданное открытие: некоторые члены племени форе, благодаря появившемуся у них в сравнительно недавнем времени новому полиморфизму гена PRNP, имеют врождённый иммунитет к куру.
В настоящее время нет ни одного средства останавливающего или тормозящего развитие прионных болезней.
Читайте также:

