Лечение гепатита с при циррозе печени в стадии декомпенсации
Обновлено: 18.04.2024
Изучение показателей белково-синтетической функции печени и портальной гипертензии у больных хроническим гепатитом С (ХГС) с декомпенсированным циррозом печени (ЦП) после успешного лечения препаратами прямого противовирусного действия.
Материалы и методы
В проспективное исследование были включены 50 больных ХГС с декомпенсированным ЦП, получавших препараты прямого противовирусного действия и достигших устойчивого вирусологического ответа (УВО). Оценивали параметры функции печени, портальной гипертензии, в том числе индексы модели терминальной стадии заболевания печени (MELD) и Чайлд-Пью, до и каждые 3-6 месяцев после противовирусной терапии (ПВТ). Медиана продолжительности наблюдения после окончания ПВТ составила 18 (6–42) месяцев.
К концу наблюдения снижение индексов MELD и Чайлд-Пью отмечено у 72% и 74% больных, соответственно. У 52% больных наблюдалась компенсация ЦП (переход в класс А по Чайлд-Пью), у 89% больных с ЦП класса С – уменьшение выраженности декомпенсации (переход в класс B), у 7,3% – ухудшение состояния (переход в класс С). Активность аланинаминотрансферазы (АЛТ) нормализовалась у 90% пациентов, у половины из них активность аспартатаминтрансферазы (АСТ) оставалась повышенной. Число тромбоцитов достоверно увеличилось (р=0,016). Асцит был купирован или уменьшился у 57% больных. По результатам многофакторного регрессионного анализа Кокса мужской пол (отношение шансов [ОШ] 5,19, p=0,003) и исходный уровень альбумина менее 32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска, ассоциировавшимися с отсутствием компенсации ЦП к концу наблюдения.
Эрадикация вируса гепатита С приводит к снижению индексов MELD и ЧайлдПью у большинства больных с декомпенсированным ЦП и компенсации заболевания у половины из них.
Вирус гепатита С (ВГС) является одной из основных причин цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и трансплантации печени в мире. Ежегодный риск декомпенсации ЦП (кровотечение из варикозно расширенных вен пищевода и желудка, асцит, печеночная недостаточность, печеночная энцефалопатия) и развития ГЦК составляет около 3–6% [1,2]. Смертность у таких пациентов достигает 60% в течение 5 лет [3,4]. Ранее было показано, что у больных с компенсированным ЦП эрадикация ВГС в результате лечения препаратами интерферона-альфа и рибавирина приводит к снижению риска прогрессирования заболевания и улучшению выживаемости 6.
Целью исследования было изучение основных показателей белково-синтетической функции печени и портальной гипертензии, в том числе динамики индексов MELD и Чайлд-Пью, у пациентов с декомпенсированным ЦП после эрадикации ВГС.
Материал и методы
В исследование включали больных ХГС с декомпенсированным ЦП (класс В и С по Чайлд-Пью), получавших препараты прямого противовирусного действия с сентября 2014 г. по июль 2018 г. и достигших УВО (неопределяемый уровень РНК ВГС в сыворотке крови методом полимеразной цепной реакции через 12 недель после окончания терапии).
Критериями исключения были следующие: класс А по Чайлд-Пью, другие сопутствующие причины поражения печени, наличие ГЦК или рака другого типа и локализации на момент начала ПВТ, перенесенная трансплантация печени. Демографические, клинико-лабораторные и ин стру ментальные характеристики изучали у каждого пациента не более чем за 3 месяца до начала ПВТ. У каждого пациента определяли генотип ВГС и вирусную нагрузку, показатели общего анализа крови, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ), уровень альбумина, общего и прямого билирубина сыворотки, протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО), альфа-фетопротеин. Всем больным выполняли эзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости и/или контрастные методы визуализации (КТ, МРТ печени с контрастным усилением).
После достижения УВО у пациентов каждые 3-6 месяцев изучали параметры функции печени, портальной гипертензии и динамику баллов по шкале Чайлд-Пью и MELD. Результаты представлены в трех временных интервалах: до лечения, на момент достижения УВО и последнего обследования.
Статистический анализ выполнен с помощью программ IBM SPSS Statistics (version 21) и GraphPad Prism 8. Количественные переменные представлены в виде медианы (диапазона), категориальные – в виде числа и процента. Изучение динамики показателей проведено с помощью tкритерия Стьюдента, критериев Вилкоксона и МакНемара. Сравнительный анализ двух независимых групп проводился при помощи t-критерия Стьюдента для количественных показателей, U-критерия Манна-Уитни – для категориальных. Для сравнения качественных признаков использовали критерий c2. Регрессионный анализ Кокса применяли для выявления независимых факторов риска наступления событий. Достоверным считали уровень значимости р
Результаты
В исследование были включены 50 больных ХГС с декомпенсированным ЦП (табл. 1). Тридцать (60%) пациентов получали софосбувир + даклатасвир, 5 (10%) – даклатасвир + асунапревир, 5 (10%) – софосбувир/ ледипасвир, 5 (10%) – софосбувир/велпатасвир, 2 (4%) – паритапревир/ритонавир/омбитасвир + дасабувир, 1 (2%) – софосбувир + симепревир, 2 (4%) – софосбувир + рибавирин, 24 (48%) – дополнительно рибавирин. Продолжительность лечения составила от 12 до 24 недель, медиана продолжительности наблюдения после окончания ПВТ – 18 (6–42) месяцев.
| Параметр | Значение |
|---|---|
| Мужчины, n (%) | 29 (58) |
| Возраст, лет (диапазон) | 53,5 (33–79) |
| Индекс массы тела, кг/м 2 (диапазон) | 27,3 (19,0–39,2) |
| Сахарный диабет, n (%) | 7 (14) |
| Злоупотребление алкоголем, n (%) | 10 (20) |
| 1 генотип вируса, n (%) | 36 (72) |
| РНК ВГС, МЕ/мл (диапазон) | 2,7×104 [5600-6,8×106] |
| Не получали ранее ПВТ, n (%) | 38 (76) |
| Софосбувир-содержащие схемы, n (%) | 43 (86) |
| Рибавирин, n (%) | 24 (48) |
| Класс по Чайлд-Пью, n (%) | |
| В | 41 (82) |
| С | 9 (18) |
| Эластометрия печени, кПа, (диапазон), | 28,7 (14,6-70,0) |
| n=20 |
Биохимический ответ. Нормализация активности АЛТ и АСТ на момент последнего осмотра отмечена у 90% и 51% больных, соответственно (табл. 2). Медиана снижения активности АЛТ и АСТ к окончанию наблюдения составила 53 Ед/л и 43 Ед/л, соответственно.
Уровень общего билирубина снизился с 33,5 [12,570,6] до 25,2 [7,1-70,0] мкмоль/л (p=0,004), медиана снижения составила 7,9 мкмоль/л. Уровень общего билирубина на момент последнего осмотра нормализовался 9 (22,5%) из 40 больных.
ПТИ увеличился с 59% 56 до 66% 74 (р=0,008), медиана изменения составила +10%. ПТИ нормализовался в 10 (26,3%) из 38 случаев.
Изменения индекса MELD и Чайлд-Пью. Индекс MELD снизился у 39 (72%) пациентов, в среднем на 3 балла (от 1 до 7), увеличился – у 7 (16%), в среднем на 1,5 балла (от 1 до 6), и не изменился у 4 (12%). У 25 (80,6%) из 31 больного с исходным индексом MELD>15 баллов отмечено улучшение и у 3 (9,7%) – ухудшение показателя MELD (рис. 1).
У 26 (52%) больных отмечена компенсация заболевания (переход в класс А), у 8 (89%) больных с ЦП класса С по Чайлд-Пью – уменьшение выраженности декомпенсации (переход в класс B), у 3 (7,3%) больных – ухудшение состояния (переход в класс С). В целом, у 37 (74%) больных отмечено снижение суммы баллов по Чайлд-Пью, у 6 (12%) – увеличение, еще у 7 (14%) сумма баллов не изменилась (рис. 1).
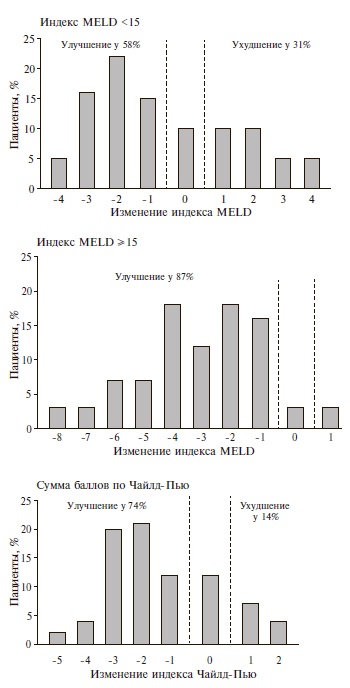
Рис. 1. Динамика индексов MELD и Чайлд-Пью
По данным однофакторного регрессионного анализа Кокса, мужской пол (отношение шансов [ОШ] 5,1, р=0,003), класс С по Чайлд-Пью (ОШ 3,51, р=0,003), индекс MELD ≥15 (ОШ 3,69, р=0,018), уровень альбумина ≤32 г/л (ОШ 2,9, р=0,025), общего билирубина ≥33,5 мкмоль/л (ОШ 3,17, р=0,011) достоверно ассоциировались с отсутствием компенсации ЦП при последнем осмотре (рис. 2). По данным многофакторного регрессионного анализа Кокса, мужской пол (ОШ 5,19, р=0,003) и уровень альбумина ≤32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска отсутствия компенсации ЦП (рис. 2).
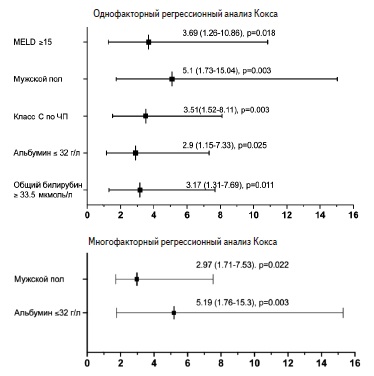
Рис. 2 Факторы, ассоциированные с отсутствием ком пенсации цирроза печени
Заключение
В нашем исследовании активность АЛТ нормализовалась у 90% больных, однако у половины из них активность АСТ оставалась повышенной, что, вероятно, связано с нарушением функции синусоидальных клеток печени при ЦП и, как следствие, снижением захвата АСТ, а также наличием у этих больных более тяжелого повреждения гепатоцитов и высвобождением в кровоток, наряду с цитоплазматической, митохондриальной фракции АСТ 20. Аналогичные результаты получены в другом исследовании, в котором среди 80 Эрадикация ВГС привела к снижению индексов MELD и Чайлд-Пью у большинства больных с декомпенсированным ЦП и компенсации заболевания (переход в класс А по Чайлд-Пью) у половины из них. Несмотря на нормализацию АЛТ у большинства больных, примерно в половине случаев АСТ оставалась повышенной. Установлено достоверное улучшение ряда параметров портальной гипертензии у большинства пациентов к концу наблюдения (повышение количества тромбоцитов, купирование или уменьшение асцита). Мужской пол и исходный уровень альбумина менее 32 г/л оказались независимыми факторами риска отсутствия компенсации ЦП. Таким образом, наше исследование демонстрирует эффективность и безопасность ПВТ у больных ХГС и декомпенсированным ЦП. Однако, требуется дальнейшее изучение влияния эрадикации вируса на прогноз и выживаемость у данной группы пациентов в рамках более крупных и длительных исследований.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Диагностическим тестом при гепатите С служит определение антител к вирусу методом ИФА (анти-HCV). Если антитела к HCV обнаружены, необходимо определять РНК HCV чувствительным методом молекулярной диагностики.
В случае положительного результата на антитела и отрицательного результата определения РНК-HCV необходимо выполнять повторные исследования для подтверждения выздоровления.
Цель лечения вирусного гепатита С
Цель лечения – полное удаление вируса и предупреждение заболеваний печени и внепеченочных заболеваний, включая воспалительно-дегенеративные поражения, фиброз, цирроз, рак печени и тяжелые внепеченочные проявления.
Контрольный показатель эффективности лечения
Устойчивый вирусологический ответ (УВО) – отсутствие вируса (определяемой РНК-HCV) через 12 и 24 недели после окончания лечения. Исследование необходимо проводить чувствительным методом молекулярной диагностики с нижним порогом определения 15 МЕ/мл и менее.
Результаты исследований с долгосрочным наблюдением показали, что УВО соответствует окончательному излечению от гепатита в 99% случаев.
У пациентов с циррозом и выраженным фиброзом исследования РНК-HCV следует продолжать и после получения УВО.
Обследование перед началом терапии (подробнее. )
Исключение других причин поражения печени
Прежде всего необходимо исключить другие факторы, влияющие на течение заболевания: наличие гепатотропных вирусов – гепатита В, ВИЧ, алкоголизма, аутоиммунного заболевания печени, поражение печени генетическими и метаболическими заболеваниями: гемахроматоз, сахарный диабет или ожирение, токсическое поражение печени и другие.
Оценка степени поражения печени.
Поскольку от стадии фиброза зависит вероятность выздоровления, прежде всего, необходимо выявление цирроза или выраженного фиброза. В настоящее время убедительно показана возможность оценки степени фиброза не инвазивными методами:
эластометрия / эластография (на аппарате фиброскан),
фибромакс и фибротест (по показателям крови)
Наиболее информативным является совместное определение степени фиброза (по крови и на аппарате фиброскан), что полностью заменяет биопсию.
Пациентам с циррозом необходимо исключать гепатоцеллюлярную карциному (первичный рак печени), а также осложнение цирроза – выраженную портальную гипертензию с расширением вен пищевода и желудка. С этой целью важно до начала терапии провести ЭГДС (гастроскопию).
Для оценки состояния печени проводится биохимическое обследование крови с определением структурных (АЛТ, АСТ, ГГТ) и функциональных показателей (альбумин, общий белок, белковые фракции, фракции липидов), а также общий клинический анализ крови.
Определение характеристик вируса.
Для назначения противовирусной терапии необходимо определить вирусную нагрузку и генотип вируса.
Количественное определение вируса должно проводиться чувствительным методом.
Генотипы устанавливаются методами, позволяющими достоверно определить подтип вируса (например, 1а и 1в), так как они влияют на выбор терапии.
Определение генетических характеристик пациента.
Определение генотипа интерлейкина 28В не потеряло своего прогностического значения.
Противопоказания для применения препаратов прямого противовирусного действия.
Абсолютных противопоказаний к применению препаратов прямого противовирусного действия нет.
Следует соблюдать меры предосторожности при лечении препаратом софосбувир пациентов с заболеваниями почек и сердца.
Пациентам с декомпенсированным циррозом класса В и С противопоказана комбинация препаратов Викейра Пак.
Продолжается исследование безопасности препарата симепревир для пациентов с декомпенсированным циррозом.
Показания к лечению: кого следует лечить?
Все пациенты с компенсированным и декомпенсированным хроническим гепатитом С являются кандидатами на лечение, если они не имеют противопоказаний.
Не имеет значения, получали они ранее терапию или нет.
Приоритет в лечении определяется стадией фиброза. В первую очередь следует назначать терапию пациентам с фиброзом F3-F4 по шкале METAVIR.
Пациентам с декомпенсированным циррозом (класс В и С по шкале Чайлд-Пью) лечение должно быть назначено незамедлительно. Желательно проводить его в условиях отделения трансплантологии.
К группе высокого приоритета относятся также пациенты, коинфецированные ВИЧ и гепатитом В, а также с клинически значимыми внепеченочными проявлениями, такими как васкулит, сопровождающийся криоглобулинемией.
Пациентам с умеренным фиброзом F2 назначение лечения оправдано, однако при необходимости оно может быть отложено (например, по материальным соображениям).
Время начала терапии у пациентов без проявлений или с легким течением заболевания (F0-1) и без внепеченочных симптомов определяется индивидуально.
Препараты прямого противовирусного действия, доступные в Европе.
СОФОСБУВИР – следует принимать в дозе 400 мг (1 таблетка) один раз в сутки.
Софосбувир выводится в основном (80%) почками с мочой, поэтому назначение его требует осторожности у пациентов с заболеваниями почек.
Возможны межлекарственные взаимодействия с многими препаратами, поэтому следует внимательно относиться к сопутствующим заболеваниям и корректировать прием препаратов, назначенных для лечения этих заболеваний.
ЛЕДИПАСВИР – доступен в комбинации с софосбувиром (400 мг софосбувира и 90 мг ледипасвира). Доза для приема – 1 таблетка в день независимо от приема пищи.
Так как ледипасвир может взаимодействовать с другими лекарственными препаратами, следует соблюдать меры предосторожности, с частым контролем функции почек. Кроме того, важно учитывать прием пациентом статинов и препаратов в схеме антиретровирусной терапии.
СИМЕПРЕВИР – следует принимать 1 капсулу 150 мг 1 раз в сутки. Пациентам, принимающим симепревир, противопоказаны некоторые препараты, в том числе антиретровирусные.
ДАКЛАТАСВИР – 1 таблетка 60 мг 1 раз в сутки. Многочисленные лекарственные взаимодействия даклатасвира требуют внимательного отношения при его назначении и соответственно контроля при его применении.
ВИКЕЙРА ПАК – комплексный препарат, включающий 4 действующих вещества (ритонавир, усиливающий действие паритапревира, омбитасвир и дасабувир).
Рекомендуемая дозировка 1 раз в сутки во время еды 2 таблетки ритонавира/паритапревира/омнитасвира, а также дасабувир 2 раза в сутки. При назначении следует учитывать многочисленные лекарственные взаимодействия и класс цирроза.
Варианты лечения различных групп пациентов.
Для лечения хронического гепатита С противовирусными препаратами прямого действия существует несколько различных схем, эффективность и безопасность которых проверена во многих клинических испытаниях.
Выбор комбинаций лекарственных средств осуществляется врачом и зависит от генотипа и подтипа вируса, тяжести заболевания печени, результатов предшествующей терапии.
Длительность терапии зависит от степени поражения печени и наличия компенсированного или декомпенсированного цирроза. Стандартный курс терапии – 12 недель, при циррозе может быть увеличен до 24 недель.
Возможно назначение дополнительно к схеме лечения препарата рибавирин у пациентов с циррозом и с отрицательными прогностическими факторами ответа на лечение, например, при содержании тромбоцитов менее 75х10^3/мкл.
Для лечения пациентов с генотипом 1 (1а и 1в) существует 4 рекомендованные схемы препаратов прямого противовирусного действия:
Для лечения пациентов с генотипом 2 существует только одна безинтерфероновая схема: софосбувир+даклатасвир в течение 12 недель.
Пациентов с циррозом, ранее уже получавших или не получавших терапию, следует лечить также 12 недель.
Для лечение пациентов, инфицированных HCV генотипа 3, пока существует только одна схема безинтерфероновой терапии: софосбувир +даклатасвир. Ледипасвир в отношении HCV генотипа 3 значительно менее эффективен, чем даклатасвир, поэтому схемы с применением ледипасвира для этого генотипа не рекомендованы.
Пациентам с HCV генотипа 3 с циррозом, получавшим или не получавшим ранее терапию, следует назначать эту схему лечения с добавлением рибавирина и длительностью курса 24 недели.
Контроль лечения
В процессе лечения необходимо контролировать эффективность и безопасность (побочные нежелательные эффекты).
Контроль эффективности лечения основан на регулярном определении уровня РНК HCV с использованием чувствительных количественных методов.
РНК HCV следует определять до начала терапии, через 2 недели, а затем через 4, 8 и 12 недель, а также через 12 и 24 недели после окончания курса лечения.
Прекращение терапии вследствие ее бесперспективности при лечении препаратами прямого противовирусного действия правилами НЕ предусмотрено.
Контроль безопасности лечения
Схемы лечения препаратами прямого противовирусного действия хорошо переносятся. Случаи выраженных нежелательных явлений, требующих отмены препаратов, отмечены редко.
Однако, во время терапии необходимо контролировать проявления токсичности других препаратов, применяемых для лечения сопутствующих заболеваний, а также проявления лекарственных взаимодействий. При лечении схемами, содержащими софосбувир, необходимо контролировать состояние почек.
Наиболее часто отмечаются утомляемость и головная боль.
Лечение следует безотлагательно прекратить при обострении гепатита (АЛТ выше нормы в 10 раз).
Тактика лечения пациентов с ожирением и метаболическим синдромом
При выявлении у пациентов с HCV сопутствующего поражения печени в результате метаболического синдрома (неалкогольная жировая болезнь печени - стеатоз) необходимо провести дополнительное обследование на показатели обменных и гормональных нарушений, характерных для этого заболевания.
Рекомендуется для оценки степени поражения печени использовать исследование крови – Фибромакс, которое дает возможность оценить отдельно степень поражения печени вирусом и отдельно метаболическим синдромом.
Тактика лечения зависит от степени поражения печени в целом, и отдельно каждым повреждающим фактором. Лечение противовирусными препаратами может быть назначено сразу, а дальнейшее лечение метаболического синдрома после получения УВО.
Если степень поражения печени вирусом значительно меньше, чем метаболическим синдромом, возможно начинать противовирусную терапию после лечения метаболического синдрома.
В случаях наличия сопутствующих заболеваний печени необходимо ставить целью лечения не только получение УВО, но и сохранение и восстановление печени, пострадавшей от других патологических факторов.
Цирроз печени – хроническое прогрессирующее заболевание печени, характеризующееся перестройкой структуры печеночной ткани и сосудистого русла, уменьшением количества функционирующих печеночных клеток (гепатоцитов), разрастанием соединительной ткани, появлением узлов регенерации и развитием в последующем печеночной недостаточности и портальной гипертензии.
В экономически развитых странах цирроз печени входит в одну из основных причин смерти в возрасте от 35 до 60 лет.
Как проявляется цирроз?
Длительное время цирроз печени протекает бессимптомно или с минимальными нетипичными проявлениями. Появляется слабость, повышенная утомляемость, снижение работоспособности, раздражительность, слезливость, обидчивость, склонность к истерическим реакциям.
Часто возникают расстройства пищеварения: тошнота, рвота, горечь во рту, непереносимость жирной пищи и алкоголя.
Тяжелые формы заболевания протекают с грубыми нарушениями функции печени и угрожающими жизни осложнениями, в первую очередь портальной гипертензией (повышение давления в портальной вене), приводящей к кровотечению из расширенных вен пищевода, асциту, печеночно-клеточной недостаточности.
Каковы причины вызывающие цирроз печени?
Наиболее частыми причинами цирроза печени являются:
хронический вирусный гепатит В (и D),
из которых основным является метаболический синдром , сопровождающийся жировым гепатозом – неалкогольная жировая болезнь печени (НАЖБП) . Кроме того, цирроз вызывают наследственные заболевания: гемохроматоз, болезнь Вильсона-Коновалова, дефицит альфа-1-антитрипсина и др. , а также аутоиммунные заболевания печени, в том числе первичный билиарный цирроз и токсическое поражение печени промышленными ядами и лекарственными средствами.
Диагностика цирроза печени

1. Оценка состояния печени
Диагноз на ранних стадиях цирроза печени устанавливается с трудом, так как выраженных изменений в печени часто нет. В первую очередь проводится ультразвуковое обследование печени ( УЗИ-диагностика ), которая позволяет выявить диффузные изменения ткани печени, увеличение ее размеров (правда, это происходит не всегда). Желательно проводить допплерографию сосудов брюшной полости с определением ширины просвета сосудов и скорости кровотока. Это позволяет установить наличие признаков портальной гипертензии.
Важным для характеристики структурного и функционально состояния печеночных клеток является биохимический анализ крови ( АЛТ, АСТ, ГГТ, билирубин, щелочная фосфатаза, белковые фракции ), а также клинический анализ крови и коагуллограмма – свертывание крови.
Для точной диагностики степени фиброза используются современные неинвазивные (заменяющие биопсию) методы обследования: эластометрия (эластография) печени на аппарате Фиброскан, Фибротес, ФиброМакс. Поражение печени характеризуется степенями от 0 до 4; 0 – здоровая печень, 4 – цирроз.
2. Установление причины цирроза печени
В первую очередь необходимо сделать анализы на вирусы гепатитов В и С, так как вирусы являются самой частой причиной цирроза, в особенности в сочетании с алкоголем. Если вирусы не выявлены, то поиски причины заключаются в исключении наследственных заболеваний печени, аутоиммунных показателей, а также алкогольной болезни печени, НАЖБП и токсического поражения печени.
- с 9:00 до 17:30 по будням
- с 9:00 до 15:00 в субботу
Степень тяжести цирроза определяется по шкале Чайлда-Пью с учетом выраженности клинико-лабораторных данных, основными из которых являются содержание в крови билирубина, альбумина, протромбина, а также выраженности энцефалопатии и асцита. Выделяют активный и неактивный цирроз, компенсированный и декомпенсированный. Для декомпенсированного цирроза характерно развитие портальной гипертензии, появление асцита, возникновение желудочно-кишечных кровотечений.
Стоимость диагностики цирроза печени
Общая стоимость обследования в нашем центре около 30 000 руб. Однако, стоимость обследования может быть существенно снижена при наличии у пациента результатов уже сделанных анализов и обследований из другого профильного медучреждения. Запишитесь на бесплатную консультацию для назначения индивидуального обследования.
Лечение цирроза печени
Лечение цирроза печени проводится с целью прекращения или замедления процессов прогрессирования заболевания и улучшения качества жизни.
Лечебная программа включает: лечебный режим и питание, медикаментозное лечение, профилактику и лечение осложнений.
Результаты лечения и прогнозы зависят от степени тяжести заболевания.
При компенсированном циррозе сохраняется функциональное состояние гепатоцитов, нет признаков портальной гипертензии и нарушения белково-синтетической функции печени. Лечение цирроза на этой стадии заболевания определяется причиной заболевания, в зависимости от которой назначается специфическая терапия. Кроме того необходимо ограничить психические и физические нагрузки.
Если причиной цирроза являются вирусный гепатит В или гепатит С , то назначается противовирусная терапия, которая, как показали исследования последних лет, не только подавляет активность вируса, но и обладает противофиброзным и противоциррозным действием.
При алкогольном циррозе ( алкогольная болезнь печени ) назначаются гепатопротекторы, которые при условии полного отказа от алкоголя дают возможность не только остановить процесс прогрессирования цирроза, но и способствуют снижению степени фиброза.
При метаболическом синдроме и неалкогольной жировой болезни печени (НАЖБ) соблюдение режима и правил питания в сочетании с медикаментозным лечением, в том числе гормональных нарушений, вызывающих поражение печени, дает хорошие результаты. Возможно обратное развитие фиброза и восстановление функционального и структурного состояния печени.
Пациент с циррозом печени в стадии декомпенсации и развития осложнений нуждается в диетическом, медикаментозном, а в ряде случаев – эндоскопическом и хирургическом лечении.
Декомпенсированный цирроз характеризуется развитием тяжелых осложнений, основное из которых – портальная гипертензия, т.е. стойкое повышение давления в портальной системе. Это проявляется спленомегалией (увеличение селезенки), варикозным расширением вен пищевода и желудка и кровотечением из расширенных вен, накоплением жидкости в брюшной полости – асцитом.
Для лечения портальной гипертензии применяются различные группы лекарственных препаратов: вазоконстрикторы и вазодилататоры.
При развитии асцита 50% больных живут около 2 лет, и только 25-50% больных, не ответивших на медикаментозную терапию, переживает 6 месяцев. Цель консервативной терапии при асците – выведение из организма накопившейся жидкости. Для этого назначают специальную бессолевую диету и диуретики.
В терминальной стадии цирроза печени только операция по пересадке печени может сохранить жизнь пациента.
Рекомендации по питанию при циррозе печени
При циррозе готовят блюда без соли, уменьшают количество свободной жидкости и вводят продукты, богатые калием.
Основные части пищи – белки, жиры, углеводы, вода, минеральные вещества и витамины, которые должны быть строго сбалансированы. Соотношение между белками, жирами и углеводами должно быть 1:1:4.
Белки животного происхождения должны составлять около 60 % от общего количества белков. Из общего количества жиров 20-25 % должны составлять растительные масла как источник полиненасыщенных жирных кислот.
Сбалансированность углеводов выражается в соотношении крахмала, сахара, клетчатки и пектинов. Сахара должны быть представлены фруктами, ягодами, молочными продуктами питания, медом. Крайне важно соблюдать сбалансированность витаминов и минеральных веществ, которые должны поступать в организм ежедневно в соответствии с суточной потребностью.
Это количество приемов пищи и интервал между ними а течение дня. Для здоровых людей 3-4 раза в день с 4-5 часовыми промежутками. При некоторых заболеваниях, например ожирении, необходимо принимать пищу 5-6 раз в день
Профилактика цирроза печени
Для профилактики необходимо предупреждение и своевременное лечение заболеваний, приводящих к циррозу (в первую очередь вирусных гепатитов и алкоголизма).
Цирроз печени – это результат длительного патологического процесса. Его можно остановить и даже вылечить. Главное – вовремя обратиться к врачу.
Отмечены осложнения лечения препаратами прямого действия при наличии гепатита В, что выражается в обострении процесса со всеми ярко выраженными проявлениями обострения вирусного гепатита В (желтуха, значительное повышение печеночных ферментов в крови, температура).
Поэтому до начала терапии необходимо провести исследование маркеров гепатита В: HBsAg, anti-HBcor, anti-HBs.
При выявлении HBsAg обязательно обследование на ДНК вируса гепатита В, на антитела к гепатиту D - anti-HDV и РНК HDV методом ПЦР.
В ходе противовирусного лечения хронического гепатита С у пациентов с anti-HBcor+, а также в периоде наблюдения после завершения терапии, следует проводить контроль ДНК HBV и при необходимости назначать противовирусное лечение хронического гепатита В.
2. Степень фиброза и лечение пациентов с циррозом печени
Опасность вирусного заболевания печени обусловлена тем, что активный вирус при размножении разрушает печень необратимо и при этом вместо разрушенной печени формируются участки повышенной плотности, состоящие из соединительной ткани. Оставшаяся здоровая часть печени компенсирует функции уже разрушенной ее части и обеспечивает, таким образом, жизнедеятельность пациента, часто без всяких симптомов и даже отклонений в биохимическом анализе крови.
Однако, при длительном процессе разрушения может сложиться ситуация, при которой оставшаяся здоровая часть печени не достаточна для компенсации – эта стадия заболевания называется цирроз, а при далеко зашедшем процессе его нельзя вылечить, так как при назначении ПППД возможно обострение цирроза, которое невозможно остановить.
Поэтому важнейшим вопросом при назначении противовирусной терапии является оценка степени поражения печени (степени фиброза). Из всех существующих в настоящее время методом оценки фиброза наиболее информативным признана эластометрия на аппарате фиброскан. В результате измерения таким образом плотности печени мы получаем ее значение в килопаскалях кПа (физические единицы измерения плотности). Начиная с 12,5 кПа мы ставим 4-ю, последнюю стадию, которая может ассоциироваться с циррозом.
Основное и самое опасное последствие уплотнения печени – это вызванное им повышение давления в портальной вене – портальная гипертензия, которая возникает из-за увеличения сопротивления кровотоку и может закончиться разрывом сосуда и несовместимым с жизнью кровотечением.
Портальная гипертензия чаще всего проходит бессимптомно и первым клиническим проявлением является увеличение селезенки и в связи с этим снижение уровня тромбоцитов. Клиническое значение портальной гипертензии заключается в угрозе кровотечения из расширенных вен пищевода и желудка, развития асцита (жидкость в брюшной полости), бактериального перитонитом и энцефалопатии.
Измерение плотности печеночной ткани на аппарате Фиброскан точно определяет степень ее фиброза, повышение которой и вызывает портальную гипертензию. Пороговый уровень плотности, ассоциирующийся с циррозом и портальной гипертензией, является 25 кПа.
Поскольку плотность печеночной ткани связана с портальной гипертензией, то сочетание уровня тромбоцитов и выраженности фиброза в килопаскалях, дает нам предварительную информацию для выбора тактики лечения и возможности назначения ПППД. Плотность меньше или равная 20 кПа и количество тромбоцитов больше 150, позволяют считать процесс компенсированным и назначать противовирусную терапию с учетом рекомендаций по лечению цирроза класса А.
Клиническая декомпенсация является противопоказанием для назначения ПППД. Для принятия решения о назначении терапии значимыми являются следующие показатели, характеризующие угрозу кровотечений: индекс LSPS, включающий плотность печеночной ткани по данным эластометрии, размеры селезенки и уровень тромбоцитов. Пороговым является значение больше 6,5 и плотность печеночной ткани больше 21 кПа.
В зависимости от прогностических показателей, в том числе плотности печеночной ткани, могут быть назначены разные схемы лечения ПППД, обязательно с учетом противопоказаний и сопутствующих заболеваний. В схему лечения как правило добавляется рибавирин и длительность терапии может быть увеличена до 24 недель.
При наблюдении пациентов с циррозом печени класса В обязательно наблюдение у опытного гепатолога или в специализированном гепатологическом центре. До начала противовирусного лечения крайне важно исключить наличие гепато-целлюларной карциномы (ГКЦ). При наличии ГЦК сначала проводится лечение рака печени, а затем вирусного гепатита С. В ряде случаев противовирусная терапия ПППД может быть назначена совместно с химиотерапией.
Читайте также:

