Лечение гепатита с зепатиром отзывы
Обновлено: 19.04.2024
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Софбувир
Таблетки, покрытые пленочной оболочкой белого цвета, капсуловидные, двояковыпуклые; на изломе таблетка белого или почти белого цвета.
| 1 таб. | |
| софосбувир | 400 мг |
Вспомогательные вещества: гипролоза - 80 мг, кремния диоксид коллоидный - 6 мг, мальтитол - 134 мг, натрия стеарилфумарат - 6 мг, повидон К30 - 14 мг.
Состав пленочной оболочки: титана диоксид - 2 мг, макрогол 3350 - 2.1 мг. поливиниловый спирт - 4.2 мг, тальк - 1.7 мг.
7 шт. - упаковки ячейковые контурные (4) - пачки картонные.
10 шт. - упаковки ячейковые контурные (3) - пачки картонные.
28 шт. - банки - пачки картонные.
Фармакологическое действие
Противовирусное средство, пан-генотипический ингибитор РНК-зависимой РНК-полимеразы NS5B вируса гепатита С. Софосбувир - нуклеотидное пролекарство, подвергается внутриклеточному метаболизму, в процессе которого формируется фармакологически активный аналог уридинтрифосфата (GS-461203). С помощью NS5B полимеразы GS-461203 может встраиваться в строящуюся цепочку РНК вируса гепатита С и действовать как обрыватель цепи. Этот активный метаболит софосбувира (GS-461203) подавляет активность полимеразы генотипов 1b, 2а, 3а и 4а вируса гепатита С в концентрациях, вызывающих 50% ингибицию (IC 50 ), в диапазоне от 0.7 до 2.6 мкмоль.
Фармакокинетика
После приема внутрь софосбувир быстро всасывается, C max в плазме крови достигается через 0.5-2 ч вне зависимости от величины принятой дозы. С max неактивного метаболита (GS-331007) в плазме крови достигалась через 2-4 ч после приема препарата. По результатам популяционного анализа фармакокинетических данных у пациентов с генотипами 1-6 вируса гепатита С, значения AUC 0-24 софосбувира и неактивного метаболита (GS-331007) в равновесном состоянии равны 1010 нг×ч/мл и 7200 нг×ч/мл соответственно. По сравнению со здоровыми добровольцами, AUC 0-24 софосбувира и неактивного метаболита (GS-331007) у пациентов с хроническим гепатитом С на 57% выше и на 39% ниже соответственно.
Прием софосбувира в однократной дозе с пищей с высоким содержанием жиров замедляет скорость всасывания софосбувира. Полнота всасывания софосбувира увеличивается примерно в 1.8 раз, при этом наблюдается незначительное влияние на C max . Прием пищи с высоким содержанием жиров не влияет на экспозицию неактивного метаболита (GS-331007). Установлено, что при приеме натощак софосбувира в дозах от 200 мг до 400 мг AUC софосбувира и неактивного метаболита (GS-331007) практически пропорциональна дозе.
Софосбувир примерно на 85% связывается с белками плазмы крови человека (данные ex vivo), степень связывания не зависит от концентрации препарата в диапазоне 1-20 мкг/мл. Неактивный метаболит (GS-331007) в минимальной степени связывается с белками плазмы крови. После однократного приема [ 14 С]-софосбувира в дозе 400 мг здоровыми добровольцами соотношение радиоактивности 14 С в крови/плазме составляло приблизительно 0.7.
Софосбувир интенсивно метаболизируется в печени с формированием фармакологически активного нуклеозидного (уридинового) аналога трифосфата (GS-461203). Метаболический путь активации включает последовательный гидролиз молекулы карбоксилэстеразы катепсином A (CatA) или карбоксилэстеразой 1 (CES1) и расщепление фосфорамидата нуклеотид-связывающим белком 1 с гистидиновыми триадами (HINT1) с последующим фосфорилированием путем биосинтеза пиримидинового нуклеотида. Дефосфорилирование приводит к образованию нуклеозидного неактивного (>90%) метаболита, который не может быть полностью рефосфорилирован, и не обладает активностью против HCV in vitro.
После однократного приема внутрь [ 14 С]-софосбувира в дозе 400 мг системная экспозиция софосбувира и неактивного метаболита (GS-331007) составляла примерно 4 и >90% соответственно от системной экспозиции материала, связанного с препаратом (сумма AUC софосбувира и его метаболитов с коррекцией на молекулярную массу).
После однократного приема внутрь [ 14 С]-софосбувира в дозе 400 мг среднее общее выведение радиоактивной дозы составляло более 92%, при этом приблизительно 80%, 14% и 2.5% выводилось почками, кишечником и легкими соответственно. Большая часть дозы софосбувира, выводимая почками, представляла неактивный метаболит (GS-331007) (78%), тогда как 3.5% выводилось в виде софосбувира. Эти данные показывают, что почечный клиренс является основным путем выведения неактивного метаболита (GS-331007) с преимущественной активной секрецией. Средний Т 1/2 софосбувира и неактивного метаболита (GS-331007) составляет 0.4 ч и 27 ч соответственно.
Фармакокинетика в особых клинических случаях
По сравнению с пациентами с нормальной функцией почек (КК >80 мл/мин), не инфицированными вирусом гепатита С, при почечной недостаточности легкой, средней и тяжелой степени тяжести, AUC 0-inf софосбувира была выше соответственно на 61%, 107% и 171%, a AUC 0-inf неактивного метаболита (GS-331007) была выше на 55%, 88% и 451% соответственно. У пациентов с хронической почечной недостаточностью по сравнению с пациентами с нормальной функцией почек AUC 0-inf софосбувира была на 28% выше, если софосбувир принимали за 1 ч до сеанса гемодиализа, и на 60% выше, если софосбувир принимали через 1 ч после сеанса гемодиализа. Основной неактивный метаболит (GS-331007) может быть эффективно удален с помощью гемодиализа (клиренс составляет около 53%). После 4-часового сеанса гемодиализа выводится примерно 18% от принятой дозы препарата.
По сравнению с пациентами с нормальной функцией печени AUC 0-24 софосбувира была на 126% и 143% выше у пациентов с печеночной недостаточностью средней и тяжелой степени тяжести, AUC 0-24 неактивного метаболита (GS-331007) была выше на 18% и 9% соответственно.
Показания активных веществ препарата Софбувир
Лечение хронического гепатита С у взрослых пациентов (в комбинации с другими лекарственными препаратами).
С позиции современных знаний рецидив вируса после лечения гепатита с представляет собой непростую клиническую задачу, которая требует всестороннего анализа, поиска причин рецидива HCV и принятия решения о повторном лечении гепатита (перелечивании). Чаще всего рецидив HCV-инфекции возникает в течение первых 3-12 месяцев (12-48 недель) после окончания курса противовирусной терапии. Срок возникновения рецидива не зависит от того чем пациент лечился, устаревшими режимами на основе интерферона-альфа или самыми современными безинтерфероновыми препаратами. В то же время рецидивы HCV после лечения интерфероном и рибавирином возникают чаще чем после безинтерфероновой терапии ингибиторами прямого противовирусного действия.

О такой сложной клинической ситуации как рецидив гепатита с через несколько лет после лечения можно говорить в тех случаях, когда по результатам контрольного анализа ПЦР после длительной авиремии в плазме крови повторно обнаруживают виремию РНК HCV. Рецидив виремии может сочетаться с повышением уровня активности АЛТ в крови и появлением характерных клинических симптомов. В части случаев никаких клинических симптомов и гиперферментемии АЛТ вообще не бывает. Однако в любом случае возврат вируса гепатита с и виремию следует рассматривать в качестве неблагоприятного состояния, которое требует повторного противовирусного лечения с целью предотвратить цирроз и рак печени, а также различные тяжелые системные лимфопролиферативные и аутоиммунные заболевания.

Причины возврата гепатита С после лечения
Наиболее часто встречающиеся причины рецидива гепатита с хорошо известны многим пациентам и практикующим врачам-гепатологам. Эти причины давно установлены, их довольно много, но в числе наиболее значимых нужно выделить следующие:
Вышеперечисленные причины рецидива HCV позволяют дать утвердительный ответ на вопрос может ли гепатит с вернуться, хорошо объясняют почему возвращается гепатит с после лечения и как этого можно избежать. На самом деле возврат гепатита с после пвт (противовирусной терапии) это нередко встречающаяся в клинической практике ситуация, особенно в тех случаях, если пациенты занимаются бесконтрольным самолечением, не соблюдают правила приема лекарственных препаратов или в качестве препаратов для противовирусной терапии принимают дженерики сомнительной репутации и не очень высокого качества. Поэтому всем пациентам с HCV-инфекцией, которые начинают курс лечения гепатита С, следует знать о том, что возврат гепатита с после дженериков более вероятен, чем после лечения оригинальными препаратами. При прочих равных условиях эффективность дженериков все-таки уступает эффективности оригинальных препаратов.

Рецидив гепатита С и лечение рецидива
Эффективное лечение рецидива гепатита с гарантией достижения УВО (устойчивого вирусологического ответа) после повторного курса лечения всегда представляет определенные трудности для пациента и врача-гепатолога. Необходим правильный выбор конкретного режима повторного лечения (перелечивания), который зависит от генотипа/субтипа HCV, характеристики противовирусных лекарственных препаратов, которыми пациент неудачно лечился и стадии фиброзных изменений в печени.
Всех пациентов с рецидивом гепатита С в зависимости от стадии фиброза условно разделяют на 3 группы:

- Peg_IFN-alfa + RBV_ribavirin
- Peg_IFN-alfa + RBV_ribavirin + SOF_sofosbuvir
- SOF_sofosbuvir + RBV_ribavirin
… является не очень сложной клинической задачей и подробно описано в общих рекомендациях EASL. В клинике ЭКСКЛЮЗИВ для повторного лечения HCV у таких пациентов успешно применяют различные по составу и продолжительности безинтерфероновые режимы, которые подробно представлены на сайте здесь.

Лечение рецидива HCV и повторное лечение гепатита у пациентов, получавших ингибиторы NS3/4A и/или NS5A
Значительно более трудной клинической задачей по сравнению с предыдущей представляется лечение рецидива гепатита С у пациентов, не достигших УВО после различных комбинированных безинтерфероновых режимов, в состав которых входили те или иные ингибиторы протеазы NS3/4A 1-го и 2-го поколений и/или ингибиторы NS5A 1-го поколения, такие как:
На сегодняшний день известны результаты первых двух многоцентровых клинических испытаний III фазы (POLARIS-I и POLARIS-IV), показавших безопасность и эффективность принципиально новой 12-ти недельной комбинации трех ингибиторов sofosbuvir (ингибитор NS5B 1-го поколения) + velpatasvir (ингибитор NS5A 2-го поколения) + voxilaprevir (ингибитор NS3/4A 3-го поколения) у пациентов, которые не достигли УВО после различных безинтерфероновых режимов, включавших те или иные ингибиторы протеазы NS3/4A 1-го и 2-го поколений и/или ингибиторы NS5A 1-го поколения.
Врачи-исследователи POLARIS-I особо отметили, что ни генотип HCV, ни профиль мутаций лекарственной устойчивости на момент начала курса повторного лечения не имели никакого влияния на конечный результат терапии у наблюдавшихся пациентов.

В параллельное исследование РOLARIS-IV было включено в общей сложности 333 пациента с рецидивом HCV. Всех пациентов разделили на 2 сопоставимые группы. В первую группу вошли 182 пациента (46% с циррозом печени), которые начали получать 12-ти недельную комбинацию трех ингибиторов sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX) . Во вторую группу включили 151 пациента (44% с циррозом печени), которые начали получать 12-ти недельную комбинацию двух ингибиторов sofosbuvir/velpatasvir (SOF/VEL) . Итоговый показатель УВО в 3D-группе SOF/VEL/VOX составил 98% (178 из 182) и был достоверно выше итогового показателя УВО в 2D-группе SOF/VEL (всего лишь 90%, 136 из 151).
Врачи-исследователи POLARIS-IV также отметили, что ни генотип HCV, ни профиль мутаций лекарственной устойчивости на момент начала курса перелечивания не оказывали никакого влияния на конечный результат у больных, получавших новый безинтерфероновый 3D-режим тремя мощными ингибиторами SOF/VEL/VOX . Важно подчеркнуть, что у тех немногих пациентов, которые на этом режиме также испытали неудачу, не было обнаружено никаких мутаций лекарственной устойчивости ни перед началом курса лечения, ни при вирусологическом прорыве во время курса лечения, ни при рецидиве HCV после окончания курса лечения.
Таким образом, на сегодняшний день для перелечивания самых сложных пациентов, не достигших УВО после первого курса безинтерфероновой терапии, в состав которой входили тот или иной ингибитор протеазы NS3/4A 2-го поколения ( Simeprevir, Asunaprevir, Paritaprevir ) и/или ингибитор NS5A 1-го поколения ( Ledipasvir, Daclatasvir, Ombitasvir ), рекомендованы две новые 12-ти недельные 3D-комбинации:
КАКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ СУЩЕСТВУЮТ ДЛЯ ЛЕЧЕНИЯ ГЕПАТИТА С
Подробное описание препаратов, их действия и схемы лечения

Проблема гепатита С и лекарств от гепатита
Врачи всего мира рассматривают гепатит С как серьезную медико-социальную проблему. И на то существует масса причин, в том числе:
- сохраняются высокие показатели распространенности активной НСV-инфекции среди людей всех без исключения стран;
- становится все более широким перечень групп людей с высоким риском заражения;
- зачастую заболевание диагностируют на поздних стадиях патологического процесса, когда в печени и иммунных клетках уже развились необратимые изменения;
- недооценивают опасность естественных и искусственных путей заражения вирусом HCV (так, например, до начала 90-х годов прошлого века донорскую кровь даже не тестировали на вирус гепатита С).
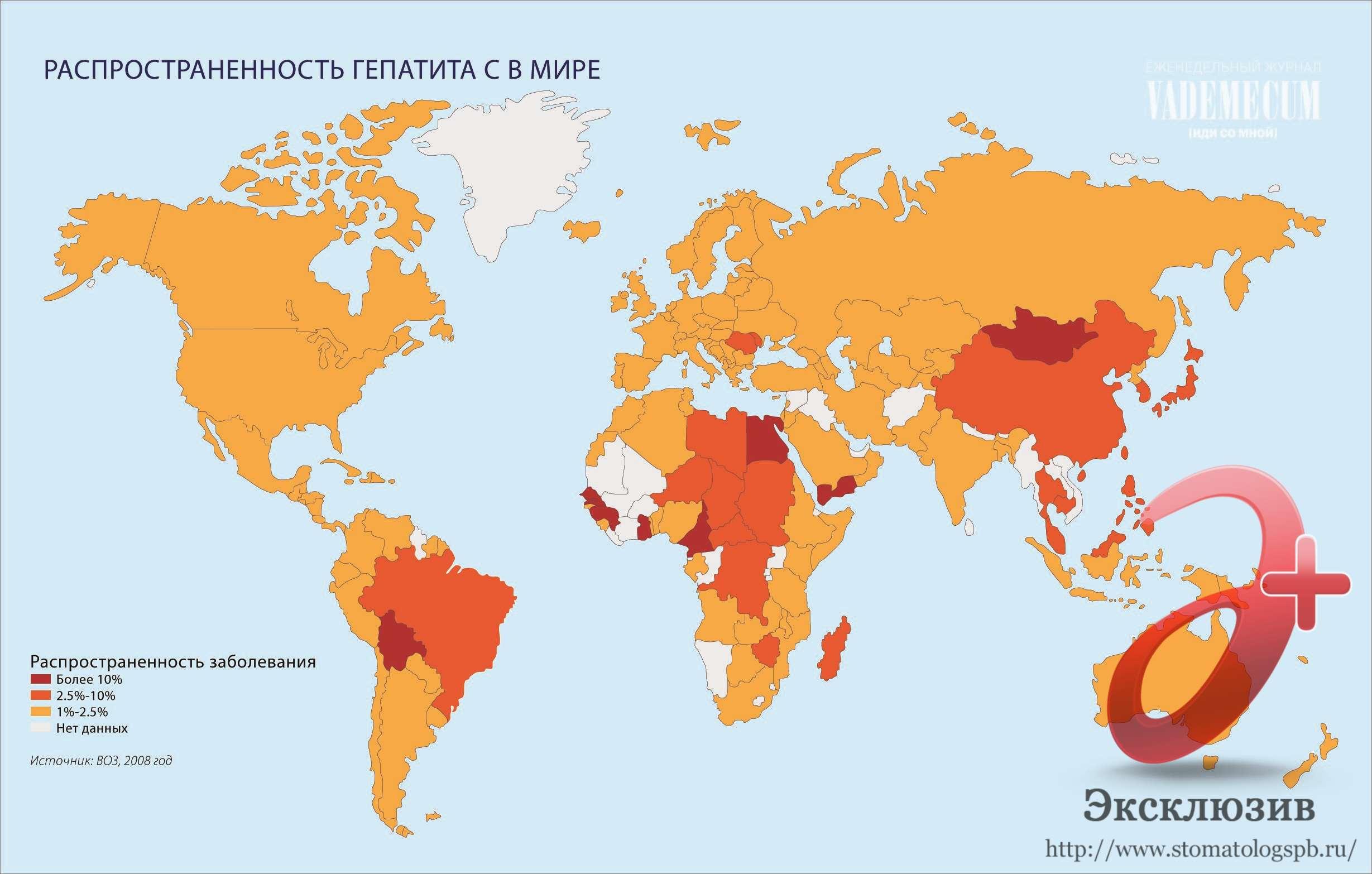
В ходе многочисленных исследований вирусологи и врачи выяснили, что генетическая структура вируса неоднородна. Вирус HCV очень быстро и активно размножается и постоянно мутирует, образовывая все новые и новые мутантные штаммы, подвиды и квазивиды. Именно поэтому до сих пор все еще не существует эффективной вакцины от гепатита С и никак не получается нанести сокрушительный удар по вирусу.
При обнаружении вируса HCV в крови врачи по старинке все еще предлагают своим пациентам длительное и сложное лечение интерфероном и рибавирином без какой-либо гарантии результата. Устаревшие интерфероны и таблетки рибавирина против гепатита С обычно вызывают серьезные побочные эффекты, которые нужно купировать приемом дополнительных лекарственных препаратов. А если учесть, что курс лечения нередко длится не менее одного года, то понятно, почему большинство пациентов прекращают делать уколы и пить таблетки, которые ухудшают их самочувствие и физическое состояние.
Zepatier (Зепатир) или Velpanat [Natko] (Велпатосвир-Софосбувир)
Zepatier (Зепатир) или Velpanat [Natko] (Велпатосвир-Софосбувир)
Всем доброго времени суток,
Хронический вирусный гепатит с 2013г, генотип 1b F0, отказались от лечения интерфероном.
Сейчас HCV RNA-6450630 МЕ/мл, с минимальной биохимической активностью, со стадией фиброза F3 (12,5 kPa).
Лечение до этого не получали.
Пошли на консультацию к доктору с чего начать:
Хотели начать ПВТ по схеме Velpanat [Natko] (Велпатосвир-Софосбувир) (много про ее читали), но
доктор порекомендовал три другие схемы (исключив нашу):
а)-Викейра пак 12 недель
b)-Харвони 12 недель (Джене́рик)
с)-Софосбувир+Даклатосфир (Джене́рик) 12 недель предпочтительнее.
Нам предоставилась возможность, так же получить лечение Zеpatier (Зепатир) оригинал.
Скажите какую схему выбрать 1, 2, 3 чем они отличаются, и почему нам исключили нашу схему Velpanat [Natko] (Велпатосвир-Софосбувир)?
Или остановиться на Zеpatier (Зепатир)?
И так же интересуют вопросы:
1-Что такое мутанты?
2-Гразопревир мегатоксичен, расшифруйте пожалуйста знающие - чем?, и как он влияет на здоровье?)
3-Что такое средняя и тяжелая степень (класс B и С по шкале Чайлд-Пью)
4-И после каких препараторов не перелечиться и почему?
5-По фиброскану F3 это что означает, (врачи говорят не его страшного, а мне так страшно)?
Поделитесь кто имел опыт лечения Zеpatier (Зепатир) при генотип 1b, с разной степенью фиброза.
Заранее большое спасибо за информацию всем
Zepatier (Зепатир) или Velpanat [Natko] (Велпатосвир-Софосбувир)
Отвечу на несколько вопрос, остальные дополнят: 1) Харвони - это оригинал Софосбувир ледипасфир, лучше купить Дженерик - он дешевле. подойдёт под ваш генотип.
2) класс B и С по шкале Чайлд-Пью - это стадии цирроза, к вам это отношения не имеет.
3) с F3 надо начинать лечение как можно быстрее.
4) подойдёт Велпатасфир или Ледипасфир - Велпатасфир более новый препарат. Смело пропивайте 3-х месячный курс.
СОФ+ЛЕД
Старт (31.01.18.)
Финиш (28.05.18.)
01.03.18. (-) кол.
10.06.18. (-) кач. 15ME
28.07.18. (-) кач. 60ME (УВО 8. )
01.11.18. (-) кач. 60ME (УВО 20)
05.12.19. (-) кач. 60ME (УВО 40+)
27.04.21. - Обнаружена Реинфекция:(
Гепатоциллюлярный рак с августа 2017г.
. Поделитесь опытом ПВТ Zepatier (Зепатир)
Всем доброго времени суток,
Хронический вирусный гепатит с 2013г, генотип 1b F0, отказались от лечения интерфероном.
Сейчас HCV RNA-6450630 МЕ/мл, с минимальной биохимической активностью, со стадией фиброза F3 (12,5 kPa).
Лечение до этого не получали.
Предложили пройти ПВТ (противовирусную террарию) схемой Zepatier (Зепатир) бесплатно , если подойдем под критерии ПВТ.
Ответ на согласие необходимо дать 2 июля 2018г.
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Произведено:
Упаковка и выпускающий контроль качества:
Активные вещества
Лекарственная форма
Форма выпуска, упаковка и состав препарата Зепатир ®
Таблетки, покрытые пленочной оболочкой светло-коричневого цвета, продолговатые, двояковыпуклые, с гравировкой "770" на одной стороне, гладкие на другой стороне.
| 1 таб. | |
| гразопревир | 100 мг |
| элбасвир | 50 мг |
Вспомогательные вещества: натрия лаурилсульфат, коповидон, маннитол, кроскармеллоза натрия, натрия хлорид, кремния диоксид коллоидный, магния стеарат, гипромеллоза 2910, витамин Е полиэтиленгликоль сукцинат, целлюлоза микрокристаллическая, лактозы моногидрат.
Состав пленочной оболочки: Опадрай II Бежевый 39К170006 (лактозы моногидрат, гипромеллоза 2910, титана диоксид, триацетин, краситель железа оксид желтый, краситель железа оксид красный, краситель железа оксид черный), воск карнаубский.
7 шт. - блистеры (2) - обложки картонные (2) - пачки картонные.
Фармакологическое действие
Комбинированное противовирусное средство. Сочетает два противовирусных препарата прямого действия с различными механизмами и с неперекрывающимися профилями резистентности для воздействия на вирус гепатита С (ВГС) на различных стадиях жизненного цикла вируса.
Элбасвир является ингибитором белка NS5A ВГС, который необходим для репликации вирусной РНК и сборки вириона.
Гразопревир является ингибитором протеазы NS3/4A ВГС, которая необходима для протеолитического расщепления кодируемого полипротеина ВГС (на зрелые формы белков NS3, NS4A, NS4B, NS5A и NS5B) и репликации вируса. В биохимическом исследовании гразопревир ингибировал протеолитическую активность энзимов рекомбинантной протеазы NS3/4A ВГС генотипов la, lb, 2, 3 и 4а со значениями IC50 от 4 до 690 пмоль/л.
Фармакокинетика
После приема данной комбинации внутрь ВГС пациентами время достижения C max элбасвира в плазме в среднем составляло 3 ч (диапазон от 3 до 6 ч), гразопревира - 2 ч (диапазон от 30 мин до 3 ч). Абсолютная биодоступность элбасвира оценивалась равной 32% и гразопревира от 10 до 40%. Связывание элбасвира и гразопревира с белками плазмы составляет >99.9% и 98.8% соответственно. Элбасвир и гразопревир связываются с альбумином сыворотки крови и альфа1-кислым гликопротеином. Элбасвир и гразопревир частично метаболизируются путем окисления, в первую очередь при участии изоферментов CYP3A. Каких-либо других циркулирующих метаболитов элбасвира и гразопревира не было обнаружено в плазме человека. Кажущийся конечный T 1/2 составляет примерно 24 ч (24%) для 50 мг элбасвира и примерно 31 ч (34%) для 100 мг гразопревира у инфицированных ВГС пациентов Элбасвир и гразопревир выводят главным образом через кишечник.
Фармакокинетика элбасвира близка к дозозависимой при приеме в диапазоне от 5 до 100 мг 1 раз/сут.
Фармакокинетические параметры гразопревира увеличивались более значительно при приеме в диапазоне от 10 до 800 мг 1 раз/сут пациентами, инфицированными ВГС, чем при увеличении в зависимости от дозы.
Показания активных веществ препарата Зепатир ®
Лечение хронического гепатита С генотипов 1, 3 или 4 у взрослых пациентов.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Принимают внутрь 1 раз/сут.
Режим применения зависит от схемы терапии.
Побочное действие
Со стороны обмена веществ: часто - снижение аппетита.
Нарушения психики: часто - бессонница, тревожность, депрессия.
Со стороны нервной системы: очень часто - головная боль; часто - головокружение.
Со стороны пищеварительной системы: часто - тошнота, диарея, запор, боль в верхних отделах живота, боль в животе, сухость во рту, рвота.
Со стороны кожи и подкожных тканей: часто - зуд, алопеция.
Со стороны костно-мышечной системы: часто - артралгия, миалгия.
Общие реакции: очень часто - усталость; часто - слабость, раздражительность.
Противопоказания к применению
Повышенная чувствительность к элбасвиру, гразопревиру; печеночная недостаточность средней (класс В по классификации Чайлд-Пью) и тяжелой (класс С по классификации Чайлд-Пью) степени; одновременное применение с ингибиторами полипептида 1В, транспортирующего органические анионы (ОАТР1В), такими как рифампицин, атазанавир, дарунавир, лопинавир, саквинавир, типранавир, кобицистат или циклоспорин; одновременное применение с препаратами атазанавир/ритонавир, дарунавир/ритонавир, лопинавир/ритонавир, саквинавир/ритонавир, типранавир/ритонавир, элвитегравир/кобицистат/эмтрицитабин/тенофовира дизопроксил фумарат; одновременное применение с индукторами изофермента CYP3A или Р-гликопротеина, такими как эфавиренз, фенитоин, карбамазепин, бозентан, этравирин, модафинил и препараты зверобоя продырявленного; возраст до 18 лет.
Пациенты с коинфекцией ВГС и ВГВ (вирус гепатита В); не рекомендуется одновременно применять с сильными ингибиторами CYP3A, такими как кетоконазол; одновременно со следующими препаратами: дабигатрана этексилат, антагонисты витамина К, аторвастатин, розувастатин, флувастатин, ловастатин, симвастатин, такролимус, сунитиниб.
Применение при беременности и кормлении грудью
Нет достаточных данных и строго контролируемых исследований по применению данной комбинации при беременности. Применение при беременности возможно только если ожидаемая польза терапии для матери превышает потенциальный риск для плода.
Неизвестно, выделяются ли компоненты данной комбинации с грудным молоком у человека. Элбасвир и гразопревир экскретируются с молоком у лактирующих крыс. Следует оценить пользу грудного вскармливания наряду с необходимостью лечения матери и возможными нежелательными явлениями у ребенка, связанными с лечением матери данной комбинацией и основным заболеванием матери.
Применение при нарушениях функции печени
Противопоказано применение у пациентов с печеночной недостаточностью средней и тяжелой степени (классы В и С по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Препарат разрешен для применения при нарушении функции почек
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
Скорость позднего повышения активности АЛТ во время лечения напрямую связана с плазменной экспозицией гразопревира.
Лабораторные тесты для мониторинга состояния печени следует проводить до начала терапии, на 8 неделе терапии и как показано клинически. Для пациентов, получающих терапию в течение 16 недель, дополнительное лабораторное тестирование должно быть проведено на 12 неделе терапии.
Следует проинформировать пациентов о необходимости безотлагательной консультации с лечащим врачом в случае приступа утомления, слабости, потери аппетита, тошноты и рвоты, желтухи или обесцвечивания кала.
Следует рассмотреть необходимость отмены данной комбинации в случае, если активность АЛТ превышает ВГН более чем в 10 раз.
Следует прекратить прием данной комбинации, если повышение активности АЛТ сопровождается признаками или симптомами воспаления печени или увеличением концентрации конъюгированного билирубина, активности ЩФ или значения МНО.
Эффективность данной комбинации не была установлена у пациентов с ВГС генотипов 2, 5 и 6; ее не рекомендуется применять у пациентов, инфицированных ВГС данных генотипов.
Случаи реактивации ВГВ, некоторые из них летальные, сообщались во время или после лечения противовирусными препаратами прямого действия. Скрининг на наличие ВГВ должен проводиться у всех пациентов до начала лечения. У коинфицированных ВГС/ВГВ пациентов есть риск реактивации ВГВ, и их состояние должно мониторироваться и контролироваться в соответствии с текущими клиническими руководствами.
Если данная комбинация применяется совместно с рибавирином или с софосбувиром, необходимо учитывать противопоказания и меры предосторожности при приеме рибавирина, включая особые меры для предотвращения наступления беременности у пациенток. Следует тщательно изучать инструкции по медицинскому применению лекарственных средств, включенных в схемы противовирусной терапии с данной комбинацией.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентов следует проинформировать, что во время терапии данной комбинацией сообщалось о повышенной утомляемости.
Лекарственное взаимодействие
Гразопревир является субстратом лекарственных транспортеров ОАТР1В. Одновременное применение данной комбинации и ингибиторов ОАТР1В, которые могут привести к значительному увеличению плазменной концентрации гразопревира, противопоказано. Элбасвир и гразопревир являются субстратами CYP3A и P-gp. Одновременное применение данной комбинации с индукторами CYP3A или P-gp противопоказано, поскольку может уменьшить плазменные концентрации гразопревира и элбасвира, что приводит к уменьшению терапевтического эффекта данной комбинации.
Одновременное применение данной комбинации с сильными ингибиторами CYP3A увеличивает плазменные концентрации элбасвира и гразопревира, и их одновременное применение не рекомендуется.
Ожидается, что одновременное применение данной комбинации с ингибиторами P-gp будет иметь минимальный эффект на плазменные концентрации гразопревира и элбасвира.
Нельзя исключить потенциальную способность гразопревира быть субстратом белка резистентности рака молочной железы (BCRP). Элбасвир и гразопревир являются ингибиторами лекарственных транспортеров BCRP на кишечном уровне у человека и могут увеличивать плазменные концентрации одновременно применяемых субстратов BCRP.
У пациентов, получающих терапию антагонистами витамина К рекомендуется проводить тщательный мониторинг значений МНО в связи с тем, что функция печени может изменяться в течение лечения.
При одновременном применении с дабигатрана этексилатом ожидается повышение концентрации дабигатрана этексилата, что повышает риск развития кровотечения. Рекомендуется проведение клинического и лабораторного мониторинга.
Читайте также:

