Лечение народными средствами при аутоиммунном гепатите
Обновлено: 07.05.2024
Аутоиммунный гепатит (АИГ) — хроническое воспалительное заболевания печени, при котором нарушена иммунорегуляция организма. Результатом этого процесса является выработка антител к клеткам печени (гепатоцитам) и их повреждение.
Суть заболевания в том, что иммунная система организма человека атакует собственную печень.
В настоящее время на основании серологических данных (специальных анализов крови) принято выделять два типа аутоиммунного гепатита:
- 1-й тип (АИГ-1) характеризуется наличием антинуклеарных (ANA) и/или антигладкомышечных (анти-SMA) антител
- при 2-м типе (АИГ-2) определяются антитела к почечно-печеночным микросомам 1-го типа (анти-LKM-1)
Существуют клинические различия между двумя типами АИГ. Пациенты со 2 типом обычно моложе, для него характерны острое начало болезни, более тяжелое течение и быстрое прогрессирование, чем при АИГ-1.
Группы риска
Около 80 % людей, страдающих аутоиммунным гепатитом, — это женщины, обычно в возрасте от 15–45 лет. Гораздо реже АИГ выявляется в группе более молодого или старшего возраста.
Природа происхождения аутоиммунного гепатита до конца не ясна. Считается, что это заболевание возникает у генетически предрасположенных людей (для определения такой предрасположенности к заболеванию проводят HLA-типирование). Считается также, что некоторые заболевания, токсины и лекарства могут вызвать аутоиммунный гепатит у восприимчивых людей, особенно женщин.
Симптомы аутоиммунного гепатита
Симптомы аутоиммунного гепатита могут варьироваться от незначительных до выраженных. Начало заболевания может быть как внезапным, так и развиваться с течением времени.
Наиболее распространенным симптомом АИГ является усталость. В начале заболевания самочувствие может напоминать грипп. Течение заболевания имеет волнообразный характер с эпизодами ухудшения.
Симптомы аутоиммунного гепатита могут быть следующими:
- потеря аппетита
- желтуха (пожелтение кожи и белков глаз)
- дискомфорт в животе, тяжесть правом подреберье
- темная моча
- осветленный стул
- тошнота, рвота
- кожный зуд и высыпания
- сосудистые звездочки (телеангиэктазии) на коже
- боли в суставах
- нарушение менструального цикла у женщин
- увеличение печени и/или селезенки (определяет врач).
К более серьезным осложнениям относятся асцит (жидкость в брюшной полости) и спутанность сознания.
Диагностика
Для диагностики аутоиммунного гепатита проводятся:
- общеклинические анализы крови: оценка работы печени, напряженности иммунитета, а так же определение показаний к лечению
- исключение других заболеваний печени, протекающих с аутоиммунным компонентом и без него (хронические вирусные гепатиты, токсический или алкогольный гепатит, неалкогольный стеатоз, первичный билиарный цирроз, болезнь Вильсона, гемохроматоз и т.д.).
- анализ крови на аутоантитела — определение типа АИГ и, в некоторых случаях, прогноза течения заболевания и ответа на терапию
- фибротест — анализ крови, позволяющий оценить степень воспалительных и фибротических изменений в ткани печени
- инструментальные методы диагностики (УЗИ органов брюшной полости, ФГДС и т.д.) - для оценки состояния гепатобилиарной системы и выявления возможных осложнений (в том числе признаков цирроза)
При необходимости врач гепатолог может назначить дополнительные методы: HLA-типирование — для оценки ответа на терапию, прогноза течения заболевания и выявления рисков заболевания у родственников; биопсию печени с гистологическим исследованием — для верификации диагноза, определения стадии заболевания и степени повреждения печени (в том числе наличие цирроза).
Тестирование на аутоиммунный гепатит настоятельно рекомендуется для людей с признаками хронического заболевания печени, которые не злоупотребляют алкоголем, не принимают наркотики и не имеют случаев любого метаболического (обменного) заболевания печени или доказанного вирусного гепатита в семье.
Лечение аутоиммунного гепатита
Аутоиммунный гепатит — хроническое, но в большинстве случаев контролируемое заболевание.
Для уменьшения воспалительного процесса в печени, улучшения самочувствия и продления жизни пациента необходима иммуносупрессивная терапия (системные или топические кортикостероиды, цитостатики, подавляющие иммунитет).
Преимущества лечения особенно очевидны в первые 2 года, когда заболевание наиболее активно и наблюдается наибольший уровень смертности.
Прогноз
Исходом хронического воспаления в печени, за редким исключением, является цирроз печени.
Примерно у 70 % пациентов аутоиммунный гепатит переходит в ремиссию в течение 3 лет от начала лечения. Некоторые люди в конечном итоге могут прекратить лечение, хотя у 2/3 из них будет наблюдаться рецидив (обострение).
При условии соблюдения лечения большинство людей с аутоиммунным гепатитом имеют нормальную продолжительность жизни. Для своевременного выявления осложнений АИГ, предотвращения развития побочных эффектов проводимой терапии необходимо пожизненное наблюдение у врача.
Для пациентов, у которых с помощью медикаментозной терапии в течение 4 лет не удалось достичь ремиссии и приостановить развитие цирроза, может быть показана трансплантация печени. 10-летняя выживаемость после трансплантации печени составляет 75–85 %.
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
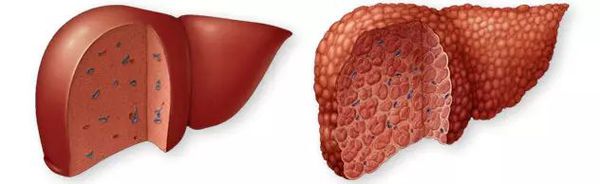
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
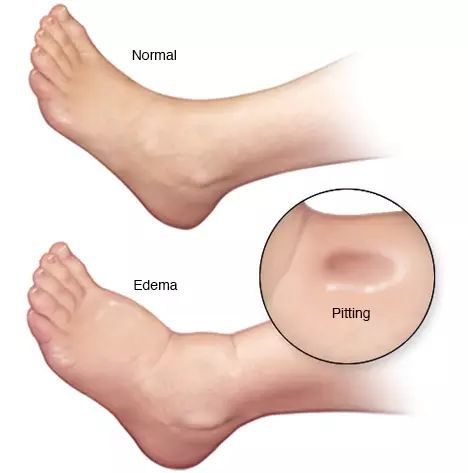
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
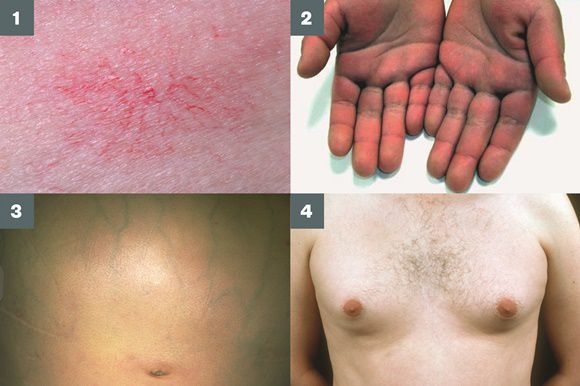
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменени
 |
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ.
| Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста |
АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2].
Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП.
Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ).
Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA.
Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ).
Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии.
Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин.
| Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] |
Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4].
Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20].
Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3].
В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз.
Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993).
Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10].
Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ
Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ.
Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24].
АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11].
Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС.
У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ.
Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения.
Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни.
Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР.
Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15].
Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами.
Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев.
Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены.
При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН.
Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта.
Литература
Аутоиммунный гепатит – это прогрессирующее хроническое воспаление печени, протекающее с признаками перипортального или более обширного поражения и наличием аутоантител к печеночным клеткам. Клинические проявления включают астеновегетативные расстройства, желтуху, боли в правом подреберье, кожные сыпи, гепатомегалию и спленомегалию, аменорею у женщин, гинекомастию – у мужчин. Диагностика основывается на серологическом выявлении антинуклеарных антител (ANA), тканевых антител к гладкой мускулатуре (SMA), антител к микросомам печени и почек и др., гипергаммаглобулинемии, увеличения титра IgG, а также данных биопсии печени. Основу лечения составляет иммуносупрессивная терапия глюкокортикостероидами.
МКБ-10
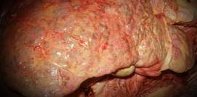
Общие сведения
В структуре хронических гепатитов в современной гастроэнтерологии на долю аутоиммунного поражения печени приходится 10-20% случаев у взрослых и 2% - у детей. Женщины заболевают аутоиммунным гепатитом в 8 раз чаще, чем мужчины. Первый возрастной пик заболеваемости приходится на возраст до 30 лет, второй – на период постменопаузы. Течение аутоиммунного гепатита носит быстропрогрессирующий характер, при котором довольно рано развивается цирроз печени, портальная гипертензия и печеночная недостаточность, ведущая к гибели пациентов.

Причины
Вопросы этиологии аутоиммунного гепатита изучены недостаточно. Считается, что в основе развития аутоиммунного гепатита лежит сцепленность с определенными антигенами главного комплекса гистосовместимости (HLA человека) - аллелями DR3 или DR4, выявляющаяся у 80-85% пациентов. Предположительными триггерными факторами, запускающими аутоиммунные реакции у генетически предрасположенных индивидуумов, могут выступать вирусы Эпштейна–Барр, гепатитов (А, В, С), кори, герпеса (HSV-1 и HHV-6), а также некоторые лекарственные препараты (например, интерферон). Более чем у трети пациентов с аутоиммунным гепатитом выявляются и другие аутоиммунные синдромы – тиреоидит, болезнь Грейвса, синовит, язвенный колит, болезнь Шегрена и др.
Патогенез
Основу патогенеза аутоиммунного гепатита составляет дефицит иммунорегуляции: снижение субпопуляции Т-супрессорных лимфоцитов, что приводит к неуправляемому синтезу В-клетками IgG и разрушению мембран клеток печени – гепатоцитов, появлению характерных сывороточных антител (ANA, SMA, анти-LKM-l).
Классификация
В зависимости от образующихся антител различают аутоиммунный гепатит I (анти-ANA, анти-SMA позитивный), II (анти-LKM-l позитивный) и III (анти-SLA позитивный) типов. Каждый из выделяемых типов заболевания характеризуется своеобразным серологическим профилем, особенностями течения, откликом на иммуносупрессивную терапию и прогнозом.
- I тип. Протекает с образованием и циркуляцией в крови антинуклеарных антител (ANA) – у 70-80% пациентов; антигладкомышечных антител (SMA) у 50-70% больных; антител к цитоплазме нейтрофилов (pANCA). Аутоиммунный гепатит I типа чаще развивается в возрасте от 10 до 20 лет и после 50 лет. Характеризуется хорошим откликом на иммуносупрессивную терапию, возможностью достижения стойкой ремиссии в 20% случаев даже после отмены кортикостероидов. При отсутствии лечения в течение 3 лет формируется цирроз печени.
- II тип. В крови у 100% пациентов присутствуют антитела к микросомам печени и почек 1-го типа (анти-LKM-l). Данная форма заболевания развивается в 10-15% случаях аутоиммунного гепатита, преимущественно в детском возрасте и характеризуется высокой биохимической активностью. Аутоиммунный гепатит II типа более резистентен к иммуносупрессии; при отмене препаратов часто наступает рецидив; цирроз печени развивается в 2 раза чаще, чем при аутоиммунном гепатите I типа.
- III тип. Образуются антитела к растворимому печеночному и печеночио-панкреатическому антигену (анти-SLA и анти-LP). Довольно часто при этом типе выявляются ASMA, ревматоидный фактор, антимитохондриальные антитела (АМА), антитела к антигенам печеночной мембраны (антиLMA).
К вариантам атипичного аутоиммунного гепатита относят перекрестные синдромы, включающие также признаки первичного билиарного цирроза, первичного склерозирующего холангита, хронического вирусного гепатита.
Симптомы аутоиммунного гепатита
В большинстве случаев патология манифестирует внезапно и в клинических проявлениях не отличается от острого гепатита. Вначале протекает с выраженной слабостью, отсутствием аппетита, интенсивной желтухой, появлением темной мочи. Затем в течение нескольких месяцев разворачивается клиника аутоиммунного гепатита. Реже начало заболевания постепенное; в этом случае преобладают астеновегетативные расстройства, недомогание, тяжесть и боли в правом подреберье, незначительная желтуха. У части пациентов аутоиммунный гепатит начинается с лихорадки и внепеченочных проявлений.
Период развернутых симптомов аутоиммунного гепатита включает выраженную слабость, чувство тяжести и боли в правом подреберье, тошноту, кожный зуд, лимфаденопатию. Для аутоиммунного гепатита характерны непостоянная, усиливающаяся в периоды обострений желтуха, увеличение печени (гепатомегалия) и селезенки (спленомегалия). У трети женщин при аутоиммунном гепатите развивается аменорея, гирсутизм; у мальчиков может наблюдаться гинекомастия. Типичны кожные реакции: капиллярит, пальмарная и волчаночноподобная эритема, пурпура, акне, телеангиэктазии на коже лица, шеи и рук. В периоды обострений аутоиммунного гепатита могу наблюдаться явления преходящего асцита.
К системным проявлениям аутоиммунного гепатита относится рецидивирующий мигрирующий полиартрит, затрагивающий крупные суставы, но не приводящий к их деформации. Достаточно часто аутоиммунный гепатит протекает в сочетании с язвенным колитом, миокардитом, плевритом, перикардитом, гломерулонефритом, тиреоидитом, витилиго, инсулинозависимым сахарным диабетом, иридоциклитом, синдромом Шегрена, синдромом Кушинга, фиброзирующим альвеолитом, гемолитической анемией.
Диагностика
Аутоиммунный гепатит диагностируется в ходе консультации гепатолога или гастроэнтеролога. Критериями патологии служат серологические, биохимические и гистологические маркеры. Согласно международным критериям, об аутоиммунном гепатите можно говорить в случае, если:
- в анамнезе отсутствуют гемотрансфузии, прием гепатотоксичных препаратов, злоупотребление алкоголем;
- в крови не обнаруживаются маркеры активной вирусной инфекции (гепатитов А, В, С и др.);
- уровень γ-глобулинов и IgG превышает нормальные показатели в 1,5 и более раза;
- значительно повышена активность АсТ, АлТ;
- титры антител (SMA, ANA и LKM-1) для взрослых выше 1:80; для детей выше 1: 20.
Биопсия печени с морфологическим исследованием образца тканей позволяет выявить картину хронического гепатита с признаками выраженной активности. Гистологическими признаками аутоиммунного гепатита служат мостовидные или ступенчатые некрозы паренхимы, лимфоидная инфильтрация с обилием плазматических клеток. Инструментальные исследования (УЗИ печени, МРТ печени и др.) при аутоиммунном гепатите не имеют самостоятельного диагностического значения.
Лечение аутоиммунного гепатита
Патогенетическая терапия заболевания заключается в проведении иммуносупрессивной терапии глюкокортикостероидами. Такой подход позволяет снизить активность патологических процессов в печени: повысить активность Т-супрессоров, уменьшить интенсивность аутоиммунных реакций, разрушающих гепатоциты.
Обычно иммуносупрессивная терапия при аутоиммунном гепатите проводится преднизолоном или метилпреднизолоном в начальной суточной дозе 60 мг (1-ю неделю), 40 мг (2-ю неделю), 30 мг (3-4-ю недели) со снижением до 20 мг в качестве поддерживающей дозы. Уменьшение суточной дозировки проводят медленно, учитывая активность клинического течения и уровень сывороточных маркеров. Поддерживающую дозу пациент должен принимать до полной нормализации клинико-лабораторных и гистологических показателей. Лечение аутоиммунного гепатита может продолжаться от 6 месяцев до 2-х лет, а иногда и на протяжении всей жизни.
При неэффективности монотерапии возможно введение в схему лечения аутоиммунного гепатита азатиоприна, хлорохина, циклоспорина. В случае неэффективности иммуносупрессивного лечения аутоиммунного гепатита в течение 4-х лет, множественных рецидивах, побочных эффектах терапии ставится вопрос и трансплантации печени.
Прогноз и профилактика
При отсутствии лечения аутоиммунного гепатита заболевание неуклонно прогрессирует; спонтанные ремиссии не наступают. Исходом аутоиммунного гепатита служит цирроз печени и печеночная недостаточность; 5-летняя выживаемость не превышает 50%. С помощью своевременной и четко проводимой терапии удается достичь ремиссии у большинства пациентов; при этом выживаемость в течение 20 лет составляет более 80%. Трансплантация печени дает результаты, сопоставимые с лекарственно достигнутой ремиссией, 5-летний прогноз благоприятен у 90% пациентов.
При аутоиммунном гепатите возможна лишь вторичная профилактика, включающая регулярное наблюдение гастроэнтеролога (гепатолога), контроль активности печеночных ферментов, содержания γ-глобулинов, аутоантител для своевременного усиления или возобновления терапии. Пациентам с аутоиммунным гепатитом рекомендуется щадящий режим с ограничением эмоциональных и физических нагрузок, соблюдение диеты, отвод от профилактической вакцинации, ограничение приема лекарственных препаратов.

Роль печени в работе организма трудно переоценить. Она участвует в пищеварении, детоксикации организма и других процессах. Это орган, который способен самостоятельно восстанавливаться, но для поддержания его здоровья важно включить в рацион определенные продукты. Врач-иммунолог, специалист по питанию Алена Парецкая расскажет о 12 самых полезных продуктах, которые нужно включать в рацион.
№1. Кофе
Кофе – спорный продукт. В исследовании, опубликованном в 2013 году, было доказано, что ежедневное употребление кофе снижает риск развития хронических заболеваний печени и их обострений. В первую очередь, речь идет о жировой болезни печени и онкопатологиях.
В другом исследовании ученые обозначили механизм этого положительного влияния на печень: основной механизм – это влияние на ферменты печени и предотвращение накопления жира в ее тканях. Еще один механизм – действие антиоксидантов на печень, укрепляющих ее защитные свойства и противостоящие онкопатологиям. Но важно отметить, что речь идет о регулярном, но умеренном употреблении кофе.
№2. Овсянка
Это источник полезной клетчатки, которая участвует в пищеварении и поддерживает его. Известно, что клетчатка овсянки полезна для печени, ведь в ней содержатся бета-глюканы.
Одно из исследований показало, что эти вещества активируют иммунную систему, подавляют воспаление, а также помогают контролировать диабет и предотвращают ожирение.
В другом исследовании, проведенном на грызунах, отмечается, что бета-глюканы помогает уменьшить количество жира, которые хранятся в печени. Однако чтобы говорить о пользе для человека, необходимы дополнительные клинические исследования.
Добавьте в рацион овсяные хлопья, которые требуют варки. Продукты быстрого приготовления, с содержанием сахара и прочих ингредиентов не приносят особой пользы для организма.
№3. Зеленый чай
Одно из исследований предположило, что зеленый чай снижает риск рака печени. Однако исследование было проведено в малочисленной группе участников. Поэтому для однозначных заверений и утверждений, необходимы дополнительные исследования.
№4. Чеснок
Чеснок стимулирует работу печени. Ряд исследований, проведенных в 2016 году, показывает, что чеснок помогает снизить массу тела и предотвратить набор лишнего веса и ожирение, что, в свою очередь, можно рассматривать как предрасполагающий фактор для развития жировой болезни печени.
№5. Ягоды
Черника, малина, клюква содержат большое количество антиоксидантов – полифенолов, защищающих печень от повреждений. Учитывая большое содержание витаминов, минералов и прочих веществ известна польза ягод для поддержания работы иммунитета.
№6. Виноград
В винограде и его косточках содержатся антиоксиданты, которые положительным образом отражаются на здоровье и работе организма и печени в частности. Известно, что регулярное употребление винограда помогает контролировать воспалительные реакции и предотвращать повреждение печени.
Специалисты рекомендуют включать в рацион свежий виноград, а также качественный сок, который оказывается полезным.
№7. Грейпфрут
Это весьма полезный продукт, содержащий несколько групп антиоксидантов, которые помогают защищать печень от повреждений, стимулируя восстановление и регенерацию клеток.
Соединения, содержащиеся в этом фрукте, уменьшают накопление жира в печени, а также стимулируют работу ферментов, которые стимулируют похудение и снижают риск развития жировой болезни печени.
№8. Растительная пища
Все разнообразие овощей и фруктов можно рассматривать как полезную пищу для здоровья печени. В обзоре 2015 года был опубликован перечень растительных продуктов, полезных для печени:
- авокадо;
- бананы;
- свекла;
- брокколи;
- коричневый рис;
- морковь;
- лимоны;
- листовые овощи и зелень;
- арбузы.
№9. Жирные сорта рыбы
Жирный сорта рыбы – основной источник Омега-3 кислот, которые контролируют воспалительные реакции в организме и участвуют в обменных процессах. Эта группа жиров положительна для полноценной работы печени и профилактики многочисленных заболеваний. Их главная роль – накопление лишних жиров и поддержание нормального уровня ферментов в печени.
Согласно рекомендациям врачей, есть жирную рыбу нужно 2 и более раз в неделю. Для тех людей, которые по каким-либо причинам не могут включать в рацион жирные сорта рыбы, рекомендовано принимать добавки с рыбьим жиром.
№10. Орехи
Включение в рацион орехов – простой и действенный способ поддержать здоровье печени и защитить ее от многочисленных болезней. В их составе большое количество ненасыщенных жирных кислот, витаминов и антиоксидантов.
В рацион рекомендовано включать грецкие орехи, миндаль, которые помогут сохранить здоровье печени. Но стоит помнить, что чрезмерное употребление орехов может оказаться вредным, ведь они высококалорийны.
№11. Оливковое масло
Включение в рацион оливкового масла без термической обработки помогает снизить окислительный стресс и улучшить функцию печени. Объяснить такое положительное влияние можно большим содержанием ненасыщенных жирных кислот.
Какие продукты вредны для печени
Общие рекомендации специалистов однозначны – сбалансированное питание, содержащее все необходимые минералы, витамины и прочие вещества помогают поддерживать здоровье печени. Тем не менее есть продукты, которые могут негативно повлиять на работу печени и их необходимо ограничивать в рационе:
1. Жирное
В эту группу продуктов можно отнести: жареное, фастфуд, полуфабрикаты, снеки и прочие закуски.
2. Крахмалистые продукты
В эту группу можно отнести: хлеб, макаронные изделия, сладкая и сдобная выпечка.
3. Сахар
Чрезмерное употребление сладостей нагружает печень, поэтому целесообразно снизить эту нагрузку.
4. Соль
Это основной источник натрия и калия, которые необходимы для нормальной работы организма. Однако чрезмерное употребление соли также оказывается вредным. Консервы, копчености и соленья содержат большое количество соли.
5. Алкоголь
Пожалуй, это самый вредный продукт для печени. И каждому важно подумать об ограничении и умеренном употреблении алкоголя.
Печень – уникальный орган, отвечающий за множество обменных процессов и защитных реакций. Ее клетки способны к регенерации и восстановлению, однако хроническое патологическое воздействие приводит к болезням, со всеми вытекающими последствиями.
Поддержать здоровье печени, особенно при наличии факторов риска и предрасположенности к болезням можно путем составления правильного рациона.
Читайте также:

