Лечение преднизолоном при вирусном гепатите в
Обновлено: 23.04.2024
М.И. МИХАЙЛОВ, член-корреспондент РАЕН, профессор, руководитель лаборатории.
В соавторстве с Т.А. СЕМЕНЕНКО. Гепатит В - широко распространенная вирусная инфекция, в клинически выраженных случаях характеризуется симптомами острого поражения печени и интоксикации, отличается многообразием клинических проявлений и исходов заболевания (выздоровление, развитие хронического гепатита, цирроза и рака печени).
Для исследователя, занимающегося вирусными инфекциями человека, гепатит В представляет особый интерес. Отвечая на вопрос, почему это так, можно привести следующие основные доводы:
- вирус гепатита В (HBV) - самый изменчивый ДНК-содержащий вирус;
- разнообразие антигенов вируса и антител к ним позволяет проводить диагностику, предсказание характера течения и исходов заболевания и профилактику постгрансфузионного гепатита, при этом требуя новых, наиболее информативных тестов индикации;
- множественность путей передачи возбудителя, определяющих его глобальное, но неравномерное распространение, что вызывает повышенный интерес эпидемиологов;
- существующие параллели между гепатитом В и ВИЧ-инфекцией делают правомерным определение, сформулированное как "гепатит В - кузина ВИЧ", заставляя организаторов здравоохранения разрабатывать новые подходы в работе;
- HBV - этиологический агент первичного рака печени.
Кроме того, наличие эффективной вакцины против гепатита В и ее применение позволяют получить удовлетворение от работы, реально ощущая воможность защиты людей от этой страшной инфекции.
Вирус, его размножение и мутантные формы
HBV - основной представитель семейства гепаднавирусов, от "hepar" - печень; "dna" - ДНК. Помимо вируса гепатита В человека в это семейство входят вирусы гепатита сурков, земляных белок, сусликов, пекинских уток и других животных. Объединяющие характеристики этих вирусов: сходное строение; циркулярная дезоксирибонуклеиновая кислота (ДНК); общая стратегия размножения вируса; преимущественное размножение в клетках печени; возможность длительной (иногда пожизненной) циркуляции вируса в организме; взаимосвязь с развитием первичного рака печени.
Частицы вируса гепатита В представляют собой сферические частицы размером 42 нм, имеющие ядро и оболочку, состоящую из поверхностного антигена вируса гепатита В (HBsAg). Информация о вирусных антигенах и белках, необходимых для его существования, заключена в небольшой (всего 3200 нуклеотидов) двуцепочечной кольцевой молекуле ДНК. В ней выделяют 4 гена - несущих информацию о HBsAg (S-ген); ядерном антигене - НВсАд (С-ген), ферменте ДНК - полимеразе (Р-ген) и Х-белке (Х-ген).
Заражение гепатитом В происходит при непосредственном попадании вируса в кровь, через слизистые оболочки или поврежденные кожные покровы. Считается, что любой человек, не имеющий антител к HBsAg, может заболеть гепатитом В. Чрезвычайно высокая инфекционность вируса (некоторые образцы сывороток крови с наличием HBV могут вызвать заболевания в разведениях 10 -7 - 10 -8 и устойчивость к различным физико-химическим воздействиям определяют широкое распространение гепатита В. Достигая по кровеносным сосудам клеток печени, вирус адсорбируется на их поверхности. Изучение механизма адсорбции и проникновения в клетку позволило выявить несколько специфических рецепторов на HBsAg и гепатоците. Помимо рецепторов, информация о которых заложена непосредственно в ДНК вируса (Pre-S1 и Pre-S2), в процессе адсорбции принимает участие печеночный белок аннексии V. В последние два года определено, что процесс адсорбции и проникновения вируса гепатита В представляет собой сложный механизм, вовлекающий несколько клеточных белков. Кроме того, установлено, что размножение вируса гепатита В может происходить не только в гепатоцитах, но и в других клетках организма человека: клетках крови, селезенки, поджелудочной железы и др.
Из всех известных ДНК-содержащих вирусов человека вирус гепатита В имеет самый сложный цикл размножения. Для того, чтобы получить новые вирусные частицы, репликация ДНК включает в себя дополнительный этап, когда с ДНК синтезируется РНК и лишь только с нее считывается информация о ДНК-HBV. Этот дополнительный этап репликации, не свойственный для других ДНК-содержащих вирусов, приводит к возможному появлению мутантных форм вируса гепатита В.
Изучение изолятов вируса гепатита В, выявленных в различных регионах мира, позволило установить наличие 6 основных генотипов, обозначенных А, В, С, D, Е и F. Определено, что HBV генотип F чаще выявляется у больных с тяжелым течением заболевания. В последние годы интерес исследователей вируса гепатита В был сконцентрирован на мутантной форме, обозначенный как Pre Core мутант вируса гепатита В. Установлено, что эта мутация возникает из-за замены одной аминокислоты (гуанин) на другую (аденин) в участке С-гена. У носителей вируса это приводит к прекращению синтеза НВеАg, атаке иммунных клеток на пораженные клетки и ухудшению самочувствия пациента. В подавляющем большинстве случаев эти больные плохо поддаются лечению препаратами интерферона. Всесте с тем продемонстрировано, что применяемые вакцины против гепатита В защищают человека от заражения различными генотипами и Pre Core мутантом вируса гепатита В.
Более тяжелому течению острого гепатита В способствуют следующие факторы: сопутствующие заболевания, такие, как сахарный диабет, язвенная болезнь, системные заболевания крови, прием наркотиков, тяжелые физические нагрузки и др.
Заражение вирусом гепатита В приводит к развитию инфекции с острым или хроническим течением заболевания. Причем инфекция может протекать как в желтушной, так и безжелтушной форме, их соотношение 1:6 - 1:8. Считается, что поражение гепатоцитов в основном связано не с непосредственным действием вируса, а с иммунопатологическими процессами. Так, механизм разрушения гепатоцитов в самых общих чертах может быть описан следующим образом: попав в кровь, вирус вызывает активацию В- и Т-клеточного звена иммунитета человека. Т-киллеры взаимодействуют с антигенами вируса гепатита В и антигенами главного комплекса гистосовместимости, представленными на поверхности печеночной клетки, вызывая разрушение гепатоцитов.
Кроме этого, значительную роль в развитии патологического процесса гепатита В играют аутоиммунные реакции, т.е. реакции на собственные компоненты гепатоцитов (полиальбумин, липополипротеид, фрагменты мембран митохондрий и др.). При этом происходит разрушение не только зараженных, но и незараженных гепатоцитов. В данном случае HBV играет пусковую роль в развитии аутоиммунного компонента гепатита В. Определенную роль имеют и циркулирующие иммунные комплексы HBsAg с антителами к нему. Считается, что эти комплексы определяют внепеченочные поражения при гепатите В, такие, как гломерулонефрит, узелковый периартериит и др.
Гепатит В может иметь легкое, средне-тяжелое и тежелое течение заболевания, включая фульминантный гепатит, который в большинстве случаев заканчивается смертью больного. Летальность при гепатите В составляет 0,4-1%. Более тяжелому течению острого гепатита В способствуют следующие факторы: сопутствующие заболевания, такие, как сахарный диабет, язвенная болезнь, системные заболевания крови, прием наркотиков, тяжелые физические нагрузки и др. К утяжелению инфекции приводит одновременное заражение вирусами гепатитов А, С и D. Так, например, известно, что острый гепатит С в подавляющем большинстве случаев имеет легкое течение, однако при сочетании с гепатитом В он протекает тяжело, иногда с летальным исходом.
Особенностью гепатита В является возможное развитие хронического гепатита В, который регистрируется в 5-10% случаев, при этом, очевидно, большая часть из них ассоциирована с присоединением дельта вирусной инфекции. Причины развития хронического процесса окончательно не установлены. Считается, что прежде всего это может быть связано с наличием у больного нарушений в клеточном звене иммунитета и с низкой продукцией эндогенно синтезированного интерферона. При гепатите В существует общая закономерность - чем в более раннем возрасте человек инфицируется вирусом, тем больше вероятность развития хронического гепатита. Так, при перинатальном инфицировании новорожденных, чьи матери помимо HBsAg имели НВеАg, хронический гепатит формируется в 80-90% случаев. У 15-20% больных хроническим гепатитом В происходит постепенное (5-20 лет) прогрессирование в цирроз, а у части из них - в первичный рак печени.
Гепатит В - "кузина СПИД"
Пaраллели между этими заболеваниями очень велики. Наличие вируса специфического фермента - ДНК-полимеразы, обладающей функцией обратной транскриптазы, позволяет называть вирус гепатита В как скрытый ретровирус. Обращает на себя внимание общность многих эпидемиологических характеристик СПИДа и гепатита В. Они касаются, в первую очередь, способов передачи заразного начала при обеих инфекциях: половой контакт, контаминированные вирусами инструменты при парентеральных манипуляциях, контаминированная кровь и ее продукты; передача от матери плоду или новорожденному. Соответственно, СПИД и гепатит В имеют общие группы риска. В случаях заражения гепатитом В лиц, инфицированных ВИЧ, инфекция быстро переходит в активную форму.
Первичный рак печени
Исследования, проведенные в различных странах мира, выявили, что около 80% всех случаев первичного рака печени связано с вирусом гепатита В. Наиболее часто он возникает у лиц старше 40-50 лет, страдающих циррозом печени. Вместе с тем необходимо отметить тенденцию к более частой регистрации первичного рака печени среди лиц молодого возраста.
Теоретически предполагают несколько путей реализации онкогенного действия HBV. Это возможное наличие в ДНК HBV нуклеиновых последовательностей с онкогенной функцией, так называемых онкогенов. Обнаружение белков, кодированных Х-геном HBV, в крови больных с первичным раком печени косвенно свидетельствует о роли этого антигена в развитии рака. Кроме того, предполагают, что HBV имеет свойство биологического мутaгена, приводящего к развитию этой опухоли печени. Взаимосвязь вируса гепатита В и первичного рака печени позволила предположить, что вакцинация против гепатита В снизит заболеваемость и первичным раком печени.
Бессимптомное носительство вируса
О носительстве HBV судят по обнаружению HBsAg в течение более шести месяцев при отсутствии клинических, морфологических и биохимических признаков гепатита. В настоящее время носительство HBV однозначно рассматривается как патологическое состояние организма. Длительный синтез HBsAg, в ряде случаев в течение всей жизни, связан с интеграцией ДНК HBV в геном гепатоцитов. Впервые гипотеза об интегративной природе носительства HBV высказана В.М. Ждановым и С. Хиршманом в конце 70-х годов, в дальнейшем она была экспериментально подтверждена. Носители HBsAg составляют основной резервуар вируса гепатита В. В настоящее время на земном шаре проживает более 300 млн бессимптомных носителей вируса, из них около 5 млн - в нашей стране. Многочисленные исследования продемонстрировали повсеместное, но неравномерное распространение носительства HBsAg. В России частота выявления колеблется от 1,5% в европейской части страны до 4-5% в Якутии и на Дальнем Востоке.
Состояние носительства может длиться до 10 лет и более. Ежегодно 1-2% носителей HBsAg спонтанно эллиминирует антиген. Причины и механизмы этого явления до сих пор не выяснены. В настоящее время отсутствуют эффективные методы и средства, способные исключить из гепатоцита интегрированный геном ДНК HBV.
Вакцины против гепатита В
Будесонид является глюкокортикостероидом 2-го поколения с высоким сродством к глюкокортикоидным рецепторам и минимальным системным действием. Он рассматривается как перспективный агент в терапии аутоиммунного гепатита, в особенности у пациентов с побочным
Budisonide is a 2nd generation glucocorticosteroid with high affinity to glucocorticoid receptors and minimum systemic effect. It is considered as a promising agent in therapy of autoimmune hepatitis, in particular, in patients with side effects for prednisolone.
Эффективное лечение аутоиммунного гепатита (АИГ), основанное на комбинации преднизолона с азатиоприном, было разработано почти полвека назад [1] и привело к существенному увеличению продолжительности жизни больных, которая в настоящее время сравнялась с популяционной [2].
В то же время не утихают дискуссии по поводу применения других, альтернативных схем терапии. Это обусловлено тем, что терапия АИГ является продолжительной: согласно недавним рекомендациям Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) она назначается на 3 года или по меньшей мере на 2 года после полной нормализации лабораторных показателей [3]. Кроме того, лечение часто является пожизненным, поскольку в достаточно небольшом проценте случаев удается достичь безмедикаментозного сохранения ремиссии. В то же время существующие режимы терапии, включающие преднизолон, приводят к большому количеству побочных эффектов, обусловленных его системным действием [3].
К сожалению, вероятно в связи с хорошей эффективностью существующей терапии, фактически не проводилось рандомизированных клинических исследований (РКИ) по применению альтернативных иммуносупрессоров при АИГ. Их действие подтверждается преимущественно описанием серий случаев и открытыми исследованиями. Исключение составляет будесонид, по применению которого существуют не только наблюдательные данные, но и результаты мультицентрового РКИ [4]. Будесонид является глюкокортикостероидом (ГКС) 2-го поколения, сродство которого к глюкокортикоидным рецепторам в 15–20 раз выше, чем у преднизолона. Кроме того, при пероральном приеме 90% его метаболизируются в печени при ее первом прохождении [4].
В проведенном M. P. Manns c соавт. в 2010 г. многоцентровом проспективном двойном слепом активно контролируемом РКИ назначение будесонида (в дозе 9 мг/сут) в комбинации с азатиоприном достоверно чаще (в 60,0% против 38,8% случаев) позволяло достичь биохимической ремиссии АИГ через 6 месяцев лечения, чем стандартная терапия преднизолоном (40 мг с последующим снижением до 10 мг) и азатиоприном. При этом системные побочные эффекты отсутствовали у 72,0% пациентов (в сравнении с 46,6% получавших преднизолон). В дальнейшем все пациенты принимали будесонид в открытом режиме. Среди пациентов, которые первоначально получали преднизолон, стероидные побочные эффекты снизились с 44,8% до 26,4% [5]. Недостатками работы M. P. Manns c соавт. является отсутствие гистологической верификации ремиссии и оценки отдаленных результатов. Но на основании полученных данных авторы сделали вывод о большей эффективности будесонида по сравнению с преднизолоном при АИГ. Этот тезис подвергался определенной критике с точки зрения эквивалентности сравниваемых доз. Существуют противоположные данные, что у части больных будесонид является менее эффективным в достижении ремиссии по сравнению с преднизолоном [6], это может быть обусловлено отсутствием возможности наращивания дозы и мальабсорбцией перорального препарата.
Однако исследование M. P. Manns c соавт. однозначно доказало следующее:
а) будесонид может использоваться при индукции ремиссии АИГ;
б) будесонид реже приводит к системным побочным эффектам, чем преднизолон;
в) пациенты, достигшие ремиссии путем назначения преднизолона, для снижения побочных эффектов ГКС могут быть переведены на терапию будесонидом с сохранением ремиссии.
Эти результаты способствовали более частому назначению будесонида при АИГ в ряде стран. Так, по данным израильского эпидемиологического исследования [7] будесонид (в качестве монотерапии или в комбинации с азатиоприном) получают 16% пациентов с установленным диагнозом АИГ. Показано, что будесонид может безопасно и эффективно применяться для индукции и поддержания ремиссии не только у взрослых, но и у детей [6].
Ограничением к применению будесонида при АИГ является стадия цирроза печени, так как в этом случае наличие портокавальных шунтов увеличивает системную концентрацию препарата, и, кроме того, растет риск тромбозов, в особенности в зоне портального кровотока [8–10].
Широкому применению будесонида при лечении АИГ препятствует ограниченное количество данных по долговременному применению препарата (возможность продолжительного поддержания ремиссии) и оптимальному варианту снижения дозы. Однако в последние годы ряд гепатологических ассоциаций выпустили рекомендации по лечению АИГ, включающие применение схем с будесонидом.
Отдельную проблему составляет лечение так называемых перекрестных (или вариантных) синдромов, наиболее распространенным из которых является комбинация АИГ и первичного билиарного цирроза (АИГ/ПБЦ).
Следует отметить, что согласно мнению части экспертов Европейской ассоциации по изучению печени [14] неконтролируемое течение ПБЦ само по себе является показанием для назначения будесонида. Этот тезис повторен в отечественных рекомендациях по лечению холестатических заболеваний, согласно которым у пациентов на доцирротических стадиях заболевания с субоптимальным биохимическим ответом на терапию урсодезоксихолевой кислотой (УДХК) предлагается использовать комбинацию ее с будесонидом (6–9 мг/день) [15]. Положительный эффект будесонида на течение ПБЦ при назначении на I-II cтадиях заболевания был показан в ряде проспективных исследований, в том числе в 3-летнем открытом РКИ H. Rautiainen с соавт. (2005) и 2-летнем двойном слепом РКИ M. Leuschner с соавт. (1999), где его назначение в сочетании с УДХК приводило к улучшению гистологической картины [16–17].
При лечении перекрестного синдрома АИГ/ПБЦ ведущие ассоциации и рабочие группы [3, 14] предлагают применять комбинацию УДХК и ГКС. Ранее обсуждалось назначение в этих случаях монотерапии УДХК, с последующим присоединением ГКС при неэффективности монотерапии [18]. Недавние рекомендации Европейской ассоциации по изучению печени подчеркивают обязательность иммуносупрессивной терапии, а при преобладании признаков АИГ рекомендуют начинать с иммуносупрессоров с последующим добавлением УДХК [3]. Проблема выработки однозначных рекомендаций по лечению АИГ/ПБЦ также связана с отсутствием клинических исследований с хорошим дизайном. В то же время применение преднизолона при ПБЦ приводит к резкому снижению минеральной плотности костной ткани, а также повышает риск развития других неблагоприятных явлений [19]. В этой ситуации предпочтительным может являться назначение будесонида.
Позволим представить собственный опыт применения будесонида при АИГ.
Материалы и методы исследования
Ответ на терапию при АИГ оценивался как ремиссия, или неэффективное лечение, или неполный ответ [13]. Дополнительно выделялись полная (нормализация аланиновой (АЛТ) и аспаргиновой (АСТ) аминотрансфераз, а также IgG) и неполная ремиссия (снижение АСТ и АЛТ до уровня, менее чем в 2 раза превышающего верхний предел референтных значений, либо нормализация АЛТ и АСТ без полной нормализации IgG) [25]. Ответ на терапию при АИГ/ПБЦ рассматривался согласно критериям ответа на АИГ, а также парижским и барселонским критериям ответа на УДХК [26, 27].
Результаты и обсуждение
Ретроспективный анализ выявил следующие показания к назначению будесонида:
В 17 случаях будесонид назначался для индукции ремиссии АИГ у первичных пациентов либо у пациентов, имевших рецидив заболевания на фоне отмены терапии или снижения доз ГКС. У 7 пациентов будесонид использовался для поддержания ремиссии после стандартного индукционного курса преднизолона (с достижением критериев полной либо неполной лабораторной ремиссии).
При АИГ в 5 случаях использовалась монотерапия будесонидом в дозе 9 мг (у этих пациентов имелись противопоказания к назначению азатиоприна — цитопения), а в 6 случаях назначалась комбинация будесонида 9 мг/сут и азатиоприна 50–100 мг/сут. При АИГ/ПБЦ в 9 случаях использовалось сочетание будесонида 9 мг/сут с УДХК (13–15 мг/кг/сут), а 4-м пациентам также назначался азатиоприн 50 мг/сут. Средняя продолжительность терапии на момент проведения анализа составила 20,3 ± 11,1 месяца (максимальная продолжительность — 36 месяцев). Результаты лечения представлены в табл.
У 15 пациентов (88,2% случаев) терапия будесонидом (в сочетании с азатиоприном и без него) позволила обеспечить ремиссию АИГ в течение первого года лечения. При этом достижение ремиссии наблюдалось в среднем через 8,3 ± 3,4 месяца от начала терапии. Побочных эффектов от приема будесонида в данной группе не отмечалось. В дальнейшем этим пациентам была продолжена поддерживающая терапия будесонидом с устойчивым сохранением ремиссии. У 10 пациентов при этом через год от начала лечения доза будесонида была снижена до 6 мг/сут.
Отсутствие клинико-лабораторного улучшения отмечалось у одного пациента с АИГ и одного с АИГ/ПБЦ. Была произведена замена будесонида на преднизолон в стандартной дозе, что также не привело к улучшению лабораторных показателей. У пациентки с АИГ/ПБЦ неполная лабораторная ремиссия позже была достигнута назначением метотрексата.
В результате у 4 пациентов весь период наблюдения сохранялась полная/неполная ремиссия, в том числе при дальнейшем снижении суточной дозы будесонида до 6 мг, а уровень лабораторных показателей соответствовал ранее наблюдавшемуся на терапии преднизолоном. У 3 пациентов ремиссия сохранялась при приеме будесонида в дозе 9 мг/сут, а рецидив АИГ возник после снижения до 3 мг/сут (1 пациент) и 6 мг/сут (2 пациента). Срок возникновения рецидива после изменения дозы составлял от 4 до 13 месяцев.
В настоящее время целью лечения АИГ является достижение ремиссии и последующее ее сохранение на минимальной поддерживающей дозе иммуносупрессоров [3]. Наши данные показывают высокую эффективность будесонида в индукции и поддержании ремиссии при АИГ и его вариантной форме и совпадают с результатами других авторов [4, 28–30]. При этом частота достижения ремиссии при ее индукции будесонидом соответствовала данным, приводимым для системных ГКС [3] при минимуме побочных эффектов. В случаях неэффективности будесонида в дальнейшем при лечении преднизолоном также наблюдалась гормонорезистентность.
При терапии АИГ/ПБЦ комбинацией УДХК с будесонидом (+/- азатиоприн) у всех пациентов наблюдалось улучшение лабораторного профиля, а ремиссия АИГ была достигнута в 77,8% случаев.
Будесонид был эффективен и при поддержании ремиссии, индуцированной ранее преднизолоном. Важно, что отдельные больные в нашем исследовании получали терапию будесонидом в течение 3 лет с сохранением его эффективности, что свидетельствует о возможности его длительного применения. В то же время при снижении поддерживающей дозы у 3 пациентов наблюдался рецидив заболевания. Именно вопросы снижения дозы при терапии будесонидом являются наименее разработанными и, несомненно, требуют проведения клинических исследований для выработки оптимальной тактики.
По нашему мнению, будесонид следует активно использовать в лечении АИГ и его вариантных форм у нецирротических больных без выраженных системных проявлений заболевания, особенно в группах риска развития стероидных осложнений.
Выводы
Будесонид является эффективным препаратом для индукции и поддержания ремиссии при АИГ, а также он может быть успешно использован в терапии АИГ/ПБЦ.
Литература
К. Л. Райхельсон* , 1 , доктор медицинских наук, профессор
М. К. Прашнова*
Н. В. Марченко*, кандидат медицинских наук
С. Н. Мехтиев**, доктор медицинских наук, профессор
Е. Н. Зиновьева***, кандидат медицинских наук
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
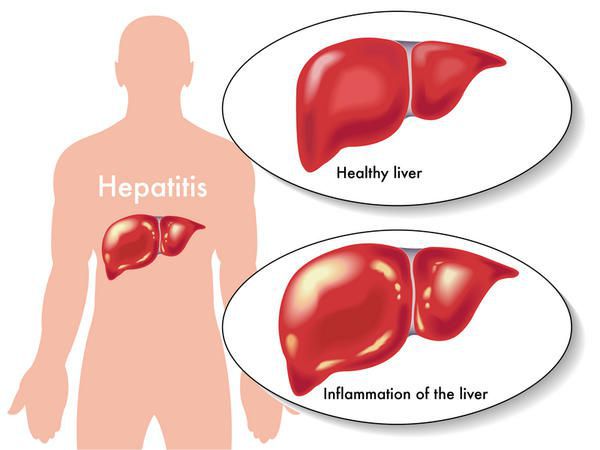
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
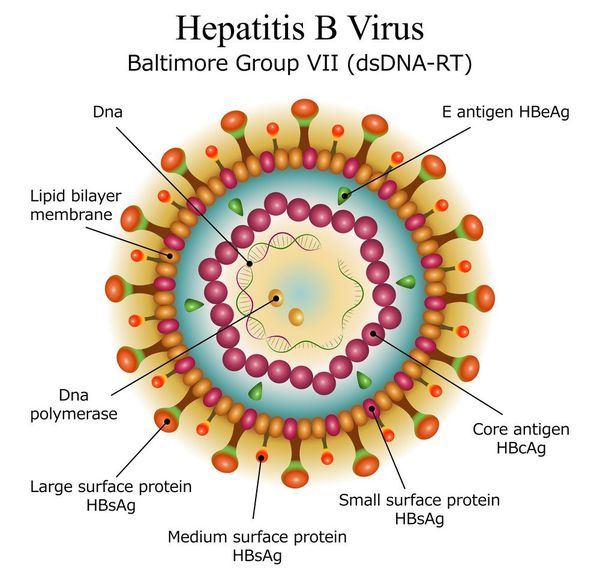
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
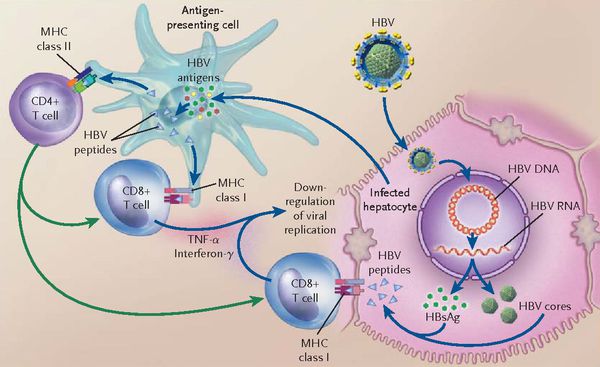
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Статья посвящена одной из ключевых проблем современной гепатологии - лечению хронических гепатитов. Применение этиотропной терапии хронических вирусных гепатитов позволило останавливать прогрессирование заболевания у значительного числа больных, а в ряде случаев добиться полного излечения. Прогресс в изучении других форм хронических гепатитов не столь заметен, однако разработка новых лекарственных препаратов и схем терапии, отказ от малоэффективных методов лечения дали возможность достижения во многих случаях выздоровления или стойкой ремиссии.
The paper deals with a key problem of modern hepatology, namely, the treatment of chronic hepatitis. The use of etiotropic therapy for chronic viral hepatitis has abolished the disease progression in most patients and, in some cases, led to a complete recovery. The advances made in studying other forms of chronic hepatitis is not so obvious; however, the design of new drugs and treatment regimens, the refusal of applying ineffective treatment hawe allowed many patients to recover or be at a complete remission.
А.О. Буеверов
Московская Медицинская Академия им. И.М. Сеченова, кафедра пропедевтики внутренних болезней
A.O. Buyeverov
Department of Internal Propedeutics, I.M. Sechenov Moscow Medical Academy
П роблема лечения хронических гепатитов, учитывая широкую распространенность и прогрессирующее течение многих форм этой группы заболеваний, является одной из ключевых в современной гепатологии. Последнее десятилетие по праву можно назвать революционным, рассматривая его с точки зрения развития учения о вирусной патологии печени.
Прогресс в изучении других форм хронических гепатитов не столь заметен, однако разработка новых лекарственных препаратов и схем терапии, отказ от малоэффективных методов лечения дали возможность достижения во многих случаях выздоровления или стойкой ремиссии.
Вирусные гепатиты
В настоящее время установлена возможность хронизации четырех из 7 форм вирусных гепатитов - B, C, D и G. Единственным препаратом с доказанной эффективностью против гепатотропных вирусов является a- интерферон ( a- ИФН). По современным представлениям, клетки под влиянием a -ИФН приобретают "противовирусное состояние" в результате связывания его со специфическим клеточным рецептором, что приводит к активации внутриклеточных ферментов, в частности, 2',5'-олигоаденилатсинтетазы и так называемых эффекторных белков, выступающих в роли посредников действия ИФН. Это, в свою очередь, вызывает активацию внутриклеточных рибонуклеаз, разрушающих вирусную транспортную РНК. Кроме того, a -ИФН ингибирует процесс раздевания, трансляции и сборки вирусов в процессе репликации. В противовирусном эффекте также играют роль некоторые иммунные механизмы: усиление экспрессии антигенов HLA I класса на поверхности инфицированных клеток, стимуляция макрофагов, узнающих вирус-HLA-антигенный комплекс на клеточной мембране, усиление активности цитотоксических Т- и NK-лимфоцитов, что в итоге приводит к активации распознавания и уничтожения зараженных гепатоцитов.
В клинической практике применяются как лимфобластные (выделяемые из культуры человеческих В- и нулевых лимфобластов), так и рекомбинантные a- ИФН. Наиболее широко применяются рекомбинантные ИФН. Различий в клинической эффективности между лимфобластными и рекомбинантными ИФН не выявлено. В зависимости от вида вируса разработаны различные схемы применения a- ИФН. Препарат вводится подкожно или внутримышечно.
При применении a- ИФН наблюдаются разнообразные побочные эффекты: лихорадка, гриппоподобный синдром (у 90 - 100% в ответ на первые инъекции, впоследствии выраженность уменьшается), диспепсические явления, лейко- и тромбоцитопения, нормохромная анемия, выработка аутоантител, реже неврологические и психические расстройства (депрессия или раздражительность), алопеция, снижение либидо и др. В большинстве случаев их выраженность умеренная и не является основанием для отмены препарата; отмечается зависимость от суточной дозы и длительности лечения. При плохой переносимости лихорадки рекомендуется прием парацетамола. Следует заметить, что у ряда больных в первые недели терапии может развиться цитолитический криз, проявляющийся повышением трансаминаз и свидетельствующий о массивной гибели зараженных гепатоцитов. Данное явление свидетельствует о развитии эффекта ИФН и не требует коррекции терапии.
Показаниями к назначению a- ИФН является обнаружение в крови маркеров репликации вируса гепатита В (HBV): HBeAg, анти-HBc IgM, HBV ДНК, ДНК-полимеразы. HBV ДНК, определяемая методом полимеразной цепной реакции (ПЦР), служит наиболее чувствительным маркером, обнаруживаемым вне зависимости от мутаций в различных областях вирусного генома. Предвестниками хорошего ответа на терапию являются: молодой возраст, короткий анамнез заболевания, отсутствие цирроза, нормальный уровень g-глутамилтранспептидазы, низкий титр HBV ДНК, выраженный синдром цитолиза (АЛТ превышает норму более чем в 2 раза). До начала лечения желательно выполнение биопсии печени.
Наибольшее распространение получила следующая схема интерферонотерапии: 5 - 10 МЕ 3 раза в неделю в течение 4 - 6 месяцев. Первоначального ответа, характеризующегося нормализацией уровня трансаминаз, сероконверсией по HBeAg (исчезновение из сыворотки HBeAg и появление антител к нему) и элиминацией сывороточной HBV ДНК, а также улучшением гистологической картины печени, удается достигнуть у 40 - 50% больных. Стойкий ответ (отсутствие маркеров репликации вируса и признаков цитолиза через 6 и более месяцев после отмены препарата) сохраняется у 35 - 40%. У 10 - 15% на фоне лечения a- ИФН наблюдается исчезновение HBsAg, что в случае длительного сохранения можно рассматривать как выздоровление от HBV-инфекции. Если больной инфицирован вирусом - мутантом по precore области (проявляется отсутствием в крови HBeAg при наличии HBV ДНК) стойкий ответ достигается только у 20% за счет высокой частоты рецидивов. При возникновении рецидива рекомендуется проведение повторного курса a- ИФН, так как доказано, что его применение достоверно снижает риск формирования цирроза и гепатоцеллюлярной карциномы.
При низком исходном уровне трансаминаз для улучшения ответа на ИФН предложено проведение предварительного курса преднизолона по схеме: 2 недели 60 мг в сутки, 2 недели 40 мг, 2 недели 20 мг, 2 недели перерыв, после чего назначается a- ИФН. Преднизолон вызывает эффект "иммунного рикошета" и способствует активации вируса, повышая его чувствительность к ИФН.
В последние годы предпринимаются попытки лечения хронической HBV-инфекции новыми противовирусными препаратами - аналогами нуклеотидов ламивудином и фамцикловиром. Первые результаты свидетельствуют о быстром и выраженном, но нестойком эффекте. В стадии разработки находятся схемы их комбинации с a- ИФН.
a- ИФН назначается при выявлении в крови HCV РНК методом ПЦР. Прогнозирование ответа на терапию проводится по тем же параметрам, что и при гепатите В. Кроме того, придается значение генотипу вируса: лучше всего поддаются лечению 2-й и 3-й генотипы.
Наиболее рациональным в настоящее время признается применение a- ИФН в дозе 3 МЕ трижды в неделю на протяжении 12 месяцев. Первичный ответ наблюдается у 50 - 60%, примерно у половины из них возникает рецидив после отмены препарата. Высокая частота рецидивов объясняется "ускользанием" HCV от иммунного ответа ввиду высокой его склонности к мутациям (как спонтанным, так и возникающим под действием ИФН), а также активной внепеченочной репликацией. Кроме того, на фоне длительной терапии эффективность ИФН может снижаться за счет образования к нему антител (как связывающих, так и нейтрализующих). При обнаружении нейтрализующих антител чувствительность к ИФН может быть восстановлена заменой рекомбинантного a- ИФН лимфобластным.
Все большее распространение получают комбинации a- ИФН с различными противовирусными и иммуномодулирующими препаратами. Наибольшее число работ посвящено сочетанию a- ИФН с рибавирином в дозе 600 - 1200 мг/кг в сутки. 6-месячный курс позволяет вызвать стойкий ответ у 40 - 50% больных, в том числе и у интерферонорезистентных лиц; частота побочных эффектов при этом не превышает таковую при монотерапии a- ИФН. Другой перспективной комбинацией является сочетание a- ИФН с урсодезоксихолевой кислотой (УДХК), обладающей антихолестатическим и иммуномодулирующим действием. Препарат хорошо переносится. Назначается в дозе 10 - 15 мг/кг массы тела на протяжении не менее 6 месяцев. По предварительным данным, такая комбинированная терапия позволяет в два раза снизить частоту рецидивов. УДХК особенно полезна при синдроме внутрипеченочного холестаза, нередко сопутствующего хроническому гепатиту С.
Характеризуется высокой резистентностью к противовирусной терапии. Разработана схема назначения a- ИФН, предусматривающая применение препарата в дозе 9 - 10 МЕ трижды в неделю в течение 12 - 18 месяцев. Последние результаты более оптимистичны: первичный биохимический и вирусологический ответ достигается у 40- 50%, стойкий ответ - у 25% и более. В то же время высокая курсовая доза увеличивает риск развития побочных эффектов и значительно повышает стоимость лечения. Одновременная репликация HBV и HDV не ухудшает прогноз. Следует заметить, что эффект ИФН при гепатите D развивается медленно, поэтому оценка результатов должна проводиться не ранее, чем через 12 месяцев после начала терапии.
Аутоиммунный гепатит
При постановке диагноза важное значение имеет тщательное исключение вирусной инфекции, принимая во внимание принципиально различную тактику лечения. Этиологический фактор аутоиммунного гепатита неизвестен, поэтому проводится патогенетическая иммуносупрессивная терапия.
Препаратами выбора являются глюкокортикоиды - преднизолон или метилпреднизолон, практически не обладающий минералокортикоидной активностью. Основой иммуносупрессивного действия глюкокортикоидов является нарушение выработки цитокинов, участвующих во взаимодействии иммунокомпетентных клеток. При умеренной активности преднизолон назначается в дозе 1 мг на 1 кг массы тела. При снижении уровня трансаминаз доза преднизолона уменьшается на 10 мг в неделю до суточной дозы 30 мг, затем на 5 мг в неделю до суточной дозы 10 - 15 мг, которая рассматривается как поддерживающая.
Недостаточная эффективность глюкокортикоидов или развитие побочных эффектов стероидной терапии (синдром Кушинга, изъязвления пищеварительного тракта, остеопороз, стероидный диабет) служат показаниями к назначению азатиоприна, являющегося производным 6-меркаптопурина и обладающего антипролиферативным действием. Азатиоприн в дозе 1 мг/кг позволяет снизить дозу преднизолона, однако его длительное применение (поддерживающая доза составляет 50 мг) вызывает серьезные побочные эффекты, наиболее опасными из которых являются лейкопения и возрастание риска развития злокачественных опухолей. При отсутствии достаточного эффекта или непереносимости азатиоприна применяются другие препараты с иммуносупрессивным действием - циклофосфамид, 6-меркаптопурин, а также циклоспорин А (селективно подавляющий Т-клеточное звено иммунного ответа).
Целью лечения служит достижение полной клинической и биохимической (определяемой в первую очередь нормализацией трансаминаз) ремиссии. Состояние ремиссии обычно требует постоянного приема поддерживающей дозы глюкокортикоидов (с азатиоприном или без него), однако у 10 - 30% больных возможна полная отмена препаратов после не менее чем 4-летнего курса терапии. Перед отменой терапии обязательно выполнение биопсии печени: при гистологическом исследовании не должно наблюдаться воспалительных изменений. В последующем такие больные подлежат наблюдению с обязательным проведением клинического и биохимического обследования не реже 2 раз в год, учитывая возможность возникновения поздних рецидивов.
Алкогольный гепатит
Обязательным условием является полное прекращение употребления алкоголя, без чего прогрессирование заболевания почти неизбежно. Во многих случаях выполнение только этого условия приводит к регрессии патологических изменений в печени.
Учитывая часто сниженный питательный статус лиц, злоупотребляющих алкоголем, обеспечение адекватного поступления питательных веществ является важным компонентом лечения. Энергетическая ценность диеты должна быть не менее 2000 калорий в сутки, с содержанием белка 1 - 1,5 г на 1 кг массы тела и адекватным количеством витаминов. При наличии анорексии применяется энтеральное зондовое питание или внутривенное введение аминокислотных смесей. При выраженном упадке питания и невысокой активности процесса возможно применение анаболических стероидов.
Для нормализации липидного обмена в печени используются липотропные препараты, такие как эссенциале-форте (средняя доза 4 - 6 капсул в день, курс лечения 6 - 8 недель). Назначается при отсутствии признаков внутрипеченочного холестаза. Положительный клинический и биохимический эффект оказывает также мембраностабилизирующий препарат легалон; при выраженном цитолитическом синдроме назначается в суточной дозе 420 мг, затем дозу снижают до 210 мг в день. Курс лечения 3 - 6 недель.
Хорошо зарекомендовал себя в качестве средства для лечения различных форм алкогольной болезни печени адеметионин (S-аденозил-L-метионин). Механизм его действия состоит в стабилизации мембран гепатоцитов и снижении повреждающего эффекта свободных радикалов, так как он принимает участие в синтезе фосфолипидов, являющихся строительным материалом для клеточных мембран (в частности, фосфатидилхолина в реакции трансметилирования), и восстановленного глутатиона - мощного внутриклеточного антиоксиданта (в реакции транссульфурирования). Адеметионин назначается в виде внутривенных инъекций (800 мг однократно в течение 16 дней) с последующим переходом на пероральный прием 1600 мг в день (по 2 таблетки утром и вечером). Особенно заметен его положительный эффект при наличии сопутствующего внутрипеченочного холестаза. Адеметионин обладает также антидепрессивным действием, в связи с чем на фоне лечения им улучшается психологическое состояние больных. Побочные эффекты при его применении незначительны и не требуют коррекции терапии.
Имеются данные об улучшении клинико-биохимической и гистологической картины при хроническом алкогольном гепатите урсодеоксихолиевой кислоты на фоне приема УДХК, уменьшающей токсическое действие на гепатоциты гидрофобных желчных кислот. Назначается в дозе 10 - 15 мг/кг массы тела в течение 6 - 12 месяцев.
Лекарственные и токсические гепатиты
В первую очередь необходима отмена препарата или прекращение контакта с токсическим веществом, вызвавшим гепатит. Элиминация этиологического фактора приводит к постепенному затуханию патологического процесса и восстановлению структуры и функции печени. Отсутствие положительной динамики или, тем более, прогрессирование заболевания указывают на необходимость поиска другой причины хронического гепатита. Необходимо отметить, что возобновление приема препарата, вызвавшего поражение печени нередко приводит к быстрому развитию более тяжелой патологии.
В качестве вспомогательного средства для ускорения регенерации паренхимы печени используются гепатопротективные средства типа легалона (доза 210 - 420 мг в день, курс лечения 3 - 6 недель). При наличии клинических симптомов внутрипеченочного холестаза назначаются антихолестатические препараты (УДХК, адеметионин).
Читайте также:

