Лекции по лабораторной диагностике вирусов
Обновлено: 25.04.2024
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
В лабораторной диагностике вирусных инфекций имеются три основных подхода (табл. 1, табл. 2):
1) непосредственное исследование материала на наличие вирусного антигена или нуклеиновых кислот;
2) изоляция и идентификация вируса из клинического материала;
3) серологическая диагностика, основанная на установлении значительного прироста вирусных антител в течение болезни.
При любом выбранном подходе к вирусной диагностике одним из важнейших факторов является качество исследуемого материала. Так, например, для прямого анализа образца или для изоляции вируса исследуемый материал должен быть получен в самом начале заболевания, когда возбудитель еще экскретируется в относительно больших количествах и не связан пока антителами, а объем образца должен быть достаточен для проведения прямого исследования. Также важен выбор материала в соответствии с предполагаемым заболеванием, то есть того материала, в котором исходя из патогенеза инфекции вероятность присутствия вируса наибольшая.
Не последнюю роль в успешной диагностике играет среда, в какую берется материал, как он транспортируется и как хранится. Так, носоглоточные или ректальные мазки, содержимое везикул помещают в среду, содержащую белок, предотвращающий быструю потерю инфекционности вируса (если планируется его изоляция), или в соответствующий буфер (если планируется работа с нуклеиновыми кислотами).
Прямые методы диагностики клинического материала
Прямые методы – это методы, которые позволяют обнаружить вирус, вирусный антиген или вирусную нуклеиновую кислоту (НК) непосредственно в клиническом материале, то есть являются наиболее быстрыми (2–24 ч). Однако из-за ряда особенностей возбудителей прямые методы имеют свои ограничения (возможность получения ложноположительных и ложноотрицательных результатов). Поэтому они часто требуют подтверждения непрямыми методами.
Электронная микроскопия (ЭМ). С помощью этого метода можно обнаружить собственно вирус. Для успешного определения вируса его концентрация в пробе должна быть примерно 1·10 6 частиц в 1 мл. Но поскольку концентрация возбудителя, как правило, в материале от больных незначительна, то поиск вируса затруднен и требует предварительного его осаждения с помощью высокоскоростного центрифугирования с последующим негативным контрастированием. Кроме того, ЭМ не позволяет типировать вирусы, так как у многих из них нет морфологических различий внутри семейства. Например, вирусы простого герпеса, цитомегалии или опоясывающего герпеса морфологически практически неотличимы.
Одним из вариантов ЭМ, используемым в диагностических целях, является иммунная электронная микроскопия (ИЭМ), при которой применяются специфические антитела к вирусам. В результате взаимодействия антител с вирусами образуются комплексы, которые после негативного контрастирования легче обнаруживаются.
ИЭМ несколько более чувствительна, чем ЭМ, и используется в тех случаях, когда вирус не удается культивировать in vitro, например при поиске возбудителей вирусных гепатитов [1].
Реакция иммунофлюоресценции (РИФ). Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей [2, 3]. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
Иммуноферментный анализ (ИФА). Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также -галактозидазу и -лактамазы [4]. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены) [5, 6].
Радиоиммунный анализ (РИА). Метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
Молекулярные методы. Первоначально классическим методом выявления вирусного генома считался высокоспецифичный метод гибридизации НК, но в настоящее время все шире используется выделение геномов вируса с помощью полимеразной цепной реакции (ПЦР).
Молекулярная гибридизация нуклеиновых кислот. Метод основан на гибридизации комплементарных нитей ДНК или РНК с образованием двунитевых структур и на выявлении их с помощью метки. Для этой цели используются специальные ДНК- или РНК-зонды, меченные изотопом ( 32 Р) или биотином, обнаруживающие комплементарные нити ДНК или РНК. Существуют несколько вариантов метода: – точечная гибридизация – выделенную и денатурированную НК наносят на фильтры и затем добавляют меченый зонд; индикация результатов – авторадиография при использовании 32 Р или окраска – при авидин-биотине; – блот-гибридизация – метод выделения фрагментов НК, нарезанных рестрикционными эндонуклеазами из суммарной ДНК и перенесенных на нитроцеллюлозные фильтры и тестируемые мечеными зондами; используется как подтверждающий тест при ВИЧ инфекции; – гибридизация in situ – позволяет определять НК в инфицированных клетках [7].
ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок – так называемых праймеров.
Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25–35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле.
Метод высокоспецифичен и очень чувствителен. Он позволяет обнаружить несколько копий вирусной ДНК в исследуемом материале. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций (вирусы гепатитов, герпеса, цитомегалии, папилломы и др.) [8, 9].
Разработан вариант количественной ПЦР, позволяющий определять число копий амплифицированного сайта ДНК. Методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения.
Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При цитомегаловирусной инфекции, например, в срезах ткани или в моче обнаруживаются характерные гигантские клетки– "совиный глаз", при бешенстве – включения в цитоплазме клеток (тельца Бабеша–Негри). В некоторых случаях, например при дифференциальной диагностике хронических гепатитов, имеет значение оценка состояния ткани печени.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
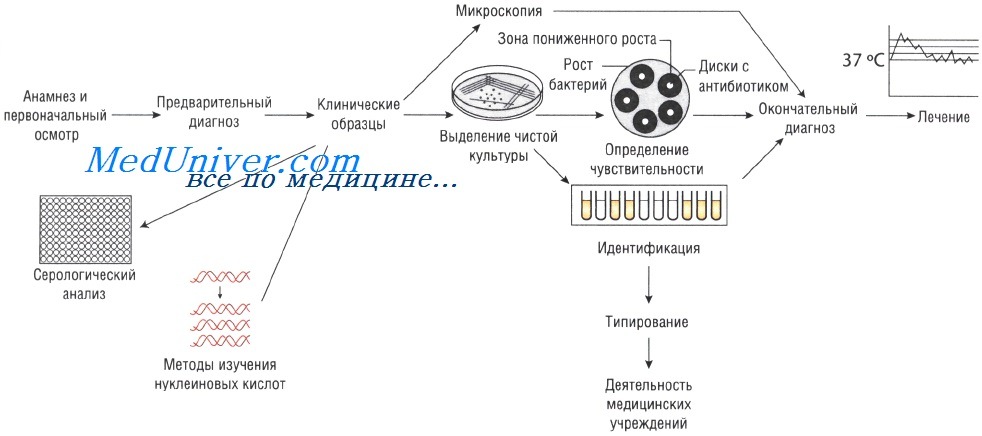
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
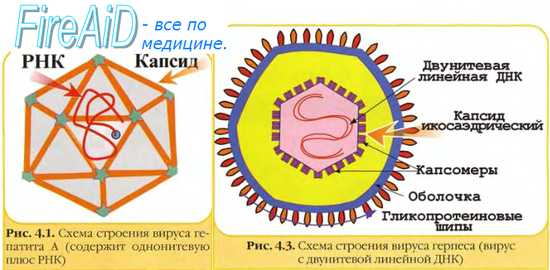
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на высокоспецифической иммунологической реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. В результате реакции фермента с хромогенным субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Любой вариант ИФА содержит 3 обязательные стадии:
- Стадия узнавания исследуемого соединения специфическим антителом;
- Стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
- Стадия превращения ферментной метки в регистрируемый сигнал.
В реакции участвуют:
- Твердая фаза;
- АГ и АТ;
- Конъюгат (антиген или антитело, меченые ферментом);
- Ферментный маркер;
- Субстрат;
- Стоп-реагент (чаще всего применяют серную кислоту).
Твердая фаза
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Антигены и антитела
АГ и AT, используемые в ИФА, должны быть высокоочищенными и высокоактивными. АГ должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант.
Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые АТ могут быть поли- или моноклональными, различного класса (IgG или IgM) и подкласса (IgG1, IgG2).
Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации АГ (AT) в образцах.
Ферментные маркеры: наибольшее применение нашли пероксидаза хрена (ПХ), щелочная фосфатаза (ЩФ) и β-D-галактозидаза.
Субстраты
- Для ПХ в качестве субстрата используют 3,3’,5,5’-тетраметилбензидин (ТМБ хромоген). Происходит цветная реакция, интенсивность которой зависит от количества связанного определяемого вещества;
- Для ЩФ субстратом является 4-нитрофенилфосфат;
- β-D-галактозидаза катализирует гидролиз лактозы с образованием глюкозы и галактозы.
Классификация ИФА
В основу классификации методов ИФА положено несколько подходов:
1 — по типу реагентов, присутствующих на первой стадии ИФА:
- В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментом и конкурирующий за центры специфического связывания с ним;
- Для неконкурентных методов характерно присутствие на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2 — по принципу определения исследуемого вещества:
- Прямое определение концентрации вещества (АГ или АТ). Используют антитела к исследуемому веществу, соединенные со специфической меткой. В этом случае метка будет находиться в образовавшемся специфическом комплексе АГ-АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу;
- Непрямое определение концентрации вещества – по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
3 — по типу результатов:
Конкурентный ИФА
- На твердой фазе иммобилизованы специфические моноклональные антитела;
- В лунки панелей вносят в известной концентрации антиген, меченный ферментом, и исследуемый образец. Параллельно в соседних лунках ставят положительный и отрицательный контроли. Для построения калибровки используют стандартный немеченый антиген в различных разведениях. Проводят инкубацию и отмывку;
- Добавляют субстрат, инкубируют, останавливают реакцию при развитии оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества обратно пропорциональна оптической плотности.
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Основным достоинством метода является высокая чувствительность, превосходящая возможности других схем ИФА.
- На твердой фазе иммобилизованы моноклональные антитела или аффинно-очищенные поликлональные антитела;
- В лунки панелей вносят исследуемый образец, параллельно ставят положительный контрольный образец и отрицательный контрольный образец в различных разведениях. Инкубируют и отмывают;
- В лунки вносят меченные ферментом моноклональные или поликлональные антитела —конъюгат. После инкубации проводят отмывку для удаления несвязавшихся антител;
- Вносят субстрат, инкубируют. Реакцию останавливают при достижении оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества прямо пропорциональна оптической плотности.
Для полуколичественного варианта проведения методики рассчитывают отношение между средней оптической плотностью образца и оптической плотностью Cut-off.
Образцы рассматриваются как:
- положительные, если отношение более 1,1;
- сомнительные, если отношение 0,9–1,1;
- отрицательные, если отношение менее 0,9.
Сомнительные результаты анализа нельзя однозначно интерпретировать и для уточнения результата необходимо повторить обследование через 1–2 недели.
Читайте также:

