Лучевая терапия при папилломе
Обновлено: 19.04.2024
Папилломатоз — общее название для патологического процесса, характеризующегося образованием множественных папиллом на участке кожи или слизистых оболочек различных органов. Папиллома являет собой доброкачественное новообразование, развивающееся из плоского или переходного эпителия, возвышающееся над ним и имеющее форму сосочка.
Причины развития папилломатоза
В большинстве случаев папилломы имеют вирусную этиологию. Возбудитель заболевания — ДНК-содержащий вирус папилломы человека (ВПЧ) семейства паповавирусов. К настоящему времени определено около 100 типов этого вируса, многие из которых обладают различным по степени риска потенциалом к онкогенности.
Вирус может передаваться от человека к человеку контактным (в том числе половым) путём; установлено, что один из путей заражения вирусом — передача от матери плоду в течение беременности или во время родов, что обуславливает появление папилломатоза и у детей младшего возраста.
Чаще всего инфицирование ВПЧ приводит к бессимптомному носительству, но в ситуациях, когда иммунитет снижается (после длительной болезни, в стрессовых ситуациях, при авитаминозе, при беременности, в случае приёма определенных лекарств, например, глюкокортикостероидов), возникает непосредственное клиническое проявление в виде папиллом.
Помимо вирусной причины, папилломатоз может быть следствием хронических воспалительных процессов. Интересно отметить, что в отдельных ситуациях при выявлении папилломатоза не выявляется признаков вирусного инфицирования, что побуждает к поиску иных причин развития данного заболевания.
Отдельные виды папилломатоза
Папилломы могут поражать кожу и слизистую оболочку практически любого внутреннего органа. Ниже приведены описания отдельных видов папилломатоза в зависимости от того, какая часть тела поражена.
Папилломатоз гортани
Вызывается преимущественно ВПЧ 6 и 11 типов, менее распространены типы 16, 18. Частота встречаемости паппиломатоза гортани в популяции — 2 на 100 000 среди взрослых и 4 на 100 000 среди детей.
Характерными симптомами являются охриплость голоса и нарушения дыхания. Несмотря на то, что папилломатоз гортани является доброкачественным заболеванием, возможны такие серьезные осложнения, как стеноз гортани, распространение папиллом на трахею и бронхи с последующим развитием лёгочной недостаточности, а также перерождение в злокачественную опухоль, особенно если папилломатоз вызван вирусом ВПЧ 16 или 18 типа, у которых высокий уровень потенциальной онкогенности.
Вестибулярный папилломатоз
Этот термин применяется для обозначения мелких паппиломовидных образований преддверия влагалища. Встречается довольно часто у женщин в возрасте до 30 лет и становится показанием к обследованию слизистых влагалища и шейки матки, в том числе и на предмет наличия вируса папилломы человека, так как может сочетаться с поражением шайки матки, хотя сам по себе вестибулярный папилломатоз может и не иметь вирусной природы.
Вестибулярный папилломатоз часто может развиваться без клинических симптомов и обнаруживается при осмотре у гинеколога с профилактической целью или по поводу иных жалоб, но может и проявляться белями, болями и жжением в области вульвы, явлениями диспареунии, сочетаться с локальным воспалительным процессом.
Вестибулярный папилломатоз, в отличие от поражений шейки матки, склонен к рецидивированию — по данным литературы, частота рецидивов составляет до 17%. Обычно рецидивы характерны при инфицировании папилломавирусном низкого онкогенного риска.
Папилломатоз кожи
Папилломатозом кожи называют разрастания многочисленных кожных новообразований на ограниченном участке. Папиллома образуется при разрастании верхнего слоя кожи — эпидермиса. Обычно кожные папилломы имеют размер 5–7 миллиметров, реже до 2 сантиметров. Форма варьирует от точечного или немного свисающего выроста кожи до горошины. Цвет папилломы чаще неотличим от цвета окружающего кожного покрова, но может быть и белого или коричневого цвета. Обыкновенные папилломы чаще всего локализуются на коже спины, ладоней и пальцев рук, подошв и стоп, нитевидные папилломы — в местах с тонкой кожей (веки, шея, подмышечные и паховые области).
Обычно имеет бессимптомное течение и являет собой преимущественно косметический дефект, однако папилломы кожи могут часто травмироваться, что может привести к развитию воспаления или быть фактором риска их озлокачествления.
Особого внимания заслуживает карциноидный папилломатоз кожи Готтрона — редкое предраковое заболевание, характеризующееся специфическими разрастаниями эпидермиса. Основным фактором его возникновения является предрасположенность к развитию множественного поражения кожи папилломами; среди прочих факторов риска следует упомянуть регулярную травматизацию кожных покровов, хронические заболевания кожи, нарушения кровообращения. При данном заболевании очаги расположены симметрично на голенях, чаще на передней поверхности, на фоне длительно существовавшего поражения кожи, имеют вид выступающих над поверхностью на 1–1,5 см папилломатозных бородавчатых разрастаний и вегетаций в виде бляшек значительного размера. Бороздки между очагами заполнены желтовато-белыми липкими массами с неприятным запахом, на некоторых участках они ссыхаются в желтовато-серые корки. Иногда возникают эрозии, поверхностные язвы, легко кровоточащие грануляции. В силу высокого риска озлокачествления (стоит отметить, что ряд авторов приравнивает карциноидный папилломатоз к высокодифференцированному плоскоклеточному раку кожи) данное заболевание требует консультации и лечения у онколога.
Папилломатоз пищевода
Является редкой патологией — согласно данным литературы, его частота составляет всего 4,5%. Папилломы имеют вид полиповидного или листовидного образования белесоватого цвета, размером обычно до 1 см. Характерна локализация поражений в дистальных отделах пищевода. Хотя основной причиной развития данной патологии считается наличие папилломовирусной инфекции, по данным ряда авторов, папилломатоз пищевода встречается и при отсутствии вирусной контаминации. Кроме того, отмечается связь между развитием папилломатоза и гастроэзофагеальным рефлюксом, который в силу длительного воздействия соляной кислоты, содержащейся в желудочном соке, приводит к повреждению и хроническому воспалению слизистой пищевода.
Папилломы пищевода могут долгое время не проявлять себя никакой симптоматикой, но по мере их роста могут появляться следующие жалобы: затрудненное глотание, легкая или умеренная боль за грудиной, отрыжка, тошнота.
В настоящее время считается, что папилломы пищевода являются предраковым заболеванием, и именно папилломатоз в силу распространённости поражения слизистой оболочки пищевода обладает наибольшим риском малигнизации, поэтому выявление папиллом пищевода — это показание к хирургическому лечению.
Внутрипротоковый папилломатоз
Под данным термином понимают папилломы, расположенные в млечных протоках молочной железы. Папилломы могут возникать как в периферических протоках любого квадранта молочной железы, так и в протоках, расположенных сразу за соском. Периферический папилломатоз представлен обычно мелкими, до 1 см, образованиями. В отдельных случаях внутрипротоковые папилломы могут иметь гигантский (более 5 см) размер, в этом случае они значительно деформируют молочную железу. По мере роста папилломы в просвете возникает механическое расширение протока, что может являться причиной развития болевого синдрома.
Внутрипротоковые папилломы могут развиваться в любом возрасте, но чаще возникают в возрасте 35–55 лет. Факторами риска их образования считаются приём оральных контрацептивов и препаратов заместительной гормональной терапии, семейный анамнез, эндокринологические нарушения, наличие хронических воспалительных процессов придатков. Наиболее частым симптомом является появление выделений из соска, не связанных с лактацией, янтарного цвета или с примесью крови. Кроме того, в связи с ростом папиллом может появиться болезненность, становится возможным пропальпировать уплотнения в молочной железе.
Внутрипротоковый папилломатоз требует хирургического лечения в объёме резекции поражённого квадранта или же, в случае значительной распространённости процесса, радикальной мастэктомии, так как обладает значительным потенциалом к перерождению в протоковый рак.
Диагностика папилломатоза
Применяемые инструментальные методы диагностики зависят от локализации папилломатоза. Так, при папилломатозе гортани показано проведение ларингоскопии, при поражении пищевода — ЭГДС, при локализации папиллом в протоках молочной железы — дуктография.
Для подтверждения вирусной природы папиллом и определения конкретного типа вируса используются лабораторные методики, позволяющие идентифицировать ДНК вируса — полимеразная цепная реакция (ПЦР), гибридизационные методы.
Наконец, в рамках комплексного лечения целесообразно оценить иммунный статус пациента с целью назначения медикаментозной терапии для профилактики рецидивирования папилломатоза.
Лечение папилломатоза
Основной метод лечения – хирургический. При всей эффективности традиционного хирургического иссечения папиллом существует риск рубцевания слизистой оболочки, поэтому в настоящее время широкое распространение получили не менее эффективные, но более щадящие методы лечения папилломатоза:
- Лазерное удаление
- Ультразвуковая дезинтеграция
- Радиочастотная холодная аблация
- Фотодинамическая терапия
- Электродеструкция
- Криодеструкция
- Диатермокоагуляция
- Удаление химическими агентами (солкодерм, подофиллин)
К сожалению, ни одна из вышеуказанных методик даже при условии полного и тщательного удаления папилломатоза не гарантирует отсутствия рецидива.
Поэтому при наличии факторов риска развития рецидива в послеоперационном периоде может быть назначена адъювантная лекарственная терапия, в рамках которой могут быть назначены следующие препараты:
- Препараты α-интерферона,
- Противовирусные препараты (ацикловир, рибавирин, цидофовир)
- Иммуностимуляторы (ликопид, галавит, циклоферон)
Также в настоящее время проводятся клинические исследования вакцины против вирусов папилломы человека в качестве противорецидивного средства.
Несмотря на обнадеживающие результаты, на данный момент применение вакцины для профилактики рецидивов у больных с уже выявленным папилломатозом стандартом лечения не является.
Профилактика
До недавнего времени наиболее эффективной профилактикой папилломатоза считалось предотвращение заражения папилломавирусной инфекцией, а также лечение сопутствующих хронических инфекционных заболеваний и скрининг, направленный на раннее выявление болезни. Сейчас возможно выполнение профилактической вакцинации. Вакцина направлена против четырех типов папилломавируса, которые имеют наибольшее клиническое значение и наибольший онкогенный риск. Вакцинация возможна как у детей для профилактики заражения этими типами вируса, так и у взрослых. Перед вакцинацией обследование на наличие вирусов папилломы не требуется, так как даже если человек уже заражен один из тех типов, на которые направлена вакцина, иммунопрофилактика убережет его от заражения остальными тремя.
Если папилломатоз уже диагностирован и подвергнут лечению, пациенты подлежат динамическому контролю. Так, больные папилломатозом гортани подлежат обязательной диспансеризации в зависимости от частоты рецидивирования заболевания, но не менее чем раз в три месяца. В случае вестибулярного папилломатоза, даже если доказано отсутствие связи его возникновения с папилломавирусной инфекцией, также требуется активное динамическое наблюдение.
Вирус папилломы человека у женщин и мужчин представляет собой очень распространенную в мире инфекцию, которая передается половым и бытовым путем, а также во время родов. Ее особенностью заключается в том, что она долгое время (многие годы) никак не проявляет себя, но потом начинают развиваться доброкачественные новообразования. Они возникают на половых органах, шее, под мышками, на груди, лице, животе, на слизистых прослойках ротовой полости и пр.
Классификация вирусов
Все типы вируса папилломы человека являются бесклеточными или доклеточными. Все вирусы считаются мельчайшими микроорганизмами, которые паразитируют на остальных клетках. Вне органической материи вирус мертв. Однако он содержит генетическую информацию, а внедряясь в клетку, заставляет ее мутировать, то есть он заставляет перестраиваться чужой генетический код.
Типы вируса папилломы человека у женщин и мужчин разнообразны, а самые распространенные проявления его активизации – остроконечные кондиломы, папилломы, стандартные бородавки.
Причины развития
Как передается вирус папилломы человека, должен знать каждый. Им можно заразиться при обычном контакте с уже инфицированным человеком, причем это особенно касается слизистых оболочек. Патоген в 75% всех случаев способен передаваться от зараженного человека к здоровому. Это уровень контагиозности.
Что касается использования барьерной контрацепции (презервативы), то это не помогает и не защищает от инфицирования. Это объясняется слишком маленькими размерами микроорганизма, его проникающей способностью, а также неизбежностью контакта слизистых оболочек при половом акте. Степень болезнетворности зависит не только от типа вируса, но и общего состояния иммунной системы человека.
Важно не только знать, как передается вирус папилломы человека у женщин и мужчин, но еще факторы, повышающие риск. Сюда относится дефицит витаминов, истощение, наличие хронических заболеваний в тяжелой форме, вредные привычки, сбои в гормональном фоне. Высок риск людей, которые относятся к маргинальным слоям населения. Инкубационный период длится от пары недель до нескольких лет.
Симптомы развития заболевания
Вирус папилломы человека у женщин и мужчин вызывает появление доброкачественных новообразований на кожных покровах. Они могут расти на специальной ножке или нет, иметь форму шишки, бугра или сосочка. Оттенок варьируется от бледно-телесного до белого, коричневого и серого. Несколько новообразований могут сращиваться вместе и образовывать своеобразную колонию. Это основные симптомы вируса папилломы человека.
Если травмировать новообразование, то начнется небольшое кровотечение. Такие наросты могут располагаться на любом участке тела, но чаще всего это руки и пальцы, а также ступни и их подошва. Кстати папилломы при ороговении преобразуются в мозоли в некоторых случаях. Также новообразования появляются на лице, в области паха и даже на внутренних органах (известны случая их нахождения на мочевых путях и лоханки почек). По габаритам наросты бывают от 1 мм до нескольких сантиметров.
Остроконечная кондилома
Симптомы вируса папилломы человека отличаются, так как наросты могут быть разными. Отдельной формой является остроконечная кондилома. От стандартной папилломы ее отличает коническая вытянутая форма. Новообразование обычно располагается на слизистых прослойках половых органов, особенно в зоне перехода от прямой кишки к половым органам. Может появляться и в ротовой полости, но намного реже.
Кондиломы могут быть как единичными (и они обычно белесые), так и в виде скоплений. При частом задевании наросты начинают чесаться, болеть, кровоточить, неприятно пахнуть. Кондиломы отличаются от папиллом еще и достаточно сильной агрессивностью. Если одни практически не вызывают симптомов, не мешают и мало заметны, то вторые – диаметрально противоположные.
Диагностика папиллом
Лечение и анализы на вирус папилломы человека проводит дерматовенеролог. Он же подбирает соответствующее лечение. В целом диагностика несложная. Она не вызывает особых затруднений. Определить точный диагноз можно во время осмотра. Также врач изучает анамнез и жалобы пациента. Кроме того, он может назначить дополнительные анализы на вирус папилломы человека – биопсию, ПЦР, а также при необходимости кольпоскопию, уроцистокоспию и пр.
Лечение
Лечение вируса папилломы человека нельзя проводить с применением народных средств, так как это может привести к тому, что новообразование преобразуется из доброкачественного в злокачественное. Таким образом, домашние средства способны вызывать рак. Даже если нарост совсем маленький и не вызывает неприятных ощущений, заниматься его удалением может только доктор.
Убрать новообразование можно хирургическим способом. Особенно это касается тех наростов, которые кровоточат, изменяют цветовую гамму, начинают увеличиваться в размерах, или возле них появляются новые новообразования. Для этого врач может проводить лазерную терапию, электрокоагуляцию, криодеструкцию и применять другие эффективные варианты удаления наростов на теле. Выбор методики зависит от индивидуальных особенностей организма человека и технических возможностей больницы.
Лечение вируса папилломы человека с помощью медикаментов отсутствует. Единственная возможность – укреплять иммунную систему. Для этого врачи назначают общеукрепляющие средства, витаминно-минеральные комплексы, иммуностимуляторы.
Лаборатория онковирусологии Томского научно-исследовательского института онкологии, Томск, Россия, 634050;
Национальный исследовательский Томский государственный университет, Томск, Россия, 634050
Клинические аспекты ВПЧ-позитивного рака ротовой полости и ротоглотки
Журнал: Вестник оториноларингологии. 2016;81(1): 72‑77
В обзоре рассмотрены частота и спектр инфицированности вирусом папилломы человека (ВПЧ) здоровых лиц и больных раком слизистой оболочки рта и ротоглотки. Сопоставлены данные о частоте встречаемости ВПЧ-позитивной и ВПЧ-негативной форм рака указанных локализаций в различных популяциях, клинические особенности течения заболевания и терапии. Рассмотрены клинико-морфологические особенности ВПЧ-позитивного рака полости рта и ротоглотки. Отдельное внимание уделено уровню общей и безрецидивной выживаемости, исходу и прогнозу у больных с вирус-негативной и ВПЧ-позитивной формой рака. Показано влияние таких факторов риска, как курение, возраст, этнические особенности пациентов. Рассматриваются подходы к лечению ВПЧ-позитивных больных. Сделано заключение о необходимости выделения ВПЧ-позитивной формы рака полости рта и ротоглотки как самостоятельной формы патологии, которая требует особого подхода к терапии (применения адекватных алгоритмов и схем лечения).
Лаборатория онковирусологии Томского научно-исследовательского института онкологии, Томск, Россия, 634050;
Национальный исследовательский Томский государственный университет, Томск, Россия, 634050
В общей структуре онкологической заболеваемости злокачественные опухоли головы и шеи занимают 20%, среди которых рак слизистой оболочки полости рта (РПР) и рак ротоглотки (РРГ) стоят на 4-м месте. Ежегодно в России регистрируется более 80 тыс. больных с данной патологией [1]. Максимальное и минимальное значение абсолютного показателя онкологической заболеваемости для РПР и РРГ среди федеральных округов России на 2011 г. составило 1221 (3,17 на 100 тыс.) и 698 (1,81 на 100 тыс.) случаев соответственно для различных областей Центрального федерального округа, 122 (1,29 на 100 тыс.) и 66 (0,70 на 100 тыс.) случаев — для Северо-Кавказского округа [2].
В США и Европе на долю рака области головы и шеи (ОГШ) приходится 3,5% от всех злокачественных новообразований, тогда как в странах Юго-Восточной Азии, Индии и Бразилии данная патология встречается с еще большей частотой [3].
Частота встречаемости рака основания языка и миндалин зависит от таких демографических показателей, как возраст, пол и этническая/расовая принадлежность. Традиционными факторами риска для рака основания языка и небных миндалин являются употребление алкоголя и курение.
Данные последних 20 лет показали, что существенный вклад в патогенез рака основания языка и миндалин вносят онкогенные вирусы папилломы человека (ВПЧ), признанные этиологическим фактором для рака шейки матки [4—6]. В 2010 г. Американское общество стоматологов, а в 2012 г. Международное агентство по изучению рака признали ВПЧ 16-го типа (ВПЧ16) этиологическим фактором для рака РПР и РРГ [7, 8].
Согласно данным других авторов, изучавших частоту ассоциации РПР и РРГ с ВПЧ в Северной Америке, ВПЧ 16 слабо ассоциировал с РРГ и был выявлен всего в 0—2% случаев [15, 16], тогда как при РПР ВПЧ 16 определяется в 50—78% случаев [17, 18]. Эти данные подтверждают результаты исследований, полученные на выборках меньшего объема [19, 20]. Наиболее высокие показатели инфицированности среди больных РПР и РРГ приводят М. Steinau и соавт. [21], согласно данным которых ВПЧ-позитивные случаи РРП отмечены в 72%, из них 62% — позитивны на типы 16/18. В литературе, к сожалению, мы не встретили объяснения причин различий в частоте инфицированности ВПЧ рака слизистой полости рта и ротоглотки, и данный вопрос остается открытым.
В литературе отсутствуют специфические гистологические критерии, позволяющие проводить дифференциальную морфологическую диагностику между ВПЧ-негативной и ВПЧ-позитивной формами плоскоклеточного РПР и РРГ. Несмотря на это, в морфологическом отношении выделяют некоторые признаки, ассоциированные с ВПЧ-инфекцией: дольчатая форма клеточного роста, гиперхроматиновое ядро, скудная цитоплазма и высокая митотическая активность опухолевых клеток [22—24]. В клиническом отношении для ВПЧ-позитивной формы плоскоклеточного РПР и РРГ характерна ассоциация со стадией опухолевого процесса, региональным и отдаленным метастазированием [17, 25]. ВПЧ-позитивную форму плоскоклеточного рака ОГШ часто диагностируют на ранней стадии, когда опухоль имеет небольшие размеры с тенденцией к региональному метастазированию [22, 26, 27], тогда как ВПЧ-негативную форму заболевания выявляют, наоборот, на более поздней стадии и с отдаленным метастазированием [17, 25]. Следует указать и на снижение среднего возраста постановки диагноза для вирус-позитивных больных до 59,8 года по сравнению с ВПЧ-негативными пациентами, средний возраст которых на момент постановки диагноза составляет 66,6 года [28].
Надо подчеркнуть, что 25% региональных метастазов из неверифицированного первичного опухолевого очага в 33—50% случаев оказываются ВПЧ-позитивными и происходят из области ротоглотки — миндалин и основания языка [29]. Вследствие особенностей гистологического строения миндалин у больных плоскоклеточным раком возможны инвазия и метастазирование уже на ранней стадии опухолевого процесса [29], поэтому в случае с метастазированием в шейные лимфоузлы при неустановленном генезе первичного очага следует провести определение ВПЧ-статуса опухоли [30]. ВПЧ-позитивный статус опухоли снижает уровень прогностической значимости регионарного метастазирования, т. е. наличие или появление метастазов у ВПЧ-позитивных больных с плоскоклеточным РРГ, получивших хирургическое лечение, не рассматривается как неблагоприятный прогностический признак [31]. Необходимо сказать и о феномене пузырчатых метастазов в шейных лимфоузлах, которые диагностируются в 40—64% случаев ВПЧ-позитивной формы плоскоклеточного РРГ (язычной/небной миндалин или корня языка), выступающего в качестве маркера не только вирус-позитивной опухоли, но и интегрированной формы генома ВПЧ [32]. Интеграция генома ВПЧ отмечается более чем в 50% вирус-позитивных опухолей миндалин и корня языка [25]. Наиболее частая локализация вторичного опухолевого очага у вирус-позитивных больных отмечается в области кожи и простаты, тогда как у вирус-негативных — в области почек и полости рта [33].
Первые сведения о значении ВПЧ-статуса опухоли для прогноза и исхода терапии больных раком ОГШ и ротоглотки были получены в небольших по объему ретроспективных исследованиях, которые показали благоприятный исход заболевания у вирус-позитивных больных по сравнению с вирус-негативными (получивших лучевое, химиолучевое лечение, хирургическое вмешательство или комбинированную терапию) [34—36]. Анализ ретроспективного материала опухолевой ткани больных ОГШ, включенных во II и III фазы клинических исследований и результаты трех метаанализов показали лучший прогноз для ВПЧ-позитивных больных [37, 38].
Плоскоклеточный рак с базолоидным фенотипом — наиболее часто встречаемый тип рака при ОГШ, для которого характерен неблагоприятный исход заболевания, подразделяют на две формы — ВПЧ-позитивную с вялым течением заболевания и благоприятным прогнозом и ВПЧ-негативную агрессивную форму с худшим прогнозом [39, 40].
Согласно данным литературы, на прогноз заболевания у ВПЧ-позитивных больных может оказывать неблагоприятный эффект такой фактор риска, как курение. Был продемонстрирован кумулятивный эффект курения, ВПЧ-статуса опухоли и TN категорий на прогноз заболевания для больных со II и III стадиями плоскоклеточного РРГ. Благоприятный прогноз отмечался у некурящих больных с вирус-позитивной формой плоскоклеточного рака и региональным метастазированием. Неопределенный прогноз был у некурящих больных с вирус-негативным плоскоклеточным раком и Т2—Т3 стадией процесса, неблагоприятный прогноз отмечался у курящих пациентов с вирус-негативной формой [41, 42]. С другой стороны, по данным С. Fakhry и соавт. [33], курение в анамнезе больных раком области головы и шеи не влияло на ассоциацию ВПЧ-статуса с выживаемостью.
Систематические обзоры и данные метаанализов, публикуемые мировым научным сообществом, убедительно демонстрируют высокую общую и безрецидивную выживаемость у ВПЧ-позитивных и относительно низкую — у ВПЧ-негативных больных плоскоклеточным РПР и РРГ [41, 43]. Так, M. O’Rorke и соавт. [38] приводят данные, согласно которым у вирус-позитивных пациентов с плоскоклеточным раком ОГШ в 54% случаев отмечен более высокий уровень общей выживаемости по сравнению с вирус-негативными (HR=0,46; 95% CI=0,37—0,57). Введенная величина — HR (hazard ratio) указывает на отношение рисков наступления неблагоприятного исхода у ВПЧ-позитивных и ВПЧ-негативных пациентов. Чем ниже значение HR, тем больше разница в уровне выживаемости между ВПЧ-позитивными и ВПЧ-негативныи пациентами, т. е. у вирус-позитивных больных больше шансов остаться в живых. HR для рака миндалин и ротоглотки составил 0,50 (95% CI=0,33—0,77) и 0,47 (95% CI=0,35—0,62) соответственно. Значение уровня безрецидивной выживаемости было значительно выше в группе больных с вирус-позитивной формой рака ОГШ, а уровень смертности от прогрессирования основного заболевания и частота рецидивирования были значительно ниже, чем в группе ВПЧ-негативных пациентов [43].
На основании обследовавания 8270 больных за период с 1981 по 2007 г. показано, что в период 1981—1995 гг. вирус-позитивные больные имели худшую выживаемость (HR=1,3; 95% CI=1,14—1,44), в период с 1996 по 2007 г. показатели выживаемости выросли и у вирус-позитивных больных в этот период отмечалась лучшая выживаемость по сравнению с вирус-негативными пациентами (HR=0,57; 95% CI=0,48—0,67) [28].
Сообщается о статистически значимых различиях по уровню 3-летней общей и безрецидивной выживаемости в группах больных РРГ, стратифицированных по р16- и ВПЧ-статусу опухоли [группа A (9 больных): ВПЧ (+)/p16 (+); группа B (14 больных): ВПЧ (+)/p16 (-) или ВПЧ (-)/p16 (+) и группа C (43 больных): ВПЧ (-)/p16 (-)], составив 100, 78 и 42% (р=0,001) для общей выживаемости и 100, 78 и 46% — для безрецидивной выживаемости (р=0,004) [44].
Интересные данные о влиянии на уровень общей выживаемости больных РПР и РРГ ВПЧ-статуса, ассоциированного с расовой принадлежностью, приводят M. Worsham и соавт. [45]. В группе вирус-негативных афроамериканцев общая выживаемость оказалась значительно ниже, чем у вирус-позитивных (HR=3,44; p=0,0012), ВПЧ-позитивных американцев европейского происхождения (HR=3,11; p=0,049) и вирус-негативных американцев европейского происхождения (HR=2,21; р=0,049). Кроме того, именно среди больных европеоидного происхождения была отмечена высокая частота встречаемости ВПЧ (OR=3,28; p=0,035). ВПЧ-негативные больные европеоидного происхождения имели 2,7-кратный повышенный риск летального исхода по сравнению с ВПЧ-позитивными (р=0,004). ВПЧ-позитивные больные РРГ в этом исследовании имели сниженный риск прогрессии заболевания (HR=0,38; 95% CI=0,12—1,15; р=0,09) и, как следствие, летального исхода (HR=0,39; 95% CI=0,5—1,5; р=0,06) по сравнению с ВПЧ-негативными.
Результаты мультицентровых клинических исследований III фазы, в которые были включены больные плоскоклеточным раком ОГШ, последовательно получавшие химиолучевую и индукционную химиотерапию, показали, что пациенты европеоидной расы имели более высокие показатели безрецидивной выживаемости по сравнению с больными негроидной расы. Медиана выживаемости составила 52,1 мес у европейцев и 23,7 мес — у афроамериканцев (р=0,009). Частота инфицирования ВПЧ у европеоидов и негроидов составила 34 и 4% соответственно. Медиана выживаемости у ВПЧ-позитивных больных европеоидов и негроидов статистически значимо различалась и составила 70,6 и 0,9 мес (р=0,032). В то же время между ВПЧ-негативными больными европеоидами и негроидами значимых различий по уровню общей выживаемости не выявлено [46].
По мнению некоторых авторов, учитывая благоприятное клиническое течение, прогноз и исход у больных ВПЧ-позитивной формой плоскоклеточного РПР и РРГ, его следует рассматривать как самостоятельный тип, который требует особого подхода к терапии [47—53]. Предполагается несколько путей уменьшения агрессивности лечения у больных ВПЧ-позитивной формой рака: использование ингибиторов рецептора эпидермального фактора роста (EGFR), снижение суммарной дозы лучевой терапии в общей схеме химиолучевой терапии с цисплатином либо замена химиолучевой терапии оперативным вмешательством с менее интенсивной адъювантной терапией [33, 37, 41, 43, 50, 54, 55].
Для доказательства эффективности реализации описанных путей уменьшения агрессивности лечения требуется проведение проспективных клинических исследований III фазы, в которое необходимо включать большое число ВПЧ-позитивных больных, что трудновыполнимо. Даже проведение ретроспективного исследования сопряжено с большими трудностями, поскольку канцер-регистры большинства стран не содержат информацию о ВПЧ-статусе больных плоскоклеточным РПР и РРГ [14]. Недавно были начаты рандомизированные клинические исследования (E1308, RTOG 1016, De-ESCALaTE HPV, NCT1088802/J0988, NCT01221753), направленные на оценку эффективности неагрессивной стратегии лечения данной категории больных. Предполагается, что ВПЧ-позитивные опухоли ОГШ обладают повышенной радиочувствительностью, в связи с чем для этой категории больных предполагается снижение интенсивности радиотерапевтического воздействия с 70 до 54 Гр. Кроме этого, проверяется и возможность снижения химиотерапевтической нагрузки, и замена цисплатина цетуксимабом [56].
Заключение
Принимая во внимание тенденцию к увеличению вирус-позитивной формы РПР и РРГ как среди больных российской, так и европейской популяции в целом, мы сочли актуальным в рамках данного обзора провести сравнительную оценку ВПЧ-позитивного и ВПЧ-негативного рака указанной локализации, акцентируя внимание на клинических особенностях течения заболевания. ВПЧ-позитивная категория больных интересна с клинической точки зрения, поскольку у вирус-позитивных по сравнению с вирус-негативными больными отмечены высокий уровень безрецидивной и общей выживаемости, лучший прогноз, ответ на химиолучевую терапию и, как следствие, благоприятный исход. Более того, для ВПЧ-позитивных больных характерна специфическая клиническая манифестация, которая проявляется в малых размерах опухоли, преимущественно региональном метастазировании и пузырчатой форме метастазов, что является маркером присутствия вируса в опухоли. Вышеприведенные факты убедительно показывают, что ВПЧ-позитивную форму РПР и РРГ следует отнести к отдельной категории и рассматривать как самостоятельную в клиническом отношении группу. ВПЧ-статус больных следует учитывать при проведении дифференциальной диагностики (для верифицикации первичного опухолевого очага) и проведении корректной терапии, направленной на улучшение показателей выживаемости больных РПР и РРГ.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
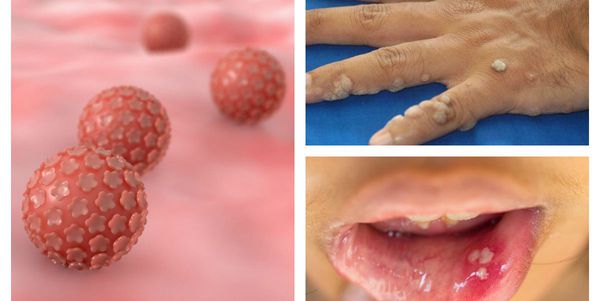
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
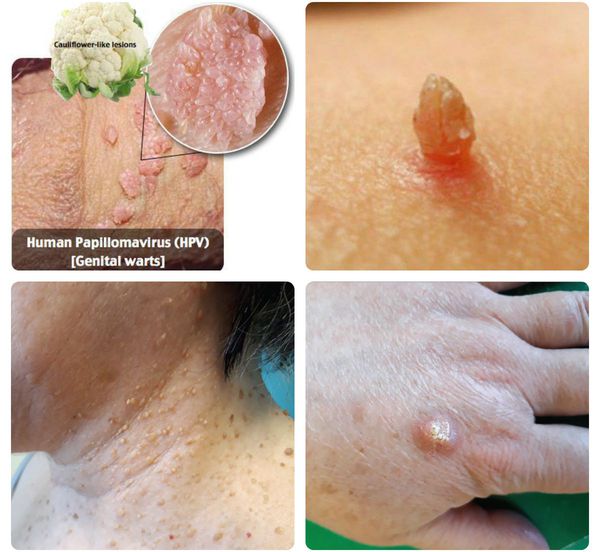
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
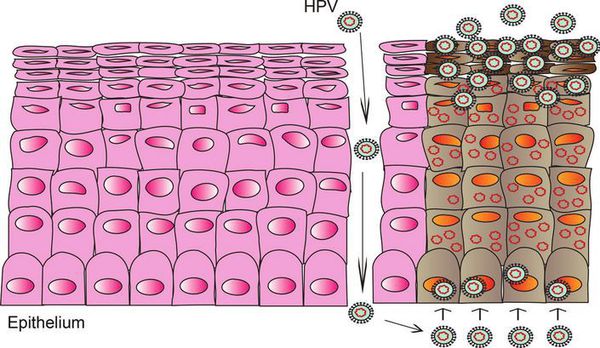
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
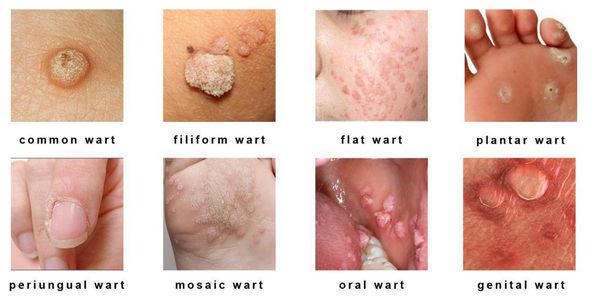
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
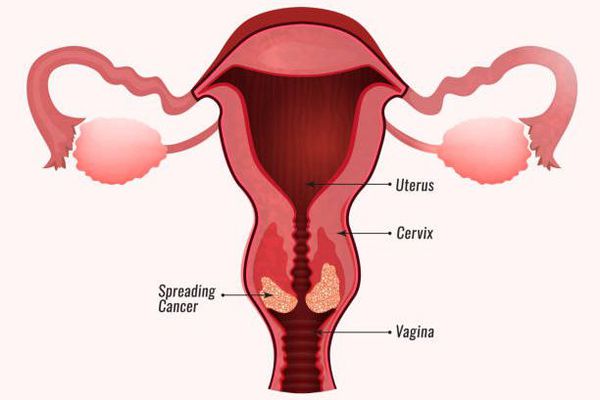
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
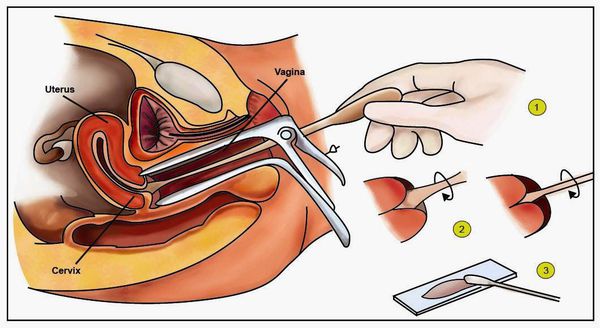
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
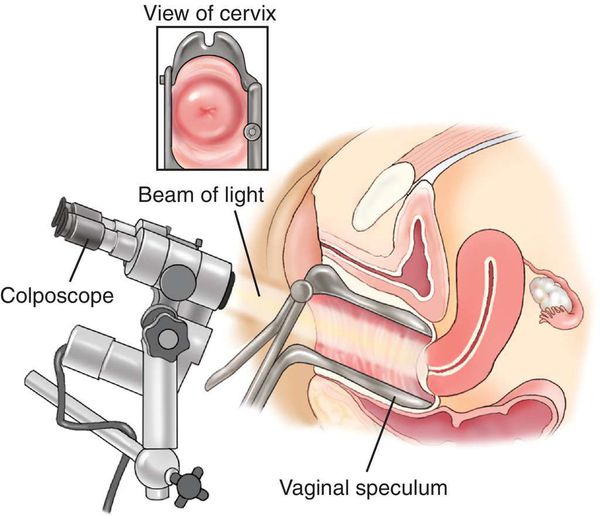
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
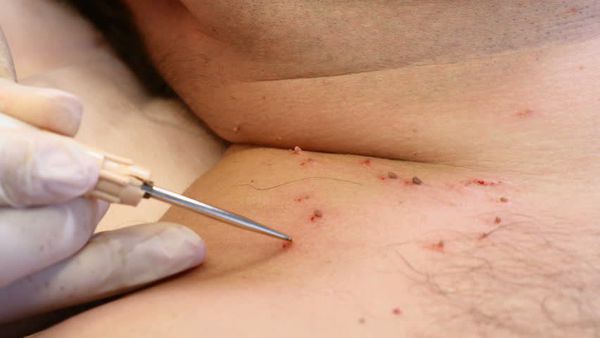
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Медицинский радиологический научный центр Минздрава России, Обнинск, Калужская область
Повторная конформная лучевая терапия рецидивных опухолей органов головы и шеи
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(2): 54‑57
Представлены клинические случаи повторного конформного облучения рецидивного плоскоклеточного рака органов головы и шеи. Использование современных технических достижений лучевой терапии позволяет проводить повторное облучение опухолей в эффективных разовых (гипофракционирование) и суммарных очаговых дозах (СОД) и снизить лучевую нагрузку на окружающие нормальные структуры. Реконструкция СОД первичного конвенционального облучения позволяет оценить риски возможных осложнений повторного облучения.
Медицинский радиологический научный центр Минздрава России, Обнинск, Калужская область
Приводим собственные клинические наблюдения случаев повторного облучения рецидивных опухолей головы и шеи.
Клиническое наблюдение 1.
Больной П., 1977 года рождения, проходил лечение в клинике МРНЦ им. Цыба в мае 2010 г. с диагнозом: плоскоклеточный рак полости носа cT1N0M0. Проведено комбинированное лечение: одновременная химиолучевая терапия в режиме гиперфракционирования с неравномерным дроблением дневной дозы (1 Гр + 1,5 Гр). После этапной оценки степени регрессии опухоли на суммарной очаговой дозе (СОД) 50 Гр в связи с регрессией менее 50% проведено оперативное вмешательство в объеме резекции остаточной опухоли полости носа. Больной регулярно наблюдался в течение 4 лет. В мае 2014 г. у пациента диагностирован рецидив опухоли, по поводу чего проведено повторное конформное облучение на фоне полихимиотерапии с использованием препаратов платины и таксотера. Область носоглотки является одной из наиболее сложных при планировании лучевой терапии, особенно с учетом сложности оценки реально полученной лучевой нагрузки на органы риска (спинной мозг, головной мозг, височно-нижнечелюстные суставы, большие слюнные железы и верхний констриктор глотки) при предшествующем конвенциональном облучении (облучение прямоугольными полями, двухмерное планирование, отсутствие фиксации больного). Поэтому для оценки первичной лучевой нагрузки была проведена реконструкция полей облучения в системе объемного планирования, что позволило нам убедиться в том, что полученная органами риска лучевая нагрузка не превышала толерантные дозы (табл. 1).

Таблица 1. Реконструированные СОД, полученные органами риска первичного конвенционального облучения и СОД повторного конформного облучения. Больной П.
С учетом близкого расположения к мишени нормальных органов и тканей и с целью минимизации воздействия на них была выбрана методика облучения с модуляцией интенсивности пучка (IMRT) (рис. 1 и далее).

Рис. 1. Дозное распределение при повторном облучении очага в носоглотке методикой IMRT. Градиентом цвета обозначен переход от максимальной дозы (красное) к минимальной (синий цвет, 10% от максимальной). Покрытие мишени (PTV) не менее 95%.
Разовая очаговая доза (РОД) составила 3 Гр, поскольку проведение лучевой терапии в традиционном режиме по 2 Гр на уже облученные опухоли является, на наш взгляд, малоэффективной. Гипофракционирование дозы позволяет лучше воздействовать на пул радиорезистентных клеток, повышая эффективность лечения в целом. СОД составила 48 Гр (EQD2 =57,6 Гр). Интервал выбора СОД при повторном облучении рецидивов, по мнению разных авторов, должен составлять эквивалент не менее 50—60 Гр в традиционном режиме. Одной из сложных и дискутабельных проблем при повторном облучении является определение толерантности опухоли и местных тканей при измененных режимах фракционирования (соотношения α/β). Поскольку консенсуса в отношении данного вопроса в доступной нам литературе нет, мы выбрали значение α/β, равное 3, так как оно наиболее точно, на наш взгляд, отражает токсичность лечения.
Больному план лечения был реализован в полном объеме. Острые лучевые реакции были выражены незначительно и проявились в виде мукозита 1-й степени. При контрольном осмотре через 1 мес после окончания лечения опухоль не визуализировалась. Больной наблюдается нами в течение 1 года без признаков рецидива и поздней лучевой токсичности.
Клиническое наблюдение 2.
Больной Е., 1957 года рождения, проходил лечение в клинике МРНЦ им. Цыба в июне 2013 г. с диагнозом: плоскоклеточный рак ротоглотки (небная миндалина справа) cT2N0M0. Проведен радикальный курс одновременной химиолучевой терапии, в конвенциональном режиме РОД 2 Гр до СОД 60 Гр. После окончания лечения достигнута полная регрессия опухоли, однако через 1 год он вновь обратился в клинику с рецидивом образования миндалины. При обращении у больного имелись осложнения предшествующего лечения в виде ксеростомии 1—2-й степени и тризма 1-й степени. Проведен курс повторной конформной лучевой терапии в режиме гипофракционирования РОД 3 Гр до СОД 48 Гр, с одновременной химиотерапией (цисплатин + 5-фторурацил). Методика IMRT в данном случае позволила практически полностью исключить из поля облучения височно-нижнечелюстные суставы и большие слюнные железы (рис. 2), поскольку после проведения реконструкции ранее полученных доз облучения органов риска было выявлено их превышение (табл. 2). Острые лучевые реакции во время повторного облучения проявились в виде мукозита 2-й степени. В настоящее время больной наблюдается в течение 1 года без признаков рецидива и усиления лучевых повреждений.

Таблица 2. Реконструированные СОД, полученные органами риска первичного конвенционального облучения и СОД повторного конформного облучения. Больной Е.

Рис. 2. Дозное распределение при повторном облучении очага в носоглотке методикой IMRT. Градиентом цвета обозначен переход от максимальной дозы (красное) к минимальной (синий цвет, 10% от максимальной). Покрытие мишени (PTV) не менее 95%.
Клиническое наблюдение 3.
Больной С., 1951 года рождения, проходил лечение в клинике МРНЦ им. Цыба в январе 2010 г. с диагнозом: плоскоклеточный рак гортани cT2N2M0. Проведен радикальный курс одновременной химиолучевой терапии, в конвенциональном режиме РОД 2 Гр до СОД 60 Гр. После окончания лечения выявлена остаточная опухоль в лимфатических узлах шеи, однако больной категорически отказался от операции. В мае 2014 г. отметил бурный рост лимфатических узлов, но за помощью обратился только в декабре 2014 г. Проведен курс повторной конформной лучевой терапии в режиме гипофракционирования РОД 3 Гр до СОД 45 Гр (EQD2 =54 Гр), с одновременной химиотерапией (цисплатин). Больному предварительно была проведена реконструкция ранее полученных доз, не выявившая превышения значений толерантности (табл. 3). При этом была выбрана методика IMRT, поскольку это позволяло в значительной степени снизить нагрузку на ранее облученную гортань (рис. 3).

Таблица 3. Реконструированные СОД, полученные органами риска первичного конвенционального облучения и СОД повторного конформного облучения. Больной С.

Рис. 3. Дозное распределение при повторном облучении очага в носоглотке методикой IMRT. Градиентом цвета обозначен переход от максимальной дозы (красное) к минимальной (синий цвет, 10% от максимальной). Покрытие мишени (PTV) не менее 95%.
В настоящее время больной наблюдается в течение полугода, имеется остаточное образование в лимфатических узлах шеи, однако по результатам проведенного ПЭТ/КТ уровень накопления радиофармпрепарата является неспецифичным (2,7 SUV ед.). Острые лучевые реакции во время лечения были умеренными (мукозит 2-й степени, дерматит 1-й степени). Признаков поздней лучевой токсичности не отмечено.
Современные технические достижения лучевой терапии позволяют проводить эффективное облучение локорегионарных рецидивов опухолей головы и шеи, несмотря на топографоанатомические сложности в данной области, при умеренном воздействии на органы риска. Медиана выживаемости при проведении конформной лучевой терапии рецидивных опухолей головы и шеи, по данным литературы, составляет 15—25,2 мес, локорегионарный 2-летний контроль 50—58% [10, 11]. Однако остается дискутабельным ряд вопросов, таких как критерии отбора больных на повторное облучение, выбор режима и препаратов при проведении одновременной химиотерапии. На наш взгляд, весьма полезным при планировании повторного облучения является реконструкция условий первичного облучения в системах объемного планирования, что позволит на основе полученной гистограммы доза—объем с приемлемой точностью оценить полученные органами риска лучевые нагрузки. Максимально возможное достижимое сокращение объемов повторного облучения нормальных органов и тканей (ALARA) позволяет минимизировать риски развития тяжелых лучевых повреждений. Таким образом, повторное конформное облучение является высокоэффективной методикой лечения достаточно сложной группы больных с рецидивами плоскоклеточного рака органов головы и шеи.
Читайте также:

