Львиный зев при папилломах
Обновлено: 22.04.2024
Статья посвящена папилломавирусной инфекции (ПВИ) - одной из самых распространенных вирусных инфекций, передаваемых половым путем. Представлены сведения о биологии вируса, путях заражения, патогенезе, клинических проявлениях инфекции. Рассматриваются различные клинические формы заболевания: манифестные - остроконечные кондиломы (аногенитальные бородавки), субклинические (интраэпителиальная неоплазия) и латентные. Обсуждаются подходы к лечению лечения ПВИ, включающие деструктивные (физические, химические), хирургические, иммунологические и комбинированные методы. Приводятся доказательства эффективности применения препарата Изопринозина - иммуномодулятора с противовирусной активностью при различных формах ПВИ, изученного в многочисленных зарубежных и отечественных исследованиях.
Ключевые слова: папилломавирусная инфекция, остроконечные кондиломы, деструктивные методы лечения, иммунокорригирующая терапия, Изопринозин
Папилломавирусная инфекция (ПВИ) относится к наиболее распространенным инфекциям, передаваемым половым путем. В США ежегодно выявляют около 5 млн новых случаев этого заболевания. По данным зарубежных исследований, практически каждый человек, живущий половой жизнью, инфицирован вирусом папилломы человека (ВПЧ). Заражение ВПЧ может произойти даже при однократном половом контакте вследствие высокой контагиозности вируса. Более половины женщин и мужчин приобретают эту инфекцию в течение первых двух лет сексуально активной жизни. Риск заражения значительно возрастает при наличии многочисленных половых партнеров и раннем начале половой жизни. По данным отечественных исследований, разные формы ПВИ гениталий встречаются у 44,3 % пациенток, обращающихся в гинекологические учреждения по различным причинам. По данным биопсий шейки матки, субклинические формы инфекции выявляются у 8,1 % женщин.
Этиопатогенез папилломавирусной инфекции
ВПЧ относится к безоболочечным вирусам, содержит двухцепочечную ДНК, имеет икосаэдрическую форму. Он является строго эпителиотропным, т. к. вначале поражает базальный слой эпителия кожи и слизистых оболочек гениталий и других органов (гортани, ротовой полости, глаз и др.), а его жизненный цикл связан с дифференциацией эпителиальных клеток. Репликация ДНК ВПЧ происходит только в клетках базального слоя, а в клетках других слоев эпидермиса вирусные частицы лишь персистируют. При заражении ВПЧ в клетках эпидермиса нарушается нормальный процесс дифференцировки. Происходит клональная экспансия инфицированных ВПЧ-клеток базального слоя с их трансформацией и последующей малигнизацией. Этот процесс контролируют гены ВПЧ, кодирующие ранние белки Е6 и Е7. Морфологически при этом наблюдаются деформация слоев эпидермиса, общее утолщение кожи и слизистых оболочек. В стадии развитой инфекции клетки шиповатого слоя при переходе в зернистый оказываются наиболее активными в синтезе вирусной ДНК. Эта фаза жизненного цикла ВПЧ характеризует второй этап экспансии вирусной инфекции внутри эпидермиса. Экспрессия поздних генов L1 и L2 наступает на конечной стадии дифференцировки в роговом слое, где наблюдаются активная сборка зрелых вирусных частиц и их выделение из клеток на поверхности кожи. Участки кожи и слизистых оболочек, на поверхности которых происходит активное выделение и почкование вируса, представляют наибольшую опасность для контактного заражения [1, 15].
Типы ВПЧ "высокого риска", особенно 16-й, 18, 31 и 45-й, ассоциируются с дисплазией шейки матки, а также с раком шейки матки, заднего прохода, вульвы и полового члена. Типы ВПЧ "низкого риска", прежде всего 6-й и 11-й, вызывают развитие остроконечных кондилом. Пациенты с остроконечными кондиломами могут быть одновременно инфицированы вирусами нескольких типов. Определение типа ВПЧ помогает оценить риск малигнизации [2].
Сексуальные контакты — основной путь заражения ВПЧ. Аутоинокуляция, контактнобытовой путь передачи инфекции допускаются, но изучены мало. Заражению способствуют микротравмы кожи и слизистых оболочек. Возможен вертикальный способ заражения, т. е. вирус может передаться новорожденному во время прохождения по родовым путям и послужить причиной развития рецидивирующего респираторного папилломатоза.
Клинические проявления ПВИ
В большинстве случаев инфекция ВПЧ протекает бессимптомно. Наиболее известными практическим врачам проявлениями этой инфекции являются остроконечные кондиломы, которые возникают в среднем через 1—3 месяца после заражения. С момента инфицирования и до развития предраковых заболеваний или рака in situ обычно проходит от 5 до 30 лет и очень редко - менее года. У 40 % больных отмечены субклинические, малосимптомные проявления заболевания в виде мелких плоских бородавок.
Манифестация инфекции ВПЧ наиболее часто сопровождается появлением остроконечных кондилом (аногенитальных бородавок). Они возникают, как правило, на коже и слизистых оболочках половых органов или в анальной области в местах трения и травматизации при половом акте. У лиц, практикующих орально-генитальные контакты, кондиломы могут возникнуть на губах, языке, небе. Чаще высыпания представлены узелковыми образованиями, сгруппированными по 5-15 элементов, иногда сливающимися в бляшки; реже высыпания бывают единичными. Слияние в крупные бляшки происходит при иммуносупрессии, соматических заболеваниях, метаболических нарушениях, интоксикациях. У некоторых больных с выраженными нарушениями клеточного иммунитета (ВИЧ-инфекцией, на фоне иммуносупрессивной терапии), при беременности развиваются очень крупные генитальные бородавки - гигантские кондиломы Бушке-Левенштейна. Эта предраковая инвазивная и деструктирующая опухоль ассоциируется с ВПЧ-6 и ВПЧ-11. Кондиломы могут быть плоской, конической или напоминающей цветную капусту форм. Цвет образований варьируется от беловато-телесного до розовато-синюшного, реже - красновато-коричневого.
Клинически выделяют четыре типа остроконечных кондилом:
Остроконечные кондиломы обычно бессимптомны и часто случайно выявляются самим больным или врачом при осмотре. Однако крупные или травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом и гнойным отделяемым. При локализации кондилом в уретре могут развиться признаки вялотекущего уретрита, кондиломы могут вызвать раздвоение струи мочи или даже обструкцию уретрального отверстия [3].
Диагностика и принципы лечения
Для диагностики ВПЧ-инфекции помимо клинического осмотра проводят лабораторные методы исследования: цитологические, гистологические, а также молекулярно-генетические, получившие в последнее время широкое распространение. ПЦР является более чувствительным методом диагностики, чем цитологическое исследование, и способна выявить субклинические и латентные формы заболевания. Метод имеет не только важную диагностическую ценность, но и прогностическое значение, т. к. позволяет идентифицировать отдельные типы ВПЧ [2].
Лечение ВПЧ-инфекции направлено на устранение ее клинических проявлений - остроконечных кондилом.
Для этого применяют различные методы наружной терапии:
Эффективность этих методов лечения составляет от 30 до 70 %. Активность ВПЧ зависит прежде всего от иммунного статуса и реакции организма на инфекцию. Для повышения эффективности терапии в лечебный комплекс необходимо включать противовирусные препараты и иммуномодуляторы для стимуляции иммунного ответа пациента [4, 16].
Показано, что иммунный ответ хозяина имеет большое значение в предотвращении клинической манифестации ВПЧ-инфекции. Клеточный иммунитет играет основную роль как в персистенции, так и в спонтанном регрессе кондилом, который может наступить через 6-8 месяцев. Это подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний у реципиентов трансплантата внутренних органов и ВИЧ-инфицированных. Нарушение Т-клеточного иммунитета у больных кондиломами проявляется снижением количества клеток Лангерганса в очагах поражения и большом числе CD4+- и CD8+-T-лимфоцитов в инфильтрате регрессирующих генитальных бородавок [1].
Изопринозин в лечении ПВИ
Иммуномодулирующее действие Изопринозина заключается в усилении пролиферации и стимулировании функций Т-лимфоцитов: Т-хелперов, естественных клеток-киллеров; увеличении продукции интерлейкинов и нормализации продукции интерферона. Препарат стимулирует биохимические процессы в макрофагах, повышает хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфноядерных клеток. Иммуномодулирующие потенции Изопринозина более активно проявляются в стимулировании клеточного, чем гуморального, иммунитета. Опытным путем было показано, что его действие в большей степени проявляется при иммуносупрессии по сравнению со здоровым организмом. Изопринозин восстанавливает и усиливает деятельность клеток иммунной системы, тем самым повышает способность организма эффективно противостоять инфекциям.
Препарат отличается от других иммуномодуляторов тем, что обладает не только иммуномодулирующим, но и противовирусным (подтвержденным in vivo и in vitro) действием. Противовирусное действие Изопринозина заключается в подавлении репликации ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Фармакокинетика препарата хорошо изучена. Максимальная концентрация Изопринозина достигается через час после приема 1,5 г препарата. Первый период полувыведения (50 минут) связан в выведением инозина и проходит с образованием мочевой кислоты. Второй период полувыведения диметиламино-2-пропанол β-ацетамидо-бензоата равен 3—5 часам, при этом метаболиты выводятся почками. Во время приема Изопринозина не рекомендуется применять иммунодепрессанты, а также лекарственные препараты, обладающие нефротоксичным действием [5, 6].
Благодаря своему комплексному действию Изопринозин более 35 лет успешно применяется при лечении различных, в т. ч. трудно поддающихся терапии, инфекционных заболеваниях кожи и слизистых оболочек. Основными показаниями к применению препарата в дерматовенерологии служат вирусные дерматозы: ПВИ, простой герпес, опоясывающий лишай. Многочисленные исследования подтвердили высокую клиническую эффективность Изопринозина в лечении персистирующих герпес-вирусных инфекций. Антивирусная активность препарата проявляется не только в области клинических проявлений (везикулы, эрозии), но и в нервных ганглиях. Поэтому он оказывает свое лечебное действие как в фазе обострения герпетической инфекции, так и в межрецидивный период. Препарат можно назначать в поддерживающей дозе на период до 6 месяцев [7, 14, 18].
Проведенные исследования показали, что применение инозиплекса в комплексе с деструктивными методами у пациентов с остроконечными кондиломами способствует более активному их разрешению и уменьшает частоту рецидивов, что объясняется активным иммунокорригирующим и противовирусным действиями препарата во всех зонах инвазии ВПЧ в коже [10, 17]. Препарат применяли по 1000 мг три раза в сутки в течение 28 дней.
В настоящее время несомненной представляется ведущая роль ВПЧ в генезе рака шейки матки. ВПЧ также может инициировать и поддерживать хронические воспалительные процессы в нижних отделах гениталий, поскольку при ВПЧ-индуцированном изменении структуры эпителия создаются предпосылки к заражению различными вирусными, бактериальными, протозойными, грибковыми и другими инфекциями. Показано, что одновременное инфицирование ВПЧ и вирусом простого герпеса II типа в два раза повышает риск развития плоскоклеточного рака шейки матки [19]. Имеются данные об успешном применении Изопринозина в лечении ПВИ шейки матки, цервикальной интраэпителиальной неоплазии и даже преинвазивного рака шейки матки.
В поликлиническом отделении Центра охраны здоровья матери и ребенка была изучена эффективность комбинированного лечения (этиотропный препарат, Изопринозин и абляция) 64 больных с гистологически подтвержденными субклиническими формами ПВИ на фоне хронического цервицита. Все пациентки были разделены на основную группу, в которой применяли комбинированное лечение с Изопринозином и этиотропным средством, и контрольную группу, где после курса этиологического лечения проводили только локальную монодеструкцию очагов плоскоклеточного интраэпителиального поражения. Изопринозин назначали по 2 таблетки (1000 мг) 3 раза в сутки на протяжении 5 дней за 7-10 дней до деструкции очагов. Анализ результатов проведенного лечения и последующее наблюдение за пациентками показали, что эффективность комбинированного лечения с применением Изопринозина была выше и составила 87,5 %, а при монодеструкции - 65,6 %. Рецидивирование ПВИ к 6-му месяцу наблюдения было выявлено лишь у 9,4 % женщин, принимавших Изопринозин, а в контрольной группе - у 28,1 % пациенток. Симптоматика воспалительного процесса на шейке матки наблюдалась только при рецидиве ВПЧ-инфекции. Кроме того, на фоне комплексного лечения через 6 месяцев чаще наблюдалась элиминация ВПЧ (65,6 и 46,9 % соответственно) и более качественная эпителизация. На основании полученных данных авторы пришли к выводу, что адекватная иммунотерапия способствует более полной элиминации ПВЧ, т. к. позволяет воздействовать не только на участок эпителия, где произошла клиническая манифестация, но и на резервуары ВПЧ в эпителии, находящиеся в латентном состоянии. Поэтому включение антивирусного иммуномодулирующего препарата Изопринозин в курс лечения больных хроническим цервицитом и ПВИ является обоснованным и перспективным [5].
Заключение
ПВИ вследствие ее широкой распространенности и отсутствия надежных методов лечения на сегодняшний день является актуальной проблемой в клинической практике. Терапевтическая стратегия при этом заболевании должна быть направлена не только на удаление локальных очагов инфекции — остроконечных кондилом, но и на воздействие на субклинические и латентные формы ВПЧ-инфекции. При этом большое значение в предотвращении рецидива и процесса канцерогенеза имеет элиминация ВПЧ. Поэтому в терапевтический комплекс необходимо включать препараты с противовирусным и иммуномодулирующим действиями для активации иммунной системы организма и подавления вирусной активности. Изопринозин является одним из наиболее изученных и эффективных иммунных препаратов с противовирусным действием. Более 35 лет его с успехом применяют в широкой клинической практике для лечения ПВИ и других вирус-ассоциированных заболеваний кожи и слизистых оболочек. Хорошая переносимость препарата, минимум побочных эффектов, возможность применять его в индивидуальной дозировке и в комбинации с другими методами лечения позволяют использовать его в лечении ВПЧ как у детей, так и у взрослых.

Геморроидальные узлы — расширенные вены заднего прохода и прямой кишки в виде небольших узелков в области ануса. Это специфический симптом геморроя. Геморроидальные узлы бывают наружные — расположенные под кожей промежности у края заднего прохода, и внутренние — локализуются в подслизистом слое просвета кишечника. Наличие геморроидальных узлов сопровождается жжением, зудом в заднем проходе, ощущением тяжести, ректальным кровотечением. Диагноз подтверждают на основании данных внешнего осмотра, пальцевого ректального исследования, аноскопии, ректороманоскопии. Наиболее эффективно хирургическое лечение геморроидальных узлов, но также используют консервативные методы терапии.
Виды геморроидальных узлов
Различают внутренние, наружные и комбинированные геморроидальные узлы. Наружные или подкожные узлы располагаются ниже зубчатой линии прямой кишки. Изменения затрагивают дистальный (задний) отдел прямой кишки и мышечно-связочный аппарат ануса. Наружные геморроидальные узлы видны при внешнем осмотре. Это уплотнения небольшого размера, выпячиваются наружу в виде шишечек или пальпируются под кожей.
Внутренние или подслизистые геморроидальные узлы находятся в прямой кишке под слизистой оболочкой выше зубчатой черты. Геморроидальные узлы, если не выпадают из анального отверстия, можно обнаружить лишь с помощью осмотра прямой кишки специальным прибором. Узлы имеют круглую форму с гладкой слизистой поверхностью, на толстой ножке, при надавливании легко опорожняются.
При комбинированной форме геморроя определяют внутренние и наружные геморроидальные узлы.
Причины геморроидальных узлов
В основе формирования геморроидальных узлов выделяют два основных фактора. Первый - это сосудистый или гемодинамический. При нарушении оттока кровь застаивается, кавернозные тела прямой кишки увеличиваются, развиваются их дистрофические изменения. При значительном расширении кавернозных тел еще ослабевает продольная мышца прямой кишки, она уже не в состоянии удерживать геморроидальные узлы, из-за чего они еще больше выпячиваются в области промежности.
Ухудшают кровообращение кишки и провоцируют формирование узлов опухоли малого таза, кишечные инфекции, портальная гипертензия (повышенное давление в воротной вене), сердечная недостаточность.
Справка! Сосудистый фактор преобладает на ранних стадиях геморроя, когда имеется возможность обратимости патологического процесса.
Второй фактор — механический. Дистрофические изменения в мышечно-связочном аппарате, который закрепляет узлы внутри анального отверстия, приводят к постепенному и необратимому смещению узлов в направлении ануса и выпадению из анального прохода. Механический фактор доминирует на поздних стадиях геморроя.
К заболеванию предрасполагают другие факторы:
малоподвижный образ жизни,
длительное вынужденное положение: сидя, стоя на ногах,
злоупотребление острой, соленой пищей,
длительные запоры, диарея,
травмы при родах,
врожденные дефекты в связочном аппарате.
Благоприятным фоном для развития геморроя служат постоянные стрессы, психоэмоциональное переутомление, психические расстройства. Все эти факторы негативно сказываются на состоянии организма в целом, в том числе нарушают функциональность прямой кишки. У лиц преклонного возраста расширение вен прямой кишки связано со слабостью и атрофией мышечных волокон.
У женщин риск формирования геморроидальных узлов связан с беременностью. Увеличенная матка сдавливает кишечник, нарушая процесс дефекации. К запорам в период беременности предрасполагает прием железосодержащих препаратов, повышенный уровень прогестерона в крови.
Справка! Повторное деторождение увеличивает риск приобрести геморроидальные узлы.
Провоцирующие факторы геморроидальных узлов у детей - это задержка стула, частое высаживание на горшок, длительный плач. Для учеников средней и старшей школы характерно длительное пребывание в сидячем положении.
Симптомы геморроидальных узлов
Первый симптом наружного геморроя — боль в области прямой кишки. Болезненные ощущения возникают спонтанно или связаны с актом дефекации. Интенсивность болевого синдрома разная: от незначительного дискомфорта до невыносимой боли.
зуд и жжение в перианальной области,
ощущение тяжести и инородного тела в кишечнике,
возникновение прозрачных слизистых выделений из заднего прохода,
выпадение геморроидальных узлов,
Кровотечение при наружном геморрое появляется редко. Как правило, кровь остается на туалетной бумаге или нижнем белье, в редких случаях на верхушке каловой массы. Также человек самостоятельно может прощупать болезненные образования в области ануса, похожие на шишечки. При воспалении узлов болезненность усиливается, повышается температура тела до 37,1–38°С.
Внутренние геморроидальные узлы на раннем этапе не имеют специфических проявлений. Симптомы возникают по мере их роста. Основной признак - это кровотечение.
В развитии внутреннего геморроя выделяют четыре стадии:
I стадия. Варикозное расширение вен незначительное, и не доставляет ощутимого дискомфорта. При травмировании узлов твердыми каловыми массами возникает воспалительный процесс. Пациенты жалуются на болезненность в области прямой кишки во время дефекации, зуд и жжение вокруг анального отверстия. На туалетной бумаге и нижнем белье определяются вкрапления крови.
II стадия. Геморроидальные узлы увеличиваются в размерах. Каждый акт дефекации сопровождается болезненностью. При тяжелой физической нагрузке, во время кашля, опорожнения кишечника узлы выпадают наружу из заднего прохода, потом скрываются самостоятельно. Кровянистые выделения более обильные. Из-за потери крови появляются симптомы анемии: слабость, быстрая утомляемость, головокружение, бледность и сухость кожи.
III стадия. Внутренние узлы выпадают из анального отверстия при малейшей физической нагрузке. Самопроизвольно не втягиваются, узлы приходится вправлять вручную. Пациента беспокоит острая непроходящая боль, ощущение инородного тела в области прямой кишки. Формируются анальные трещины, которые сопровождаются зудом, жжением, спазмом анального сфинктера.
Клиническая картина и скорость формирования внутренних геморроидальных узлов зависит от особенностей организма и интенсивности провоцирующих факторов.
Осложнения геморроидальных узлов
Крупные по размеру геморроидальные узлы снижают качество жизни, доставляют постоянный дискомфорт и боль, у пациента развивается ректофобия (стулобоязнь). Выход узлов за пределы анального канала, особенно у лиц преклонного возраста, приводит к бесконтрольному выделению газов, твердых и жидких каловых масс.
Частое осложнение внутреннего геморроя — тромбоз геморроидального узла. Если своевременно не оказать медицинскую помощь происходит некроз и изъязвление слизистой оболочки. В отдельных случаях патологический процесс затрагивает жировую ткань, которая окружает прямую кишку, развивается гнойный парапроктит, в тяжелом случае — сепсис.
Непрекращающиеся кровотечения угрожают железодефицитной анемией. Люди с таким диагнозом плохо переносят физические нагрузки, быстро устают, ослаблены, часто болеют ОРВИ, бронхитами. Беспокоит бессонница, непроизвольное мочеиспускание, отсутствие аппетита, со стороны сердечно-сосудистой системы — пониженное артериальное давление, обмороки, учащенное сердцебиение.
Диагностика геморроидальных узлов
При формировании наружных геморроидальных узлов или подозрении на внутренний геморрой необходима консультация проктолога. При первичном обращении врач проводит проктологический осмотр. На проктологическом кресле осматривает задний проход и перианальную область. Пальпаторно определяет места варикозного расширения вен в виде плотных узлов разной локализации и размера. Обращает внимание на цвет и состояние кожи заднего прохода, степень выпадения узлов, оценивает возможность их вправления.
Для более детального осмотра прямой кишки используют аноскоп, сигмовидной кишки — специальную трубку (ректороманоскоп). Эндоскопические исследования позволяют увидеть количество геморроидальных узлов на глубину до 25 см, степень их выпячивания, определить другие патологические изменения, провести биопсию видоизмененного участка.
Ирригоскопия толстого и тонкого кишечника с помощью введения контрастного вещества информативна в рамках внутренних геморроидальных узлов, опухолей, аномалий развития. Исследование незаменимо для детей. Его не назначают при геморроях, сопровождающихся интенсивной болью из-за риска спровоцировать массивное кровотечение.
К вспомогательным методам относят анализ на скрытую кровь, расширенный анализ кала. Данные исследований позволяют судить о функциональной деятельности кишечника.
В ходе диагностики необходимо исключить другие патологии со схожими симптомами: рак прямой кишки, выпадение прямой кишки, кондиломы, анальную трещину и бахромки, проктит, варикоз ректальных вен.
Лечение геморроидальных узлов
Лечение может быть консервативное и хирургическое. Всем пациентам рекомендована диета с большим содержанием клетчатки. Для нормализации стула в рацион включают продукты слабительного действия: свеклу, чернослив, инжир.
Консервативная терапия
Медикаментозное лечение эффективно на ранних стадиях заболевания. С учетом выраженности симптомов и причин формирования геморроидальных узлов назначают разные группы препаратов:
нестероидные противовоспалительные — уменьшают выраженность боли, тормозят воспалительный процесс;
лактобактерии — нормализуют микрофлору кишечника и функции ЖКТ;
антикоагулянты — снижают степень проницаемости сосудов, профилактируют тромбообразование;
венопротекторы — нормализуют микроциркуляцию, повышают тонус венозных стенок.
При запорах возможно назначение слабительных препаратов. Эффективна лечебная физическая культура, дозированные прогулки. Выпавшие узлы вправляют вручную.
Хирургические методы
Малоинвазивные или радикальные операции показаны в случае отсутствия эффективности консервативной терапии, осложнений в виде тромбозов, воспалений и внутренних кровотечений.
На ранних стадиях геморроидальных узлов наиболее востребованы малоинвазивные методы:
Склеротерапия. В геморроидальные узлы инъекционно вводят специальные препараты, которые вызывают слипание сосудистых стенок.
Латексное лигирование. На ножку геморроидального узла набрасывают латексное кольцо, которое пережимает сосуды, кровоснабжение нарушается, ткани узла отмирают.
Криодеструкцию. Сосуды замораживают жидким азотом.
Радиоволновое удаление. Иссекают патологические участки радиоволнами высокой частоты.
Фотокоагуляция. Прижигают основание узла лазерным лучом.
Дезартеризация геморроидальных узлов. Перевязывают и ушивают артерии, которые кровоснабжают узлы.
Несмотря на высокую безопасность для пациентов, малоинвазивные методики не всегда применимы. На последних стадиях геморроя необходимы радикальные операции. По показаниям проводят хирургическое удаление узлов III и IV степени (геморроидэктомия Миллигана-Моргана) или геморроидэктомию по Лонго. Участок слизистой прямой кишки удаляют с последующим подтягиванием и спаданием увеличенных геморроидальных узлов.
Важно! После операции пациент должен через 2‒4 недели пройти обследование у проктолога. План дальнейшего наблюдения определяет врач в индивидуальном порядке.
При условии своевременного и грамотного лечения геморроидальных узлов прогноз благоприятный. Вероятность выздоровления при консервативной терапии на ранних стадиях достигает 70%, после хирургического лечения — 90‒95%. Однако полностью исключить рецидивы невозможно.
Профилактика геморроидальных узлов
Чтобы снизить риск возникновения геморроидальных узлов, важно вести активный образ жизни, получать умеренные физические нагрузки, соблюдать правила здорового питания, избегать длительного нахождения в положении сидя, стоя.
Профилактика рецидивов заключается в терапии венотонизирующими препаратами. С этой же целью принимают препараты для нормализации функций ЖКТ, чтобы не допускать запоров, диареи.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
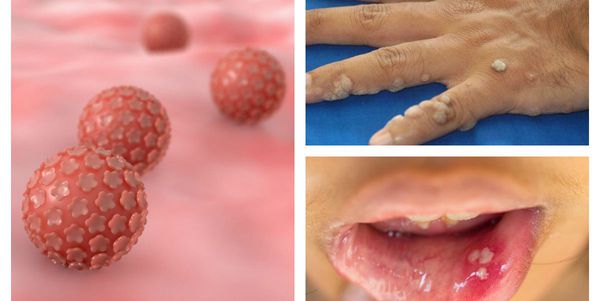
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
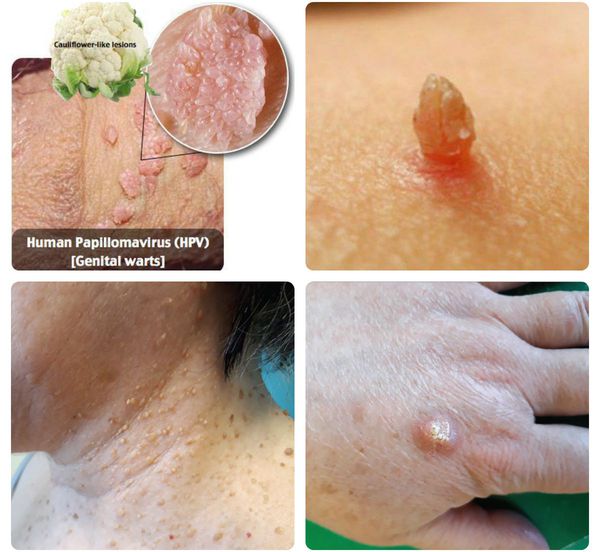
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
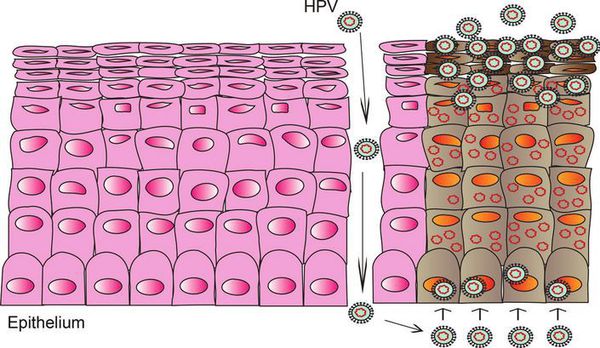
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
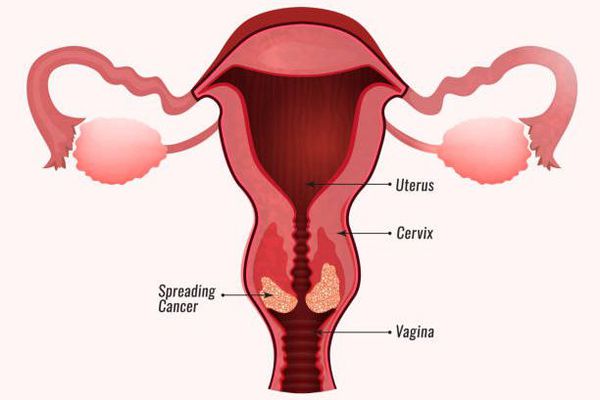
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
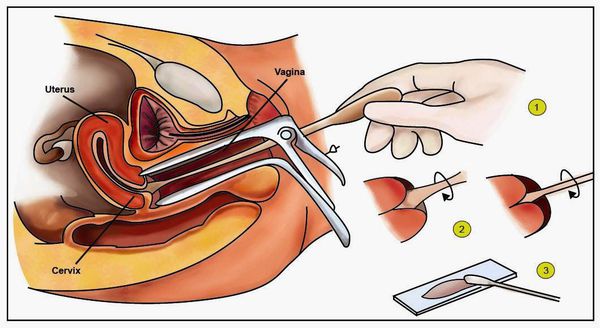
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
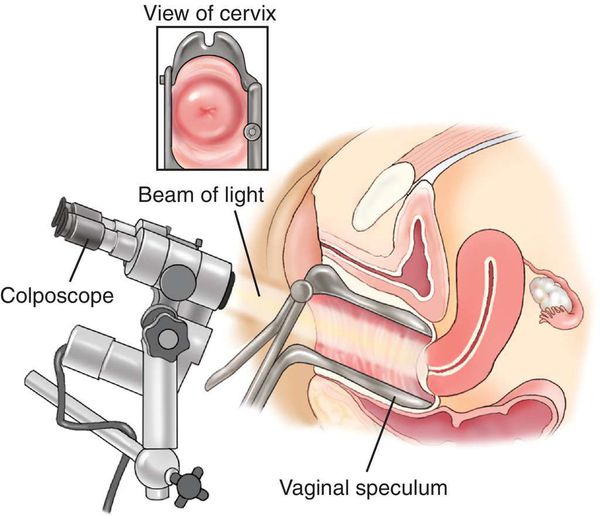
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Как охотники готовятся к охоте — изучают следы, устанавливают кормушки, размещают загонщиков, ставят стрелков на линию огня, выпускают собак — так же и иммунологи, чтобы избавить организм от вируса, поэтапно готовят и направляют процесс активации иммунной системы. Первое действие — определить мишень.
Мишень — белок вируса
Вирус папилломы, попав в клетки кожи, проявляет себя как двуликий Янус. Его геном может находиться в двух формах: или встроиться в хромосому клетки, или существовать в виде свободной молекулы — ДНК-эписомы. Если он встроился в клеточную хромосому, то при наличии предрасполагающих факторов происходит реализация программы его генома и вирус начинает размножаться. Пораженный участок превращается в папиллому, или бородавку. Причем порой это случается не на руке или ноге, а на слизистой оболочке в самых интимных местах человеческого тела. И если вирус принадлежит к особому подтипу, то лет через десять пораженные клетки, возможно, трансформируются в раковую опухоль.
Для своей успешной жизни вирус должен заставить клетку синтезировать несколько полезных ему белков. В частности, вирусу папилломы нужен белок L1, который идет на строительство оболочки новых вирусных частиц, а также белки Е6 и Е7 — они делают зараженную клетку бессмертной, это онкогенные белки.
Бороться с вирусом можно несколькими принципиально разными способами. Первый — запретить ему связываться с клетками-мишенями, второй — не дать ему в них размножаться, третий — уничтожать больные клетки вместе с вирусом. Поскольку в случае с вирусом папилломы больные клетки не содержат его в традиционном понимании — ведь после попадания в клетку от него остается одна ДНК, которая и задает синтез тех самых опасных белков, — запретить размножение нельзя. Поэтому в руках медиков остаются первый и третий способы, то есть профилактическая вакцина и терапевтическая. Недавно появился еще один — применение коротких, так называемых молчащих РНК, которые принуждают замолкнуть вирусные гены. Но движение по этому пути еще в самом начале.
Ситуация осложняется тем, что у каждого вида млекопитающих имеются свои вирусы папилломы, которые не живут в тканях других видов, а в культуре клеток вирус человека размножается чрезвычайно неохотно. В результате поиск вакцины приходится вести на мышах, а потом надеяться, что эти результаты удастся воспроизвести при испытаниях с участием добровольцев.
Большим успехом в борьбе с вирусом папилломы оказалось открытие в 1991 году интересного феномена, сделанное Чжоу Цзянем и Яном Фрэйзером, работавшими в брисбенском госпитале им. принцессы Александры, Австралия (Яна Фрэйзера в ноябре 2008 года наградили за эту работу итало-швейцарской премией фонда Бальцана в размере 1 млн швейцарских франков. — Примеч. ред.). Они обнаружили, что белки L1 самопроизвольно собираются в вирусоподобные частицы (ВПЧ) даже если внутри них нет никакого генетического материала. Такие белки очень просто и в больших количествах можно синтезировать с помощью дрожжей, встроив в них нужный ген. Из дрожжей они выходят уже в виде готовых частиц, причем их иммунногенные свойства такие же, как и у настоящего вируса. Если ВПЧ ввести в организм, то в нем начнут вырабатываться защитные антитела. Во многих экспериментах такая защита доказала свою надежность, и спустя одиннадцать лет после открытия большой эксперимент с участием 1533 добровольцев показал, что подобная вакцина от вируса папилломы человека подтипа 16 (HPV16), во-первых, вполне безопасна, а во-вторых, обеспечивает полную защиту организма. Этот результат важен еще потому, что именно на подтипы 16 вместе с 18, 31 и 45 приходится 80% всех случаев опухолевого перерождения пораженной вирусом ткани, прежде всего рака шейки матки. За оставшиеся 20% ответственны еще 13 разновидностей этого вируса. За шесть лет, прошедшие с начала эксперимента с участием добровольцев, действие вакцины не ослабло — ни одного случая заражения вирусом среди них зафиксировано не было.
Пептидные пули
Однако это все — профилактические вакцины, причем пока неизвестно, сколь быстро иммунная система забудет о той информации, которую она получила в момент прививки. Поэтому огромный интерес вызывает терапевтическая вакцина, которая уничтожает уже зараженные клетки.
Для ее создания иммунологи надеются использовать столь яркий след вируса, как те самые два белка, Е6 и Е7. Они обязательно должны быть на поверхности заболевших клеток, и, стало быть, задача состоит в том, чтобы научить клетки-киллеры находить эти следы.
Многие лаборатории в мире соревнуются на этом поприще, ведь цена победы очень велика. Для возбуждения иммунного ответа применяют и сами Е-белки, и их пептидные фрагменты (Т-эпитопы), и химерные конструкции из Е- и L-белков. (Напомним, что вещества, которые возбуждают иммунный ответ, называются антигенами.) Для усиления ответа в вакцину добавляют цитокины, белки теплового шока и другие стимулирующие элементы.
Непременный компонент вакцины — вектор, который обеспечивают доставку антигенов — Е-белков или их пептидных фрагментов — в специальные клетки иммунной системы (макрофаги, дендритные клетки), после чего те начинают вырабатывать особые белки цитокины и давать инструкции клеткам-киллерам, что им, собственно, надо уничтожать. Векторами для антигенов папилломавируса в разных опытах служили вирус осповакцины, аденовирус, альфавирус, бактерии. Надо отметить, что дендритные клетки — самые активные партнеры для возбуждения сильного иммунного ответа, поэтому желательно, чтобы антигены попадали именно в них.
Вот почему большое внимание уделяют химерным конструкциям на основе белков теплового шока, то есть содержащим и Е-белок, и белок-усилитель иммунного ответа. Белок теплового шока имеет сродство к дендритным клеткам. Именно таким методом в модельных экспериментах удалось уже при однократной иммунизации зафиксировать уменьшение размера опухоли. Сейчас несколько кандидатов в терапевтические вакцины находятся на различных проверочных стадиях, но в отличие от профилактических вакцин пока ни одна из них не дала приемлемой эффективности. Возникает мысль, что успеха можно достичь, совершенствуя все части вакцины: пептидные фрагменты, которые наиболее правильно повторяют Т-эпитопы Е-белка, вектор для направленной доставки вакцины в дендритную клетку, стимулятор иммунного ответа, а также носитель вакцины, на котором все это держится.
Параллельно в ГОСНИИГенетики был налажен синтез в дрожжах белков L1 трех типов (с одним из них была проблема), который собирался в правильные вирусоподобные частицы и правильно реагировал с антипептидными антителами и референс-моноклональными антителами.
Ответы на разные пептиды сильно отличались, и эти эксперименты позволили выявить наиболее эффективные фрагменты как белка L1, так и Е7. Окончательная проверка показала, что если в качестве носителя-адъюванта к этим пептидам использовать гемоцианин улитки или специальный иммуностимулятор ПМ, то реакция иммунной системы будет наиболее сильной. Самое главное, что при этом вырабатывается сильный иммунный ответ к L1, а также активируются популяции специфических клеток-киллеров, так называемые цитотоксические Т-клетки CD8 + . Именно они должны уничтожать зараженные клетки. Фактически, полученные данные дают основание считать, что нам удалось создать отдельные компоненты прототипа комбинированной вакцины, профилактической и терапевтической. Пока это еще не вакцина, препарат надо испытывать на приемлемой биологической модели, например на мышах с перевиваемой опухолью, вызываемой онкогенным белком Е7. Причем полученные вакцинные препараты скорее ориентированы на профилактику, поскольку уже доказано, что белок L1 генерирует сильный защитный ответ даже в отсутствие адъюванта.
Пептиды — слабые иммуногены, в этом мы убедились, сделав конъюгат одного пептида из белка Е7 со стандартным адъювантом Фрейнда. Активировать Т-клетки таким путем непросто, и, вероятно, нужно менять тактику. Прежде всего для этого требуется обеспечить целевую доставку пептидных антигенов из Е-белка в дендритные клетки, чтобы достичь специфической и сильной активации киллерных CD8 + лимфоцитов.
И тогда мы решили применить новый подход: использовать как усилитель доставки фуллерены, высокая клеточно-проникающая способность которых хорошо известна, и добавить вектор, который бы направлял их в дендритные клетки. Для этого пришлось заняться работой, не имеющей прямого отношения к созданию вакцины: определить иммуногенность фуллерена и их производных с аминокислотами и пептидами, а также их способность проникать внутрь клеток. И здесь мы получили очень интересные результаты.
Фуллерен и жизнь
Проблема токсичности фуллеренов и прочих наночастиц давно уже стала весьма актуальной. Сразу же за открытием фуллеренов среди ученых распространилась идея, что эти молекулы могут пригодиться в качестве средства для транспортировки лекарственных препаратов. Сейчас синтезированы сотни соединений фуллеренов, многие из них проявляют биологическую активность, однако до создания коммерческих препаратов дело не дошло. Возможно, потому, что у них нет особых преимуществ по сравнению с нефуллереновыми аналогами, а возможно — из-за недостаточно глубокого понимания механизмов метаболизма фуллеренов и их взаимодействия с живыми клетками.
Однако из-за развития нанотехнологий практически неизбежно возникают условия для загрязнения окружающей среды этими весьма стойкими соединениями, масштаб производства которых возрастает. Пора решать вопрос об опасности или безопасности фуллеренов в том числе и об иммунологической безопасности. Прежде всего речь идет о способности фуллеренов вызывать иммунный ответ, например аллергию.
Безразличный фуллерен
В своих опытах мы использовали кристаллический фуллерен, называемый фуллеритом, наносуспензию гидратированого фуллерена Андриевского, а также соединения фуллерена со всевозможными аминокислотами, пептидами и белками. При этом аминокислоты присоединялись непосредственно к шарику фуллерена. Способ получения таких производных разработали еще в 1994 году в ИНЭОС РАН им. А. Н. Несмеянова. Там же в содружестве с Институтом проблем химической физики РАН был создан еще один функциональный фуллерен, который очень быстро пришивается к пептидам и белкам, содержащим аминокислоту цистеин. Для чего нужно было получать столь сложные соединения?
Дело в том, что еще 12 лет назад мы уже пытались вызвать у мышей специфический иммунный ответ на чистые фуллерены и их аминокислотные производные и нисколько не преуспели в этом деле. Однако в 1998 году появились сведения, что одной американской группе удалось-таки добиться иммунного ответа на фуллерен в присутствии сильного иммуностимулятора. В своих опытах мы как раз и хотели проверить этот результат, а в качестве иммуностимуляторов взяли известные аллергены вроде яичного и сывороточного альбумина. Однако результат оказался тем же: никакого специфического ответа на собственно фуллерен замечено не было. Зато мы обнаружили хорошо выраженную реакцию на аминокислоты, пришитые к фуллерену. (На чистые аминокислоты ответ вообще не развивается, организм к ним толерантен.)
Отсутствие иммунной реакции на фуллерен можно объяснить следующим образом. Теоретически в водной среде молекулы гидрофобного фуллерена не могут существовать в одиночном состоянии, а собираются в кластеры из десятков, а то и сотен молекул. Попав в живой организм, эти кластеры должны взаимодействовать с гидрофобными компонентами среды и электронодонорными молекулами — белками, жирами или аминами. В результате углеродная сфера может быть полностью закрыта этими молекулами, и тогда она не способна связываться с рецептором В-лимфоцита, который дает сигнал на развитие иммунного ответа. Впрочем, само по себе наличие у В-клеток специфического рецептора на фуллерен вызывает серьезные сомнения. Фуллерены как искусственные молекулы получены совсем недавно, в 1991 году, и в процессе эволюции организмы с ним не могли контактировать, следовательно, вряд ли существуют клеточные клоны, распознающие такие молекулы. Как показали работы по созданию углеродных эндопротезов еще в 1979 году, антитела к другим формам углерода — графиту и алмазу получить невозможно. Хотя известен такой фермент, как протеаза ВИЧ, чей активный центр имеет гидрофобную полость: фуллерен (с гидрофильной подвеской) хорошо ее заполняет и тем самым блокирует активность вируса. Но рецепторы на В-лимфоците для улавливания чужеземцев располагаются снаружи, то есть обращены в водную среду, имеют гидрофильную природу и вряд ли будут захватывать фуллерен.
Как нож в масло
Если фуллерен не вызывает иммунного ответа, то может ли он как-то повредить клетку? Ответ на этот вопрос дает серия опытов, проведенная нами с эритроцитами, тромбоцитами человека и симбиосомами — продуктами симбиоза бобовых растений с азотфиксирующими бактериями рода Rhizobium. О том, что фуллерен проник внутрь симбиосомы можно судить по заряду ее мембраны. В присутствии АТФ и ионов магния она способны генерировать на внутренней стороне своей мембраны положительный заряд. Фуллерены с пришитыми аминокислотами пролином или аминокапоновой кислотой — отрицательно заряжены. Попав внутрь симбиосомы, они нейтрализуют заряд на мембране, что можно зафиксировать спектральными методами, используя специальные зонды. Как оказалось, процесс этот весьма быстрый: при добавлении раствора с производными фуллерена, мембрана клетки моментально теряла накопленный ею потенциал.
Фуллерен с другой кислотой, аргинином, наоборот, приобретает положительный заряд, и поэтому его влияние на симбиосому заметить не удалось. Зато оно проявилось на эритроцитах, мембрану которых заряжали отрицательно с помощью валиномицина (из клетки при этом выходит K + ): при добавлении C60-Arg происходила быстрая разрядка потенциала.
Изменение потенциала мембраны оказалось не единственным эффектом. Есть такой флуоресцентный краситель — акридин оранжевый. Он меняет свое свечение при изменении кислотности среды. С его помощью удалось дополнительно подтвердить, что аминокислотные производные фуллеренов в самом деле легко проникают внутрь клеток и меняют кислотность среды.
Мы подтвердили также, что фуллерены легко проникают в разные типы клеток. Например, в тромбоцитах много кальция, поэтому изучать транспорт фуллерена можно с помощью другого красителя, хлортетрациклина, свечение которого зависит от концентрации ионов кальция: если фуллерен с ним взаимодействует, то гасит это свечение. Так оно и вышло: при добавлении к тромбоцитам, нагруженным хлортетрациклином, фуллеренов, в том числе и фуллерена Андриевского, наблюдалось тушение флуоресценции. Правда, оказалось, что фуллерен Андриевского входит в клетку в сто раз медленнее, чем с аминокислотными производными.
Итак, установлено, что фуллерен благодаря своей гидрофобности достаточно свободно проходит сквозь липидную мембрану клетки. Отсюда появляется идея, которая уже у многих на слуху: фуллерен с закрепленным пептидом может протащить его внутрь клетки. А это значит: он может служить отличным средством доставки пептидов в дендритные клетки иммунной системы.
Чтобы проверить этот предположение, мы, во-первых, присоединили к фуллерену найденные на предыдущем этапе пептиды белка Е7, вызывающие наибольший иммунный ответ. Во-вторых, синтезировали носитель для вакцины на основе сополимера винилпирролидона и малеинового ангидрида, к которому были присоединены цепочки жирных кислот. К этим гидрофобным хвостам за счет ван-дер-ваальсовых связей и цеплялись молекулы фуллеренов с пептидами. Результат оказался очень неплохим уже в первом эксперименте. Препарат действительно вел себя, как и положено терапевтической вакцине, генерировал специфические Т-клетки и антитела. Но пока что нам не удалось детально проследить механизм его действия. К сожалению, из-за прекращения финансирования эту работу пришлось прервать. Хотя мы и не теряем надежды на продолжение, но время упущено, а зарубежные исследователи не стоят на месте.
Читайте также:

