Люди которые привили себе вирус
Обновлено: 18.04.2024
В нашей стране в настоящее время активно проводится иммунизация от ковида. Неудивительно, что она вызывает множество вопросов. Одним из них является следующий: можно ли заразиться от вакцинированного человека? Давайте разбираться. Для этого рассмотрим, как действуют препараты.
Может ли заразить привитый от коронавируса другого?
Чтобы ответить на данный вопрос, нужно разобраться, как действуют препараты от ковида. Важно понимать, что современные средства для иммунизации не содержат живого вируса и не распространяют его. Прививка не приводит к болезни! Благодаря этому в популяции инфекция не распространяется.
При этом не стоит отказываться от мер безопасности. Привитый человек может быть переносчиком вируса. Заразиться от него можно, если он сам заболеет (а это не исключено). Важно понимать, что современные препараты не предотвращают факт заражения, они сокращают риски осложнений и тяжелого течения патологии. При этом ни сам человек, ни его окружение могут даже не догадываться о том, что он болеет. Возможно бессимптомное течение вирусной инфекции. По этой причине как окружающим, так и самому привитому нужно продолжать соблюдать все меры безопасности: носить маску, пользоваться перчатками, регулярно мыть руки, избегать посещения массовых мероприятий и др.
При этом следует учитывать и тот факт, что необходимые для борьбы с заболеванием антитела вырабатываются не сразу. Для образования действительно надежного и эффективного иммунитета требуется немногим больше месяца. В это время вакцинированному следует быть особенно осторожным. Заражение может иметь место даже непосредственно в день введения препарата.
Можно ли заразиться ковидом от вакцинированного человека? Сам по себе вводимый препарат не приводит к такой опасности. При этом до образования антител окружающие находятся в зоне риска. В это время можно подхватить вирус и передать его другому. Тем не менее самоизоляция после иммунизации не требуется. Необходима она исключительно при болезни. Это также обусловлено тем, что в препаратах для вакцинации нет патогенного вируса, опасного для человека.
А если имеются все признаки заражения?
Дело в том, что после постановки прививки возможно появление побочных эффектов.
К основным относят:
- повышение температуры тела
- небольшое покраснение кожи и отечность
- болезненность в месте введения инъекции
- слабость и ощущение усталости
- головную боль
Как правило, они исчезают самостоятельно через несколько дней. Не стоит думать, что вы заболели и теперь заразны для окружающих.
Если симптомы сохраняются, лучше, конечно, посетить врача. Он проведет необходимую диагностику и определит, являются ли ваши жалобы признаками заражения или побочными эффектами после вакцинации. Если вы были заражены, вам назначат необходимое лечение.
Чтобы устранить дискомфорт в руке, можно накрыть зону локализации боли чистой прохладной и влажной салфеткой. Также можно слегка размять предплечье, выполнив простейшие движения.
К врачу нужно обращаться при:
- кашле, насморке и воспалении горла
- усилившихся покраснении и боли
- ухудшении общего состояния
- повышении температуры тела до 39 и более градусов
- появлении сыпи на теле
- выраженной головной боли, которая не купируется лекарственными препаратами
- одышке
- затруднениях дыхания
Ни в коем случае не отказываться от введения второй дозы. Напротив, в этом случае иммунизация является обязательной. Обусловлено это тем, что только после получения второй дозы препарата возможно формирование полноценного иммунитета.
Важно! Если срок вакцинации пропущен (по причине болезни и температуры), первую дозу вводить заново не придется. Прививку допускается поставить и немного позже. В этом случае ничего страшного не произойдет. Препарат не утратит своей эффективности. Не усугубятся и побочные эффекты от второй его дозы.
Преимущества обращения в МЕДСИ
Чтобы уточнить условия вакцинации или записаться на прививку, достаточно позвонить . Наш специалист ответит на все вопросы. Также запись возможна через приложение SmartMed.

— Вы привились и сильно переболели. Почему так произошло?

Не могу сказать, что перенес ковид тяжело. По ощущениям, заболевание протекало скорее как средней степени тяжести. Было много разных симптомов, температура держалась выше 38 градусов пять дней, что уже было показанием для проведения компьютерной томографии.
Но, исходя из данных КТ, заболевание протекало скорее в легкой форме. Оно никак не отразилось на картине легочной ткани. Общий анализ крови свидетельствовал о вирусном заболевании, а воспалительные белки и специфические лабораторные показатели не изменились. Пульсоксиметр на протяжении всего заболевания показывал хорошее насыщение крови кислородом — 95–97%.
— Поскольку вы сами работаете в лаборатории, то имели возможность секвенировать свой вирус. Что это дало?
— Во мне просто сработал дух научного любопытства, но ни к каким открытиям это не привело. Вирус, которым я инфицировался, ничем не отличался от основного циркулирующего штамма, который на территории России присутствует последние полгода. Ни у меня, ни, скорее всего, у моей жены, которая тоже была вакцинирована и тоже переболела, не было тех мутантных вариантов, которые сейчас привлекают к себе внимание.
— Индийский, так называемый дельта-вирус?
— Да, он, по-видимому, получает распространение на территории России, и можно предположить, что взрывной рост заболеваемости связан с ним. Дельта-вариант более трансмиссивный — если год назад один инфицированный передавал ковид 2–2,5 новым людям, то после появления британского альфа-варианта в Англии этот показатель стал 4–5, а сейчас один инфицированный дельтой может заразить ковидом 5–8 человек.
Инкубационный период тоже сокращается — несколько поколений вируса успевают распространиться между контактными за 10 дней. Частота госпитализаций при дельте тоже увеличивается, как это показывает опыт Великобритании.

— Привившись, мы, конечно, ожидаем, что достаточно защищены хотя бы от тех штаммов, которые в процессе эволюции и приобретения новых мутаций не сильно удалились от первоначального варианта вируса. Ведь при производстве вакцин использовались те данные об S-белке, которые были получены в самом начале пандемии, и, соответственно, чем дальше мы удаляемся от этого периода, тем больше волнений насчет эффективности вакцин.
Сегодня появление вариантов альфа, бета, гамма и дельта (индийского штамма) демонстрирует возрастающую возможность вируса частично уходить от антител. Мне было просто любопытно, что же все-таки пробило оборону. Тем более что титр общих антител у меня был достаточно высокий.
— И какой же вывод?
— Самый простой: что все-таки можно заболеть, будучи вакцинированным, и не только после встречи с каким-то новым штаммом.
— Зачем вакцинироваться, если даже при высоком уровне антител все равно заболеешь?
— Да, так сейчас многие говорят. Мы более эмоционально реагируем на реальное событие, чем на абстрактные цифры, котор ы е трудно применить к себе.
— Конечно, эффективность потом по факту становится меньше. Во-первых, клинические исследования предполагают определенную подборку людей, во-вторых, сам период проведения первой и особенно второй фазы клинических исследований выпал на период, когда вирус еще не был на подъеме и не существовало других штаммов. Если бы клиническое исследование проводилось сейчас, то вероятность вакцинированного человека заболеть резко бы возросла.
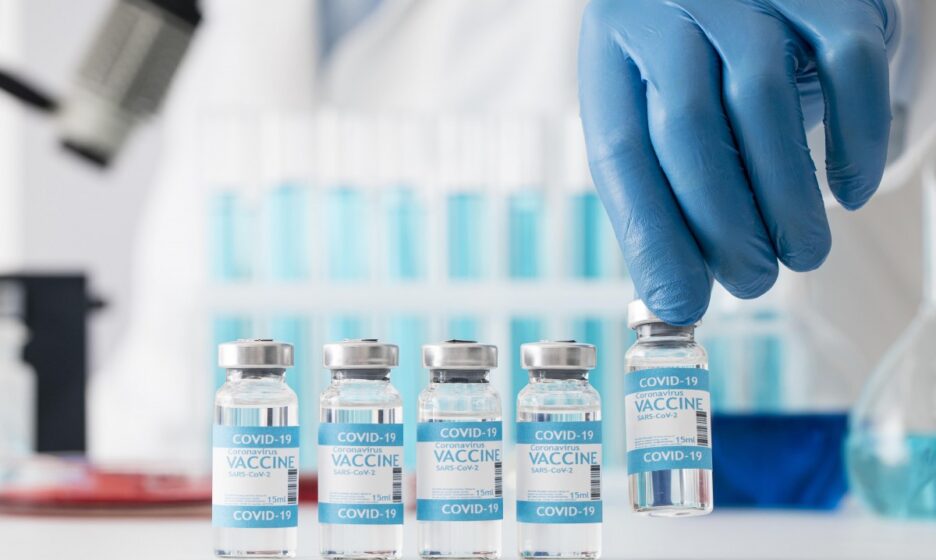
— И о чем все это нам говорит?
— Что какая-то часть пациентов, получивших полный курс вакцины, может заболеть, попасть в больницу и даже умереть. Но нужно сопоставлять эти данные с другими, показывающими, что происходит в этот же период времени, в этой же стране, в этой же популяции с теми, кто не привит. И мы увидим, что среди непривитых показатели заболеваемости, госпитализаций и смертности в десятки раз выше.
— Да, мне это тоже очень сложно объяснить.
Я часто привожу параллель между вакциной и ремнем безопасности. Мы пристегиваемся, чтобы снизить риск тяжелого исхода в случае ДТП, потому что верим статистике, которая говорит нам — те, кто были пристегнуты, выжили, а те, кто не были, погибли. С вакцинацией то же самое. Но, видимо, сказывается страх перед медицинской манипуляцией, когда человеку вводят какое-то непонятное для него вещество.
На мой взгляд, единственный важный вывод из всей этой истории — давать людям как можно больше информации, на основании которой они бы понимали, что происходит и каковы риски.
Без манипулирования и без запугивания. Когда информации недостаточно — это тоже некая дезинформация.
С другой стороны, мы уже настолько привыкли к статистике, которая отличается на единицу случаев заболевания на протяжении нескольких месяцев, что это для нас становится рутиной. Ну да, умирают каждый день в какой-нибудь области 12–13 человек. Даже в СМИ уже про это не пишут. Это стало неотъемлемой частью нашей жизни и перестало большинством людей восприниматься как угроза.
— Если привитый человек все же заболел, он так же распространяет вирус, как непривитый?
— По данным исследований, общая позиция такова — люди, инфицированные в период после вакцинации, в меньшей степени выступают в роли переносчиков инфекции, если они бессимптомны. Если в ресторане, например, собрались люди, которые провакцинированы, и среди них окажется человек, который имеет на своих слизистых коронавирус, то риск заразить соседей кратно отличается от ситуации, когда вакцинированный человек окажется в среде невакцинированных, среди которых тоже будут заболевшие.
При появлении симптомов заболевания вакцинированный так же опасен для окружающих, как и без вакцинации. Поэтому рекомендуется в общественных местах тоже использовать маски — особенно там, где сегодня наблюдается высокий уровень распространения инфекции. А при появлении первых симптомов заболевания рекомендуется самоизоляция.
Коронавирусом теперь болеют и дети
— Почему у нас начался такой подъем? В прошлом году летом как раз был спад.
— Тут трудно сравнивать, в прошлом году эпидемия в нашей стране только набирала обороты, причем везде по-разному. В Москве и в Санкт-Петербурге первая волна пришлась на апрель и первую половину мая, а затем, действительно, пошла на спад.
Но в целом по стране было иначе. У нас в Екатеринбурге, да и в других регионах, весной еще не было высокой заболеваемости, но поскольку мы ориентируемся на то, что происходит в столице, все сели в жесткий локдаун. А потом в Москве его стали смягчать, ну и, соответственно, в субъектах тоже. И тут-то как раз волна докатилась до нас. В Свердловской области в прошлом году первая волна, сильно сказавшаяся на системе здравоохранения, пришлась как раз на июнь–июль.
На южные курорты ковид пришел еще позже. Пока люди до них доехали, принесли инфекцию, перемешались, пик еще сместился по времени.
Но сейчас ситуация другая. Коронавирус распространился повсюду. И дальше в каждом субъекте федерации ситуация развивается в непрямой связи с тем, что происходит в Москве или в Санкт-Петербурге. Здесь несколько факторов играют роль.
— То, что все расслабились?
— Да, но так было и в других странах. Сначала шло снижение заболеваемости, а потом новый лавинообразный подъем в связи с появлением новых штаммов. Это мы видели в Великобритании, потом увидели в Индии, в Бразилии.
Мы тоже находились на этой фазе в конце зимы и весной. Снижение заболеваемости и госпитализаций создало ощущение, что у нас все относительно благополучно, мы близки к формированию коллективного иммунитета. Плюс были первые радужные ожидания от старта массовой вакцинации. Все это вместе породило ощущение, что все позади. Но вирус никуда не делся.
— Более того, стали болеть молодые, которые раньше не болели.
— В 2020-м сложилось ошибочное представление, что дети практически не болеют или болеют легко. Была информация о случаях мультисистемного воспаления у детей, но это все же большая редкость.
Но, когда стали появляться новые варианты коронавируса, резко изменилась возрастная структура заболевших. Уже в декабре прошлого года отчеты по Великобритании демонстрировали рост числа заболевших среди школьников. Потом это отмечалось почти во всех странах, которые проходили третью волну.
Беспокойство было связано не просто с тем, что возросло количество детей школьного возраста, но и с тем, что они госпитализируются.
Чем больше народу болеет тяжело, тем больше наблюдается летальных случаев. Есть данные, что с появлением дельта-варианта в Великобритании произошел существенный рост заболеваемости именно среди школьников и людей до 30 лет.
— И при этом они не привиты.
— Да, это ровно та когорта, которая почти не защищена вакцинами, потому что во всех странах приоритет был у людей старшего возраста.
Потом появились работы , в которых сопоставлялся уровень вирусной концентрации у детей и у взрослых, и выраженность симптомов. На сегодняшний день известно, что дети в случае инфицирования имеют точно такую же концентрацию вируса в организме, как и взрослые. Это означает, что они — активные участники распространения коронавируса.
И третий любопытный факт связан с тем, что клиническая картина у детей более размыта, чем у взрослых. То есть если сопоставлять количество клинических симптомов, то у детей их может быть 3–4, а у взрослых — 7–10.
Иными словами, у детей это похоже на банальную простуду: заложенность носа, покашливание, боль в горле.
— Может быть, вирус в силу большого распространения утрачивает свои болезнетворные качества?
— Вы писали, что начинать лечиться нужно как можно раньше. Но эффективных препаратов как не было, так и нет. Разве что-то изменилось?
— Конечно, клинические рекомендации в разных странах (не только в нашей) — это не тот уровень доказательности, который хотелось бы увидеть. Но ковид всех нас поставил в ситуацию, когда мы должны действовать, не имея надежных данных.
На мой взгляд, все-таки надо себе давать дополнительный шанс. Мы знаем, что вирус, попадая в организм, начинает активно размножаться: сначала в месте первоначального проникновения, а потом захватывая другие органы и ткани. И, конечно, очень хотелось бы ему помешать. Если есть малейший шанс это сделать, то им надо воспользоваться, но обязательно под наблюдением врача.
Сейчас, когда закрыто огромное количество СМИ, Правмир продолжает свою работу. Мы работаем, чтобы поддерживать людей, и чтобы знали: ВЫ НЕ ОДНИ.
18 лет Правмир работает для вас и ТОЛЬКО благодаря вам. Все наши тексты, фото и видео созданы только благодаря вашей поддержке.
Поддержите Правмир сейчас, подпишитесь на регулярное пожертвование. 50, 100, 200 рублей - чтобы Правмир продолжался. Мы остаемся. Оставайтесь с нами!

Обзор
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Мутации и вариации
Известно три разновидности вируса гриппа, опасных для человека:
- тип А (Alphainfluenzavirus) — наиболее подвержен мутациям и является постоянной головной болью Всемирной организации здравоохранения (ВОЗ);
- тип В (Betainfluenzavirus) — более стабилен, но все же может видоизменяться;
- тип С (Gammainfluenzavirus) — наиболее стабилен, поэтому к нему вырабатывается длительный иммунитет. Эпидемичных вспышек не дает, чаще всего приводит к нетяжелому заболеванию у детей.
Если бы все типы вируса гриппа были похожи на тип С, больших проблем с ними не было. Однако тип А постоянно мутирует, поэтому довольно часто появляются его новые вариации (штаммы), с которыми наша иммунная система еще не знакома [2]. Из-за этой изменчивости классификация вирусов гриппа достаточно сложная: внутри каждого типа существуют подтипы (в случае с типом В — линии), в которые объединяют штаммы вируса. Причем, штаммы подтипов могут быть как родственными (то есть эволюционно недалеко ушедшими друг от друга), так и непохожими.
Кому опасен грипп?
Причем в случае с беременными женщинами риск касается не только будущей мамы, но и ее ребенка: грипп во время беременности более чем в 7 раз повышает риск госпитализации, а также может привести к преждевременным родам (около 30% случаев), мертворождению и малому весу при рождении [2], [6]. Поэтому во многих странах мира (США, Великобритания, Австралия, Италия) беременным рекомендована вакцинация против гриппа. Делают это по двум причинам:

Рисунок 1. Строение вируса гриппа (типы А и В)
Когда лучше сделать прививку?
Вакцинация против гриппа — это ежегодная прививка , которая защищает от трех или четырех наиболее распространенных в данной местности штаммов вируса. Это значит, что каждый год на основании рекомендаций ВОЗ и региональной ситуации национальные комитеты по контролю над гриппом составляют рекомендации антигенного состава будущей вакцины [15], [16]. Однако чаще всего эти рекомендации совпадают с рекомендациями ВОЗ, которые публикуются отдельно для северного и южного полушарий.
Большинству людей прививают одну дозу вакцины, однако детям от шести месяцев до двух лет (и до девяти лет в случае их первой вакцинации [17]) рекомендованы две дозы с минимальным интервалом в один месяц. Исследования показывают, что в этом случае эффективность вакцинации увеличивается [18], [2].
Состав противогриппозных вакцин все время меняется: например, в сезоне 2019–2020 были заменены оба штамма вируса типа А, и в итоге в четырехкомпонентную вакцину вошли:
- A/Brisbane/02/2018 (H1N1);
- A/Kansas/14/2017 (H3N2);
- B/Colorado/06/2017 (линия B/Victoria/2/87);
- B/Phuket/3073/2013 (линия B/Yamagata/16/88).
В трехкомпонентную вакцину, соответственно, рекомендовано включить первые три штамма вируса [16]. Однако бывает и так, что каждый год в составе вакцин повторяется название одного из штаммов. Значит ли это, что постоянно прививают одно и то же? Нет, даже в этом случае штаммы могут существенно различаться, в том числе и по генам, не входящим в классификацию.
Как долго длится иммунитет после вакцинации и имеет ли он пролонгированный эффект на будущий год? К сожалению, эффективность прививок против гриппа недолговечна. Она зависит от времени, прошедшего с момента прививки и штамма вируса: в среднем, считается, что защита снижается примерно на 7% в месяц для H3N2 и штаммов линии В и на 6–11% — для H1N1 [17]. Конечно, скорость и степень снижения могут различаться, но эффективной защиты, скорее всего, хватает на год [11].
Как выбирают штаммы и почему четыре лучше трех?
В течение всего года специалисты NICs анализируют циркулирующие штаммы вирусов на основании лабораторных анализов пациентов с респираторными заболеваниями, выделяют из общей массы пробы с вирусом гриппа и выбирают подходящих кандидатов для дальнейшего изучения в одном из пяти центров ВОЗ (WHO CCs) [19]. Отбор идет по принципу типичности вируса для данного региона и новизне, которую определяют по его реакции с антителами из набора ВОЗ. Дальнейшая работа осуществляется уже в центрах ВОЗ, где штаммы культивируют, анализируют, сравнивают между собой, составляют карты антигенности, строят математические модели и в итоге на основании всех этих данных выбирают претендентов в состав вакцины [19]. Как происходит этот процесс и сколько времени занимает каждая стадия, показано на рисунке 2.

Рисунок 2. Процесс отбора штаммов для противогриппозной вакцины
И наконец, дважды в год проходят Сезонные совещания ВОЗ, посвященные составам противогриппозных вакцин (Seasonal influenza vaccine composition meeting), на которых объявляют рекомендации для будущего сезона: в феврале — для северного полушария, в сентябре — для южного. Как только составы обнародованы, и производители получают вакцинные штаммы, запускается процесс производства, на который уходит около полугода (видео 1). Однако ошибки в планировании могут задержать весь цикл, что скажется на количестве произведенной вакцины или на сроках ее поставки.
Видео 1. Производство противогриппозных вакцин
Почему все-таки четырехкомпонентная вакцина лучше трехкомпонентной, если циркулирующих штаммов гораздо больше? Все дело в линии В, вирусы которой обычно циркулируют вместе, но в разных пропорциях [3], поэтому в случае с вакцинами, состоящими из трех компонентов, штамм линии В всегда является компромиссным вариантом. Экспертам ВОЗ приходится выбирать большее из двух зол, но так как невозможно точно предсказать ситуацию, которая будет наблюдаться через восемь месяцев, периодически случаются ошибки, сказывающиеся на эффективности вакцины. Например, в сезоне 2017–2018 она оказалась ниже ожидаемой, так как ВОЗ прогадала со штаммом вируса типа В, предположив, что доминировать будет линия Victoria, а оказалось — Yamagata [20]. Кроме того, уже не первый год наблюдается низкая эффективность вакцины в отношении штамма H3N2. Точная причина неизвестна, но существует несколько предположений:
- Адаптация штамма во время производства может приводить к некоторым изменениям (антигенному несоответствию), и иммунитет развивается уже к новому штамму, который отличается от циркулирующего.
- Циркулирующие штаммы подтипа H3N2 меняются быстрее, чем другие — им хватает полугода (то есть времени, прошедшего с момента объявления рекомендаций ВОЗ), чтобы измениться и стать менее похожим на вакцинный штамм.
- Стандартной дозы, содержащейся в вакцине, может быть недостаточно для эффективной защиты [18], [21].
Какой должна быть идеальная вакцина?
Вакцины против гриппа бывают живыми (интраназальные вакцины, применяются редко) и инактивированными. Современные инактивированные делятся на нескольких категорий:

Рисунок 3. Виды антигенов инактивированных вакцин. а — Инактивированный вирусный вирион в цельновирионной вакцине. б — Расщепленный инактивированный вирион в сплит-вакцине. в — Частички антигена в субъединичной вакцине.
Все вышеперечисленные вакцины являются вакцинами против сезонного гриппа .
В отдельную группу выделяют препандемические и пандемические вакцины. Их производят в случае возникновения угрозы пандемии. Препандемические (зоонозные) состоят из штамма зарождающегося вируса животного происхождения, который, по мнению экспертов, обладает пандемическим потенциалом, пандемические — из штамма, вызвавшего пандемию (такие вакцины появляются на волне заболеваемости) [15].
Однако выбрать штаммы для состава — лишь полдела. Главное, чтобы вакцина была эффективной. Для этого существуют определенные критерии.
Во-вторых, существуют требования к титрам антител после вакцинации (в том числе и для вакцин с адъювантами), которые указаны в таблице 1.
| Показатель | Люди от 18 до 60 лет | Люди старше 60 лет |
|---|---|---|
| 1. Кратность нарастания среднего геометрического титра антител после вакцинации (GMT increase) | 2,5 раза | 2 раза |
| 2. Уровень сероконверсии * (процент привитых с нарастанием титра антител минимум в четыре раза по сравнению с исходым) | 40% | 30% |
| 3. Уровень серопротекции (число лиц с защитным титром) ** | 70% | 60% |
| * — В тестах, измеряющих ингибирование гемагглютинина (HI), сероконверсия соответствует отрицательной сыворотке до вакцинации (HI < 1:10) и сыворотке крови после вакцинации HI ≥ 1:40. ** — Серопротекция соответствует проценту привитых с сывороткой HI ≥ 1:40. | ||
Для сезонных вакцин необязательно соблюдение всех трех условий; соответствие всем требованиям необходимо только для пандемических [24]. Мало того, сейчас титр HI ≥ 1:40 уже не считается надежным фактором для определения эффективности защиты (50–70% против клинических симптомов гриппа), так как уровни защиты могут варьировать в зависимости от индивидуальных характеристик, групп населения, возрастных групп и даже от типа вакцины [25].
В-третьих, есть отдельные требования к вакцинам, содержащим адъюванты:
- Совместимость адъюванта с антигенными компонентами вакцины.
- Доказательство последовательной связи адъюванта с вакцинными антигенами во время производства и в течение срока годности.
- Данные о влиянии адъюванта на эффективность вакцины.
- Биохимическая чистота адъюванта [23].
Если все это суммировать, то идеальная вакцина должна быть безопасной (низкореактогенной ), содержать 15 мкг гемагглютинина на дозу, вызывать определенные уровни титров антител у привитых в зависимости от их возраста (при этом количество эффективно привитых должно быть не менее 70% среди взрослого населения до 60 лет). Если же вакцина содержит адъювант, он должен быть безопасным, связанным с антигенами и вызывать иммунный ответ в соответствии со строгими стандартами.
Что касается безопасности, то благодаря широкому использованию сплит- и субъединичных вакцин, прививки против гриппа демонстрируют низкую реактогенность. В основном наблюдаются местные реакции (у 10–64 привитых из 100) и повышение температуры (чаще всего у детей: 12 из 100 привитых) [26].
Вакцинация против гриппа и аллергия на куриный белок
В противопоказаниях к вакцинам против гриппа указано, что их нельзя прививать людям, у которых есть аллергические реакции на любой из компонентов, в том числе и на белок куриного яйца [27]. Однако в международной практике людей с аллергией на куриный белок совершенно спокойно прививают как против гриппа, так и против кори, краснухи и паротита, хотя вирусы для этих вакцин выращивают с использованием куриных эмбрионов. Вакцинации аллергиков дали зеленый свет после серии исследований [28–30], в которых изучали реактогенность у людей с аллергическими реакциями на куриный белок: в итоге эти вакцины признали безопасными, и теперь прививают даже людям с анафилактической реакцией на куриный белок (единственное, таких пациентов нельзя прививать в аптеках или школах, как это делают в некоторых странах — только в медицинских центрах, где есть противошоковые медикаменты).
Во время производства вакцины клеточную культуру подвергают сериям центрифугирований и ультрафильтраций, которые позволяют отделить вирусные частицы от остальных белков. Конечно, эта технология не идеальна, но даже если в препарат вдруг что-то и попадает, то лишь следовые количества овальбумина — основного белка куриного яйца: ≤ 1 мкг на 0,5 мл дозы инактивированной и 0,24 мкг на 0,2 мл дозы живой вакцины [31]. Поэтому основным противопоказанием для вакцинации против гриппа являются только тяжелые реакции на введение этих вакцин в прошлом (реакция на предыдущую дозу и аллергия на куриный белок не всегда связаны между собой: человек мог отреагировать на другой компонент, например, на неомицин) [27], [31].
Чем же прививаться?
Это вопрос, который волнует многих. В России прививают следующими вакцинами:
В какие противогриппозные вакцины добавляют адъюванты?
Муки выбора
Но, честно говоря, таких исследований единицы, поэтому выводы приходится делать по косвенным данным — официальной статистике заболеваемости гриппом в зависимости от количества привитых в нашей стране (рис. 4).

Рисунок 4. Заболеваемость гриппом и количество привитых против гриппа в России за 1996–2018 годы
Автор благодарит врача-биофизика Кирилла Скрипкина за помощь в подготовке материала.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

