Материал от больного для микробиологического исследования при чуме
Обновлено: 08.05.2024
1. Чума является чрезвычайно контагиозной, поэтому взятие материала от больного (особенно легочной формы) производится с соблюдением мер предосторожности. Работа в очаге проводится в полном противочумном костюме.
В лабораторию могут быть доставлены следующие материалы:
• содержимое бубона (легочная форма чумы);
• отделяемые язвы или пунктет из карбункула (кожная форма чумы);
• материал из зева, взятый тампоном, и мокрота (легочная форма чумы);
• секционный материал (кусочки органов трупа, кровь);
Материал необходимо брать до назначения лечения. Значение микробиологического диагноза огромно, особенно для выявления первых случаев чумы. Предварительный диагноз устанавливают на основании микроскопического исследования материала, окончательный — на основании выделения и идентификации культуры.
Микроскопическое исследование: мазки фиксируют погружением полностью в жидкость Инпифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим Леффлера, так как этот метод лучше выявляет биполярность.
2. Бактериологическое исследование: посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота), к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Инкубацию посевов проводят при 28 °С. В положительных случаях через 12 ч появляются колонии в виде характерных "кружевных платочков". Когда чистая культура выделена путем прямого посева, она подлежит идентификации на основании следующих данных.
• внешний вид колонии на агаре;
• характерный рост на бульоне;
• типичная морфология микробов в мазках и отрицательная окраска по Граму;
• типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
• агглютинация со специфической сывороткой;
• отношение к специфическому бактериофагу. Исследование ферментативных свойств, подвижности и т. п. производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий. Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких — путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать о явлении изменчивости.
3. Биологическая проба обязательна при исследовании; наиболее чувствительными из лабораторных животных являются морские свинки и белые мыши. Для постановки биологической пробы животных заражают внутрибрюшинно, подкожно или внутрикожно, а в случае загрязнения материала посторонней микрофлорой — втиранием в скарифицированную кожу.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3—9-й день после инфицирования, изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов — множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
4. Ускоренные методы бактериологического исследования. Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды. Исследуемый материал наносят на 3 агаровые пластины с гемо-лизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль). Результаты начинают читать через 2,5—3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30—40 мин) размножаться в присутствии микроба чумы.
Большого внимания заслуживает люминесцентно-серологический метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3—3 Уг ч удается обнаружить 1 млн палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1%-ный водно-спиртовой раствор на 100 мл среды) для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
5. Серологические реакции в практике нашли широкое применение. Они используются при подозрительных на чуму заболеваниях для ретроспективного диагноза, при обследованиях природных источников чумы. С этой целью применяют иммунофермент-ную агглютинацию, реакцию пассивной гемагглютинации, реакции непрямой агглютинации. Экспресс-методом является люминесцентно-серологический, позволяющий обнаружить возбудителя в исследуемом материале через 2 ч.
Диагностика и лечение туляремии
Полиморфизм клинических симптомов при спорадической заболеваемости туляремией вызывает большие диагностические трудности. В начальном периоде (до появления бубона) туляремию принимают за многие инфекционные болезни: грипп, риккетсиозы, малярию и др. Ведущее место принадлежит антибиотикотерапии. Наиболее эффективны стрептомицин (суточная доза 1-2 г), тетрациклин (1,5-2 г), левомицетин (2 г). Проводится дезинтоксикационная терапия.
При аллергических реакциях назначают десенсибилизирующие средства. Местно применяют мазевые повязки, компрессы, тепловые процедуры. При флюктуации бубонов показано хирургическое вмешательство - вскрытие широким разрезом, чего нельзя делать при сибиреязвенном карбункуле в связи с угрозой сепсиса. Уплотнение бубонов при клиническом выздоровлении не является противопоказанием к выписке из стационара Летальность при висцеральных формах туляремии не превышает 0,5%. Трудоспособность больных восстанавливается медленно.
Основным резервуаром и источником инфекции при туляремии являются грызуны - водяные полевки (крысы), обыкновенные полевки и домовые мыши, ондатры, землеройки-бурозубки, а также зайцы. С выделениями больных животных возбудитель широко рассеивается во внешней среде. Так, в Подмосковье встречаются лугополевые, лесные, озерно-болотные типы очагов. Основные меры профилактики сводятся к ограничению возможных контактов с грызунами; соблюдению техники безопасности лицами определенных профессий.
Для экстренной профилактики туляремии применяют доксициклин по 100 мг-2 раза в сутки в течение 14 дней. Плановую иммунизацию живой противотуляремийной вакциной проводят по эпидемическим показаниям.
Чума, Pestis - лат, Plague - англ., La Peste - франц., Pest - нем., SCHU Y - кит, JOKY - японск.
Чума - острая природно-очаговая болезнь, проявляющаяся выраженной интоксикацией, лихорадкой, поражением кожи, лимфатических узлов, легких и сепсисом; относится к группе карантинных (конвенционных) особо опасных инфекций.
В конце XX столетия на юге Индии в 1994 г. возникла локальная вспышка чумы, которая не вышла за пределы одного из южных регионов Индии благодаря своевременно принятым противоэпидемическим мерам. Во всех случаях чума была связана с эпизоотиями среди крыс. Поэтому современная ситуация возрастания численности их во многих городах России должна серьезно заботить органы санэпиднадзора и власти этих городов.
Многие открытия в изучении чумы, начиная с Д. Самойловича, были сделаны отечественными учеными (И.И. Мечников, Н.Ф. Гамалея, В.А. Хавкин и многим другим). Это касается прежде всего открытия природных очагов чумы и главных источников инфекции. Д К. Заболотный установил роль тарбаганов, И.В. Деминский(1912 г)- роль сусликов -на правобережье Нижней Волги, Н.Н. Клодницкий показал возможность заражения человека чумой от верблюдов. Н.Н. Жуков-Вережников разработал комплексный метод лечения легочной чумы, обосновал его этиопатогеническую сущность.
Классическое описание клиники чумы дал Г.П. Руднев. М.П. Покровская и М.М. Файбич создали первую противочумную вакцину. Весомый вклад в изучение чумы внесли Е И Коробкова, Б.К. Фенюк, Н.И. Калабухов и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1. Чума является чрезвычайно контагиозной, поэтому взятие материала от больного (особенно легочной формы) производится с соблюдением мер предосторожности. Работа в очаге проводится в полном противочумном костюме.
В лабораторию могут быть доставлены следующие материалы:
• содержимое бубона (легочная форма чумы);
• отделяемые язвы или пунктет из карбункула (кожная форма чумы);
• материал из зева, взятый тампоном, и мокрота (легочная форма чумы);
• секционный материал (кусочки органов трупа, кровь);
Материал необходимо брать до назначения лечения. Значение микробиологического диагноза огромно, особенно для выявления первых случаев чумы. Предварительный диагноз устанавливают на основании микроскопического исследования материала, окончательный — на основании выделения и идентификации культуры.
Микроскопическое исследование: мазки фиксируют погружением полностью в жидкость Инпифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим Леффлера, так как этот метод лучше выявляет биполярность.
2. Бактериологическое исследование: посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота), к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Инкубацию посевов проводят при 28 °С. В положительных случаях через 12 ч появляются колонии в виде характерных "кружевных платочков". Когда чистая культура выделена путем прямого посева, она подлежит идентификации на основании следующих данных.
• внешний вид колонии на агаре;
• характерный рост на бульоне;
• типичная морфология микробов в мазках и отрицательная окраска по Граму;
• типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
• агглютинация со специфической сывороткой;
• отношение к специфическому бактериофагу. Исследование ферментативных свойств, подвижности и т. п. производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий. Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких — путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать о явлении изменчивости.
3. Биологическая проба обязательна при исследовании; наиболее чувствительными из лабораторных животных являются морские свинки и белые мыши. Для постановки биологической пробы животных заражают внутрибрюшинно, подкожно или внутрикожно, а в случае загрязнения материала посторонней микрофлорой — втиранием в скарифицированную кожу.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3—9-й день после инфицирования, изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов — множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
4. Ускоренные методы бактериологического исследования. Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды. Исследуемый материал наносят на 3 агаровые пластины с гемо-лизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль). Результаты начинают читать через 2,5—3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30—40 мин) размножаться в присутствии микроба чумы.
Большого внимания заслуживает люминесцентно-серологический метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3—3 Уг ч удается обнаружить 1 млн палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1%-ный водно-спиртовой раствор на 100 мл среды) для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
5. Серологические реакции в практике нашли широкое применение. Они используются при подозрительных на чуму заболеваниях для ретроспективного диагноза, при обследованиях природных источников чумы. С этой целью применяют иммунофермент-ную агглютинацию, реакцию пассивной гемагглютинации, реакции непрямой агглютинации. Экспресс-методом является люминесцентно-серологический, позволяющий обнаружить возбудителя в исследуемом материале через 2 ч.
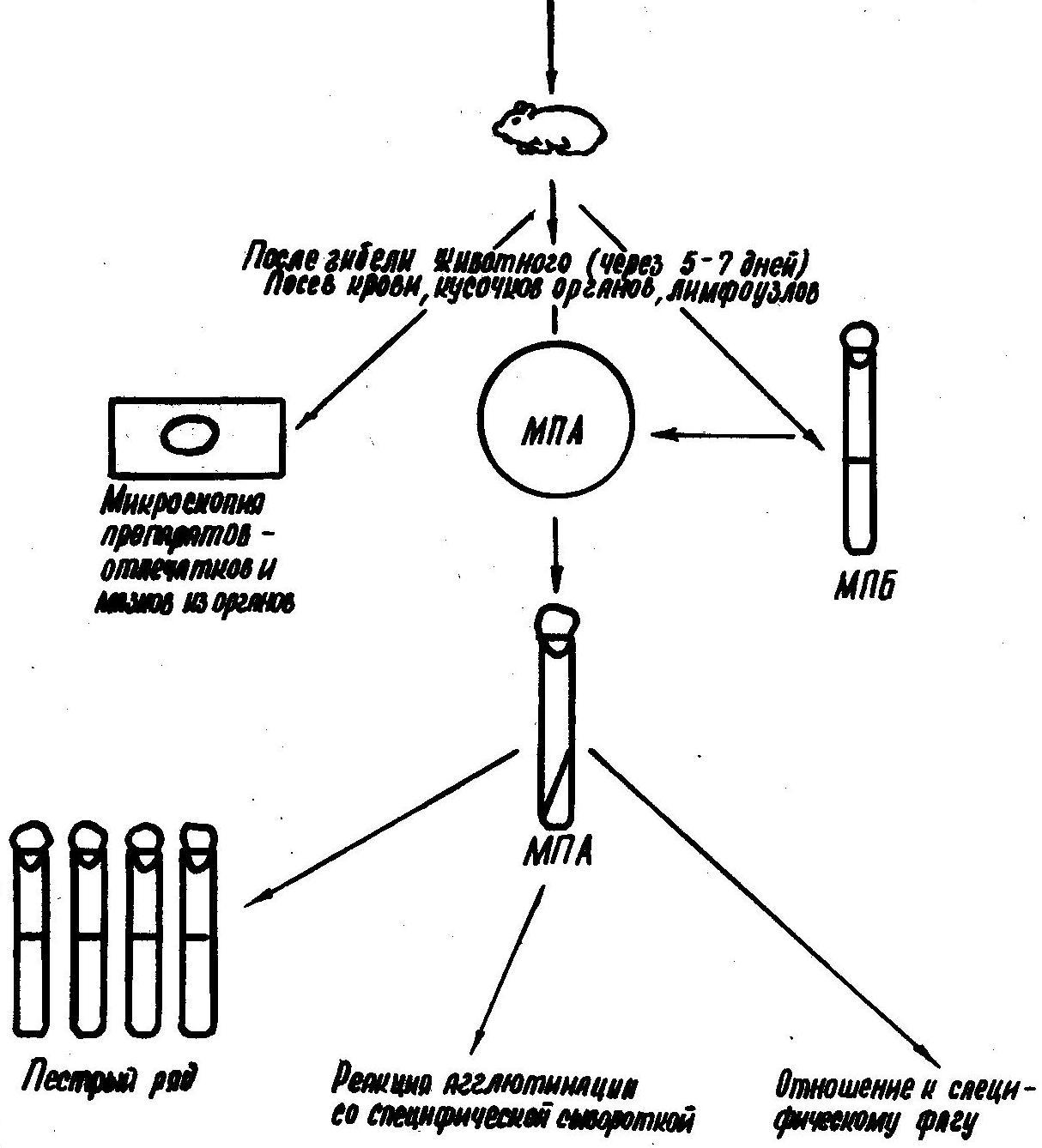
от трупов - кусочки органов, лимфоузлы, кровь, костный мозг.


Микроскопия




МПА и МПБ (с 0, 1% крови кролика или лошади, с 0,05% сульфита натрия и антифаговой сывороткой). Инкубирование при 25-30°C


Микроскопия
МПА

Пестрый ряд
Реакция агглютинации со специфической сывороткой
Отношение к специфическому фагу
Заражение морской свинки втиранием в кожу, подкожно, внутрибрюшинно
Б. Биологический
Исследуемый материал (см. метод А)
В. Аллергический
(для ретроспективной диагностики) – проба с пестином.
Г. Серологический
Применение иммунологических реакций для обнаружения антигенов возбудителя (РПГА и ее модификации, ИФМ, РИМ).
Методы микробиологической диагностики туляремии
А. Бактериологический и биологический
Материал: пунктат из бубона, гной из конъюнктивы, пленка из зева

Б. Серологический
Реакция агглютинации по типу реакции Райта (с 10-12 дня заболевания,
диагностический титр 1:100)
В. Аллергический
Аллергическая проба с тулярином – накожная и внутрикожная
(с 5-7 дня заболевания).
Приложение к ЗАНЯТИЮ 1
А. Иерсинии - возбудители псевдотуберкулеза (Yersinia pseudotuberculosis)
и кишечного иерсиниоза (Y. enterocolitica)
Иерсинии неприхотливы к питательным средам, хорошо растут на обычных универсальных средах, способны активно размножаться в почве и воде. Оптимальная для роста температуре 30ºС, верхняя и нижняя границы роста составляют 43°С и 0-2°С соответственно, оптимум рН 6,6-7,8. На среде Эндо колонии имеют диаметр 0,1-0,2 мм, круглые выпуклые, блестящие с ровными краями, бесцветные (не ферментируют лактозы). Колонии возбудителя псевдотуберкулеза, находящиеся в R-форме, почти не отличаются от колонии возбудителя чумы (пигментированный центр и фестончатый "кружевной" край). Биохимические различия трех видов иерсиний представлены в таблице.
Все три вида иерсиний отличаются и по своим антигенным свойствам.
Возбудитель псевдотуберкулеза по O-антигенам разделяется на восемь групп (1-8) с 20 O-факторными антигенами (1-20). По O- и Н-антигенам (а-е) этот вид подразделяют на 13 сероваров и подсероваров (la, 1в, 2а, 2в, 2с, 3, 4а, 4в, 5а, 5в, 6, 7, 8).
Y. enterocolitica характеризуется антигенной неоднородностью по 0-антигену. В настоящее время различают более 30 сероваров этого вида. Большинство из них адаптированы к некоторым видам животных или широко распространены во внешней среде. Подавляющее большинство штаммов, выделенных от человека, принадлежат к сероварам 03 и 09, реже встречаются серовары 08, 05в и очень редко - серовары 01, 02, 06, 07, 010, 011, 013, 014, 015, 016, 017.
От людей, больных псевдотуберкулезом, чаще всего выделяются штаммы, относящиеся к серовару 1, реже 3 и 4.
В ходе эволюции у иерсиний закрепилась необходимость существования в двух средах обитания - внешней (сапрофитическая фаза жизни) и в организме теплокровных животных и человека (паразитическая фаза). Для осуществления паразитической стадии иерсинии должны проникнуть в организм теплокровного животного. Заражение возбудителем псевдотуберкулеза чаще всего происходит при употреблении в пищу инфицированных иерсиниями продуктов, хранившихся при пониженной температуре (4-12ºС) в холодильниках и овощехранилищах. В этих условиях бактерии в силу своей психрофильности могут размножаться и накапливаться в пищевых субстратах.
Иерсинии при пониженной температуре обладают высоким потенциалом клеточной и тканевой инвазивности и способны сохранять высокий уровень вирулентности, однако возбудитель может проникнуть в организм человека и через любые слизистые оболочки, вероятно, за счет неспецифических механизмов.
Основным источником иерсиниозов являются дикие и синантропные грызуны, домашние и сельскохозяйственные животные. Возможно заражение человека от человека. Штаммы Y. pseudotuberculosis выделены от 175 видов млекопитающих, 124 видов птиц, 7 видов рыб. Зараженные грызуны, животные и люди выделяют возбудителя с испражнениями и мочой, загрязняя воду, растения и другие объекты внешней среды. Таким образом, пищевой путь в передаче возбудителей псевдотуберкулеза и кишечного иерсиниоза является ведущим. Заражение происходит в результате употребления в пищу сырых или недостаточно термически обработанных продуктов (мяса, мясных продуктов, молока, овощей, фруктов, зелени). Оба вида возбудителя способны существовать внутри растений (салата, гороха, овса и т.п.).
Заболевания, вызываемые иерсиниями, характеризуются полиморфностью клинических проявлений, поражением желудочно-кишечного тракта, тенденцией к генерализации, септикопиемии и поражению различных органов и систем.
Патогенные свойства иерсиний обоих видов, как и возбудителя чумы, во многом определяются наличием у них плазмид с молекулярной массой 42-48 МД и 82 МД. Плазмиды контролируют такие свойства возбудителей, как зависимость роста от наличия в среде кальция, способность синтезировать антигены вирулентности (v-w), пили адгезии, способность вызывать кератоконъюнктивит у морской свинки и т.п.
Микробиологическая диагностика иерсиниозов включает использование бактериологического метода и серологических реакций.
Подозрительные колонии (мелкие бесцветные на средах Эндо и Плоскирева и окрашенные колонии двух различных форм на средах Серова) пересевают для получения чистых культур, которые идентифицируют по биохимическим признакам и окончательно типируют с помощью диагностических агглютинирующих сывороток.
Для серологической диагностики псевдотуберкулеза и кишечного иерсиниоза используют развернутую реакцию агглютинации (по типу реакции Видаля) с соответствующими диагностикумами или реакцию пассивной гемагглютинации (РПГА) с антигенным эритроцитарным диагностикумом. Положительными считают реакции при титре антител 1:400 и выше. Реакции рекомендуется ставить с парными сыворотками (с интервалом в несколько дней). Нарастание титра антител будет свидетельствовать о специфичности инфекционного процесса.
Б. Дифференциальные признаки биоваров Y. рestis
Читайте также:

