Медленные вирусные инфекции центральной нервной системы
Обновлено: 23.04.2024
Нейроинфекции – группа инфекционных патологий, которые вызываются бактериями, вирусами, грибками или простейшими, характеризуются преимущественной локализацией возбудителя в ЦНС и признаками поражения ее отделов. Клинические проявления представлены менингеальным, интоксикационным, ликвородинамическим синдромами, вегетососудистыми расстройствами. В процессе диагностики используются анамнестические данные, результаты физикального, общеклинического лабораторного, серологического, бактериологического или вирусологического исследования. В ходе лечения назначаются антибиотики или противовирусные препараты, патогенетические и симптоматические средства.
МКБ-10
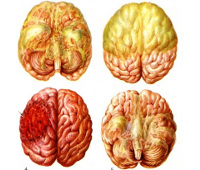
Общие сведения
Нейроинфекции – сравнительно распространенная группа патологий. По данным статистики, инфекционные поражения ЦНС достигают 40% в структуре неврологической заболеваемости. Основную часть составляют бактериальные и вирусные менингиты, распространенность которых в различных географических регионах находится в пределах 5-12 случаев на 100 000 населения в год. Для большинства болезней, входящих в данную группу, характерна осенне-зимняя сезонность. Они могут встречаться среди всех возрастных категорий населения, но основную часть пациентов составляют дети до 10-12 лет и лица, не получившие вакцины согласно календарю прививок.

Причины нейроинфекций
Этиология инфекционного поражения структур центральной нервной системы зависит от вида заболевания. В большинстве эпизодов источником заражения становится больной или здоровый человек-носитель. Способствующими факторами являются постоянный контакт с большим количеством людей, ЧМТ, иммунодефицитные состояния, хронические соматические патологии, беспорядочная половая жизнь. Выделяют следующие механизмы инфицирования:
- Воздушно-капельный. Реализуется при кашле, чихании, разговоре. Характерен для возбудителей бактериальных и вирусных менингитов, энцефалитов, полиомиелита, герпетической инфекции.
- Контактно-бытовой. Подразумевает передачу инфекционного агента при прямом контакте с больным, носителем или инфицированными предметами быта. Это один из путей распространения герпес-вирусов, полиомиелита, сифилиса.
- Фекально-оральный. Тип передачи, при котором возбудитель выделяется вместе с испражнениями, проникает в организм с продуктами питаниями или водой. Может реализовываться при герпес-инфекции, вирусах ЕСНО и Коксаки, ботулизме, полиомиелите.
- Половой. При этом варианте заражение происходит во время полового акта через слизистые оболочки половых путей. Таким способом распространяется ВИЧ-инфекция, сифилис, реже – вирусы-возбудители менингитов, энцефалитов.
Патогенез
Для каждой формы нейроинфекции характерны свои патогенетические особенности, но механизмы развития большинства синдромов и симптомов, как правило, аналогичны при всех вариантах этой группы заболеваний. Инфекционный синдром обуславливают комплексы антиген-антитело и токсины возбудителей, которые оказывают деструктивное воздействие на ЦНС, провоцируя нарушения тонуса сосудов, метаболизма и гемодинамики в целом. Менингеальный синдром развивается при воспалительном поражении мозговых оболочек и повышении внутричерепного давления. Вегетативные расстройства вызываются как прямым контактом инфекционных агентов с центрами автономной нервной системы, так и опосредованным воздействием через внутричерепную гипертензию. Ликвородинамические изменения потенцируются усиленной продукцией спинномозговой жидкости на фоне раздражения сосудистых сплетений и блокадой пахионовых грануляций, усложняющей процесс ее резорбции.
Классификация
Использование систематизации обусловлено необходимостью объединить между собой большое количество разнородных инфекционных патологий с вовлечением нервной системы. В зависимости от характера морфологических изменений, клинических особенностей и конкретного возбудителя в неврологии различают несколько групп поражений ЦНС инфекционного происхождения. Основными вариантами нейроинфекций являются:
1. Энцефалиты. Заболевания с воспалением ткани головного мозга. Наиболее распространенными считаются клещевой, герпетический, ветряночный и краснушный энцефалиты. Проявления зависят от типа возбудителя, могут включать общемозговые, очаговые симптомы, системную интоксикацию разной степени выраженности.
2. Менингиты. Болезни, при которых наблюдается поражение мозговых оболочек. Характеризуются наличием менингеального и интоксикационного синдромов, с учетом особенностей воспалительного процесса подразделяются на:
- Гнойные. Провоцируются бактериями, простейшими или грибами, могут быть первичными либо вторичными. К первичным относятся менингиты, вызванные менингококком, пневмококками, гемофильной палочкой. Вторичные поражения являются осложнением гнойных процессов других локализаций – околоносовых пазух, среднего уха и пр.
- Серозные. Сопровождаются преимущественно лимфоцитарным плеоцитозом. В роли возбудителей выступают туберкулёзная палочка, вирус паротита, энтеровирусы Коксаки и ЕСНО.
3. Полиомиелит. Поражение ЦНС, вызванное РНК-содержащим вирусом полиомиелита. Может протекать в двух формах: непаралитической (менингеальной, абортивной, инаппарантной) и паралитической (спинальной, мостовой, бульбарной, энцефалитической).
4. Абсцесс головного мозга. Представляет собой ограниченное капсулой скопление гнойных масс в тканях мозга. Может иметь отогенное, риногенное, метастатическое или посттравматическое происхождение. Проявляется системной интоксикацией, очаговой неврологической симптоматикой, реже – эпилептическим и гипертензивным синдромами.
5. Опоясывающий лишай. Вариант хронической нейроинфекции, обусловленный герпесвирусом человека III типа – Варицелла-Зостер. Наблюдается персистенция возбудителя в спинномозговых ганглиях с активацией при снижении иммунитета или травмах. К основным симптомам относятся острая боль, герпетические высыпания в области 1-2 дерматомов.
6. Нейросифилис. Инфекционная патология, провоцируемая бледной трепонемой. На ранней стадии поражения ЦНС отмечаются общеинфекционные, общемозговые и очаговые симптомы с нарушением функций II, III, VI, VIII пар черепно-мозговых нервов. На поздних стадиях развивается прогрессирующая деменция, выявляются психические расстройства, инсультоподобная симптоматика.
7. Ботулизм. Инфекционное заболевание, вызываемое Clostridium botulinum и сопровождающееся прерыванием передачи нервных импульсов в холинэргических синапсах. Обнаруживаются признаки поражения двигательных ядер ствола мозга, передних рогов.
8. НейроСПИД. Обусловлено инфицированием вирусом иммунодефицита человека. Зачастую представлено первичными поражениями ЦНС: энцефалопатиями, рецидивирующими ВИЧ-менингитами, вакуолярной миелопатией. Проявления разнообразны, включают парезы, афазии, атаксию, мнестические расстройства, психопатологические нарушения.
Симптомы нейроинфекций
Менингальный синдром возникает при вовлечении в патологический процесс мозговых оболочек, состоит из общемозговой симптоматики, мышечно-тонических и корешковых симптомов. В первую группу входит интенсивная диффузная распирающая головная боль; фотофобия, повышенная чувствительность к звукам и свету, рвота без тошноты, не приносящая облегчения. Зачастую наблюдается нарушение сознания по типу галлюцинаций, бреда, оглушения, сопора. У детей возможны фебрильные судороги. Мышечно-тонические и радикулярные проявления включают в себя ригидность затылочных мышц, симптомы Кернига, Брудзинского, Лессажа, Гордона, Менделя, Бехтерева и др.
Вегетативно-сосудистые расстройства при нейроинфекциях могут носить симпатоадреналовый, вагоинсулярный или смешанный характер. В первом случае обнаруживается учащение сердечного ритма, повышение артериального давления, чрезмерная потливость и жажда, во втором – брадикардия, артериальная гипотония, обильное мочеиспускание. При смешанном варианте симптомы из разных групп сочетаются между собой. Нарушение нормальной циркуляции ликвора может протекать по гипертензивному и гипотензивному типу. Более характерной для нейроинфекций является внутричерепная гипертензия, сопровождающаяся угнетением сознания, судорожными и дислокационными синдромами.
Диагностика
Диагностическая программа при инфекциях ЦНС основывается на анамнезе, физикальном исследовании, общеклинических и специфических лабораторных тестах. Лучевые методы диагностики используются редко, зачастую – с целью дифференциации с объемными поражениями нервной системы. Программа обследования больного может включать следующие процедуры:
- Выяснение анамнеза. При общении с пациентом или его родственниками лечащий инфекционист или невролог осуществляет детализацию имеющихся жалоб, выясняет динамику их развития. Важную роль играет эпидемиологический анамнез – контакт с инфекционными больными или выезд за границу на протяжении последних 21 дней.
- Общий и неврологический статус. При осмотре врач определяет уровень сознания, изучает кожу и слизистые оболочки с целью поиска высыпаний, определяет частоту сердечных сокращений и артериальное давление. При установлении неврологического статуса специалист оценивает тонус затылочных мышц, выявляет специфические симптомы, характерные для различных неврологических синдромов.
- Общеклинические лабораторные тесты. В общем анализе крови помимо повышения СОЭ отмечаются следующие изменения: при бактериальной инфекции – высокий нейтрофильный лейкоцитоз, при вирусной – лейкоцитоз со смещением лейкоцитарной формулы вправо, при ВИЧ-инфекции и тяжелых иммунодефицитах – лейкопения. Показатели биохимического анализа крови зависят от сопутствующих поражений внутренних органов.
- Спинномозговая пункция. При нейроинфекциях существует два основных варианта изменений ликвора (белково-клеточных диссоциаций) – по гнойному и серозному типу. При первом типе СПЖ мутная, имеет определенный окрас (белый, желтоватый), наблюдается нейтрофильный плеоцитоз от 1 000, повышение уровня белка от 1,0 г/л. При серозной форме ликвор прозрачный, опалесцирует, при цитологическом исследовании обнаруживается лимфоцитарный плеоцитоз более 100, уровень белка составляет выше 0,4 г/л.
- Серологическое исследование. Заключается в определении повышенного уровня антител в крови при помощи реакций подавления гемагглютинации, связывания комплемента или нейтрализации. Применяется ИФА, в ходе которого выявляется специфический IgM к возбудителю. Проводится ПЦР для уточнения ДНК или РНК инфекционного агента.
- Вирусологическая или бактериологическая диагностика. Предполагает определение возбудителя заболевания в крови или спинномозговой жидкости пациента путем посева образцов на специфические питательные среды. После идентификации патогенного агента целесообразно уточнение чувствительности к основным антибактериальным препаратам.
Лечение нейроинфекций
Все нейроинфекции являются показанием к госпитализации больного в инфекционный или неврологический стационар. При тяжелом состоянии, необходимости непрерывного контроля жизненно важных функций (дыхание, сердцебиение), пациента транспортируют в отделение ОРИТ. Лечебная программа включает следующие мероприятия:
- Этиотропная терапия. Основной целью является элиминация возбудителя из организма больного. Вначале используются препараты широкого спектра действия. После получения результатов серологического и бактериологического исследований медикаменты заменяют антибактериальными или противовирусными средствами, к которым выявленный возбудитель проявил наибольшую чувствительность.
- Патогенетические препараты. Применяются для борьбы с системной интоксикацией, отеком головного мозга и нарушениями гомеостаза, для коррекции водно-электролитного баланса, десенсибилизации и стимуляции иммунитета. Назначаются плазмозаменители, диуретики, глюкокортикостероиды, антигистаминные средства, интерфероны, донорские и искусственные иммуноглобулины, антикоагулянты.
- Симптоматические средства. К этой категории относятся медикаменты, купирующие отдельные симптомы и улучшающие общее состояние больного: анальгетики, жаропонижающие, противорвотные медикаменты, антиконвульсанты, нейролептики.
- Хирургическое лечение. Характер оперативного вмешательства зависит от обнаруженных изменений. Операция может потребоваться в случае абсцесса, туберкуломы головного мозга, компрессии спинного мозга при туберкулезном спондилите, больших областях некроза при опоясывающем лишае.
Прогноз и профилактика
Исход нейроинфекции определяется типом заболевания, общим состоянием больного, своевременностью и полноценностью лечения. В большинстве случаев вовремя поставленный диагноз и адекватная терапия позволяют сохранить жизнь пациента, минимизировать риск развития осложнений. При некоторых формах нейроинфекций, например – энцефалитах, летальность достигает 50-80%. Специфическая профилактика представлена вакцинами против конкретных возбудителей: вирусов герпеса, ботулизма, клещевого энцефалита, кори, полиомиелита, менингококка и т. д. Неспецифические превентивные мероприятия направлены на укрепление иммунитета, своевременное лечение иммунодефицитных состояний и предотвращение контакта с потенциальными носителями инфекционных заболеваний.
1. Инфекционные поражения головного мозга: учебное пособие/ Гладкий П.А., Сергеева И.Г., Тулупов А.А. – 2015.
Медленные инфекции ЦНС — поражения центральной нервной системы вирусными вирионами или инфекционными прионами, возникающие после длительного скрытого (инкубационного) периода. Клинически характеризуются парезами, гиперкинезами, расстройством мозжечковых функций, психическими нарушениями, когнитивным снижением до глубокой деменции. Диагностика осуществляется при помощи неврологического обследования, церебральной томографии, анализа спинномозговой жидкости, определения антивирусных антител в крови. Лечение проводится симптоматическими средствами.
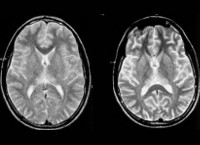
Общие сведения
Понятие медленные инфекции ЦНС включает целый ряд неврологических болезней, обусловленных вирионами (вирусными частицами) и прионами (вирусоподобными белками). Первые данные были опубликованы в 1954 году в Исландии учёным, длительно наблюдавшем неописанные ранее заболевания овец, поражающие ЦНС. Автор дал им название медленные инфекции. В 1957 году появилось описание нового заболевания — куру, распространённого среди жителей Новой Гвинеи. Болезнь полностью соответствовала критериям медленных инфекций и открыла список подобных патологий у человека, который продолжает пополняться. Медленные инфекции ЦНС — редко встречающаяся группа нозологий, точные данные о заболеваемости не собраны. Одни формы распространены повсеместно, другие имеют эндемичный характер.

Причины медленных инфекций ЦНС
Изучение свойств возбудителей позволило установить вирусный характер инфекций. Ранее ошибочно предполагалось, что возбудителями выступают специфические вирусные агенты. В последующем удалось определить два этиологических фактора возникновения патологии: вирусы и прионы.
- Вирусы. В настоящее время опровергнута теория специфической этиологии, подтверждена роль обычных вирусов: полиомавируса, флавивируса, цитомегаловируса, вирусов кори, краснухи, простого герпеса. Медленные инфекционные процессы в ЦНС развиваются вследствие персистирования вируса в организме на протяжении многих лет после перенесённого в типичной форме заболевания. Заражение может происходить воздушно-капельным, алиментарным, парентеральным, трансплацентарным путём.
- Прионы. Являются белками, обладающими некоторыми свойствами вирусов, в отличие от последних не имеют ДНК или РНК. Инфекционные прионы вызывают развитие болезни путём трансформации аналогичных нормальных белков нервных клеток в патологические. Инфицирование происходит при употреблении в пищу недостаточно термически обработанного мяса заражённых животных, трансплантации содержащих патогенные прионы тканей, гемотрансфузиях, нейрохирургических вмешательствах.
Доподлинно неизвестно, что становится причиной многолетнего персистирования вирусов, которые остаются в организме переболевших обычной инфекцией пациентов. Возможными причинами считают дефектное строение вирионов, недостаточность иммунной системы, сопровождающуюся пониженной выработкой антител, активацию пролиферативных процессов внутри поражённых вирусами клеток.
Патогенез
Общей патогенетической характеристикой, объединяющей различные медленные инфекции, выступает длительное скрытое развитие патологии, сопровождающееся накоплением возбудителя в церебральных тканях. После перенесённого вирусного заболевания (чаще внутриутробно или в раннем детстве) возбудители остаются в клетках головного мозга в неактивной форме. Причины и механизмы их активации не установлены. Перейдя в активную фазу, возбудители вызывают постепенное развитие воспалительных изменений в ЦНС.
Попавший в клетку прион взаимодействует с находящимся внутри неё геном, что приводит к синтезу аналогичных прионов вместо нормальных клеточных белков. Продолжительный скрытый период обусловлен временем, требующимся для попадания прионов в головной мозг, длительным процессом внутриклеточного накопления синтезируемых патологических белков. Результатом аномального белкового синтеза являются метаболические изменения, приводящие к гибели нейрона.
Морфологическая картина медленных инфекций достаточно вариабельна. Наиболее часто в тканях ЦНС наблюдается формирование очагов глиоза, демиелинизирующихся участков. При истинно вирусной этиологии процесса типично образование периваскулярных лимфоцитарных инфильтратов, фокусов астроцитоза. Морфологические изменения захватывают различные области мозга, часто носят распространённый характер.
Классификация
Медленные инфекции ЦНС имеют различную клиническую картину, однако отмечаются отдельные особенности течения болезней, связанные с их вирусным или прионным генезом. С учетом этого обстоятельства в неврологии заболевания подразделяются по этиологическому принципу на:
- Вирионные — вызванные типичными вирусами. Сопровождаются выработкой специфичных противовирусных антител. Наиболее распространены подострый склерозирующий панэнцефалит, прогрессирующая мультифокальная лейкоэнцефалопатия, краснушный панэнцефалит.
- Прионные — вызванные белками-прионами. Близкое сходство инфекционных прионов с внутриклеточными белками организма обуславливает практически полное отсутствие иммунного ответа при их внедрении. Большинство случаев составляет болезнь Крейтцфельдта-Якоба. К прионным инфекциям относятся также фатальная семейная инсомния, куру, синдром Герстмана.
Симптомы медленных инфекций ЦНС
Общей чертой заболеваний этой группы является медленное незаметное начало без температурной реакции. Характерен продромальный период, в котором отмечается раздражительность, эмоциональная неуравновешенность, рассеянность больного, лёгкие расстройства координации, шаткость во время ходьбы. Период клинической манифестации отличается постепенным нарастанием симптоматики, длящимся 1-3 недели. Типичны экстрапирамидные и пирамидные нарушения, атаксия, психические расстройства, когнитивное снижение.
Экстрапирамидные симптомы включают гиперкинезы (атетоз, тремор, дистонические синдромы), иногда — брадикинезию, паркинсоническую скованность. Пирамидные двигательные расстройства протекают в виде прогрессирующих геми- и тетрапарезов. Возможно поражение черепных нервов, проявляющееся парезом лицевой мускулатуры, тугоухостью, нарушением зрения, затруднением глотания и пр. Психические отклонения характеризуются эпизодами эйфории, фобий, бреда, спутанного сознания, отрывочных галлюцинаций. Все медленные инфекции сопровождаются постепенным распадом интеллектуальных функций (памяти, мышления, внимания) с исходом в глубокую деменцию. Нарушения речи обусловлены одновременно сенсомоторной афазией и когнитивным дефицитом. В терминальной стадии наблюдается мутизм — речь отсутствует полностью.
Симптоматика каждой отдельной инфекции имеет свои особенности. Для болезни Крейтцфельдта-Якоба, краснушного панэнцефалита характерна мозжечковая атаксия. Отличительным клиническим проявлением фатальной бессонницы выступает инсомния, доводящая пациентов до психического и физического истощения. Базовым симптомом болезни куру является тремор, типична насильственная улыбка. Синдром Герстмана-Штраусслера-Шейнкера протекает с мышечной гипотонией и угнетением сухожильных рефлексов.
Диагностика
Поскольку медленные инфекции — редкие заболевания, диагностировать их непросто. Неспецифическая клиническая симптоматика, трудности выделения вируса-возбудителя, инфекционного приона осложняют диагностику. Диагностический поиск осуществляется в рамках следующих исследований:
- Сбор анамнеза. Большое значение имеет расспрос относительно перенесённых в прошлом (возможно внутриутробно) инфекций, операций с пересадкой тканей. Опрос включает выявление продромальных симптомов, особенностей дебюта патологических проявлений.
- Оценка неврологического статуса.Неврологи исследует двигательную, чувствительную, рефлекторную, когнитивную сферы, координацию. На основании полученных данных формируется картина многоочагового поражения, свидетельствующая о диффузном характере патологических изменений церебральных тканей.
- Нейровизуализация. Проводится при помощи МРТ, КТ, МСКТ головного мозга. Томография определяет мультифокальное поражение мозга в виде демиелинизации, дегенерации, атрофии. Наблюдается расширение желудочков, говорящее о наличии гидроцефалии.
- Исследование цереброспинальной жидкости. Материал получают при люмбальной пункции. Отсутствие воспалительных изменений спинномозговой жидкости позволяет исключить типичные нейроинфекции. Проводятся ПЦР-исследования, направленные на выявление ДНК вероятных возбудителей, анализ на наличие противовирусных антител. В случае вирионного генеза инфекции эти методики дают возможность верифицировать возбудителя у 70-90% больных.
- Анализ крови на антитела. Информативен в случае вирусной этиологии. Осуществляется с определением противокоревых, противокраснушных антител. Диагностически значимы повторные исследования, демонстрирующие нарастание титра в период активации вируса.
- Биопсия мозга. Выполняется при крайней необходимости. Исследование биоптатов позволяет выявить интранейрональные скопления прионов. Однако в ходе биопсии существует вероятность забора участка неизменённых тканей.
При наличии показаний проводятся консультации смежных специалистов: офтальмолога, психиатра, инфекциониста, генетика. Необходима дифференциальная диагностика с энцефалитами, имеющими подострое начало, сосудистой деменцией, хроническими энцефалопатиями, болезнью Альцгеймера.
Лечение медленных инфекций ЦНС
Эффективная терапия не разработана. Предложенные схемы лечения противовирусными фармпрепаратами оказались безрезультатными. Назначается симптоматическая терапия, которая позволяет облегчить состояние пациентов, но не может замедлить прогрессирование патологического процесса. Она включает противоотёчные, нейропротекторные, витаминные, психотропные, противосудорожные средства. Поиск эффективных способов лечения продолжается.
Прогноз и профилактика
Медленные инфекции ЦНС остаются смертельными заболеваниями. Гибель пациентов вследствие тотального поражения мозга происходит в среднем в течение 1-2 лет от момента развития клинических симптомов. Наибольшая продолжительность жизни наблюдается у больных синдромом Герстмана — 3-5 лет. Профилактические мероприятия сводятся к предупреждению распространения вирусных инфекций, поддержанию должного уровня иммунитета. В отношении кори и краснухи возможна специфическая профилактика, которая проводится путём обязательной вакцинации детей соответствующими вакцинами. Способы предупреждения прионных заболеваний не найдены, поскольку отсутствуют методики определения прионов в трансплантируемых тканях, препаратах крови.

Осень — время, когда вирусная инфекция набирается сил и наращивает обороты, а в практике врача все чаще появляются дети с симптомами бронхообструкции. Одним из опасных заболеваний, сопровождающихся бронхообструкцией, является бронхиолит — вирус-индуцированное поражение мелких бронхиол у детей до 2 лет. Наиболее подвержены бронхиолитам недоношенные дети, дети с бронхолегочной дисплазией и врожденными гемодинамически значимыми пороками сердца.
Бронхиолит является ведущей причиной госпитализации детей в возрасте до 2 лет, чаще всего болеют дети в возрасте до 6 месяцев. Многие здоровые дети с бронхиолитом могут лечиться амбулаторно, однако недоношенные дети и дети с бронхолегочной дисплазией, с врожденными пороками сердца, нейромышечными нарушениями и иммунодефицитом имеют повышенный риск тяжелого течения болезни и летального исхода [1].
Основной причиной бронхиолита (до 90% всех случаев бронхиолита) является респираторный синцитиальный вирус (РСВ), за ним следуют человеческий метапневмовирус, вирусы парагриппа, вирусы гриппа, аденовирусы, риновирусы, коронавирусы и (редко) Mycoplasma pneumoniae [1]. Примечательно, что в данный момент все чаще сообщается о случаях одновременного заражения РСВ и COVID-19 ((COrona VIrus Disease 2019) — коронавирусная болезнь 2019) с более тяжелым течением ко-инфекции и сравнительно большим числом госпитализаций детей [2,3].
Респираторно-синцитиальный вирус – РНК (содержащий рибонуклеиновую кислоту) вирус рода Pneumovirus, семейства Paramyxoviridae обладающий тропностью к эпителию верхних и нижних дыхательных путей. С точки зрения строения наибольший интерес представляют белки оболочки вируса — G-белок присоединения (attachment protein) и F-белок слияния (fusion protein), обеспечивающие прикрепление, слияние и образование многоядерных гигантских клеток — синцития, состоящих из инфицированных и здоровых клеток [4].
Сезон РСВ инфекции совпадает с холодным временем года, начинаясь в октябре и продолжаясь до марта-апреля на территории нашей страны [5,6].
Инкубационный период РСВ инфекции составляет как правило 4-6 дней, а ранний период заболевания схож с обычной простудой, сопровождающейся насморком, чиханием, малопродуктивным кашлем. В течение 3-7 дней заболевание прогрессирует с поражением нижних дыхательных путей, что клинически проявляется свистящим дыханием, дыхательной недостаточностью и апноэ [1,4,7].
Коварство вируса заключается в том, что у детей более старшего возраста и взрослых течение заболевания имеет мало отличий от любой другой инфекции верхних дыхательных путей, в том числе доминирующей в настоящее время инфекции СOVID-19, но для младенцев из группы риска исход РСВ-инфицирования может быть летальным, в связи с чем становится актуальным вопрос о профилактике инфицирования данных детей [1].
Группы риска тяжелого течения РСВ инфекции [4,7-9]:
- Дети в возрасте до 6 месяцев, рождённые на 35 неделе беременности или ранее
- Дети в возрасте до 2 лет, которым требовалось лечение по поводу БЛД в течение последних 6 месяцев
- Дети в возрасте до 2 лет с гемодинамически значимыми врожденными пороками сердца (ГЗВПС)
Дополнительные факторы риска тяжелого течения РСВ инфекции [4]:
- Мужской пол
- Низкий вес при рождении
- Дети от многоплодной беременности
- Искусственное вскармливание
- Воздействие табачного дыма
- Посещение амбулаторных детских учреждений
- Перенаселенность жилища
- Врожденный или приобретенный иммунодефицит
- Муковисцидоз
- Поражения центральной нервной системы
- Синдром Дауна
На сегодняшний день единственной доступной опцией профилактики является пассивная иммунизация паливизумабом. Паливизумаб - моноклональное антитело, которое связывается с участком вирусного F-белка и тем самым препятствует слиянию оболочки вируса с мембраной клетки-хозяина [4,10,11,16].
Профилактику РСВ инфекции необходимо начинать до начала эпидемиологического сезона, а курс иммунизации состоит из 5 инъекций - по 1 инъекции в месяц. Согласно исследованиям, каждая последующая инъекция увеличивает среднюю 30-и дневную концентрацию вещества и титр антител в сыворотке крови по сравнению с предыдущей. Эффективность менее и более 5 доз в течение эпидемического периода не установлена, что говорит о необходимости соблюдения кратности введения препарата [11,12].
Клиническое исследование Impact-RSV показало, что профилактика паливизумабом снижает частоту госпитализаций из-за РСВ на 55% по сравнению с группой плацебо. В последующем исследовании профилактическая иммунизация паливизумабом у детей с врожденными пороками сердца была связана с относительным сокращением госпитализаций, связанных с РСВ, на 45% [13]. Последние исследования также показывают, что паливизумаб показывает хорошую эффективность для предотвращения заражения РСВ (70%) и госпитализации (82%) у детей младше 2 лет из групп риска, что несомненно положительно сказывается на здоровье и развитии этих детей [14].
Самым важным можно отметить, что применение паливизумаба по данным метаанализа продемонстрировала снижение на 70% снижение шанса младенческой смерти от всех причин при проведении иммунизации от РСВ инфекции [15].
Нейроковид – это неофициальное название поражений центральной и периферической нервной системы при COVID-19. Состояние вызвано как прямым повреждающим действием коронавируса, так и опосредованными системными нарушениями работы организма. Патология имеет полиморфные проявления: астенический синдром, психоэмоциональные нарушения, когнитивный дефицит. Тяжелые формы нейроковида характеризуются расстройствами церебрального кровообращения. Диагностика требует проведения нейровизуализации (КТ, МРТ), ЭЭГ, УЗДГ сосудов головы и шеи. Для лечения неврологических последствий COVID-19 используют методы фармакотерапии, физиотерапии, психотерапии, коррекцию образа жизни.
МКБ-10



Общие сведения
По данным зарубежных исследований, с неврологическими последствиями новой коронавирусной инфекции сталкиваются 49% пациентов в США, 50% в Великобритании, 35-45% в Германии. В среднем более трети больных, перенесших COVID-19, предъявляют жалобы, типичные для поражения головного мозга и периферических нервов. Ситуация осложняется тем, что симптоматика накладывается на другие проявления острого периода коронавируса и постковидного синдрома. Неврологические аспекты коронавирусной пандемии требуют дальнейшего изучения и подбора оптимальных схем медицинской помощи, включая длительную реабилитацию.

Причины нейроковида
Поражение нервной системы возникает при любой клинической форме COVID-19, в том числе при бессимптомном или малосимптомном течении. Поскольку повреждение ЦНС и периферических нервных структур не всегда имеет непосредственную связь с коронавирусной болезнью, требуются дальнейшие масштабные исследования и метаанализы. При этом установление точных причинно-следственных связей затруднительно, особенно у пациентов с сопутствующими заболеваниями.
Предрасполагающие факторы
Важный фактор риска позднего нейроковида – длительное и массивное медикаментозное лечение. Применение высоких доз системных кортикостероидов, моноклональных антител и сосудистых препаратов негативно влияет на церебральный кровоток. Ситуация ухудшается при полипрагмазии и у пациентов с коморбидными состояниями, требующими поддерживающей терапии. Прослеживается тенденция к увеличению частоты и тяжести нейроковида среди пожилых больных.
Патогенез
Последние исследования показывают, что SARS-CoV-2 способен преодолевать гематоэнцефалический барьер (ГЭБ). Это реализуется по трем основным механизмам. Во-первых, вирус взаимодействует с рецепторами ангиотензинпревращающего фермента, которые активно экспрессируются на эндотелии церебральных сосудов. Во-вторых, вирусный протеин S напрямую повреждает ГЭБ. В-третьих, возбудитель активизирует сосудистую воспалительную реакцию и нарушает микроциркуляцию.
Инфекция SARS-CoV-2 вызывает прямое повреждение нервных клеток. Вирусный геном встраивается в митохондриальный матрикс нейронов, после чего активизируется репликация возбудителя. В инфицированных клетках развивается окислительный стресс, активизируется приток ионов кальция и нарастает дисфункция митохондрий. Такие изменения результируют некрозом или апоптозом нейронов в разных участках головного мозга.

Симптомы нейроковида
Головная боль – самое распространенное неврологическое проявление коронавирусной инфекции, которое возникает у большинства больных в остром периоде и беспокоит более 13% пациентов во время постковида. Симптом зачастую сопровождается головокружением, мышечными болями, повышенной утомляемостью. Аносмия и дисгевзия возникают у 85-88% людей в начальном периоде болезни, в 10% случаев сохраняются более 6 месяцев после перенесенного COVID-19.
Серьезную проблему представляет астенический синдром при нейроковиде, который проявляется снижением работоспособности, быстрой утомляемостью после незначительных нагрузок, отсутствием бодрости даже после длительного отдыха. Ситуация усугубляется когнитивными нарушениями: ухудшением краткосрочной и долгосрочной памяти, снижением концентрации внимания, расстройствами мышления.
Неврологические осложнения коронавирусной инфекции включают нарушения работы вегетативной нервной системы, контролирующей деятельность внутренних органов. Характерны колебания артериального давления и пульса, особенно при вертикализации и физических нагрузках. Возникают ортостатические и рефлекторные обмороки, несистемное головокружение. Развивается постуральная гипоксемия, которая проявляется одышкой при вставании с постели.
Осложнения
У пожилых людей и пациентов с другими факторами риска возможно развитие цереброваскулярных последствий: ишемического инсульта, тромбоза венозного синуса, кровоизлияния в ткани головного мозга. Риск развития инсульта в остром периоде коронавирусной инфекции варьирует от 2,8% до 8,7%. Смертность при ОНМК в группе пациентов с COVID-19 в 5-6 раз выше, чем в среднем в популяции.
В периоде нейроковида возможен дебют аутоиммунных полирадикулоневропатий (синдромов Гийена-Барре и Миллера-Фишера), лейкоэнцефалопатии, рассеянного склероза. К тяжелым осложнениям относят менингоэнцефалит, острую некротизирующую энцефалопатию. Около 50% людей с гипертермией и снижением сатурации имеют признаки энцефалопатии: атаксию, спутанность сознания, психические симптомы.
Диагностика
Обследование больных с острыми проявлениями нейроковида требует участия невролога, инфекциониста, врачей-реаниматологов. При хронических последствиях COVID-19 пациенты проходят диагностику и терапию в неврологическом отделении. Важную роль играет сбор жалоб, выяснение инфекционного и эпидемиологического анамнеза, статуса вакцинации против коронавирусной инфекции. Полная диагностическая программа включает следующие методы:
- Осмотр у невролога. Оценка неврологического статуса – базовый метод исследования при нейроковиде. При физикальном исследовании определяют уровень сознания, сохранность поверхностной и глубокой чувствительности, состояние моторных и высших психических функций. По показаниям диагностику дополняют консультацией психиатра.
- МРТ головного мозга. На снимках обнаруживаются мультифокальные очаги поражения в белом веществе, признаки точечных кровоизлияний. При острых нарушениях мозгового кровообращения в 80-90% случаев видны участки гиперинтенсивности, которые появляются в первые часы и позволяют быстро провести дифференциальную диагностику.
- Ультразвуковая допплерография. Исследование быстро выявляет нарушения кровотока в экстра- и интракраниальных сосудах, указывает на локализацию и протяженность патологических изменений. УЗДГ также показывает параметры венозного оттока, состояние коллатерального кровообращения, наличие артериовенозных мальформаций.
- ЭЭГ. Исследование электрической активности головного мозга проводится при когнитивных нарушениях, судорожных пароксизмах, инсомнии. По форме и соотношению разных типов волн удается судить о функциональном состоянии нервных структур, определить локализацию и степень патологических изменений.
- Лабораторная диагностика. Анализы клеточного и биохимического состава крови необходимы для оценки общего состояния здоровья. Дополнительно проводится исследование острофазовых показателей, аутоиммунных маркеров. При сохраняющейся одышке требуется анализ газов крови.
Основная задача дифференциальной диагностики – разграничить проявления нейроковида и неврологические проблемы, возникающие по другим причинам. Для этого пациенты проходят полную лабораторную диагностику с ПЦР-исследованием, анализом на антитела классов M и G. Также больным требуется консультация кардиолога, пульмонолога, иммунолога, чтобы исключить прочие проявления постковидного синдрома.

Лечение нейроковида
Терапевтическая программа подбирается с учетом нозологической формы нейроковида, тяжести состояния больного и наличия сопутствующих заболеваний. При критических неврологических осложнениях лечение проводится в реанимационном или неврологическом стационаре. Хронические симптомы требуют длительной амбулаторной терапии с последующей нейрореабилитацией.
Медикаментозное лечение нейроковида включает вазоактивные препараты, нейропротекторы и ноотропы, витаминные комплексы. Для стабилизации психического состояния используются седативные средства, антидепрессанты и легкие транквилизаторы. При ОНМК необходима тромболитическая, антикоагулянтная и антиагрегантная терапия. Манифестация аутоиммунных процессов требует приема стероидных гормонов и иммуносупрессоров.
Для восстановления здоровья большую роль играют немедикаментозные методы: изменение образа жизни, постепенное расширение физической активности, сбалансированное и витаминизированное питание. После улучшения самочувствия рекомендовано санаторно-курортное лечение, талассотерапия, спелеотерапия и бальнеотерапия. Пациентам оказывают помощь на сеансах индивидуальной и групповой психотерапии, применяют методы арт-терапии, музыкотерапии.
Прогноз и профилактика
При проведении комплексной терапевтической программы удается полностью восстановить неврологические функции у большинства пациентов. Однако выздоровление и реабилитация требуют времени: у 20% людей патологические симптомы сохраняются более 5 недель, у 10% – дольше 3 месяцев. Менее благоприятный прогноз при развитии ишемического или геморрагического инсульта при нейроковиде, после чего остаются резидуальные неврологические изменения.
Основу профилактики нейроковида составляют противоэпидемические меры, направленные на борьбу с распространением COVID-19. При отсутствии противопоказаний настоятельно рекомендовано пройти полный курс вакцинации против SARS-CoV-2, что является самой надежной защитой от заражения и развития тяжелых осложнений. Также важны неспецифические меры: физическое дистанцирование, ношение средств индивидуальной защиты, ограничение социальных контактов.
1. Неврологические последствия COVID-19 у пожилых/ А.Ю. Никитина, А.Ш. Чимагомедова, О.С. Левин// Журнал неврологии и психиатрии им С.С. Корсакова. – 2021. – №10.
2. Неврологические нарушение у пациентов с long COVID синдромом и методы клеточной терапии для их коррекции: обзор литературы/ И.С. Долгополов, Г.Л. Менткевич, М.Ю. Рыков, Л.В. Чичановская// Сеченовский вестник. – 2021. – №3.
3. Неврологические аспекты COVID-19. Тактика ведения пациентов неврологом с учетом эпидемиологической ситуации/ Демьяновская Е. Г., Крыжановский С. М., Васильев А. С., Шмырев В. И.// Лечащий врач. – 2021. – №2.
4. Неврологические проявления и осложнения у пациентов с COVID-19/ И.К. Терновых, М.П. Топузова, А.Д. Чайковская, П.Ш. Исабекова, Т.М. Алексеева// Трансляционная медицина. – 2020. – №7.
История

Гистологический препарат головного мозга, на котором видны микрополости


Как уже было сказано выше, основы знаний о прионах заложил Стенли Прузинер. Немного из его биографии. Родился в США в 1942 году. Его предки - эмигранты из российской империи, еврейского происхождения, вынужденные покинуть страну из-за еврейских погромов. Сам Стенли Прузинер в 1968 г. закончил Университет Пенсильвании и работал ординатором-неврологом в Медицинской школе Калифорнийского университета (Сан-Франциско). В 1970 впервые встретился с болезнью Крейтцфельдта — Якоба. У пациента, находившегося на лечении у Прузинера, никак не выявлялся возбудитель. Плотно занявшись этим исследованием, невролог обратился к трудам другого врача – Сиггурдсона, выявившего определенные закономерности у непонятных на тот момент болезней.
Такими закономерностями стали:
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- неизбежность смертельного исхода.
Что же такое прионы и каков их механизм действия на организм (современные представления)?
На самом деле в организме человека и многих других живых существ есть белки PrPC. По-русски – нормальная форма прионных белков (открыты были после исследований Сиггурдсона, поэтому такая странность в название). Известна его длина, последовательность аминокислот, вторичная структура. Важно знать, что конечная структура состоит из трёх α-спиралей и двухцепочечного антипараллельного β-листа. Обладают интересным свойством, а именно осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга. Тем не менее, функции PrP исследованы недостаточно.

(a) норма (b) патология
Считается, что прионное заболевание может быть приобретено 3 путями: в случае прямого заражения, наследственно или спорадически (спонтанно) или их комбинациями. Спорадическая (то есть спонтанная) прионная болезнь возникает в популяции у случайной особи. Таков, например, классический вариант болезни Крейтцфельдта — Якоба. Существуют две основные гипотезы относительно спонтанного появления прионных болезней. Согласно первой из них спонтанное изменение происходит в самом доселе нормальном белке в мозге, то есть имеет место посттрансляционная модификация. Альтернативная гипотеза гласит, что одна или несколько клеток организма в какой-то момент претерпевают соматическую мутацию (то есть, не передающуюся наследственно) и начинают производить дефектный белок PrPSc. Как бы то ни было, конкретный механизм спонтанного возникновения прионных болезней неизвестен. Вторая – заражение. По данным современных исследований, основной путь приобретения прионных заболеваний — поедание заражённой пищи. Считается, что прионы могут оставаться в окружающей среде в останках мёртвых животных, а также присутствуют в моче, слюне и других жидкостях и тканях тела (кровь, ликвор). Из-за этого заражение прионами может произойти и в ходе пользования нестерильными хирургическими инструментами. Это усложняет стерилизацию хирургических инструментов или устройств на скотобойне. Прионы в большинстве своём устойчивы к протеазам, высокой температуре, радиации и хранению в формалине, хотя эти меры и снижают их способность к заражению. Эффективная дезинфекция против прионов должна включать гидролиз или повреждение/разрушение их третичной структуры. Это можно достичь обработкой хлорной известью, гидроксидом натрия и сильнокислыми моющими веществами. Пребывание в течение 18 минут при температуре 134 °C в герметичном паровом автоклаве не может деактивировать прионы. В качестве основного современного метода для деактивации и денатурации прионов в настоящее время изучается озоновая стерилизация. Ренатурация полностью денатурированного приона до инфективного состояния зафиксирована не была, однако для частично денатурированных прионов в некоторых искусственных условиях это возможно. Еще стоит помнить, что эти белки могут долго сохраняться в почве за счёт связывания с глиной и другими почвенными минералами. Не впадайте в паранойю, но теоретически они могут быть повсюду. В 2011 году было сообщено об открытии прионов, передающихся по воздуху в частицах аэрозоля (то есть воздушно-капельным путём). Также в 2011 году было опубликовано предварительное доказательство того, что прионы могут передаваться с получаемым из мочи человеческим менопаузальным гонадотропином, применяемым для лечения бесплодия. Теоретически с помощью всего одного больного животного с прионной болезнью, можно уничтожать целые нации и страны, просто добавляя его костную муку в кормовые добавки и продавая их в нужное государство. Сходная ситуация произошла в конце 80-х годов в Британии (эпидемия коровьего бешенства). Тогда, скорее всего по незнанию (а не по злому умыслу) произошел вышеуказанный процесс, унесший жизни около 200 человек (на 2009 год) и 179 тыс. голов крупного рогатого скота.

Клиника
Поговорим о болезнях и клинических проявлениях. Теоретически может возникать у всех живых существ, обладающих PrPc Вот некоторые примеры. У овец и коз, как это уже говорилось выше, главное проявление - это скрейпи. Для коров характерно коровье бешенство (губчатая энцефалопатия крупного рогатого скота) У норок- Трансмиссивная энцефалопатия норок. И так далее. Зафиксированы проявления заболеваний у кошек, диких парнокопытных, страусов. Но нас интересуют болезни человека.
Болезнь Крейтцфельдта — Якоба. Код по МКБ-10 A81.0; F02.1. Код А соответствует инфекционным болезням (А81 – инфекционные болезни нервной системы). Код F – психические расстройства, F02 – деменции.

Темно зеленый распространение К-Я
Светло зеленый - коровьего бешенства
Основные клинические критерии для постановки диагноза:
Выделяют несколько клинических форм:
Спонтанная — классическая (sCJD) Согласно современным представлениям (прионной теории), прионы при этой форме заболевания возникают в мозге спонтанно, без какой-либо видимой внешней причины. Болезнь обычно поражает людей в возрасте старше 50 лет и проявляется с вероятностью 1-2 случая на миллион жителей. Вначале проявляется в форме кратких потерь памяти, изменениями настроения, потерей интереса к происходящему вокруг. Далее симптомы деменции прогрессируют со всеми вытекающими последствиями.
Наследственная (fCJD) Болезнь возникает в семьях, где наследуется повреждение гена для прионового белка. Дефектный прионовый белок является намного более подверженным спонтанному превращению в прион. Признаки и ход болезни подобны классической форме.
Ятрогенная (1CJD) Болезнь обусловлена непреднамеренным внесением прионов в тело пациента при медицинском вмешательстве. Источником прионов ранее были некоторые лекарства, инструменты или мозговые оболочки, которые забирались у мертвых людей и использовались для закрытия раны при операциях на мозге. Признаки и ход болезни подобны классической форме. Новый вариант (nvCJD) Болезнь появилась впервые в 1995 году в Великобритании и с того момента от нее умерло не более 100 человек. Вероятнее всего, что они заразились мясными продуктами, содержащими бычьи прионы.
- психические расстройства и сенсорные нарушения,
- характерны глобальные когнитивные нарушения и атаксия.
- описано несколько случаев заболевания, дебютировавшего с корковой слепоты (вариант Heidenhain).
- эписиндром представлен также миоклоническими припадками.
- мозжечковая симптоматика выявляется в 100 %.
- Пациент страдает от всё более тяжёлой бессонницы, панических атак и фобий. Эта стадия длится в среднем 4 месяца.
- Панические атаки становятся серьёзной проблемой, и к ним присоединяются галлюцинации. Эта стадия длится в среднем 5 месяцев.
- Полная неспособность спать, сопровождаемая быстрой потерей веса. Эта стадия длится в среднем 3 месяца.
- Пациент перестаёт говорить и не реагирует на окружающее. Это последняя стадия болезни, длящаяся в среднем 6 месяцев, после чего пациент умирает.
Куру, почти не встречается в настоящее время, в связи с искоренением каннибализма. Интересно, что в 2009 году американские учёные сделали неожиданное открытие: некоторые члены племени форе, благодаря появившемуся у них в сравнительно недавнем времени новому полиморфизму гена PRNP, имеют врождённый иммунитет к куру.
В настоящее время нет ни одного средства останавливающего или тормозящего развитие прионных болезней.
Читайте также:

