Метаболический синдром и гепатит с
Обновлено: 18.04.2024
Успешное лечение острого токсического гепатита у пациента со стеатозом печени и метаболическим синдромом
Русских А.В.
ГБОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ, Москва
Сочетание “алкогольного” анамнеза со стеатозом печени, по данным разных авторов, может встречаться в 50 % случаев. Строго разделить острый алкогольный гепатит (ОАГ) и неалкогольный стеатогепатит (НАСГ) удается не всегда, т. к. в клинической практике эти состояния часто сочетаются. Данный клинический пример иллюстрирует “перекрест” двух заболеваний печени, которые могут взаимоотягощать течение двух патологических процессов – ОАГ и НАСГ. Для комплексного лечения ОАГ и НАСГ в настоящее время может использоваться хорошо изученная и безопасная комбинация орнитина, адеметионина, пентоксифиллина, метформина, урсодеоксихолиевой и тиоктовой кислот (Тиогамма). С учетом участия тиоктовой кислоты в антиоксидантной защите можно считать обоснованным назначение Тиогаммы всем больным с признаками метаболического синдрома и токсическим поражением печени.
Несмотря на значительный прогресс в изучении патогенеза заболеваний печени алкогольной этиологии, остается много нерешенных вопросов, поэтому в настоящее время все больше внимания уделяется патологическим процессам, отягощающим течение токсического гепатита и являющимся фоновыми заболеваниями. К таким состояниям в первую очередь следует отнести метаболический синдром (МС) с главенствующей ролью инсулинорезистентности и стеатоз печени.
Строго разделить острый алкогольный гепатит (ОАГ) и неалкогольный стеатогепатит (НАСГ) удается не всегда, и в клинической практике эти состояния часто сочетаются, взаимоотягощая друг друга. При этом разговор о “безопасной” дозе алкоголя не всегда можно использовать как универсальный под-
ход к каждой клинической ситуации.
НАСГ – это дисметаболический процесс, который характеризуется инфильтрацией и жировой дистрофией гепатоцитов, воспалительными изменениями с последующими цитолизом и фиброзом. На первом этапе болезни архитектоника печени остается сохранной. Однако доказано, что без правильного лечения и при употреблении алкоголя НАСГ может прогрессировать в цирроз печени и привести к печеночно-клеточной недостаточности. Развитие дистрофических, воспалительно-некротических и фибротических изменений в печени в такой ситуации связано с нарушением процессов перекисного окисления липидов вследствие инсулинорезистентности, с одной стороны, и с токсическими эффектами ацетальдегида, с другой.
Сочетание “алкогольного” анамнеза со стеатозом печени, по данным разных авторов, может встречаться в 50 % случаев. При этом в каждом конкретной ситуации целесообразно выявление преобладающего этиологического фактора [1, 2].
ОАГ – это процесс, вызванный основным метаболитом этанола – ацетальдегидом, образующимся в гепатоцитах под воздействием алкогольдегидрогеназы и цитохрома Р450 2Е1 из молекул С2Н5ОН и заканчивающийся повреждением гепатоцитов. Примерно в половине случаев этот процесс сочетается с МС [2, 7].
Варианты ОАГ
1. Латентный (безжелтушный) вариант встречается в 30 % случаев и характеризуется в основном лабораторными изменениями при минимальной клинике. Пациенты с указанным вариантом поражения печени при правильном лечении имеют благоприятный исход болезни.
2. Желтушный вариант ОАГ встречается наиболее часто (до 50 %). У пациентов отмечаются выраженная клиническая картина – слабость, желтуха, боль в правом подреберье, асцит, диспепсические явления. Часто наблюдаются субфебрилитет, повышение билирубина до 5–7 норм.
3. Холестатический вариант наблюдается в 15 % случаев и сопровождается желтухой, обесцвечиванием кала, потемнением мочи, выраженным зудом, характерно повышение билирубина до 20 норм. В половине случаев данный вариант заканчивается летально.
4. Фульминантный ОАГ встречается в 5 % случаев и отличается быстрым прогрессированием желтухи, энцефалопатии и печеночноклеточной недостаточности. Лабораторные изменения представлены лейкоцитозом, достигающим 20–40 тыс. в 1 мкл, повышением СОЭ до 40–50 мм/ч, анемией с макро-
цитозом. Билирубин повышается преимущественно за счет прямой фракции, достигая высоких
показателей. Активность трансаминаз возрастает многократно, при этом соотношение АСТ/АЛТ
больше 2, повышается активность γ-глутаматтранспептидазы (ГГТП), щелочной фосфатазы. Нарастают
биохимические признаки печеночной недостаточности: снижение протромбинового индекса, уровней альбумина и холинэстеразы. К летальному исходу (до 95 %) приводят печеночная кома и кровотечение из варикозно расширенных вен пищевода.
Исход ОАГ зависит от варианта течения и фонового хронического поражения печени, а также от своевременной диагностики и правильного лечения [2]. Главными терапевтическими принципами лечения ОАГ являются отказ от приема алкоголя, богатая белками и достаточно калорийная диета (30 ккал/кг массы тела), дезинтоксикационная терапия, орнитин, адеметионин, пентоксифиллин и урсодеоксихолевая кислота (УДХК).
УДХК обладает противовоспалительным и антиооксидантным эффектами, способствует регенераторным процессам [9]. Пентоксифилин подавляет синтез фактора некроза опухоли α, предотвращая развитие гепаторенального синдрома, снижает смертность на 40 % [2]. Адеметионин – обладает детоксикационным, регенерирующим, антиоксидантным эффектами, действует как метаболический субстрат важнейших биохимических реакций в организме. Он восстанавливает структуру и свойства клеточных мембран, повышая выживаемость, отодвигает сроки трансплантации печени при тяжелых формах ОАГ [1, 2, 7].
Данные мета-анализа 10 исследований указывают на достоверное повышение выживаемости больных тяжелым ОАГ при использовании глюкокортикостероидов. Стандартный курс составляет 40 мг преднизолона или 32 мг метилпреднизолона перорально в сутки с обязательным назначением ингибиторов протонной помпы [2].
МС включает нарушение всех видов обмена: углеводного, белкового, липидного, и проявляется нарушением толерантности к углеводам различной степени, инсулинорезистентностью, гиперурикемией и подагрой, ожирением с явлениями стеатоза печени или НАСГ; в некоторых случаях МС включает не все вышеперечисленные признаки. У больных МС, протекающим с минимальными проявлениями, практически в 100 % случаев выявляется стеатоз печении, а у 25–30 % пациентов имеет место НАСГ [2, 3].
Варианты НАСГ
Клинически НАСГ характеризуется мало- и бессимптомным течением. Наиболее часто при НАСГ больные отмечают неопределенный дискомфорт, проявления диспепсического синдрома. Незначительное увеличение размеров печени характерно для большинства пациентов; признаки
портальной гипертензии, печеночной недостаточности выявляются редко – не более чем у 8–10 % больных. Биохимическое исследование крови обнаруживает умеренное повышение уровней АЛТ и АСТ (1,5–3,0 нормы) в сочетании с незначительным повыением уровней ГГТП и щелочной фосфатазы (до 1,5–2,0 норм) [3, 10].
Несмотря на определенные достижения в области терапии МС, лечение таких больных остается сложной задачей. Принципы лечения НАСГ включают перестройку пищевых поведенческих реакций. Рациональное снижение массы тела на 1500 г в неделю способствует уменьшению жировой инфильтрации гепатоцитов. Медикаментозная коррекция МС инсулинсенсетайзерами, например метформином, снижает у больных НАСГ уровень гипергликемии и повышает чувствительность
к инсулину, уменьшает активность печеночных ферментов, выраженность жировой дистрофии, воспалительных изменений и фиброза в печени [6, 7]. Как важное направление может рассматриваться применение препаратов с антиоксидантной активностью (тиоктовой кислоты и УДХК) [3–5], которое может быть вполне оправданно с точки зрения патогенеза НАСГ. В настоящее время проводится исследование по применению вышеуказанных препаратов больными с хроническими
вирусными гепатитами для коррекции инсунорезистентности (при НАСГ и/или токсическим поражение печени) перед проведением противовирусной терапии. Из положительных эффектов тиоктовой кислоты обращаем внимание на следующие: препарат способствует снижению концентрации глюкозы в крови и увеличению гликогена в печени, а также преодолению инсулинорезистентности. Участвует в регулировании липидного и углеводного обмена, стимулирует обмен холестерина. Улучшает функцию печени, снижает повреждающее влияние на нее эндогенных и экзогенных токсинов, в т. ч. алкоголя. Благотворно воздействует на репаративные процессы: уменьшает проявления висцеральной микроангиопатии в тканях, в т. ч. в гепатоцитах, улучшает печеночную функцию. Препараты тиоктовой кислоты и УДХК также способствуют снижению синтеза провоспалительных цитокинов, уменьшают абсорбцию холестерина в подвздошной кишке, снижая синтез холестерина в печени.
Клинический пример
Пациент Р. 64 лет, физик, обратился в поликлинику с жалобами на слабость, потливость, повышение артериального давления (АД) до 170/100 мм рт. ст., сухость во рту, боли в правом подреберье, увеличение живота, склонность к жидкому стулу.
печеночных трансаминаз: АСТ, ГГТП –норма, АЛТ – 1,5 нормы. Уровень глюкозы натощак – 7,0 ммоль/л; от дальнейшего обследования и лечения в тот период отказался. Ухудшение состояния отметил неделю назад, когда появились слабость, сухость во рту, увеличился живот (в течение 10 дней
ежедневно после стресса употреблял крепкие спиртные напитки до 200 мл). Обратился в поликлинику, при амбулаторном обследовании выявлено: АСТ 1749 ЕД (43 нормы), АЛТ 607 ЕД (15 норм), ГГТП 441ЕД (8 норм), глюкоза натощак – 8,8 ммоль/л, мочевая кислота – 554 ммоль/л. Пациенту была предложена госпитализация в стационар дневного пребывания.
При осмотре в стационаре: общее состояние удовлетворительное, обращает на себя внимание повышенная масса тела до 110 кг (индекс массы тела – 32 кг/м2), гиперемия кожных покровов. Над легкими прослушивается везикулярное дыхание, хрипов нет. Частота дыханий – 18 в минуту. Тоны
сердца звучные, ритм правильный. АД –160 /90 мм рт. ст. Пульс – 80 в минуту. Живот при пальпации мягкий, увеличен за счет подкожножировой клетчатки, безболезненный, печень + 5 см (размеры по Курлову – 15–12–10 см). Перкуторно жидкость в брюшной полости не определяется.
Больному в стационаре проведен комплексный клинико-лабораторный мониторинг: общий анализ крови – гемоглобин 162 г/л, эритроциты 5,4 × 1012/л, лейкоциты 9,3 × 109/л, тромбоциты 169 тыс., СОЭ 40 мм/ч. Биохимический анализ: глюкоза 9,8 ммоль/л, билирубин общий 45,6 мкмоль/л, мочевина 4,2 ммоль/л, креатинин 89 мкмоль/л, мочевая кислота 521 мкмоль/л, железо 31,4 ммоль/л, АСТ 1843 ЕД (45 – норм), АЛТ 720 ЕД (18 норм), ГГТП 524 ЕД (9,5 норм), щелочная фосфатаза 192 ЕД (9,5 – норм),
холестерин 6,4 ммоль/л. Наличие гепатотропных вирусов не подтверждено. По данным ультразвукового исследования брюшной полости размеры печени увеличены: правая доля – 167 × 90, левая 78 × 65 мм, портальная вена – до 13 мм, селезеночная вена – до 11 мм, размеры селезенки – 15 × 10 см. Желчный пузырь не увеличен, толщина стенки – 2,5 мм, конкрементов нет. Поджелудочная железа несколько увеличена, гиперэхогенна, главный панкреатический проток не расширен. Жидкость в брюшной полости не определяется.
С учетом данных, полученных при сборе жалоб, анамнеза, а также результатов осмотра и лабораторных данных поставлен диагноз “острый токсический гепатит высокой степени активности, протекающий на фоне стеатоза печени в рамках метаболического синдрома”.
В условиях дневного стационара проведено следующее лечение: физиологический раствор 0,9 % – 500 мл + адеметионин 10,0 мл внутривенно капельно № 10, Тиогамма 600 мг внутривенно капельно № 10, метформин (Метфогамма) 1000 мг на ночь, орнитин 5 г 2 раза в сутки. На фоне проведенного лечения через 10 дней состояние значительно улучшилось, выписан в удовлетворительном состоянии со следующими биохимическими показателями: АСТ 51 ЕД, АЛТ 95 ЕД, ГГТП 159 ЕД, щелочная
фосфатаза 83 ЕД. Рекомендован полный отказ от алкоголя. С учетом сохраняющегося синдрома холестаза также рекомендован прием УДХК 500 мг вечером в течение 3 месяцев, орнитин 5 г 2 раза в
сутки в течение 3 месяцев, Тиогамма 600 мг утром в течение 2 месяцев, метформин (Метфогамма) 1000 мг на ночь постоянно. Контроль биохимических показателей 1 раз в 3 месяца.
Через месяц после полного восстановления функции печени пациенту предложена реабилитация по МС (питание до 1200 ккал/сут, ежедневные аэробные нагрузки, например ходьба или плавание в бассейне). В тот период проведен ФиброТест, который применяется для оценки стадии фиброза при алкогольном и неалкогольном стеатозе. Применять данный тест при активном воспалительном процессе в печени не рекомендовано.
Приводим результаты данного исследования: диагностика фиброза Fibro 1–2, НешТест NASH-2 свидетельствует о выраженном неалкогольном стеатозе, АшТест ASH-0 – об отсутствии или наличии минимального алкогольного стеатоза. Данные результаты полностью соответствуют предшествующей диагностической концепции.
Анализируя этот клинический пример, обращаем внимание на следующее: у пациента несомненно имеет место “метаболический орнамент”, скорее всего связанный с генетической предрасположенностью и неправильным образом жизни (гиподинамия, избыточное питание, отсутствие физических нагрузок), подтвержденный лабораторно. Для коррекции инсулинорезистентности, лежащий в основе МС, назначены метформин (Метфогамма) и тиоктовая кислота (Тиогамма). С другой стороны, четкое указание на употребление гепатотоксической дозы алкоголя перед ухудшением состояния позволило с учетом лабораторных данных поставить диагноз острого токсического гепатита, латентного (безжелтушного) течения. Для коррекции этого процесса назначен орнитин и адеметионин, а затем УДХК.
Таким образом, данный клинический пример иллюстрирует “перекрест” двух заболеваний печени, которые могут взаимоотягощать течение патологического процесса – НАСГ и ОАГ. Своевременная диагностика, правильное, патогенетически обоснованное лечение в сочетании с полным отказом от алкоголя в короткие сроки привели к купированию ОАГ и полной нормализации лабораторных показателей.
Литература
1. Яковенко Э.П., Григорьев П.Я., Агафонова Н.А. и др. Метаболические заболевания печени: проблемы терапии // Фарматека 2003. № 10.
2. Практическая гепатология / Под ред. Н.А. Мухина. М., 2005.
3. Mendez-Sanchez N, Arrese M, Zamora-Valdes D, Uribe M, et al. Current concepts in pathogenesis of nonalcoholic fatty liver disease. Liver Int 2007;27(4):423–33.
4. Arivazhagan P, Panneerselvam C. Effect of DL –alpha-lipoic acid on tissue nucleic acid contents in aged rats. Pharmacol Res 2000;42(3):223-6.
5. Roberts E. A. Pediatric nonalcoholic fatty liver disease (NAFLD): A “growing” problem? J Hepatol 2007;46(6):1133–42.
6. Konrad T, Vicini P, Kusterer K, et al. Alpha-Lipoic acid treatment decreases serum lactate and pyruvate concentrations and improves glucose effectiveness in lean and obese patients with type 2 diabetes. Diabetes Care 1999;22(2):280–87.
7. Tilg H, Kaser A. Management of acute alcoholic hepatitis. In: Prevention and Intervention in Liver Disease. IASL–EASL Postgraduate Course. Madrid, 2002:28–37.
8. Lazaridis KN, Gores GJ, Lindor KD. Ursodeoxycholic acid mechanisms of action and clinical use in hepatobiliary disorders. J Hepatol 2001;35:134–46.
9. Brunt EM. Nonalcoholic steatohepatiatis. Semin Liver Dis 2004;24:3–20.
Об авторах / Для корреспонденции
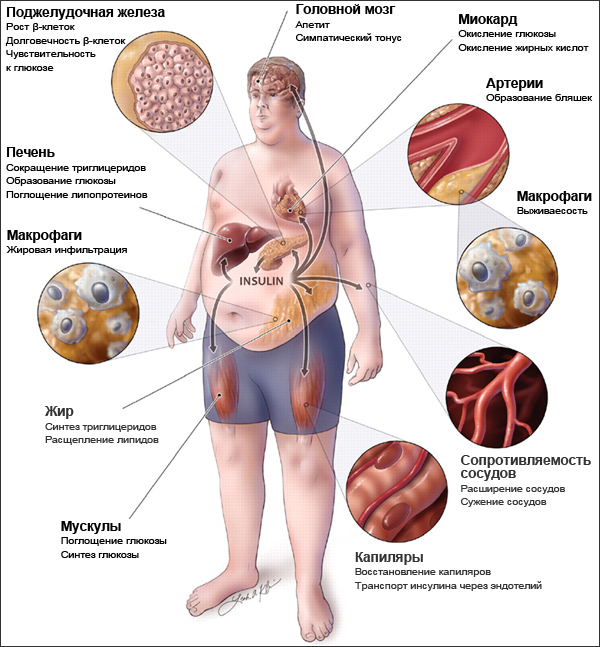
Метаболический синдром развивается у 40 % людей в основном пенсионного возраста и у всех, кто ведет малоподвижный образ жизни и неправильно питается. Распространенность метаболического синдрома продолжает расти.
В основе метаболического синдрома и его проявлений лежит инсулинрезистентность. Резистентность (устойчивость) к инсулину заключается в том, что для поддержания нормального метаболизма требуется большее количество инсулина.
Отмечено, что инсулинрезистентность часто встречается у больных с хроническим вирусным гепатитом С (ХГС), что свидетельствует о тесной связи этих двух состояний. Поскольку ХГС больны более 170 млн. человек, сочетание инфекции с инсулинрезистентностью представляет серьезную проблему мирового здравоохранения.
С резистентностью к инсулину связано также развитие у больных ХГС стеатоза – жирового перерождения печени, которое почти в 2 раза чаще, чем в среднем у населения. Стеатоз связан также с повышением индекса массы тела (ИМТ), сахарным диабетом 2 типа, возрастом старше 40 лет, гепатитом С, вызванным вирусом С генотипа 3 и фиброзом.
Генотип вируса 3 оказывает прямое стеатогенное действие, у пациентов с другими генотипами вируса основную роль в формировании стеатоза играет инсулинрезистентность.
Независимо от того, что развивается первым, резистентность к инсулину является основным фактором риска тяжелого фиброза печени и рассматривается как важный прогностический фактор формирования цирроза печени.
Резистентность к инсулину играет основную роль в формировании сахарного диабета 2 типа, поэтому не удивительно, что среди больных гепатитом С он встречается в 2 раза чаще.
Резистентность к инсулину ухудшает результаты лечения ХГС. Для оценки инсулинрезистентности используют индекс HOMA-IR. При значении этого индекса больше 4 эффективность лечения (частота устойчивого вирусологического ответа – УВО) снижалась на 40 %. У пациентов с индексом HOMA-IR меньше 2 ранний вирусологический ответ определялся у всех пациентов.
Жировой гепатоз также значительно ухудшает прогнозы на выздоровление.
Поскольку на успех противовирусной терапии значительно влияют степень ожирения, резистентность к инсулину и стеатоз печени, следует оценивать эти факторы при назначении терапии. Если они присутствуют, то для достижения наилучшего терапевтического эффекта требуется коррекция резистентности к инсулину и лечение стеатоза.
Симптомы метаболического синдрома
Нарушения, объединенные рамками метаболического синдрома, длительное время протекают бессимптомно. Наиболее ранними проявлениями метаболического синдрома являются дислипидемия и повышение артериального давления. Часто не все компоненты метаболического синдрома встречаются одновременно:
- абдоминально-висцеральное ожирение (окружность талии более 102 см у мужчин и более 88 см у женщин);
- инсулинорезистентность при высоком уровне инсулина;
- дислипидемия (сочетание гипертриглицеридемии — больше 1,7, низкого уровня ХЛ ЛВП и повышения фракции мелких ХЛ ЛНП;
- артериальная гипертензия (артериальное давление выше 130/85 мм рт. ст.);
- ранний атеросклероз и ишемическая болезнь сердца.
Возможные жалобы на повышенную утомляемость, апатию, одышку, повышенный аппетит, жажду, учащенное мочеиспускание, головную боль, сухость кожи, потливость.
Лечение метаболического синдрома
Лечение назначают в зависимости от степени обменных нарушений и тех заболеваний, которые выявлены у пациента. Лечение направлено на коррекцию углеводного обмена, снижение массы тела, купирование артериальной гипертонии и симптомов сахарного диабета.
Немедикаментозное лечение метаболического синдрома
Первым этапом лечения метаболического синдрома является изменения стиля жизни, в первую очередь правильное питание и повышение физической нагрузки. Первым шагом и его обязательным звеном должно быть снижение таким образом массы абдоминально-висцерального жира, который играет ключевую роль в развитии и прогрессировании метаболического синдрома.
Снижение общей массы тела на 10-15% от исходной сопровождается уменьшением висцеральной жировой ткани, т. е. жира, расположенного не в подкожном слое, а вокруг внутренних органов. Это, как правило, ведет к повышению чувствительности тканей к инсулину, улучшению показателей липидного и углеводного обмена, нормализации повышенного артериального давления.
Снижение массы тела должно быть постепенным. Быстрый и резкий сброс массы тела на 10-20 кг приводит к снижению гормона лептина и к возникновению труднопреодолимого чувства голода, и в результате к возврату лишних килограммов, иногда даже в большем количестве, чем до терапии.
Потеря массы тела снижает содержание свободных жирных кислот в печени, что приводит к снижению инсулинрезистентности, повышает внепеченочную чувствительность к инсулину, уменьшает воспаление в жировой ткани.
Медикаментозное лечение метаболического синдрома
Дополнительным лечением метаболического синдрома является назначение урсодезоксихолевой кислоты и витамина Е, которые оказывают антиоксидантное действие и улучшают результаты лечения ХГС.
Препараты, повышающие чувствительность к инсулину (тиазолидиндиолы и метформин) снижают резистентность к инсулину и уменьшают выраженность фиброза и степени жирового гепатоза у больных гепатитом С.
Все это улучшает результаты терапии противовирусными препаратами.
Поэтому обследование пациентов, готовящихся к противовирусной терапии, в особенности с генотипом 3, обязательно должно включать анализ на инсулинрезистенстность (индекс HOMA-IR), оценку степени метаболического синдрома и всех его компонентов с обязательной последующей коррекцией желательно до начала терапии.
Тактика лечения пациентов с ожирением и метаболическим синдромом при гепатите С
При выявлении у пациентов с HCV сопутствующего поражения печени в результате метаболического синдрома (неалкогольная жировая болезнь печени - стеатоз) необходимо провести дополнительное обследование на показатели обменных и гормональных нарушений, характерных для этого заболевания.
Рекомендуется для оценки степени поражения печени использовать исследование крови – Фибромакс, которое дает возможность оценить отдельно степень поражения печени вирусом и отдельно метаболическим синдромом.
Тактика лечения зависит от степени поражения печени в целом, и отдельно каждым повреждающим фактором. Лечение противовирусными препаратами может быть назначено сразу, а дальнейшее лечение метаболического синдрома после получения УВО.
Если степень поражения печени вирусом значительно меньше, чем метаболическим синдромом, возможно начинать противовирусную терапию после лечения метаболического синдрома.
В случаях наличия сопутствующих заболеваний печени необходимо ставить целью лечения не только получение УВО, но и сохранение и восстановление печени, пострадавшей от других патологических факторов.
Одним из важнейших факторов, снижающих в 2 раза эффективность противовирусной терапии при гепатите В и гепатите С, является метаболический синдром. Кроме того, наличие у пациента с гепатитом метаболического синдрома увеличивает частоту развития цирроза печени в 3 раза по сравнению с пациентами без метаболического синдрома.

Метаболический синдром характеризуется увеличением массы висцерального жира (в области живота, талии и органов брюшной полости) и снижением чувствительности тканей к инсулину (инсулинорезистентностью).
· Артериальная гипертония (повышение ад выше 130\85 мм рт ст)
· Повышение уровня глюкозы (сахара крови) натощак (более 6.1 ммоль\л)
· Нарушение толерантности к глюкозе или сахарный диабет (глюкоза плазмы через 2 часа после нагрузки глюкозой более 7.8 ммоль\л)
· Нарушение липидного обмена.
При метаболическом синдроме жирные кислоты накапливаются в клетках печени, приводя к нарушению ее функции и, как следствие, классическим проявлением метаболического синдрома является жировой гепатоз. Это состояние связано с высоким риском формирования выраженных фиброзных изменений в печени и печеночной недостаточности. У пациентов с ожирением, повышением уровня холестерина и сахарным диабетом риск цирроза возрастает.
Основой лечения метаболического синдрома является изменение питания и образа жизни в целом. Однако, успех лечения и, главное, сохранение полученного результата требует квалифицированной помощи специалиста-эндокринолога и усилий со стороны пациента. Существуют препараты, улучшающие печеночную чувствительность к инсулину и позволяющие, таким образом, уменьшить проявления жирового гепатоза.
Тактика ведения пациентов с вирусным гепатитом в сочетании с метаболическим синдромом определяется совместно врачом-гепатологом и эндокринологом.
Снижение веса всего на 4-5% позволяет добиться значительного улучшения состояния печени и прогноза лечения вирусного гепатита.
Жировой гепатоз (стеатоз печени) – мировая эпидемия
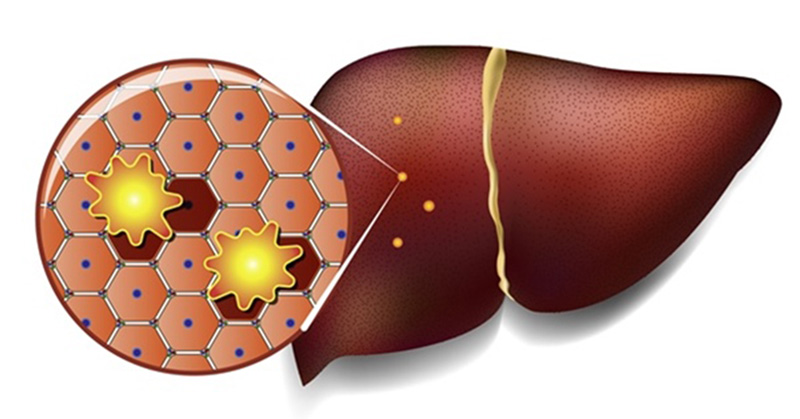
Жировая болезнь печени, или жировой гепатоз, или как еще называют - стеатоз печени - самое распространенное в наше время заболевание печени во всем мире, практически у подавляющего большинства людей старше 40 лет, а в последнее время достаточно частое заболевание людей молодого возраста и не только с избыточным лишним весом. Суть заболевания заключается в ожирении печени, замещением нормальной здоровой печени на жир, что приводит к циррозу, как и любые другие заболевания печени, в том числе вирусные гепатиты.
Диагноз устанавливается при ультразвуковом обследовании печени и при этом чаще всего пациент слышит от врача, что заболевание это практически у всех и единственный способ лечения - снижение веса. Чаще всего эти рекомендации не принимаются всерьез, а снижение веса не такое простое решение, так как причиной ожирения, в том числе внутреннего ожирения, являются патологические изменения в обмене веществ и гормональные нарушения.
Жировой гепатоз или стеатоз печени – не результат плохого поведения, неправильного образа жизни, в том числе питания и физических нагрузок. Жировой гепатоз – это опасная болезнь, которая требует лечения.
Однако, в отличие от многих других заболеваний печени, жировой гепатоз – трудно излечимое заболевание, так как у гепатологов нет единого стандарта медикаментозного лечения этой патологии.
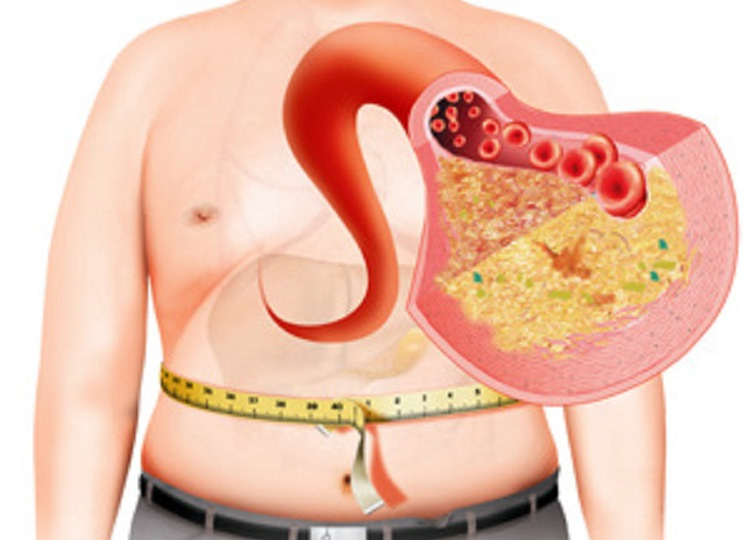
Поскольку основной причиной заболевания являются обменные и гормональные изменения в организме, так называемый метаболический синдром, то к лечению привлекается эндокринолог. Однако, и в этом случае, только медикаментозное лечение препаратами, восстанавливающими обменные и гормональные процессы, а также способствующие удалению жира из печени, не дает результатов. Индивидуальные рекомендации по питанию и физическим нагрузкам, без которых невозможно получить выздоровление, часто являются непреодолимым препятствием, так как всегда легче принимать таблетки, чем изменять образ жизни.
В нашем центре 10-летний опыт лечения жирового гепатоза показал, что это заболевание излечимое в любой стадии за исключением цирроза, а успех лечения – совместная работа врача и пациента.
В нашем гепатологическом центре установлено уникальное оборудование для оценки степени стеатоза печени (ожирения печени): от S0 до S4, при котором S4 - цирроз (как и при любом другом заболевании печени, сопровождающимся ее разрушением и замещением на другую, не функционирующую ткань). Фиброскан нового поколения позволяет оценить, какая часть печени (в процентах) уже не функционирует как печень. Это важно для диагностики и выбора тактики лечения, а также контроля эффективности лечения. Результатом лечения должно быть выздоровление.
Особенно важно определять степень жирового гепатоза (стеатоза печени), если есть сопутствующие заболевания, например, чаще всего, вирусные гепатит В и гепатит С. Повреждение печени вирусами сопровождается замещением здоровой печени на соединительную ткань, что также ведет ее к циррозу.
Аппарат Фиброскан нового поколения позволяет оценить отдельно степень каждого повреждающего фактора: вируса и жира. От этого зависит тактика лечения. Иногда врач не имеет права назначать противовирусную терапию, если печень поражена жиром и лечение противовирусными препаратами не остановит процесс формирования цирроза.
Обследование для определения степени фиброза и стеатоза на аппарате Фиброскан значительно дешевле, чем определение тех же показателей по крови ФиброМакс , и значительно точнее, так как биохимические показатели – маркеры повреждения печени, - меняются значительно быстрее, чем формирование фиброза и стеатоза.
Аппарат Фиброскан определяет с помощью ультразвуковой диагностики физические характеристики плотности печеночной ткани и результат измерений выражается в физических единицах, которые соответствуют с медицинской точки зрения степеням поражения печени: фиброз от F0 до F4, стеатоз от S0 до S4 (четвертая стадия соответствует циррозу). Результаты измерений выдает программа, что исключает субъективизм в оценке.
Обследование – первый шаг к выздоровлению. Мы проводим обследование в день обращения после бесплатной консультации гепатолога для определения задач и объема обследования. По результатам вам будет назначено эффективное лечение, которое в подавляющем большинстве случаев заканчивается выздоровлением.
Стеатоз печени и инсулинорезистентность при хроническом гепатите С
Ж.Ж. Байжанова 1, Т.М. Игнатова 2, М.М. Северова 1, Э.Э. Бурневич 1
1 Кафедра терапии и профессиональных заболеваний ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития России, Москва, 2 Лаборатория изучения ревматологических проблем заболеваний печени Института ревматологии РАМН, Москва
В настоящее время факторами прогрессирования хронического гепатита С признаны стеатоз печени и инсулинорезистентность, которые могут быть как метаболического (в рамках метаболического синдрома), так и вирусного (при инфицировании HCV 3-го генотипа) генеза. Важно, что стеатоз печени и инсулинорезистентность значимо ухудшают результаты противовирусной терапии хронического гепатита С. В связи с этим лечение стеатоза печени и коррекция инсулинорезистентности представляются важнейшими условиями профилактики быстрого прогрессирования хронического гепатита С и повышения частоты стойкого вирусологического ответа при проведении противовирусной терапии.
Разнообразие темпов прогрессирования хронического гепатита С (ХГС) связывают с наличием множества факторов, влияющих на его течение.
Среди них рассматривают следующие:
• факторы вируса – генотип HCV (hepatitis С virus), степень гетерогенности популяции вируса (квазивиды), объем инфицировавшего материала (контаминированной HCV крови);
• факторы хозяина – возраст в момент инфицирования, наличие синдрома перегрузки железом, злоупотребление алкоголем и ряд дополнительных факторов (коинфицирование другими вирусами, действие факторов внешней среды, сопутствующие патологические состояния) [1].
Ассоциация СП и ИР с ХГС
СП является частой находкой при исследовании гистологических препаратов печени больных ХГС. Так, крупнокапельную жировую дистрофию гепатоцитов выявляют в среднем у 50 % (от 30 до 80 %) больных хронической HCV-инфекцией [4]. В публикациях 1990-х гг. этот феномен рассматривался как один из наиболее типичных признаков HCV-инфекции, позволявших проводить дифференциальную диагностику с гепатитами другой этиологии.
Среди основных причин СП у больных ХГС рассматривают сопутствующие метаболические нарушения (ожирение, сахарный диабет [СД] 2 типа, гиперлипидемию), которые приводят к “неалкогольному”, или “метаболическому”, СП, а также злоупотребление алкоголем, приводящее к “алкогольному” СП. В то же время у значительной части больных ХГС и без вышеперечисленных нарушений (метаболического синдрома, злоупотребления алкоголем) часто выявляется жировая инфильтрация печени, что позволяет также обсуждать роль вируса в развитии стеатоза – “вирусного” СП. При инфицировании HCV 3-го генотипа СП носит преимущественно “вирусный” характер [5], в то время как при инфицировании HCV 1-го генотипа чаще имеет место “метаболический” СП с ИР [6].
Полагают, что СП при ХГС обусловлен прямым цитопатическим действием вируса, при этом основную роль отводят core-белку HCV, который нарушает метаболизм и транспорт липидов в гепатоците [7]. Кроме того, известно, что в сыворотке крови HCV находится в соединении с β-липопротеидами (липопротеидами низкой и очень низкой плотности), а среди клеточных рецепторов, используемых HCV для проникновения в гепатоциты, рассматриваются рецепторы к липопротеидам низкой плотности (ЛПНП). При этом среди больных, инфицированных HCV 3-го генотипа, наблюдается снижение уровня аполипопротеина-В (компонент ЛПНП) в крови, которое коррелирует с выраженностью СП [8].
Патогенез “метаболического” СП объясняется концепцией “двух ударов” [9]. ИР (“первый удар”) вызывает повышенный липолиз и приводит к нарушению обмена глюкозы и к гиперинсулинемии. Эти два биохимических синдрома (ИР и гиперинсулинемия) ответственны за накопление триглицеридов и других липидов в гепатоцитах. Продолжающееся поступление жира в гепатоциты приводит к их гидропическому изменению (баллонной дистрофии), деструкции клеток и нарушению структуры синусоидов. “Второй удар”, вероятно обусловленный многими факторами, приводит к развитию воспаления, т. е. к стеатогепатиту. Среди этих факторов обсуждается участие повышенного содержания жирных кислот и/или функциональной недостаточности митохондрий, нарушающих окисление системой цитохрома Р450 (CYP4A, CYP2E1 и др.) липидов длинных и очень длинных цепей жирных кислот с образованием токсичных дикарбоновых кислот (микросомальное ω-окисление). Одновременно в электронно-транспортной цепи в цитоплазме и эндоплазматическом ретикулуме образуются и другие токсичные молекулы свободных радикалов – анионы супероксида, гидроксильные, метильные и нитрогруппы, Н2О2. Эта ситуация описывается как оксидативный (кислотный) стресс. В ряде случаев оксидативный стресс не имеет последствий, в других – он может вызывать пролиферацию клеток, задержку их роста, апоптоз и некроз. В условиях оксидативного стресса в клетках печени увеличивается экспрессия многочисленных цитокинов (фактора некроза опухоли α [ФНО-α], трансформирующего фактора роста β, интерлейкина-10 и др.), усиливается их активность, включаются реакции фиброгенеза в печени, а также усугубляется ИР. На моделях животных конечным эффектом таких изменений является значительная редукция синусоидальных пространств (приблизительно 50 % в контроле) и снижение числа нормально кровоснабжаемых синусоидов, что демонстрирует ишемически перфузионное повреждение печени при неалкогольном стеатогепатите.
Важно, что СП и стеатогепатит любого генеза могут в конечном итоге приводить к формированию ЦП и ГЦК. Так, еще в 1884 г. Frerichs изучал изменения, происходившие в печени больных “сахарной болезнью”, а в 1970-х гг. постулировался факт возможной трансформации жировой дистрофии печени в ЦП. Однако только в 1980 г. J. Ludwig, наблюдая характер изменений печени у больных ожирением и СД 2 типа без указаний на прием алкоголя в гепатотоксичных дозах, сформулировал понятие “неалкогольный стеатогепатит” и указал на риск развития ЦП в его исходе [10].
Механизмы, лежащие в основе провоспалительной и профиброгенной роли как “вирусного”, так и “метаболического” СП, остаются не до конца изученными. Предполагают, что при жировой дистрофии гепатоциты становятся более чувствительными к повреждающему действию различных провоспалительных цитокинов и свободных радикалов, которые в большом количестве образуются в печени в ответ на инфицирование HCV. Именно окислительный стресс и перекисное окисление липидов, наблюдающиеся при СП, способствуют развитию фиброза печени [11]. Кроме того, нагруженные жиром гепатоциты более подвержены апоптозу, который в настоящее время признается основным механизмом гибели клеток печени при хроническом вирусном гепатите. В ряде исследований показано, что выраженность СП прямо коррелирует со степенью апоптоза гепатоцитов и, что особенно интересно, с активностью звездчатых клеток печени, которые являются одним из основных источников профиброгенных факторов в печени [12].
В последнее время появляется все больше данных, которые подтверждают прямое действие HCV на метаболизм глюкозы. Так, СД 2 типа чаще наблюдается среди больных HCV-ассоциированным ЦП по сравнению с популяцией больных, имеющих ЦП иной этиологии [13]. Ретроспективный анализ исследования 1117 больных хроническим вирусным гепатитом продемонстрировал, что частота встречаемости СД 2 типа при HCV-инфекции составила 22 %, в то время как при HBV-инфекции только 12 % [13]. Многофакторный анализ показал, что HCV-инфекция может рассматриваться как независимый фактор риска развития СД 2 типа, а во многих нормативных документах национальных гепатологических ассоциаций СД 2 типа рассматривается как одно из внепеченочных проявлений ХГС [14].
Влияние ИР и СП на эффективность противовирусной терапии ХГС
Классическая ПВТ ХГС – еще один пример, свидетельствующий о наличии неслучайной ассоциации между HCV и развитием ИР. М. Romero-Gomez и соавт. показали, что чувствительность к инсулину может значительно и достоверно улучшаться у больных, достигших клиренса РНК HCV, в то время как у пациентов с сохраняющейся репликацией вируса чувствительность к инсулину не меняется, несмотря на сопутствующее снижение массы тела в процессе ПВТ [15]. Экспериментальные данные показывают, что HCV напрямую влияет на инсулиновый каскад реакций, угнетая инсулиновые рецепторные субстрат-1 и субстрат-2, а также воздействуя на функциональную активность и экспрессию рецепторов посредством повышения уровня таких провоспалительных цитокинов, как ФНО-α, или посредством нарушения пострецепторных механизмов [16].
С середины 1990-х гг., когда была дана детальная характеристика прогностических факторов достижения СВО у больных ХГС, СП стал рассматриваться как отрицательный прогностический фактор формирования СВО [17]. Впоследствии данное предположение было подтверждено в многочисленных клинических исследованиях [18]. Результаты крупных рандомизированных исследований показали, что у больных ХГС, инфицированных HCV 1-го и 2-го генотипов и, следовательно, имеющих “метаболический” СП, частота СВО на комбинированную ПВТ интерфероном α (ИФН-α) и рибавирином была в 2–3 раза ниже, чем у больных с нормальной массой тела и без признаков СП. При этом у больных, инфицированных HCV 3-го генотипа (т. е. “вирусным” СП), наличие СП не влияло на эффективность ПВТ; более того, элиминация вируса приводила к достоверному снижению выраженности СП и в ряде случаев нормализации повышенного уровня холестерина в крови [19]. В эпоху применения комбинации пегилированного ИФН-α и рибавирина, несмотря на большую эффективность ПВТ, СП по-прежнему выступает в качестве отрицательного прогностического признака ответа на лечение [20].
Коррекция ИР и лечение СП
Принимая во внимание, что СП способствует прогрессированию фиброза печени при ХГС, целесообразно выстраивать стратегию лечения таких больных с учетом снижения его степени. Это может быть достигнуто как за счет снижения массы тела, так и с помощью лекарственных препаратов, корригирующих разные компоненты метаболического синдрома: снижающих гипергликемию, повышающих чувствительность к инсулину, нормализующих липидный спектр. Задержку начала ПВТ от нескольких недель до нескольких месяцев в таких случаях следует признать оправданной.
Снижение массы тела достигается с помощью смены образа жизни, увеличения физической активности, фармакологических методов, хирургических пособий, применяемых в комплексе или по отдельности [21]. Согласно рекомендациям Национального института здоровья США, фармакологическая коррекция ожирения показана при индексе массы тела (ИМТ) ≥ 30 кг/м² или ≥ 27 кг/м² при наличии осложнений, вызванных ожирением. Для длительной фармакотерапии используется сибутрамин (ингибитор захвата серотонина и норадреналина, подавляющий чувство голода и способствующий быстрому наступлению чувства сытости во время приема пищи) и орлистат (ингибитор кишечной липазы, снижающий всасывание жиров). Недостатками фармакотерапии ожирения является обратный быстрый рост массы тела при отмене препаратов и наличие противопоказаний к назначению сибутрамина больным ожирением с сопутствующими сердечно-сосудистыми заболеваниями, например артериальной гипертензией [22].
Для лиц с морбидным ожирением или в отсутствие эффекта от фармакотерапии в качестве альтернативы выступает хирургическое лечение. Оно показано при ИМТ ≥ 40 кг/м² или ≥ 35 кг/м² при наличии осложнений ожирения [23]. Из хирургических методик лечения ожирения используются операции гастроеюнального и гастроинтестинального шунтирования с выключением двенадцатиперстной кишки, осложнением которых могут быть синдром нарушенного всасывания, авитаминозы. Одним из вариантов является наложение бандажа на желудок, что не исключает последующей дилатации желудка или соскальзывания бандажа. Вертикальная гастропластика – формирование малого объема желудка путем прошивания его малой кривизны – характеризуется самым быстрым снижением массы тела, однако при систематическом превышении объема желудка объемом принимаемой пищи также возможна его дилатация и снижение эффекта от операции [24]. В настоящее время наложение илеоеюнального анастомоза не применяют в связи с возможностью прогрессирования СП и воспалительно-фибротических изменений в печени, несмотря на снижение массы тела.
Соответствующая подготовка больного: изменение образа жизни, использование гипокалорийной диеты, а в ряде случаев – фармакологическая коррекция СП и неалкогольного стеатогепатита – может быть полезной для больных ХГС с избыточной массой тела перед началом ПВТ [25]. Среди препаратов особенно многообещающими являются лекарства, увеличивающие чувствительность периферических тканей к инсулину, – метформин (диметилбигуанид), росиглитазон и пиоглитазон (тиазолидиндионы второго поколения) [26]. Одной из основных причин использования этих препаратов больными ХГС с метаболическим синдромом были экспериментальные данные, показавшие, например, что метформин может значительно снижать жировую дистрофию печени у лептиндефицитных мышей ob/ob и у больных неалкогольным стеатогепатитом [27]. Глитазоны способствуют перераспределению висцеральной жировой ткани под кожу, что также способствует повышению чувствительности рецепторов к инсулину в самой печени, а это в свою очередь ведет к стимуляции синтеза адипонектина, уменьшая выработку и биологическую реализацию действия провоспалительных цитокинов [28].
Все ли из перечисленных эффектов инсулиносенситайзеров будут способствовать повышению частоты достижения СВО при ПВТ ХГС? Может оказаться, что повышение чувствительности к инсулину (уменьшение ИР) не будет достоверно влиять на результаты ПВТ ХГС. Однако очевидно, что имеется еще одна причина (помимо уже известных ранее), индуцирующая и ускоряющая фиброгенез у больных ХГС, – метаболический синдром. При этом следует учитывать, что такие меры его коррекции, как изменение образа жизни и снижение массы тела, далеко не всегда приводят к снижению уровня ИР у больных ХГС. Однако практически во всех исследованиях, в которых данной категории больных была рекомендована дозированная физическая нагрузка, наблюдалось значительное и достоверное уменьшение слабости и выраженности астенического синдрома, являющихся основными спутниками ХГС. Это может быть косвенным отражением антагонизма в системе лептинпровоспалительных адипокинов [29].
Таким образом, очевидно, что сегодня формируется новая составляющая ПВТ у больных ХГС и метаболическим синдромом. Когда ее начинать, как долго, какими препаратами, в какой период (предшествующий ПВТ и/или совместно с ней) – на все эти вопросы, как представляется, будут получены ответы, и, вполне возможно, гепатологи очень скоро будут иметь в своем арсенале еще один стратегический подход к проведению ПВТ ХГС.
Литература
1. Ciuffreda D, Kim AY. Update on hepatitis C virus-specific immunity. Curr Opin HIV AIDS 2011;6(6):559–65.
2. Persico M, Iolascon A. Steatosis as a co-factor in chronic liver diseases. World J Gastroenterol 2010;16(10):1171–76.
4. Patel JH, Cobbold JF, Thomas HC, Taylor-Robinson SD. Hepatitis C and hepatic steatosis. QJM 2010;103(5):293–303.
5. Negro F. Mechanisms and significance of liver steatosis in hepatitis C virus infection. World J Gastroenterol 2006;12(42):6756–65.
7. Khan M, Jahan S, Khaliq S, et al. Interaction of the hepatitis C virus (HCV) core with cellular genes in the development of HCV-induced steatosis. Arch Virol 2010;155(11):1735–53.
8. Ascione A, Tartaglione T, Di Costanzo GG. Natural history of chronic hepatitis C virus infection. Dig Liver Dis 2007;39(Suppl. 1):4–7.
9. Bondini S, Younossi ZM. Non-alcoholic fatty liver disease and hepatitis C infection. Minerva Gastroenterol Dietol 2006;52(2):135–43.
12. El-Zayadi AR. Hepatic steatosis: a benign disease or a silent killer. World J Gastroenterol 2008;14(26):4120–26.
14. Patel K, Zekry A, McHutchison JG. Steatosis and chronic hepatitis C virus infection: mechanisms and significance. Clin Liver Dis 2005; 9(3):399–410.
16. Harrison SA. Steatosis and chronic hepatitis C infection: mechanisms and significance. Clin Gastroenterol Hepatol 2005;3(10 Suppl. 2):92–6.
17. Zekry A, McHutchison JG, Diehl AM. Insulin resistance and steatosis in hepatitis C virus infection. Gut 2005;54(7):903–6.
18. Arrese M, Riquelme A, Soza A. Insulin resistance, hepatic steatosis and hepatitis C: a complex relationship with relevant clinical implications. Ann Hepatol 2010; 9(Suppl.):112–18.
19. Basaranoglu M, Basaranoglu G. Pathophysiology of insulin resistance and steatosis in patients with chronic viral hepatitis. World J Gastroenterol2011;17(36):4055–62.
20. Trpkovic A, Stokic E, Radak D, et al. Chronic hepatitis C, insulin resistance and vascular disease. Curr Pharm Des 2010;16(34):3823–29.
21. Adinolfi LE, Restivo L, Zampino R, et al. Metabolic alterations and chronic hepatitis C: treatment strategies. Expert Opin Pharmacother2011;12(14):2215–34.
22. Puri P, Sanyal AJ. Role of obesity, insulin resistance, and steatosis in hepatitis C virus infection. Clin Liver Dis 2006;10(4):793–819.
23. Ahn J, Flamm SL. Hepatitis C therapy: other players in the game. Clin Liver Dis 2011;15(3):641–56.
26. Kawaguchi T, Sata M. Importance of hepatitis C virus-associated insulin resistance: therapeutic strategies for insulin sensitization. World J Gastroenterol 2010;16(16):1943–52.
27. Douglas MW, George J. Molecular mechanisms of insulin resistance in chronic hepatitis C. World J Gastroenterol 2009;15(35):4356–64.
28. Castera L, Chouteau P, Hezode C, et al. Hepatitis C virus-induced hepatocellular steatosis. Am JGastroenterol 2005;100(3):711–15.
29. Sheikh MY, Choi J, Qadri I, et al. Hepatitis C virus infection: molecular pathways to metabolic syndrome. Hepatology 2008;47(6):2127–33.
Об авторах / Для корреспонденции
Читайте также:

