Метаболизм клеток зараженных вирусом
Обновлено: 23.04.2024
Рецепторы клеток в условиях вирусной инфекции.
Проблема адренергического контроля, да и вообще проблема передачи регуляторного сигнала внутрь клетки в условиях вирусной инфекции настолько сложна и интересна, насколько не изучена. Ведь даже выяснение роли липидов во взаимодействии вируса гриппа с клеткой-хозяином может пролить свет на понимание характера и причин изменений липидного матрикса мембран, опосредующего трансдукцию разнообразных регуляторных влияний в условиях вирусной инфекции.
Липиды вируса образуют бислой, присущий всем биологическим мембранам. Генез вирусной мембраны, представляющей дифференцированный сегмент плазматической мембраны клетки-хозяина, обусловливает высокую степень сходства этих мембран по липидному составу. Результаты изучения вируса гриппа и других оболочечных вирусов позволяют считать, что их липидный состав отражает состав доменов плазматической мембраны в момент сборки на них вирионов. Как известно, оболочки вирусов содержат значительно больше холестерина, чем мембраны клетки-хозяина.
Естественно, что в процессе инфекции, вызванной вирусом гриппа, липидный метаболизм клетки-мишени может модифицироваться. Если учесть, что эритроциты (наряду с лейкоцитами и макрофагами) рассматриваются как реальные вирусоносители не только при вирусемии в острый период, но и на этапе персистенции, а возможность прикрепления к эритроцитам и даже визуализация этого процесса убедительно продемонстрирована, то можно ожидать, что вирус способен индуцировать изменение микровязкости в эритроцитарных мембранах.

Эта модификация может быть обусловлена, в частности, обогащением вирусной мембраны холестерином. Кстати, только адсорбция на поверхности клеток оболочечных вирусов (в том числе вируса гриппа) сопровождается быстрым и значительным повышением текучести мембранных липидов инфицированных клеток.
Изменения микровязкости липидного матрикса при кратковременном и длительном воздействии на клетки-мишени, несомненно, могут модифицировать и рецепторно-мембранные события при опосредовании связывания самых различных лигандов (токсинов, медиаторов, гормонов, лектинов, антител). При этом для адренергической активации могут быть характерны так называемые парадоксальные ответы вследствие инверсии проведения сигнала.
Весьма любопытны данные о том, что неполный вирус гриппа по сравнению со стандартным вирусом характеризуется более низким содержанием холестерина и повышенной текучестью вирусной мембраны, что определяет низкую инфекционность неполного вируса, опосредующего развитие персистентной инфекции.
Подытоживая раздел об особенностях мембрано-рецепторных изменений при остром бактериальном и вирусном воспалении в бронхолегочной системе, необходимо еще раз подчеркнуть фрагментарность знаний по данной проблеме. Судя же по имеющимся данным, можно сделать вывод о том, что острая бактериальная и вирусная инфекция могут вызывать изменения конечного эффекторного механизма в адренореактивной системе, хотя конкретные звенья этой рецепторной системы (количество и аффинитет адренорецепторов, свойства сопрягающих N-белков, аденилатциклазы) не изучены.
По-видимому, существует обратимость изменений в мембрано-рецепторном комплексе, отражающая фазу воспаления.
И, наконец, - при вирусной инфекции наблюдаются наиболее выраженные изменения МРК, приводящие к формированию так называемых парадоксальных или извращенных конечных эффектов, а также к нарушениям негативного контроля в рецепторных системах.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
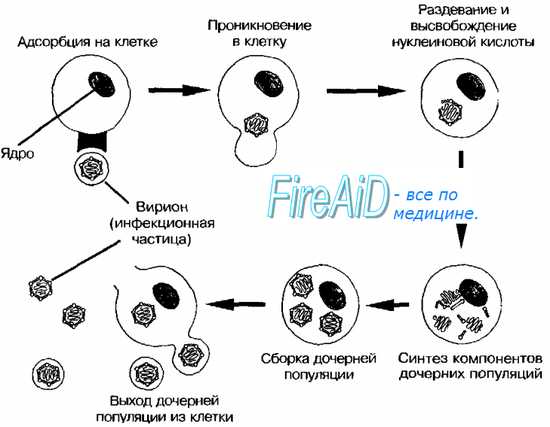
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
По-видимому, самые фундаментальные вопросы клеточной биологии — это вопросы клеточной и тканевой архитектуры и такие связанные с ними явления, как подвижность клетки и митоз.
Многие принципы, лежащие в основе сборки, функционирования и природы клеточных структур, начинают проясняться только сейчас. Относительно низкий уровень наших знаний в этой области можно объяснить, в частности, ограниченными воз-можностями тех методов исследования морфологических особенностей, которыми мы располагаем. Световой микроскоп позволяет выявить высокоупорядоченные субклеточные скелетные структуры, но обладает слишком малым разрешением. Что же касается стандартного метода тонких срезов в электронной микроскопии, то результаты, полученные с его помощью, весьма скудны, если не считать исследований клеточных структур, связанных с мембраной. Цитоскелет на обычном залитом срезе виден плохо, хотя из опытов с использованием флуоресцентных антител известно, что он существует. Ядра на стандартных срезах просматриваются лишь как скопления волокон хроматина, и, чтобы обнаружить более тонкую их организацию, приходится применять чрезвычайно сложные, специальные методики [36, 39].
Можно изучать биохимию структурных элементов с помощью фракционирования клеток, однако прогресс в этой области сдер-живается отсутствием хороших морфологических маркеров. Главный недостаток электронной микроскопии состоит в том, что смолы, используемые при приготовлении тонких срезов, в значительной степени маскируют белковые структуры. Недавно попытались вновь использовать ранние методы электронной микроскопии без заливки [26, 38а]; в результате удалось с поразительной четкостью визуализировать трехмерную структуру кле- точного белкового скелета, причем многие детали клеточной архитектуры были выявлены впервые. С помощью электронного микроскопа удается увидеть фиксированные и обработанные методом высушивания в критической точке интактные клетки [52].
Портер и др. показали, что сложная белковая сеть, которая видна в электронном микроскопе, состоит из обычных клеточных белков, в том числе и растворимых. Однако в полной мере возможности электронной микроскопии без заливки реализуются лишь при использовании избирательной экстракции, в ре-зультате которой удаляются растворимые белки [9, 32, 38, 45, 46, 48]. Оставшиеся скелетные структуры можно разделить на цитоскелет, хроматин и компоненты ядерного матрикса [15, 22, 37]. Далее можно исследовать морфологию и биохимию этих структур. На первый взгляд кажется удивительным, что элект-ронная микроскопия объектов, помещенных в вакуум, обладает гораздо более высоким разрешением, чем электронная микроскопия объектов, залитых в смолы. Однако это объясняется чрезвычайной сложностью и переплетенностью клеточного скелета. Клеточный скелет — это свободно стоящая, самоподдерживающаяся структура. Такая структура должна быть видна в вакууме, если она по крайней мере на несколько нанометров возвышается над подложкой. Наиболее важные вирус-специфические белки и нуклеиновые кислоты часто можно обнаружить лишь в одной фракции, в комплексе с каким-либо структурным компонентом клетки; например, РНК полиовируса связана с цитоскелетом, а вири- онSV40 — с ядерным матриксом [3, 31].
Результаты применения этих новых процедур в вирусологических исследованиях весьма впечатляющи. С их помощью были обнаружены многие клеточные структуры, причем оказалось, что по крайней мере отчасти метаболизм всех вирусов животных предполагает использование структур цитоплазматического и ядерного скелета клеток. Действительно, вирус-специфический цитопатический эффект легко объяснить, предположив, что он обусловлен не бессмысленным для вируса повреждением клетки, а специфической перестройкой элементов клеточного скелета, цель которой — создание условий для роста вируса. Сейчас с помощью электронной микроскопии без заливки и биохимического фракционирования можно прямо изучать связь между метаболизмом вирусов и клеточной архитектурой.
До недавнего времени большое внимание в вирусологии уде-лялось изучению способов экспрессии уникальных информационных вирусных систем, т.
Растворимые белки высвобождаются, и остается самопод- держивающийся переплетенный клеточный скелет. При после-дующей обработке смесью ионного и неионного детергентов либо 0,25 М сульфатом аммония удаляется цитоскелет. Хроматин удаляют с помощью нуклеаз и последующей элюции с повышением ионной силы. После этого остается ядерная сеть, или матрикс* вместе с промежуточными филаментами [22]. На рис. 11.1 схематически изображена процедура ступенчатой экстракции, при которой прекрасно сохраняется морфология и очень хорошо разделяются биохимические фракции, так что все клеточные белки , Морфология Интактная клетка
1%-ный твин40, 0,5^-ный дезокснхолат или 250 мМ (NH4)2S04
ДНКаза 1, РНКаза А, затем _250 мМ (NH4)2S04
Белки ядерного матрикса и проме-жуточных: филамен- тов
Рис. 11.1.Ступенчатая экстракция, позволяющая получить цитоскелетиую основу и комплекс ядерного матрикса с промежуточными филаментами.
хроматина оказываются в одной из этих структурных фракций. На рис. 11.2 изображена клетка после всех описанных процедур экстракции, так, как она выглядит в электронном микроскопе при использовании метода нанесения целого объекта. Из этого рисунка видно, что структурный скелет после удаления липидов и растворимых белков по-прежнему поддерживает общую форму клетки и даже ее детальную морфологию. Клетка покрыта белковой оболочкой (пленкой), состоящей из белков плазматической мембраны,
Рис. 11.2. Клетка после всех описанных в тексте процедур экстракции.
большая часть которых остается связанной со скелетной основой и после удаления липидов [5]. Эта плазматическая пленка содержит участки связывания полиовируса, а также, вероятно, других вирусов. В плазматической мембране иногда обнаруживаются вирус-специфические белки, такие как гликопротеин вируса Синдбис или белок src вируса саркомы Рауса, но в основном они удерживаются цитоскелетом в составе плазматической пленки.
На рис. 11.2 показано также, как выглядит ядро после удаления хроматина и волокон RNP. Все ядерное пространство заполнено густой сетью белковых филаментов. Их морфология и биохимический состав совсем иные, чем у плазматических волокон.
На рис. 11.3 представлено несколько цитоплазматических структур при разном увеличении. На микрофотографиях отчетливо видны белковые волокна, в то время как с помощью обычной электронно-микроскопической методики удается получить лишь весьма приближенное представление о внутренних структурах клетки. Белковые волокна гетерогенны по своей морфологии и чрезвычайно сложны по составу. В процессе подготовки препаратов для электронной микроскопии микротрубочки могут деполимеризоваться (как в данном примере). Этот процесс удается предотвратить путем стабилизации препаратов таксолом.
Особый интерес для вирусологических исследований представляет визуализация ядерного матрикса [7, 18, 24, 28, 42]. Очень много споров вызвал вопрос о самом существовании этой структуры, главным образом из-за того, что с помощью обычной методики заливки среза не удавалось визуализировать чисто белковую сеть. На незалитом срезе ядерный матрикс виден совершенно отчетливо. На рис. 11.4 показаны два вида матрикса после удаления хроматина: первый с еще неудаленными волокнами РНК, второй — без них.
Морфология и биохимический состав матрикса зависят в определенной степени от метода приготовления препарата. Нами была разработана методика сравнительно мягкой экстракции, в которой используются растворы с низкой ионной силой (0,25 М сульфат аммония) и которая обеспечивает полное удаление белков, связанных с хроматином [15, 23]. О действенности этой методики свидетельствует эффективное отделение компонентов ядра от других компонентов клетки, а сравнительно хорошее сохранение различных структур позволяет предположить, что такие мягкие процедуры могут оказаться полезными и для дальнейших исследований вирусов.
Метаболизм вирусов и клеточные структуры
Рис. 11.4. Электронно-микроскопические фотографии среза ядерного матрикса с удаленным хроматином без заливки в смолу. А. Матрикс с волокнами RNP. Б. Только матриксные белки.
Полиовирус — цитоплазматический вирус, лишенный оболочки
Одной из первых систем, на которой были проверены возмож-ности использования избирательной экстракции в биохимических и морфологических исследованиях, были клетки HeLa, зараженные полиовирусом [31]. Вирусная РНК, специфически меченая в обработанных актиномицином клетках, была прикреплена к скелетной основе как во время репликации, так и при ее функ-ционировании в качестве мРНК в полирибосомах. Полностью связанными оказались геномная и матричная 35S-PHK и двух-цепочечные 205-формы. Растворимая вирусная РНК обычно по-является после лаг-периода длительностью 60 мин в виде 1355-частиц, обладающих биохимическими свойствами зрелых вирионов. В присутствии гуанидина, который препятствует выходу РНК из места репликации, блокируется высвобождение 35S-PHK из скелета [13, 27]. Высвобождение вирусной РНК начинается непосредственно перед созреванием частицы или совпадает с ним по времени.
В отличие от метаболизма РНК процессинг полиовирусного белка довольно сложен [29, 41]. Исходный крупный полицроте- ин претерпевает несколько стадий протеолитического расщепления. При этом образуются три группы белков: белки капсида, или VP, РНК-полимераза и белки, участвующие в формировании мембранных везикул, характерных для поздней стадии развития вируса.
Результаты опытов по разделению белков на растворимые и связанные со скелетом фракции далеко не однозначны. К сожалению, это характерно для применения этого метода в вирусологических исследованиях. Большинство белков встречается как в связанной, так и в свободной форме [49]. При этом большинство белков капсида быстро высвобождается из скелетной сети, тогда как примерно половина всех предшественников полимераз остаются связанными со скелетом, в котором, по-видимому, и локализуется активная форма полимеразы. Белки везикул в основном (но не полностью) остаются связанными с остовом после обработки детергентом; возможно, они участвуют в изменении архитектуры клетки.
Рис. 11.5. Электронно-микроскопические фотографии залитого эпоном среза клеток HeLa, обработанных детергентом, л. Незараженная клетка. Б. Ранняя стадия полиовирусной инфекции. В я Г. Поздние стадии полиовирусной инфекции.
В заражённых вирусом клетках возможны патологические проявления разностороннего характера.
Морфология патологических эффектов. Зараженные вирусом клетки. Основные реакции зараженных вирусом клеток.
Характерные проявления взаимодействий между вирусом и чувствительными клетками-видимые поражения заражённых клеток вплоть до их гибели, а также присутствие возбудителей в исследуемом материале.
Альтерация и воспаление зараженных вирусом тканей. При вирусных инфекциях на первый план выступает картина повреждения клеток и воспалительных изменений тканей, при различных инфекциях их соотношение и выраженность варьируют. В противоположность бактериальным инфекциям (где доминируют полиморфноядерные лейкоциты), при вирусных поражениях среди клеточных элементов воспалительных реакций доминируют мононуклеары (лимфо- и моноциты). На этапах, предшествующих разрушению клеток, можно визуально наблюдать их дегенеративные и некротические изменения.
Тельца включений зараженных вирусом клеток. Микроскопия заражённых клеток часто позволяет выявить тельца включений — характерный, но не абсолютный признак вирусных поражений. Тельца значительно крупнее, чем отдельные вирионы, и часто окрашиваются кислыми красителями (например, эозином).
• При заражении клеток ДНК-содержащими вирусами тельца включений располагаются в ядре; исключение — тельца включений поксвирусов (тельца Гварнери).
• При заражении клеток РНК-содержашими вирусами тельца включений располагаются в цитоплазме (например, тельца Бабеша-Нёгри, выявляемые в цитоплазме клеток головного мозга при бешенстве).
Причины гибели зараженных вирусом клеток. Размножаясь в клетке, вирусы индуцируют синтез вирусспецифических белков, в той или иной степени подавляющих метаболизм клетки. Нарушение синтеза макромолекул вызвано нарушением трансляции клеточной мРНК. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление макромолекулярных синтезов в клетке вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы. Действие указанных вирусов реализуется на ранних этапах (до появления морфологических признаков цитопатического эффекта). Ингибирование синтеза РНК и ДНК обычно вторично по отношению к воздействию на белки, контролирующие экспрессию генов и пролиферацию клетки. Значительно реже нарушения вызывают вирусные белки, напрямую ингибирующие синтез нуклеиновых кислот. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление синтезов нуклеиновых кислот вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы.
Во время репродукции вируса в клетке накапливаются вирусные компоненты, оказывающие токсическое и повреждающее действие на клеточные структуры. Например, цитотоксические свойства проявляют капсомеры некоторых аденовирусов, гликопротеины парамиксовирусов. В процессе вирусной инфекции также происходит повреждение мембран лизосом, содержимое которых высвобождается и осуществляет аутолиз клетки. Таким образом, гибель клеток наступает в результате сочетания раннего подавления синтеза клеточных компонентов, накопления токсических вирусных продуктов и повреждения лизосом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

