Методика отбора проб на вирусы
Обновлено: 23.04.2024
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
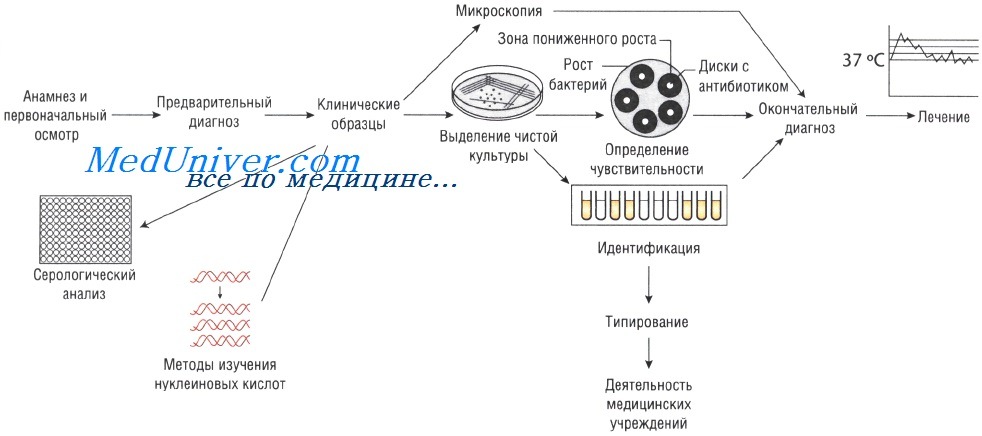
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-вирусологический контроль водных объектов
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ГУ НИИ экологии человека и гигиены окружающей среди им. А.Н.Сысина РАМН (А.Е.Недачин, Р.А.Дмитриева, Т.В.Доскина, Д.В.Лаврова, А.Г.Санамян); ГУ НИИ полиомиелита и вирусных энцефалитов им. М.П.Чумакова РАМН (О.Е.Иванова, Т.П.Еремеева); ГУ Центральный НИИ эпидемиологии (Г.А.Шипулин, В.П.Чуланов, Е.Н.Родионова, А.Т.Подколзин); ГУ Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера (В.В.Малышев, М.А.Бичурина, Н.В.Железнова); Санкт-Петербургской Военно-медицинской академией им. С.М.Кирова (П.И.Огарков); Белорусским НИИ эпидемиологии и микробиологии (Т.В.Амвросьева).
В подготовке материалов принимали участие: ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (Т.В.Воронцова); Аналитический Центр ЗАО "РОСА" (В.Б.Конторович); Нижегородский НИИ эпидемиологии и микробиологии им. И.Н.Блохиной (К.В.Блохин, М.И.Попкова); ФГУЗ "Центр гигиены и эпидемиологии в г.Москве" (С.Г.Курибко, Г.М.Бабкина); ФГУЗ "Центр гигиены и эпидемиологии в Вологодской области" (И.Р.Лесников); ФГУЗ "Центр гигиены и эпидемиологии в Воронежской области" (О.Т.Агеева); ФГУЗ "Центр гигиены и эпидемиологии в Оренбургской области" (В.О.Скворцов); ФГУЗ "Центр гигиены и эпидемиологии во Владимирской области" (Н.И.Джакаридзе); ФГУЗ "Центр гигиены и эпидемиологии в Ленинградской области" (Э.В.Маликова); ФГУЗ "Центр гигиены и эпидемиологии в Калужской области" (Е.И.Косолапова); Территориальное управление Роспотребнадзора по Липецкой области (И.А.Ходякова); ФГУЗ "Центр гигиены и эпидемиологии в г.Ростове-на-Дону" (Т.А.Зыкова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека 6 октября 2005 года (протокол N 3).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 18 ноября 2005 года.
4. С момента введения в действие методических указаний считать утратившими силу пункты 1.1-1.3; 3.1.1-3.1.3; 3.2; 4 методических рекомендаций "Методические рекомендации по санитарно-вирусологическому контролю объектов окружающей среды", утвержденных Начальником Главного Управления карантинных инфекций В.П.Сергиевым 7 июня 1982 года.
1. Область применения
1.2. Методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих государственный санитарно-эпидемиологический надзор за качеством питьевой воды, состоянием водоемов в местах водопользования населения, использованием сточных вод в системах промышленного оборотного водоснабжения и для орошения сельскохозяйственных угодий.
1.3. Методические указания также могут использоваться организациями, эксплуатирующими системы централизованного хозяйственно-питьевого водоснабжения, системы канализования, и осуществляющими производственный контроль.
2. Гигиенические и эпидемиологические показания к проведению
санитарно-вирусологического контроля качества водных объектов
2.1. Виды санитарно-вирусологического контроля
В системе государственного санитарно-эпидемиологического надзора за загрязнением кишечными вирусами водных объектов используют следующие виды санитарно-вирусологического контроля:
Плановый санитарно-вирусологический контроль осуществляют в течение года в соответствии с разработанной программой для каждой системы водоснабжения на конкретной территории, согласованной с территориальными органами Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
В рабочую программу включают перечень контролируемых объектов, показателей, периодичность проведения исследований, перечень используемых методов, план точек отбора проб воды, количество контролируемых проб воды. При этом необходимо учитывать, что предварительную оценку возможного вирусного загрязнения водных объектов осуществляют с использованием косвенных показателей вирусного загрязнения - общей группы колифагов, а также обнаружением антигенов ротавирусов и (или) антигена ВГА методом ИФА.
При обнаружении колифагов либо вирусных антигенов (ВГА, ротавирусов) в исследуемых пробах необходимо исследовать воду на наличие энтеровирусов, а также РНК энтеровирусов, РВ и ВГА методом ОТ-ПЦР.
Внеплановый санитарно-вирусологический контроль предусматривает проведение исследований воды на наличие колифагов, антигенов ротавирусов и ВГА и энтеровирусов в случае внезапных или непредвиденных изменений санитарно-эпидемической ситуации на контролируемой территории:
каких-либо аварий или нарушений в системах водоснабжения и канализации, в результате которых может произойти массивное микробное загрязнение поверхностных и подземных водоисточников, а также питьевой воды. В этот период все работы заинтересованных организаций, включая и санитарно-вирусологический контроль, координирует Чрезвычайная противоэпидемическая комиссия города, района, субъекта Российской Федерации;
по санитарно-эпидемиологическим показаниям контроль осуществляют в случае наличия факторов-предшественников в санитарно-эпидемиологической ситуации на территории и последующего подъема заболеваемости населения кишечными вирусными инфекциями, которая превышает уровень круглогодичной заболеваемости, характерной для конкретной местности.
Санитарно-вирусологический контроль в период эпидемического риска предусматривает более частые исследования по сравнению с установленными в программе текущего контроля, его утверждает главный государственный санитарный врач города, района, субъекта Российской Федерации, либо его проводят по решению Чрезвычайной противоэпидемической комиссии города, района, субъекта Российской Федерации.
Производственный санитарно-вирусологический контроль проводят постоянно, он предусматривает исследования воды водных объектов в организациях водоснабжения: на этапах водоподготовки, выходе с водоочистных сооружений (после обеззараживания), в разводящей сети; в организациях по производству воды, расфасованной в емкости; при выборе водоисточника; при оценке эффективности работы обеззараживающих установок, режима их работы; при превышении нормативов уровня колифагов, либо при обнаружении антигенов ВГА и (или) ротавирусов.
Определение энтеровирусов и (или) РНК РВ и ВГА проводят в санитарно-вирусологических лабораториях, обеспечивающих деятельность государственного санитарно-эпидемиологического надзора, профильных учреждений и других организаций, имеющих разрешение на данный вид деятельности в установленном законодательством Российской Федерации порядке.
2.2. Объекты исследования
Объектами исследования является вода различных водных объектов:
сточная на этапах очистки и обеззараживания;
пресных и морских поверхностных водоемов, используемых в рекреационных целях, а также в качестве источников хозяйственно-питьевого водоснабжения;
питьевая (водопроводная; вода, расфасованная в емкости и др.);
из децентрализованных водоисточников.
2.2.1. Сточные воды
Сточные воды, поступающие на очистные сооружения, исследуют с целью изучения спектра энтеровирусов, циркулирующих среди населения, и по эпидемическим показаниям.
Сточные воды на этапах очистки и обеззараживания исследуют для изучения эффективности работы очистных сооружений в отношении возбудителей кишечных вирусных инфекций в соответствии с санитарно-эпидемиологическими правилами и нормативами СанПиН 2.1.5.980-00 "Гигиенические требования к охране поверхностных вод".
2.2.2. Вода поверхностных водоемов
Воду пресных водоемов исследуют на наличие вирусного загрязнения с целью изучения процессов самоочищения, при выборе поверхностных водоемов в качестве водоисточников для централизованного хозяйственно-питьевого водоснабжения, установления зон санитарной охраны, по эпидемическим показаниям.
Контроль воды морских и пресных водоемов за уровнем загрязнения осуществляют при использовании их в рекреационных целях в соответствии с санитарно-эпидемиологическими правилами и нормативами СанПиН 2.1.5.980-00 "Гигиенические требования к охране поверхностных вод", по эпидемическим показаниям.
2.2.3. Вода подземных водоисточников
Воду подземных водоисточников исследуют на наличие вирусного загрязнения при выборе источника хозяйственно-питьевого водоснабжения, контроле ее качества в соответствии с ГОСТ 2761-84 "Источники централизованного хозяйственно-питьевого водоснабжения", по эпидемическим показаниям.
2.2.4. Вода плавательных бассейнов и аквапарков
2.2.5. Вода питьевая
Питьевую воду исследуют на наличие вирусного загрязнения в соответствии с требованиями санитарно-эпидемиологических правил и нормативов СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества", СанПиН 2.1.4.1116-02 "Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества", в соответствии с программой исследования воды, утвержденной главным государственным санитарным врачом города, района, субъекта Российской Федерации, по эпидемическим показаниям.
2.2.6. Контроль воды децентрализованных источников
Исследование воды децентрализованных источников проводят в соответствии с санитарно-эпидемиологическими правилами и нормативами СанПиН 2.1.4.1175-02 "Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана водоисточников", по эпидемическим показаниям.
2.3. Санитарно-вирусологические показатели качества водных объектов
Санитарно-вирусологический контроль воды водных объектов предусматривает исследования по следующим показателям:
кишечные вирусы (энтеровирусы и аденовирусы в культурах ткани);
антигены ротавирусов и вируса гепатита А в качестве маркеров вирусного загрязнения;
РНК вирусов гепатита А, ротавирусов, энтеровирусов и ДНК аденовирусов методом полимеразной цепной реакции со стадией обратной транскрипции (ОТ-ПЦР) для РНК-содержащих вирусов;
колифаги (исследования проводят бактериологические лаборатории) в качестве косвенных показателей вирусного загрязнения вод различного назначения в соответствии с нормативными и методическими документами.
Выбор показателей осуществляют в соответствии с нормативными и методическими документами или по рекомендациям эпидемиолога.
2.4. Оценка эпидемической безопасности водных объектов
Вода водных объектов и питьевая вода подлежит обязательному санитарно-вирусологическому контролю.
Основным принципом регламентирования вирусного загрязнения воды на настоящем этапе является отсутствие возбудителей кишечных вирусных инфекций в нормируемом объеме воды водных объектов и питьевой воде.
Критерием эпидемической безопасности воды водных объектов является отсутствие спорадической и вспышечной заболеваемости населения, обусловленной кишечными вирусами, распространяющимися водным путем.
Санитарно-вирусологический контроль воды осуществляют в соответствии с положениями раздела 2 с использованием санитарно-показательных микроорганизмов - колифагов, косвенных показателей вирусного загрязнения, что является экономичным и дает быстрый ответ о потенциальной эпидемической опасности водных объектов в отношении вирусного загрязнения и риска заболевания населения вирусными кишечными антропонозами.
В соответствии с результатами исследований воды на колифаги проводят обязательное прямое определение энтеровирусов и аденовирусов с использованием "культуральных" методов.
Для выявления в пробах воды труднокультивируемых в клеточных культурах вирусов (вирус гепатита А, ротавирусы) проводят анализ воды на наличие их антигенов с использованием методов ИФА, или ОТ-ПЦР - на наличие РНК вирусов. Положительный результат анализа пробы воды в ИФА после обеззараживания хлором или озоном, содержащей только антиген или РНК определенного вируса, оценивают как ориентировочный, свидетельствующий о циркуляции данного возбудителя на изучаемой территории и возможного водного пути передачи в реализации эпидемического процесса данной инфекции.
Наличие в анализируемой пробе помимо антигена или РНК вируса других форм микроорганизмов (общее микробное число - ОМЧ, колиформных бактерий, колифагов) свидетельствует о вирусном загрязнении воды.
Подтверждением этому является развитие соответствующей эпидемической ситуации на изучаемой территории, а также гомологичность РНК вирусов, выделенных из воды и из материалов от больных.
Для получения информации о степени гомологии штаммов вирусов, выделенных из воды и из материалов от больных на исследуемой территории, проводят ПЦР-амплификацию вариабельного фрагмента генома вируса с последующим секвенированием. Полная гомология данных фрагментов генома свидетельствует в пользу водного пути распространения возбудителя, тогда как наличие генетических отличий исключает роль водного фактора в возникновении данной эпидемической вспышки (эти исследования выполняют в специализированных лабораториях, имеющих разрешение на данный вид деятельности в установленном законодательством Российской Федерации порядке).
Объем проб, условия и периодичность отбора проб воды водных объектов на вирусологический анализ
Вид водного объекта
Объем исследуемой воды, показания к проведению
и кратность анализа при контроле:
внепла- новом - по экстренным показаниям
внеплановом -
по санитарно- эпидемическим показаниям, по согласованию с ТУ Роспотребнадзора
производ- ственном -
в соответ- ствии
с рабочей программой
Ионообменная смола.
Мембранная.
Фильтрация.
Двухэтапный метод.
Для забора и доставки материала лечебно-профилактические организации края должны быть обеспечены одноразовыми пластиковыми пробирками и флаконами с завинчивающимися крышками, зондами-тампонами в индивидуальной упаковке или пробирке (тубсере). Не допускается забирать материал в агаризованные транспортные системы среды (Эймса, Кери-Блейр, Стюарта).
Правила сбора клинического (секционного) материала
Сбор клинического материала и его упаковку осуществляет медицинский работник лечебно-профилактической организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность высокопатогенными штаммами вируса гриппа A(H1N1). Забор производят в стерильные одноразовые пластиковые пробирки, контейнеры, стерильными инструментами. Все виды работ проводят с соблюдением противоэпидемического режима, в строгом соответствии с требованиями действующих нормативно-методических документов.
Упаковка, маркирование, условия хранения и транспортирования материала для проведения лабораторной диагностики заболеваний, должны соответствовать требованиям действующих нормативно методических документов.
Для исследования забирают следующие виды клинического материала:
- мазки из полости носа (обязательный материал для ОТ-ПЦР-анализа);
- мазки из ротоглотки (обязательный материал для ОТ-ПЦР-анализа);
- носоглоточное отделяемое (для выделения вируса, ОТ-ПЦР-анализа);
- мокрота (при подозрении на вирусную или вирусно-бактериальную пневмонию).
Целесообразно также включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж и биоптаты легких при возможности их забора. Данные процедуры осуществляет подготовленный медицинский персонал в соответствии с действующими нормативно-методическими документами (МР от 24.05.09 № 01/7161-9-34, МУК 4.2.3115-13).
Выбор времени забора клинического материала очень важен, так как наиболее высокое содержание вируса в дыхательных органах человека регистрируется в течение первых четырех дней после появления признаков заболевания. Образцы должны быть собраны в течение 3 суток после появления клинических признаков.
Для постмортальной диагностики используют аутоптаты легких, трахеи и селезенки.
От одного больного должно забираться не менее двух видов клинического материала. Обязательно следует забирать мазки из полости носа, мазки из ротоглотки. Каждый образец материала помещают в отдельную транспортную емкость.
Упаковка и транспортирование образцов.
Все материалы, доставляемые в лабораторию, должны быть герметично упакованы в соответствии с действующими нормативно-методическими документами:
1) в транспортную емкость (плотно закрывающиеся пластмассовые пробирки или флаконы с завинчивающимися крышками, проверенные на герметичность); плотно закрытый верхний конец транспортной емкости вместе с крышкой герметизируют различными пластификаторами (парафин, лейкопластырь и др., но не скотч), емкость маркируют;
2) в плотный полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве достаточном для адсорбции всего образца в случае его утечки; полиэтиленовый пакет следует герметично заклеить или запаять.
В отдельный полиэтиленовый пакет вкладывают бланк заполненного направления. Пакеты с образцами от одного пациента вместе с направлением упаковывают во второй плотный полиэтиленовый пакет. Не допускается упаковывание образцов материалов от разных людей в один и тот же пакет.
Герметично закрытые полиэтиленовые пакеты помещают в термоизолирующий, плотно закрывающийся контейнер (термос, сумка-холодильник), приспособленный для транспортирования биологических материалов в вертикальном положении, исключающем переворачивание образцов.
В термоконтейнеры и термосы помещают охлаждающие элементы или пакеты со льдом. К наружной стенке термоконтейнера или термоса прикрепляют этикетку с указанием вида материала, условий транспортирования, названия пункта назначения. Сроки и условия транспортирования упакованных проб клинического материала указаны в приложении № 1. На транспортировочные термоконтейнеры должно быть нанесено название лечебной организации краской, устойчивой к действию моющих и дезинфицирующих средств.
Транспортирование проб клинического материала в лаборатории для первичного исследования материала осуществляется нарочно лицом, информированным о правилах доставки материала в соответствии с действующими нормативно-методическими документами. Термоконтейнеры, термосы после доставки материала двукратно обрабатываются дезинфицирующим раствором и возвращаются на следующий день лечебно-профилактической организации.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация и проведение вирусологических исследований материалов из объектов окружающей среды на полиовирусы, другие (неполио) энтеровирусы
1. РАЗРАБОТАНЫ ГУ Институт полиомиелита и вирусных энцефалитов им. М.П.Чумакова РАМН (О.Е.Иванова, Т.П.Еремеева, С.Г.Дроздов, М.И.Михайлов, О.Ю.Байкова, О.В.Юрашко); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г.Ф.Лазикова, Е.Б.Ежлова); ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (Т.В.Воронцова, А.А.Ясинский, О.П.Чернявская) с учетом замечаний и предложений ФГУЗ "Центр гигиены и эпидемиологии" в г.Москве, Ставропольском, Хабаровском краях, Омской, Свердловской областях; Санкт-Петербургского НИИЭМ им.Пастера.
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (от 3 апреля 2008 г. протокол N 1).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 4 мая 2008 г.
4. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. Настоящие методические указания предназначены для специалистов органов и учреждений государственного санитарно-эпидемиологического надзора при реализации национального плана действий по поддержанию свободного от полиомиелита статуса Российской Федерации.
1.2. В методических указаниях определены требования к организации сбора, упаковки, хранения, транспортирования и проведения лабораторных исследований материалов из объектов окружающей среды, выполняемых в целях выявления циркуляции полиовирусов, других (неполио) энтеровирусов, а также для установления причин, факторов передачи инфекции при повышенной заболеваемости или при эпидемических вспышках заболеваний энтеровирусной этиологии.
1.3. Методические указания также могут быть использованы специалистами организаций, эксплуатирующих системы централизованного хозяйственно-бытового водоснабжения, системы канализования, в рамках осуществления производственного контроля.
2. Общие положения
2.1. Вирусологические исследования материалов из объектов окружающей среды (далее - ООС) на полиовирусы, другие (неполио) энтеровирусы (далее - ПОЛИО/НПЭВ) являются одним из важнейших элементов системы эпидемиологического надзора за полиомиелитом и острыми вялыми параличами (далее - ПОЛИО/ОВП), другими энтеровирусными инфекциями, осуществляемого в рамках реализации национального плана действий по поддержанию свободного от полиомиелита статуса Российской Федерации.
2.2. Все процедуры по сбору, транспортированию, подготовке к исследованию и лабораторному исследованию материалов из ООС на полиовирусы, другие (неполио) энтеровирусы осуществляется в строгом соответствии с требованиями нормативных и методических документов (прилож.1).
2.3. Выполнение требований методических указаний направлено на совершенствование эпидемиологического надзора за ПОЛИО/ОВП, энтеровирусными инфекциями.
3. Организация вирусологических исследований материалов из объектов окружающей среды на полиовирусы, другие (неполио) энтеровирусы
3.1. Вирусологические исследования материалов из объектов окружающей среды на полиовирусы, другие НПЭВ проводят вирусологические лаборатории ФГУЗ "Центр гигиены и эпидемиологии" в субъектах Российской Федерации, вирусологические лаборатории региональных центров эпидемиологического надзора за полиомиелитом и острыми вялыми параличами (в г.Москве, Хабаровском, Ставропольском краях, Свердловской, Омской областях, Санкт-Петербургском НИИЭМ им.Пастера (далее - РЦ), Приволжском и Дальневосточном региональных центрах по изучению энтеровирусных инфекций (Нижегородский, Хабаровский НИИЭМ), Национальном центре по лабораторной диагностике полиомиелита (Институт полиомиелита и вирусных энцефалитов им. М.П.Чумакова РАМН) (далее - НЦ).
3.2. Указанные учреждения проводят отбор проб из ООС, подготовку их к исследованию, лабораторное исследование.
3.3. При выделении полиовирусов изоляты направляются для идентификации и внутритиповой дифференциации (далее - ВТД) в НЦ.
3.6. При обнаружении в исследуемом образце РНК энтеровирусов методом обратной транскрипции и полимеразной цепной реакции (далее - ОТ-ПЦР) следует провести идентификацию вируса.
3.7. Результаты исследования материалов из ООС передаются в учреждения, направившие их.
4. Показания к проведению вирусологических исследований материалов из объектов окружающей среды на полиовирусы, другие (неполио) энтеровирусы
4.1. Планирование организации вирусологических исследований.
Вирусологические исследования материалов из ООС на полиовирусы, НПЭВ проводят в плановом порядке, внепланово и в рамках производственного контроля.
Плановые вирусологические исследования материалов из ООС осуществляют в течение определенного времени для получения информации о циркуляции полиовирусов, НПЭВ среди населения, если предполагается, что эффективность эпидемиологического надзора за ПОЛИО/ОВП недостаточна (или требуются дополнительные данные) и группа населения, в отношении которой предпринимается надзор, обладает одной из нижеперечисленных или несколькими особенностями:
недостаточный охват иммунизацией;
наличие сведений о недавней (или возможной) циркуляции в обследуемой группе населения дикого или вакцинородственного полиовируса;
существование риска заноса дикого полиовируса из эндемичных (неблагополучных) по полиомиелиту стран (территорий).
Плановые исследования осуществляются в рамках эпидемиологического надзора за ПОЛИО/ОВП, энтеровирусными инфекциями, с научными целями.
Внеплановые вирусологические исследования материалов из ООС проводятся в случае непредвиденных изменений санитарно-эпидемиологической ситуации на определенной территории. Ими могут быть:
установленный факт заноса дикого полиовируса или циркуляция вакцинородственного полиовируса;
подъем заболеваемости населения энтеровирусными инфекциями;
возникновение эпидемической вспышки энтеровирусной инфекции;
авария или нарушения в системах водоснабжения или канализации, в результате которых может произойти интенсивное биологическое загрязнение поверхностных и подземных водоисточников, а также питьевой воды.
Для проведения плановых и внеплановых исследований на полиовирусы, НПЭВ составляется план проведения этих исследований, который должен включать:
продолжительность и сроки отбора проб из ООС;
характеристику группы населения, в отношении которой предпринимается исследование (численность населения, сведения об иммунизации против полиомиелита);
распределение ответственности за сбор, обработку, исследование проб из ООС;
наличие нормативных и методических документов, материального обеспечения для проведения исследований, протоколов проведения исследований;
наличие обученного персонала и контроля качественного проведения исследований;
определение порядка отчетности о результатах исследования;
определение возможностей для своевременной пересылки выделенных штаммов вирусов (или РНК-позитивных материалов) для дальнейшего изучения в установленном порядке.
Исследования материалов ООС в рамках производственного контроля проводится постоянно с целью санитарно-вирусологической оценки производственных (технологических) процессов.
4.2. Объекты вирусологических исследований, места отбора, продолжительность исследований.
При проведении плановых исследований объектами исследований являются сточные воды, происходящие от той группы населения, в отношении которой предпринимается надзор. Места отбора проб выбираются вместе с представителями инженерной службы. В соответствии с целями исследования исследуют неочищенные сточные воды, при этом следует исключить стоки, которые могут быть загрязнены производственными отходами.
Большой объем сточных вод, поступающих на очистные сооружения или в канализационный коллектор, может снизить чувствительность обследования вследствие фактора разбавления. Поэтому в больших городах можно разбить обследуемое население на группы и обследовать небольшие фрагменты этих групп.
При проведении плановых исследований в соответствии с целями исследования также могут быть обследованы:
сточные воды на этапах очистки и обеззараживания;
вода поверхностных водоемов, которые используются для целей рекреации, в качестве источников хозяйственно-питьевого водоснабжения;
вода плавательных бассейнов;
питьевая вода на различных этапах водоподготовки.
Продолжительность плановых исследований обычно составляет не менее 1 года, оптимальным сроком следует считать 3 года. Кратность сбора - 4 пробы в месяц, но не менее 2 проб.
При проведении внеплановых исследований продолжительность исследования может быть более короткой, но кратность сбора проб должна быть увеличена, а выбор обследуемой группы населения - максимально точный.
Если исследования сточных вод обусловлены известной или подозреваемой реинтродукцией дикого полиовируса или появлением случаев полиомиелита, вызванных вакцинородственным полиовирусом (или случайной его детекцией), продолжительность исследования должна быть не менее 1 года, кратность отбора проб - не менее 4 раз в месяц, а выбор целевой группы - максимально "прицельный".
Исследования в рамках производственного контроля проводятся в соответствии с рабочей программой и нормативными документами.
При планировании и организации любых исследований следует руководствоваться нормативными и методическими документами (прилож.1).
5. Правила сбора, маркировки, хранения и транспортирования материалов для исследования
Существуют два принципа отбора проб материалов из ООС для исследований на полиовирусы, НПЭВ:
одномоментный, при котором отбирают определенный объем воды в определенное время, или, что предпочтительнее, серию проб определенного объема отбирают в разное, заранее намеченное время, чтобы затем составить смешанную пробу. Пробы, отобранные одномоментным способом подвергают последующему концентрированию с использованием фильтрующих мембран, ионообменных смол, с помощью метода двухфазного разделения (прилож.2);
"адсорбционный", при котором в ток воды на определенное время помещают адсорбирующий материал, а затем проводят элюцию вирусных частиц с адсорбента (метод Риордана, концентрирование на макропористом стекле) (прилож.3).
Сотрудник, производящий отбор проб сточной воды, должен быть иммунизирован против полиомиелита. Если по техническим соображениям отбор проб выполняет сотрудник инженерно-технических служб, он также должен быть иммунизирован против полиомиелита.
Отбор проб производят только в защитной одежде - халате, закрытой обуви, резиновых перчатках. Для отбора проб воды одномоментным способом используют предназначенную для этих целей стерильную одноразовую посуду или стерильные емкости многократного применения, изготовленные из материалов, не оказывающих инактивирующего действия на вирусы. Емкости должны быть оснащены плотно закрывающимися пробками или, что более предпочтительно, навинчивающимися крышками. Крышки должны надежно предохранять содержимое емкости от протечек. При отборе проб адсорбционным методом пакет с адсорбентом помещают в плотный пластиковый мешок, не допускающий протечек.
Немедленно после отбора поверхность емкости, в которую была отобрана проба, протирают дезинфектантом, маркируют, помещают в термоконтейнеры/термосы, обеспечивающие температурный режим 4-8 °С и доставляют в лабораторию. Пробу сопровождают актом отбора проб с указанием места отбора, даты и времени отбора.
После доставки проб в лабораторию термоконтейнер (термос) распаковывают в отведенной для этого зоне, соблюдая правила биологической безопасности. В зоне, где происходит распаковка, должны иметься емкость для мусора, тампоны, смоченные 70%-м раствором этилового спирта, биологическое защитное укрытие (далее - БЗУ) 2 класса защиты (или рабочий стол с покрытием, которое легко подвергается обработке лабораторными дезинфектантами).
Распаковка и регистрация материалов осуществляется двумя сотрудниками - один регистрирует поступившие материалы в рабочем журнале, другой открывает упаковку, проверяет целость емкостей с материалом, отсутствие протечек, полноту сопроводительных документов. В этот момент фиксируется состояние присланных проб - отсутствие протечек, соблюдение температурного режима, полнота документации.
Каждой пробе присваивают идентификационный номер, под которым она регистрируется в лабораторном журнале. Далее этим номером помечают все емкости (центрифужные пробирки, флаконы/пробирки с культурой клеток и пр.), относящиеся к данной пробе в процессе ее исследования и хранения в данной лаборатории.
Обработку проб следует начать незамедлительно после доставки в лабораторию. Если обработка будет начата в течение 48 ч, пробы можно поместить в холодильник (0-8 °С). Если исследование будет начато позже, пробы, отобранные одномоментным методом, хранят при температуре -20 °С. Пробы, собранные адсорбционным методом, рекомендуется подготовить для исследования в течение 48 ч. В любом случае следует помнить, что исследование ООС предпринимается для получения оперативной информации и последующего оперативного реагирования, поэтому пробы не должны накапливаться в лаборатории для ретроспективного исследования.
Все процедуры во время получения, распаковки и регистрации проб осуществляют в защитной одежде и резиновых перчатках.
6. Обработка проб из объектов окружающей среды в лаборатории
При обработке проб могут образовываться аэрозоли. Поэтому все работы по подготовке проб воды для исследования проводятся в БЗУ 2-го класса защиты. Для исключения перекрестной контаминации проб все манипуляции по подготовке к исследованию не следует совмещать с работой с материалами, полученными от случаев ПОЛИО/ОВП. Оптимально работа с пробами из ООС и с материалами, полученными от случаев ПОЛИО/ОВП, должна выполняться в разных помещениях и разными группами персонала.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
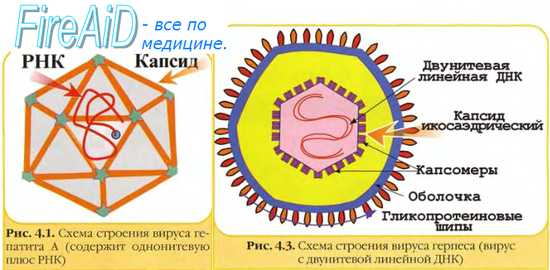
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

