Методы детекции вируса гриппа
Обновлено: 24.04.2024
Уровень доказательности рекомендаций
Оценка уровня доказательности и значимости рекомендаций производилась в соответствии с данными, изложенными ниже.
Оценка уровня доказательности
Убедительные доказательства эффективности и существенной клинической пользы| Уровень рекомендаций | Определение | Применение |
|---|---|---|
| A | Убедительные доказательства эффективности и существенной клинической пользы | Настоятельно рекомендуется |
| B | Сильные или умеренные доказательства эффективности, ограниченные клинические преимущества | Как правило, рекомендуется |
| С | Недостаточные доказательства эффективности или эффективность незначима по сравнению с возможными неблагоприятными последствиями | Необязательно к исполнению |
| D | Умеренные доказательства эффективности или эффективность незначима по сравнению с возможными неблагоприятными последствиями | Как правило, не рекомендуется |
Качество доказательности рекомендации
| I | Данные рандомизированных контролируемых клинических исследований или строго разработанных экспериментальных лабораторных исследований, выполненных независимыми исследователями |
| II | Данные хорошо спланированных клинических исследований без рандомизации, когортных исследований или исследований случай-контроль, аналитических исследований (предпочтительно более чем одного исследования),убедительные доказательства лабораторных экспериментов |
| III | Мненияавторитетных специалистов, основанные на данных клинических или лабораторных исследований, описательных исследованияхили отчетах экспертов |
Уровни доказательности рекомендаций приводятся при изложении текста ниже.
Общие положения и область применения
В методических рекомендациях представленысовременныесведения о возбудителях ОРВИ, включая эпидемиологические данные о новых видахвирусов, описанных в последнее десятилетие. Представленобщий методический подход и подробный порядокпроведения лабораторного исследования методом ПЦРс целью обнаружения НК гриппа и других значимых возбудителей ОРВИ. Особое внимание уделено описанию перечня биологического материалаи правил его получения, упаковки, транспортирования и хранения биологическогоматериала от больных (умерших).
Клинические рекомендации предназначены для специалистов лабораторий, выполняющих работы c использованием методов амплификации НК при исследовании материала, содержащего (подозрительного на содержание) микроорганизмы I-IV групп патогенности (опасности), аккредитованных в установленном порядке и имеющих лицензии на данный вид деятельности в соответствии с законодательством Российской Федерации.
Введение
Заболеваемость острыми инфекциями верхних дыхательных путей (ОРВИ) множественной или неуточненной локализации и гриппом в России по данным официальной статистики (форма 1) в совокупности составляет 19-20 тыс. на 100 тыс. населения ежегодно, превышая в десятки раз аналогичные показатели для других инфекционных болезней, и составляет 90% всех регистрируемых случаев инфекционных и паразитарных болезней. Дети дошкольного возраста подвержены острым респираторным заболеваниям (ОРЗ), в среднем, 4-8 раз в год, школьники от 2 до 6 раз в год, взрослые 2-3 раза в год. В контингентах часто болеющих детей эпизоды ОРЗ регистрируются от 10 до 12 раз в год.
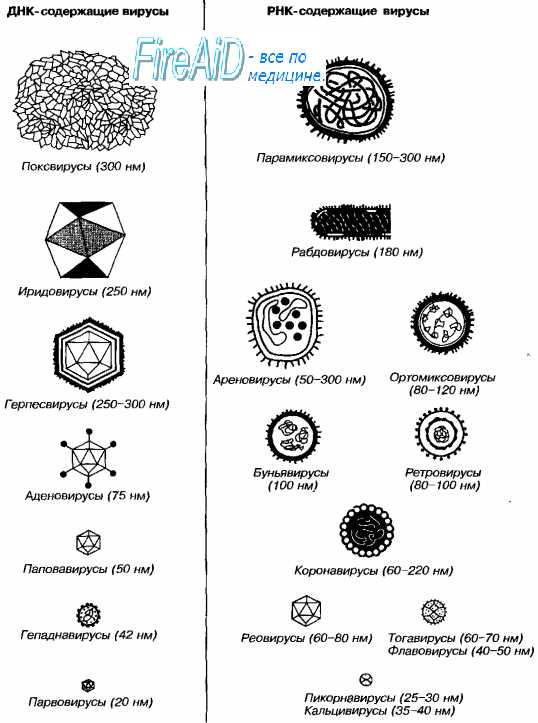
В 90% случаев ОРЗ вызывают возбудители ОРВИ, причиной которых могут являться представители 4-х семейств вирусов, геном которых представлен молекулой РНК (ортомиксовирусы, парамиксовирусы, коронавирусы и пикорнавирусы) и 2-х семейств вирусов, геном которых представлен молекулой ДНК (аденовирусы, парвовирусы). Ведущее место среди острых инфекций дыхательных путей занимает грипп, возбудитель которого периодически вызывает пандемии, последняя из которых наблюдалась в 2009-2010 гг. Эпидемии гриппа охватывают от 5 до 20% населения, приводят к госпитализации порядка 3 млн. человек и вызывают до 250-500 тыс. летальных исходов в мире ежегодно [CDC. MMWR, 2010]. У взрослых больных гриппом в 10-15% случаев развиваются осложнения, причем80% из них приходится на пневмонию. При развитии пневмонии у детей вирусы гриппа обнаруживают в 7-22% случаев. Возбудители гриппа относятся к семейству Orthomyxoviridae, в котором выделяют три рода -InfluenzavirusA, InfluenzavirusВи InfluenzavirusС, каждый из которых имеет по одному виду - InfluenzaAvirus, InfluenzaВ virusи InfluenzaС virus.
Вирусы гриппа В до сих пор выделяли только от людей. Наряду с гриппом А, они занимают значительную долю в структуре летальности при гриппе у детей. Так, в США в сезоне 2010-2011гг.вирус гриппа В стал причиной 38% случаев смерти детей, заняв в структуре циркулирующих вирусов гриппа 26% [CDC. MMWR., 2011].
У людей вирусы гриппа С вызывают спорадические ОРЗ. Среди животных вирусы гриппа С выделяют от свиней, при экспериментальном заражении заболеванию подвержены собаки. Вирусы гриппа А, В и С дифференцируют друг от друга с помощью иммунологических и МАНК.
Помимо гриппа, причиной ОРЗ являются парамиксовирусы: респираторно-синцитиальный вирус (HumanRespiratorysyncytialvirus), метапневмовирус человека (HumanMetapneumovirus), 4 вида (1-4) вирусов парагриппа (Human Parainfluenza virus1-4), коронавирусы (Human Coronavirus 229E, Human CoronavirusOC43, Human CoronavirusNL63, Human CoronavirusHKUI), риновирусы (Rhinovirus) виды А, В, С, относящиеся к пикорнавирусам, аденовирусы (Human mastadenovirus) виды B, C, E, бокавирус человека (Human bocavirus), относящийся к парвовирусам. Все вышеперечисленные вирусы вызывают ОРЗ среди всех возрастных групп, за исключением бокавируса человека, инфицирующего только детей. У лиц со сниженной активностью иммунной системы, причиной ОРЗ могут быть также энтеровирусы, вирусы герпеса, цитомегаловирус. Дифференциальная диагностика гриппа и других ОРВИ возможна только с помощью лабораторных методов исследования.
Респираторно-синцитиальный вирус (hRSv, РС-вирус) является основным возбудителем бронхиолитов и пневмоний у младенцев и детей младшего возраста во всем мире [Nair H; Stockman LJ]. Частота hRSv у больных внебольничной пневмонии детей колеблется от 15,7% до 31,8% в зависимости от региона эпидемического сезона и возраста и максимальна у госпитализированных детей первого года жизни [Rohde GGU; Harris M]. В группу риска тяжелого течения PC-инфекциивходят недоношенные младенцы, дети до 2-х лет, дети и взрослые с ослабленной вследствие заболеваний или лечения иммунной системой, пожилые люди (старше 65 лет). В годы эпидемической активности hRSv составляет 44% в этиологической структуре острых бронхитов у госпитализированных детей [Яцышина С.Б., 2008].
Вирусы парагриппа (hPiv) разделяют на 4 вида, относящиеся к двум родам: респировирусы (парагрипп 1 и 3) и рубулавирусы (парагрипп 2 и 4). Вирусы парагриппа часто обнаруживаются у детей младшего возраста. Ко второму году жизни каждый ребенок хотя бы один раз переболевает ОРЗ, вызванным вирусами парагриппа. hPiv 2 и 4 чаще обнаруживают у детей первого года жизни по сравнению с другими возрастными группами, где превалируют вирусы парагриппа 1 и 3. Доля hPiv в этиологической структуре ОРЗ составляет от 9 до 30%. При этом, в этиологической структуре крупов у детей первых лет жизни вирусы парагриппа 1 –4 занимают до 20%. Среди детей с заболеваниями нижних дыхательных путей, госпитализированных в стационары, инфицированные hPiv,составляют около 22% [Weinberg GA]. Все это ставит вирусы парагриппа на второе место среди возбудителей ОРВИ по частоте госпитализации и тяжести заболевания после респираторно-синцитиального вируса.
Среди аденовирусов (hAdv) выделяют 7 видов: A, B, C, D, E, F, G. В зависимости от вида,аденовирусы вызывают различные инфекционные заболевания: конъюнктивиты и кератоконъюнктивиты (A, D), острые диарейные заболевания (F), гастроэнтериты (G), крупы, гриппоподобные заболевания, бронхиты и пневмонии – B, C, E. Известны случаи бессимптомного носительства hAdv в лимфоидной ткани верхних дыхательных путей на протяжении нескольких месяцев и лет, которые могут быть источником возбудителя. Будучи относительно устойчивыми к химическим и физическим воздействиям, hAdv могут длительное время сохранять стабильность в окружающей среде, и по этой причине,часто вызывают вспышки в детских дошкольных учреждения, домах ребенка, домах престарелых, и прежде всего, в воинских частях, где частота выявления hAdv достоверно превышает таковую у взрослых штатских и детей [Львов Н.И.]. При этом заболевание может протекать со случаями пневмонии тяжелого течения, и даже заканчиваться летальным исходом [Яцышина С.Б., 2014].
Коронавирусы (hCov) представляют собой большую разнообразную группу вирусов, которая классифицируется как альфа, бета и гамма коронавирусы. Различные виды коронавирусов широко распространены в природе, вызывая различную инфекционную патологию у животных: гастроэнтериты и респираторные инфекции у свиней, инфекционный бронхит кур, энтериты у собак, инфекционный перитонит у кошек. Как показали исследования последних двух лет, летучие мыши инфицированы разнообразными альфа-и бета-коронавирусами. У человека острую респираторную инфекцию вызывают 4 вида коронавирусов: 229E, OC43, NL63, HKUI, чаще протекающую с поражением верхних дыхательных путей легкой или средней тяжести [Bradburne AF], и в редких случаях – с инфекциями нижних дыхательных путей [Woo PC]. Коронавирусы обнаруживаются преимущественно у детей младшего возраста с симптоматикой крупа иларингита [vander HoekL]. У детей старшего возраста и у взрослых при коронавирусной инфекции может отмечаться гриппо-подобная симптоматика, а также кашель и ринорея.
Самым распространенным возбудителем ОРВИ среди взрослого населения и детей всех возрастных групп являются риновирусы (hRv), вызывающие воспаление слизистой верхних дыхательных путей с ринореей и кашлем; в качестве осложнения нередко развивается трахеит. Среди Rv в настоящее время выделяют 3 вида вирусов: А, В, C. Принимая во внимание тот факт, что риновирусы достаточно часто обнаруживают у детей при пневмонии [Kieninger E; Яцышина С.Б., 2016], и экспериментально доказана возможность репликации риновирусов в ткани легких млекопитающих [Schroth MK], нельзя недооценивать данный возбудитель как причину поражения нижних дыхательных путей у детей.
Бокавирус (hBov), впервые описанный в 2005 г., обнаруживается со среднегодовой частотой 1,5-19% как единственный возбудитель острой инфекции дыхательных путей у детей до 5 лет [Кондратьева Т.Ю.], вызывая лихорадку, кашель, риниты и диарею [Вартанян Р.В.]. Помимо этого, бокавирус часто обнаруживается в сочетании с другими возбудителями ОРЗ. При пневмонии у детей бокавирусы обнаруживаются в 4-15% случаев [Honkinen M; Esposito S; Яцышина С.Б., 2016]. У взрослых, находящихся в тесном контакте с больными детьми, бокавирус может вызывать легкие симптомы ОРЗ [Кондратьева Т.Ю.], в редких случаях вирус обнаруживается при пневмонии на фоне иммунодефицита.
Наиболее тяжело протекают острые инфекции дыхательных путей, вызванные респираторно-синцитиальным вирусом, метапневмовирусом, вирусами парагриппа и коронавирусами, у детей в возрасте до 5 лет, пожилых и у лиц с иммунодефицитом. Современные данные свидетельствуют, что случаи инфекций нижних дыхательных путей вирусной этиологиине следует рассматривать как единичные или очень редкие. Вирусные возбудители инфекций дыхательных путей обнаруживаются у 10% пациентов ВП, нуждающихся в интенсивной терапии [Harris M].
Внедрение в клиники методов ранней этиологической лабораторной диагностики вирусных инфекций позволит клиницистам своевременно применять средства специфической противовирусной терапии, разрабатывать эффективную тактику ведения пациентовс инфекцией определенной этиологии, и тем самым, предотвращать осложнения и летальные исходы.
Диагностика гриппа. Лечение гриппа. Профилактика гриппа.
Материалы для исследования при гриппе — смывы и мазки из носоглотки, мазки-отпечатки из носовой полости и кровь.
Основные методы диагностики гриппа — вирусоскопические, вирусологические и серологические. К методом экспресс-диагностики гриппа относят определение Аг вируса в мазках-отпечатках из носа и смывов носоглотки в РИФ и ИФА.
Выделение возбудителя гриппа проводят заражением 10-11-суточных куриных эмбрионов или, реже, различных клеточных культур. Вирусы гриппа проявляют слабый цитопатический эффект и чаще определяют феномен гемадсорбции. Типовую принадлежность вирусов идентифицируют в РСК; подтип гемагглютинина — в РТГА (вирусы гриппа агглютинируют эритроциты человека и различных животных); подтип нейраминидазы — в реакции ингибирования активности фермента.

Лечение гриппа
Препараты выбора при лечении гриппа —- амантадин или ремантадин, ИФН и его индукторы, противогриппозный у-глобулин. Терапевтические мероприятия следует начинать как можно раньше.
Профилактика гриппа. Иммунопрофилактика гриппа.
Разработаны методы активной и пассивной иммунопрофилактики гриппа. Для пассивной иммунизации применяют противогриппозный иммуноглобулин человека, приготовленный из крови доноров, иммунизированных гриппозными вакцинами.
Для активной иммунизации против гриппа применяют живые и инактивированные вакцины. Живые аттенуироеанные вакцины проявляют большую иммуногенность. Инактивированные вакцины включают вирионные (приготовлены из высоко-очищенных культур вирусов), субвирионные или расщеплённые (получают обработкой высоко-очищенных культур вирусов детергентами), субъединичные (содержат только гемагглютинин и нейраминидазу) препараты. Вакцинацию осуществляют в периоды наибольшего риска развития эпидемий. Она в большей степени показана лицам младшего и преклонного возраста, страдающим обструктивными лёгочными и сердечно-сосудистыми заболеваниями, а также сотрудникам ЛПУ.
Применение убитых вакцин от гриппа требует ежегодной ревакцинации; их эффективность не превышает 60-70%. Поскольку антигенные вариации возбудителя наблюдают часто, то набор Аг соответствующего вируса для иммунизации может быть определён только после начала вспышки заболевания.
Эпидемиология гриппа. Распространенность гриппа. Морфология вирусов гриппа.
Грипп [от фр. gripper, хватать], или инфлюэнца [от итал. influenza di freddo, влияние холода], — острая инфекция, проявляющаяся поражениями дыхательного тракта, непродолжительной лихорадкой, упадком сил, головной болью, миалгиями и др.
Резервуар гриппа — инфицированный человек (больные и бессимптомные носители). Больной становится заразным за 24 ч до появления основных симптомов и представляет эпидемическую опасность в течение 48 ч после их исчезновения.
Грипп регистрируют повсеместно, рост заболеваемости наблюдают в холодные месяцы. Эпидемии гриппа развиваются с интервалом 2-3 года.
Передача возбудителя гриппа происходит воздушно-капельным путём. Наиболее восприимчивы дети и лица преклонного возраста. Вирусы гриппа чувствительны к действию высоких температур, высушиванию, инсоляции и УФ-облучению. Также они лабильны к действию эфира, фенола, формальдегида и других веществ, денатурирующих белки.

Морфология вирусов гриппа
Суперкапсид вируса гриппа образован липидным бислоем, который пронизывают гликопротеиновые шипы (спикулы), определяющие гемагглютинирующую (Н) либо нейраминидазную (N) активность. Репликация ортомиксовирусов первично реализуется в цитоплазме инфицированной клетки; синтез вирусной РНК происходит в ядре.
• Гемагглютинин обусловливает проникновение вирусов гриппа в клетки в результате слияния с мембраной клетки и мембранами лизосом. AT к нему обеспечивают защитный эффект. Нейраминидаза распознаёт и взаимодействует с рецепторами, содержащими N-ацетилнейраминовую кислоту, то есть приводит к проникновению вируса, а также, отщепляя нейраминовую кислоту от дочерних вирионов и клеточной мембраны, к выходу вирусов из клеток.
• Семь сегментов вирусного генома кодируют структурные белки, восьмой — неструктурные белки NS1 и NS2 вируса гриппа, существующие только в инфицированных клетках. Основные из них — матриксный (М) и нуклеопротеидный (NP) белки. В меньших количествах присутствуют внутренние белки (P1, P2, Р3), участвующие в этапах транскрипции и репликации вируса гриппа.
• М-белок вирусов гриппа играет важную роль в морфогенезе вирусов и защищает геном, окружая нуклеокапсид. Белок NP выполняет регуляторные и структурные функции. Внутренние белки являются ферментами: Р1 — транскриптаза, Р2 — эндонуклеаза, Р3 — репликаза.
Выявление противовирусных антител ( AT ) в сыворотке крови. РТГА. РСК. РИФ. Иммуносорбционные методы выявления противовирусных антител.
Более простой и доступный подход — выявление противовирусных антител ( AT ) в сыворотке. Образцы крови необходимо отбирать дважды: немедленно после появления клинических признаков и через 2~3 нед. Чрезвычайно важно исследовать именно два образца сыворотки. Результаты однократного исследования нельзя считать окончательными из-за невозможности связать появление AT с настоящим случаем. Вполне возможно, что эти AT циркулируют после предшествующей инфекции. В подобной ситуации роль исследования сыворотки, полученной в период рекон-валесценции, трудно переоценить. На наличие заболевания в период отбора первой пробы указывает не менее чем четырёхкратное увеличение титра AT, выявленное при исследовании второй пробы.
Перечисленные ниже методы не позволяют дифференцировать антитела ( AT ), образующиеся во время болезни и циркулирующие после выздоровления (продолжительность этого периода вариабельна для различных инфекций). Поскольку для адекватной диагностики необходимо подтвердить достоверное увеличение титров AT в двух пробах, то первую пробу исследуют в острой фазе, а вторую — в период выздоровления (через 2-3 нед). Полученные результаты носят ретроспективный характер и более пригодны для проведения эпидемиологических обследований.
РТГА выявляет AT, синтезируемые против гемагглютининов вирусов (например, вируса гриппа). Метод позволяет легко выявлять подобные антитела ( AT ) в сыворотке больного.
РСК — основной метод серодиагностики вирусных инфекций (среди доступных). Реакция выявляет комплементсвязывающие IgM и IgG, но не дифференцирует их; для оптимизации получаемых результатов постановка реакции требует определённых навыков персонала.
РИФ. При возможности получить биоптат инфицированной ткани и доступности коммерческих наборов AT, меченных флюоресцеином, диагноз может подтвердить реакция прямой иммунофлюоресценции. Постановка реакции включает инкубацию исследуемой ткани с AT, их последующее удаление и люминесцентную микроскопию образца.
Иммуносорбционные методы выявления противовирусных антител
Иммуносорбционные методы (например, ИФА и РИА) более информативны, поскольку выявляют IgM и IgG по отдельности, что позволяет делать определённые выводы о динамике инфекционного процесса или состоянии реконвалесценции. Для выявления AT известный Аг сорбируют на твёрдом субстрате (например, на стенках пробирок, пластиковых микропланшетах, чашках Петри) и вносят различные разведения сыворотки пациента. После соответствующей инкубации несвязавшиеся AT удаляют, вносят антисыворотку к Ig человека, меченную ферментом, повторяют процедуру инкубирования и отмывания несвязанных AT и вносят какой-либо хромогенный субстрат (чувствительный к действию фермента). Поскольку изменение окраски пропорционально содержанию специфических AT, то вполне возможно определение их титра спектрофотометрическим способом. В диагностике ВИЧ-инфекции наи- большее распространение нашёл метод иммуноблотннга.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ПЦР — полимеразная цепная реакция
РВИ — риновирусная инфекция
РСВ — респираторно-синцитиальный вирус
СД — сахарный диабет
СО — слизистая оболочка
ССЗ — сердечно-сосудистые заболевания
ХОБЛ — хроническая обструктивная болезнь легких
Острые респираторные вирусные инфекции (ОРВИ) — кратковременная, как правило, легко протекающая инфекция верхних дыхательных путей (включая полость среднего уха и околоносовые пазухи), которая вызывается различными респираторными вирусами и сопровождается ринореей, общим недомоганием, гипертермией, першением и болью в горле, кашлем.
Для ОРВИ характерен крайне высокий уровень заболеваемости, который приводит к серьезному экономическому ущербу. По официальным данным, в России каждый год регистрируется 27,3—41,2 млн случаев респираторных инфекций, на которые в структуре общей заболеваемости приходится почти 40% дней нетрудоспособности [1]. Однако стоит предположить, что реальное число заболевших, часто не обращающихся за медицинской помощью, превышает официальные данные в 1,5—2 раза. Столь высокая заболеваемость ОРВИ напрямую ассоциируется со значительными экономическими потерями, в первую очередь за счет косвенных издержек, связанных с потерей трудоспособности. Немаловажны и материальные расходы пациентов, вынужденных покупать целый ряд лекарственных препаратов.
Другой серьезной проблемой является неоправданное назначение при ОРВИ антибактериальных препаратов. Так, в российской практике по поводу респираторных инфекций антибиотики назначаются 52% детей [2]. Показано, что антибиотикотерапия была назначена в 74% случаев при лечении ОРВИ у военнослужащих [3]. Между тем неоправданное назначение антибиотиков при ОРВИ приводит к увеличению затрат на медицинскую помощь, повышает вероятность развития нежелательных реакций и служит важным фактором формирования и распространения антибиотикорезистентности.
Эпидемиология. Заболеваемость риновирусной инфекцией (РВИ) носит отчетливый сезонный характер с пиком в осенне-зимний период и снижением весной. Эпидемии гриппа чаще всего возникают в зимние месяцы, а заболеваемость РСВ-инфекцией остается стабильно невысокой в течение всего года. Наиболее часто респираторные инфекции регистрируются у детей (в среднем 6—8 эпизодов в год), тогда как у взрослых не более 2—4.
Передача вирусов может осуществляться следующими путями:
— через руки при контакте с секретами, содержащими вирусные частицы, непосредственно от инфицированного человека или опосредованно через окружающие предметы;
— через мелкодисперсный аэрозоль, содержащий вирусы и длительное время находящийся во взвешенном состоянии;
— непосредственно при откашливании/чихании инфицированного человека через крупные частицы респираторных секретов.
При РВИ чаще инфицирование происходит через руки (контактный путь); напротив, при гриппе преимущественный путь заражения — воздушно-капельный (через мелкодисперсный аэрозоль).
Общий механизм развития заболевания можно представить следующим образом: возбудители, обладая тропностью к слизистой оболочке (СО) верхних дыхательных путей, проникают в клетки эпителия, вследствие чего развивается локальная воспалительная реакция. В дальнейшем продукты клеточного распада, попадая в системный кровоток, приводят к системным токсическим проявлениям и в конечном итоге мы наблюдаем типичный для простуды симптомокомплекс: сочетание общетоксических (головная боль, слабость, вялость, повышение температуры тела, боли в мышцах) и местных (насморк, ринорея, боль в горле, кашель и пр.) реакций.

Клинические проявления ОРВИ. Симптоматика ОРВИ, продолжительность инкубационного периода варьируют при поражении различными вирусами. Например, при РВИ клиническая картина наблюдается спустя 10—12 ч от заражения; напротив, при гриппе инкубационный период может достигать 7 дней (в среднем 2 дня). Продолжительность заболевания чаще всего не превышает 7—10 дней, но некоторые симптомы (кашель, астения) могут сохраняться 3 нед и более. Каждый случай заболевания имеет некоторые отличительные черты. Так, вирусы гриппа, РСВ, аденовирусы поражают эпителий как верхних, так и нижних дыхательных путей с возможным развитием острого трахеобронхита, бронхиолита, сопровождающихся синдромом обструкции. При РВИ поражается преимущественно эпителий носовой полости, при парагриппе — гортани, а аденовирусная инфекция характеризуется возникновением конъюнктивита (см. таблицу).
Типичная РВИ начинается с болей в горле при глотании, затем присоединяются заложенность носа, насморк, чихание, реже кашель. Лихорадка чаще всего отсутствует, наблюдается лишь небольшой субфебрилитет. К другим симптомам относятся общее недомогание, вялость, апатичность, потеря аппетита, головные боли.
В большинстве случаев диагностика ОРВИ основывается на анализе клинической картины, эпидемиологической ситуации в регионе и не вызывает затруднений. При этом стоит помнить, что, несмотря на некоторые различия в клинических проявлениях разной вирусной инфекции, на основании только клинических данных невозможно точно определить этиологию заболевания. К методам идентификации вирусной инфекции относят выделение культуры вируса, определение антигена и полимеразную цепную реакцию (ПЦР). Выделение вируса чрезвычайно трудоемкий процесс, в настоящее время не имеющий клинического значения. Для быстрой диагностики гриппа используют экспресс-методы обнаружения вируса с помощью флюоресцирующих антител (результат в течение 2—3 ч). Определение антигенов перспективно при гриппозной, аденовирусной и РСВ-инфекции, но не используется для диагностики РВИ (огромное число серотипов вируса). ПЦР-диагностика позволяет получить результаты в течение получаса, но является дорогостоящей методикой, вследствие чего редко применяется в повседневной практике.
Перспективным методом, по нашему мнению, требующим широкого внедрения в клиническую практику (в том числе амбулаторную), является качественное определение нуклеопротеиновых антигенов гриппа А и В по носоглоточному или назальному мазку либо назальному смыву/аспирату с помощью иммунохроматографического экспресс-теста BinaxNOW. Чувствительность метода составляет 96%, специфичность 100%, результат доступен через 15 мин. В настоящее время стоимость одного исследования не превышает 300 руб.
Фармакотерапия ОРВИ.Противовирусная терапия. В настоящее время этиотропная противовирусная терапия может проводиться только при гриппозной (блокаторы М2-каналов, ингибиторы нейроминидазы) и РСВ-инфекции (рибавирин). Необходимо отметить, что противовирусные препараты целесообразно назначать в случае, если с момента появления симптомов заболевания прошло не более 48 ч. В то же время в российской медицинской практике наиболее частыми являются ситуации, когда с момента начала заболевания до обращения за медицинской помощью проходит более 3 сут.
В настоящее время в качестве этиотропной терапии гриппозной инфекции используются ингибиторы нейроаминидазы (занамивир, осельтамивир) и блокаторы М2-каналов (амантадин, римантадин). Озельтамивир доступен в лекарственной форме для приема внутрь (капсулы по 75 мг). Согласно результатам клинических исследований препарат достоверно уменьшает продолжительность симптомов заболевания, тяжесть его течения, частоту развития осложнений. Занамивир используется ингаляционно и рекомендуется для лечения гриппа у детей старше 7 лет при сроке появления клинических симптомов не более 36 ч. Важно, что перекрестной резистентности между озельтамивиром и занамивиром, как правило, не наблюдается, и это позволяет использовать последний, в том числе для эффективного лечения больных, инфицированных вирусом гриппа A высокопатогенных штаммов — H5N1 и H1N1 [7, 8].
Лечение бактериальных осложнений. Показания к антибактериальной терапии. Антибактериальная терапия при ОРВИ является наиболее распространенной ошибкой в реальной клинической практике. Несмотря на то что антибиотики неактивны в отношении вирусной инфекции, врачи широко назначают их, предполагая, что применение препаратов этой группы минимизирует риск развития бактериальных осложнений простуды. Стоит еще раз отметить, что такая практика не имеет доказательной базы [9], а приводит лишь к значительному увеличению затрат на медицинскую помощь и повышает вероятность развития нежелательных реакций.
Единственным показанием к назначению антибактериальной терапии является развитие бактериальных осложнений вирусной инфекции (пневмония, острый бактериальный синусит, острый средний отит) и только в определенных клинических ситуациях.
Иммуномодулирующая терапия. Основным фактором противовирусной защиты человеческого организма является система интерферона (ИФН). Сывороточный ИФН — один из первых барьеров, препятствующих вирусной экспансии. Супрессия выработки собственного ИФН сопровождается высокой заболеваемостью ОРВИ, осложненным течением инфекции. Среди причин снижения синтеза ИФН выделяют генетические факторы, стресс, недостаток витаминов и микроэлементов. Нарушение синтеза ИФН особенно характерно для часто болеющих детей, беременных женщин, пожилых людей. Выделяют 3 основных типа ИФН — ИФН-α, ИФН-β и ИФН-γ, при этом наиболее выраженным противовирусным свойством обладает ИФН-α, в то время как для ИФН-γ более характерны иммуномодулирующие свойства. Препараты экзогенного ИФН доступны в 2 лекарственных формах — для интраназального применения и рекомбинантные формы в виде свечей. Перспективы использования интраназальных форм связаны с доказанным в целом ряде клинических исследований профилактическим эффектом [13]. В то же время перспективы лечения ОРВИ обусловлены применением рекомбинантных форм ИФН в форме суппозиториев, которые обеспечивают длительную циркуляцию ИФН в организме (до 12 ч). В настоящее время в ходе рандомизированных исследований показана эффективность препаратов ИФН при лечении ОРВИ у детей [14]. Имеются также результаты лишь одного исследования [15], показавшего эффективность и экономическую рентабельность применения препаратов ИФН при лечении острого бронхита у взрослых пациентов.
Перспективным направлением профилактики ОРВИ является использование средств для активизации неспецифической резистентности организма. Механизм действия препаратов данной группы связан с индукцией синтеза в организме человека собственных ИФН в концентрациях, обладающих противовирусной активностью, и циркулирующих в течение длительного времени. Индукторы эндогенного ИФН обладают хорошей переносимостью, их использование позволяет увеличить концентрацию ИФН в пределах физиологической нормы [16]. Однако использование препаратов данной группы характеризуется непостоянством профилактического и лечебного эффектов в плацебо-контролируемых исследованиях. Одной из возможных причин неэффективности индукторов ИФН является их использование у пациентов с супрессией выработки эндогенного ИФН. К этой категории относятся пациенты с хроническими заболеваниями внутренних органов и вторичными иммунодефицитами. Кроме того, влияние индукторов на концентрацию ИФН в сыворотке крови является отсроченным, что обусловливает их меньшую эффективность при назначении в терапевтических целях.
В связи с этим клинических рекомендаций по применению индукторов ИФН в конкретных клинических ситуациях не существует. Их применение наиболее актуально у невакцинированных лиц в предэпидемический период как дополнение к химиопрофилактике ингибиторами нейроминидазы (либо при их непереносимости) у пациентов с факторами риска развития осложнений (иммуносупрессии, СД, ССЗ и хронические легочные заболевания).
В отношении препаратов эхинацеи до настоящего времени не существует доказательных данных, позволяющих широко рекомендовать их применение в клинической практике.
Направления симптоматической фармакотерапии. Симптоматическая терапия ОРВИ предполагает использование препаратов различного действия — анальгетики-антипиретики, противокашлевые средства, деконгестанты и пр.
Для купирования лихорадки, головной боли и миалгии при ОРВИ широко применяются представители группы нестероидных противовоспалительных препаратов (НПВП), которые наряду с жаропонижающим эффектом оказывающие анальгезирующее действие. Наиболее безопасный и часто рекомендуемый препарат — парацетамол, реже (в случае выраженной головной боли или миалгии) может использоваться ибупрофен. Данные препараты не оказывают побочных эффектов, свойственных остальным НПВП (эрозивно-язвенные поражения желудочно-кишечного тракта, бронхоспазм, нарушение картины периферической крови и пр.). Применение ацетилсалициловой кислоты (аспирин) должно быть ограничено, а у пациентов младше 18 лет и вовсе исключено с целью минимизации риска развития синдрома Рейе. Применение нимесулида в рамках лечения ОРВИ также не рекомендовано, а в педиатрической практике запрещено.
С целью устранения заложенности носа и ринореи — наиболее частых симптомов РВИ — применяются так называемые деконгестанты (местные — для интраназального применения или системные). К местным относятся нафазолина нитрат (нафтизин), ксилометазолин (галазолин), оксиметазолин (називин) и пр. По продолжительности сосудосуживающего действия наиболее эффективным является оксиметазолин, несколько короче эффект у ксилометазолина. Производные нафазолина (нафтизин) тетризолина и инданазолин характеризуются непродолжительным сосудосуживающим эффектом (не более 4—6 ч) и наибольшим токсическим действием на клетки реснитчатого эпителия СО носа. Напротив, оксиметазолин — один из самых безопасных деконгестантов, рекомендованных в том числе в педиатрической практике. Необходимо помнить, что местные деконгестанты нельзя использовать более 5 дней (3 дня для препаратов короткого действия) из-за опасности развития медикаментозного ринита, который характеризуется повторным появлением гиперемии и отека СО носа с нарушением носового дыхания на фоне терапии. Чаще всего медикаментозный ринит развивается при использовании препаратов короткого действия.
Наиболее широко применяемым системным деконгестантом для приема внутрь является фенилэфрин (мезатон). К его недостаткам стоит отнести отсутствие селективности действия и, как следствие, потенциальный риск развития разнообразных побочных эффектов. Так, при применении фенилэфрина могут развиться нарушения функции ЦНС, проявляющиеся возбуждением, беспокойством, раздражительностью, возникновением тремора; головокружение и головная боль; артериальная гипертония, боли в области сердца и аритмия, что обусловливает необходимость осторожного его применения у пациентов с сопутствующими ССЗ. В педиатрической практике системные деконгестанты разрешены для использования только у детей старше 12 лет.
Для купирования насморка также используются антигистаминные препараты первого поколения, эффект которых обусловлен их побочным антихолинергическим действием. Доказано, что сочетание фенилэфрина с антигистаминными препаратами первого поколения повышает эффективность купирования симптомов насморка. К серьезным недостаткам гистаминоблокаторов первого поколения относят выраженный седативный эффект, что не позволяет их использовать у социально-активных пациентов. В числе противопоказаний недопустимость вождения автомобиля и выполнение работ, требующих концентрации внимания.
Необходимо отметить, что препараты, содержащие кодеин и декстрометорфан, малоэффективны для лечения острого кашля, возникшего на фоне ОРВИ. Более того, их применение не рекомендовано при гриппе, особенно на ранних стадиях заболевания. Муколитики (ацетилцистеин, амброксол) показаны только при кашле с отхождением вязкой мокроты. Некоторые препараты — фенирамин и хлорфенирамин (нередко, входящие в состав комбинированных средств), кроме антигистаминного оказывают противокашлевое действие, в основе которого лежит угнетение кашлевого центра. Данные средства дают выраженный седативный эффект (усиливающийся на фоне приема алкоголя, транквилизаторов), поэтому их применение должно быть ограничено.
С целью уменьшения сухости, болезненности в горле наиболее эффективно обычное полоскание теплыми растворами. Получившие огромную популярность средства в виде леденцов, пастилок, содержащие чаще всего местный анестетик (2,4-дихлорбензил алкоголь, амилметакрезол) и различные растительные добавки, позволяют уменьшить болезненные проявления.
Перечень клинических проявлений ОРВИ разнообразен: общетоксический, катаральный синдром с поражением различных уровней респираторного тракта. Для купирования конкретных симптомов болезни могут вполне оправданно применяться несколько классов лекарственных препаратов. Столь широкий перечень средств, необходимых для лечения, является попросту неудобным для пациента, ведущего активный образ жизни. Решением данной проблемы явилось создание комбинированных/мультисимптомных средств, позволяющих воздействовать на основные симптомы вирусной инфекции. Кроме удобства применения, что нашло свое безусловное отражение в высокой популярности данных средств, комбинированные препараты обладают более низкой стоимостью, чем набор различных препаратов. В большинстве случаев рецептура комбинированных средств стандартная, содержащая жаропонижающий компонент — НПВП, системный деконгестант, антигистаминные препараты, аскорбиновую кислоту. Некоторые препараты содержат также противокашлевые средства (терпингидрат, гвайфеназин).
Очевидно, что при выборе комбинированного средства для конкретной клинической ситуации необходимо руководствоваться анализом клинических симптомов заболевания. Основным требованием, предъявляемым к мультисимптомному средству, является наличие в структуре не более 3 активных ингредиентов из различных фармакологических групп, и не более одного активного вещества из каждой фармакологической группы. При выборе препарата необходимо также обращать внимание на риск развития побочных эффектов (например, предупреждать о наличии седативного эффекта у средств, содержащих фенирамин, или отказаться от применения фенилэфрина у пациентов с ССЗ). Другим недостатком комбинированных препаратов является отсутствие противовирусного действия. В настоящее время на российском рынке представлен лишь один комбинированный препарат, сочетающий перечисленные выше симптоматические средства и содержащий противовирусный компонент. Это АнвиМакс. В то же время чаще всего, пациент обращается за медицинской помощью спустя несколько дней от начала заболевания, когда имеющиеся в арсенале врача противовирусные средства малоэффективны, и его первым действием является прием широко используемых комбинированных средств. Таким образом, наличие в рецептуре противовирусного компонента является перспективным направлением создания комбинированных препаратов для лечения ОРВИ.
Читайте также:

