Методы культивирования вирусов в клеточных культурах в курином эмбрионе
Обновлено: 07.05.2024
1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает. Если болезнь не развивается, то патологические изменения можно обнаружить при вскрытии. У животных наблюдаются иммунологические сдвиги. Однако далеко не все вирусы можно культивировать в организме животных;
2) культивирование вирусов в развивающихся куриных эмбрионах. Куриные эмбрионы выращивают в инкубаторе 7—10 дней, а затем используют для культивирования. В этой модели все типы зачатков тканей подвержены заражению. Но не все вирусы могут размножаться и развиваться в куриных эмбрионах.
В результате заражения могут происходить и появляться:
1) гибель эмбриона;
2) дефекты развития: на поверхности оболочек появляются образования – бляшки, представляющие собой скопления погибших клеток, содержащих вирионы;
3) накопление вирусов в аллантоисной жидкости (обнаруживают путем титрования);
4) размножение в культуре ткани (это основной метод культивирования вирусов).
Различают следующие типы культур тканей:
1) перевиваемые – культуры опухолевых клеток; обладают большой митотической активностью;
2) первично трипсинизированные – подвергшиеся первичной обработке трипсином; эта обработка нарушает межклеточные связи, в результате чего выделяются отдельные клетки. Источником являются любые органы и ткани, чаще всего – эмбриональные (обладают высокой митотической активностью).
Для поддержания клеток культуры ткани используют специальные среды. Это жидкие питательные среды сложного состава, содержащие аминокислоты, углеводы, факторы роста, источники белка, антибиотики и индикаторы для оценки развития клеток культуры ткани.
О репродукции вирусов в культуре ткани судят по их цитопатическому действию, которое носит разный характер в зависимости от вида вируса.
Основные проявления цитопатического действия вирусов:
1) размножение вируса может сопровождаться гибелью клеток или морфологическими изменениями в них;
2) некоторые вирусы вызывают слияние клеток и образование многоядерного синцития;
3) клетки могут расти, но делиться, в результате чего образуются гигантские клетки;
4) в клетках появляются включения (ядерные, цитоплазматические, смешанные). Включения могут окрашиваться в розовый цвет (эозинофильные включения) или в голубой (базофильные включения);
5) если в культуре ткани размножаются вирусы, имеющие гемагглютинины, то в процессе размножения клетка приобретает способность адсорбировать эритроциты (гемадсорбция).
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Инфекционная РНК и реконструкция вирусов
Инфекционная РНК и реконструкция вирусов Доказательства того, что РНК вирусов является генетическим материалом, предоставил нам все тот же ВТМ. Прежде всего ученым удалось изменить частицы ВТМ, устранив из их состава белковый компонент. В таком состоянии вирусы
Мутации вирусов в лаборатории
Мутации вирусов в лаборатории Мы говорили о мутантах ВТМ, созданных природой. Сегодня нам известны уже и его лабораторные мутанты. Первые из них увидели свет в лаборатории Г. Шрамма.Шрамм в своих опытах исходил из возможности замены аминогруппы (—NH2) в молекуле цитозина
Угроза вирусов
10. Морфология вирусов, типы взаимодействия вируса с клеткой
10. Морфология вирусов, типы взаимодействия вируса с клеткой Вирусы – микроорганизмы, составляющие царство Vira.Вирусы могут существовать в двух формах: внеклеточной (вириона) и внутриклеточной (вируса).По форме вирионы могут быть: округлыми, палочковидными, в виде
11. Культивирование вирусов. Противовирусный иммунитет
11. Культивирование вирусов. Противовирусный иммунитет Основные методы культивирования вирусов:1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает;2) культивирование вирусов в развивающихся куриных эмбрионах. Куриные
2.4. Влияние вирусов на организм человека
2.4. Влияние вирусов на организм человека Большую группу паразитов человека, животных и растений образуют вирусы. Они могут вызывать ряд тяжелых заболеваний, таких как натуральная и ветряная оспа, полиомиелит и др. Вирусы изучаются специальной наукой –
1. Морфология и структура вирусов
1. Морфология и структура вирусов Вирусы – микроорганизмы, составляющие царство Vira.Отличительные признаки:1) содержат лишь один тип нуклеиновой кислоты (РНК или ДНК);2) не имеют собственных белоксинтезирующих и энергетических систем;3) не имеют клеточной
2. Взаимодействие вирусов с клеткой хозяина
2. Взаимодействие вирусов с клеткой хозяина Взаимодействие идет в единой биологической системе на генетическом уровне.Существует четыре типа взаимодействия:1) продуктивная вирусная инфекция (взаимодействие, в результате которого происходит репродукция вируса, а
Глава 10 Мир вирусов и его эволюция
Глава 10 Мир вирусов и его эволюция Пер. Г. ЯнусаВирусы были открыты как нечто совсем непримечательное, а именно необычная разновидность инфекционных агентов, а возможно, и особый род токсинов, вызывающих болезни растений, например табачную мозаику. Так как эти агенты
3.1. Генетический материал вирусов и прокариот
3.1. Генетический материал вирусов и прокариот Генетический материал вирусов представлен одной молекулой нуклеиновой кислоты (либо ДНК, либо РНК), окруженной защитной белковой оболочкой – капсидом. Функционирование вирусов происходит по-разному, в зависимости от их
Открытие фильтрующихся вирусов
Открытие фильтрующихся вирусов Вирусы… Живые существа, увидеть которые позволил лишь электронный микроскоп при увеличении в десятки тысяч раз, а тонкую структуру — в сто тысяч раз и более. Вирусология — наука о вирусах, расцвет которой стал возможным лишь в наш век
Сколько всего вирусов?
Сколько всего вирусов? Вирусами называют внеклеточные формы жизни, способные проникать в определенные живые клетки и размножаться только внутри них. Вирусы являются внутриклеточными паразитами на генетическом уровне. Впервые их (вирус табачной мозаики) открыл в 1892 году
Положение вирусов в системе живой природы
Индикацию, т.е. обнаружение факта репликации вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка - гемагглютинина. В настоящее время использование животных для культивирования вирусов ограничено, в соответствии с Европейской конвенцией о защите позвоночных животных, используемых в экспериментальных научных целях.
2. Культивирование вирусов в куриных эмбрионах.
Большинство известных вирусов обладают способностью реплицироваться в курином эмбрионе. Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9-10, осповакцины - в 12, паротита - в 7-дневных куриных эмбрионах. Репродукция вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
3. Культивирование вирусов в тканевых культурах.
Клеточная культура– система клеток, получаемая из ткани, находящаяся в виде слоя клеток, прикрепленных к стеклу, или в виде суспензии.
Наиболее практическое применение получили однослойные культуры первично-трипсинизированных и перевиваемых линий клеток.
Сущность методов при приготовлении первичных культур тканей заключается в разрушении межклеточной ткани и разобщения клеток для последующего получения монослоя. Разобщение клеток проводится путём воздействияна ткань протеолитических ферментов (трипсина).
Для культивирования культуры клеток применяют синтетические питательные среды – 199, Игла, Хенкса, Эрла (эти среды имеют аминокислоты, витамины, глюкозу, минеральные соли). Смена питательной среды проводится через 2-3 дня.
первичные (трипсинизированные) культуры клеток – у которых межклеточные связи разрушают ферментами (трипсином, панкреатином) и получают монослой клеток на стекле.
а) нормальные (ПКБ – почки барана; СОЦ – сердце обезьяны циномольгус);
б) опухолевые – Hela– рак шейки матки;Hep–1 – эпидермоидный рак гортани; Дейтройт 6 – костный мозг больного раком легкого.
О наличии вирусав зараженной культуре клеток можно судить по цитопатическому действию (ЦПД) – патологические изменения морфологии клеток, вплоть до их гибели, возникающие в результате репродукции вирусов, и наблюдаемые под микроскопом:
дегенерация клеток (округление, изменение формы, разрушение);
появление включений (Липшются – вирус герпеса; Гварниери – вирус натуральной оспы) и телец (Бабеша-Негри – вирус бешенства);
разрушение пласта клеток (парамиксовирусы);
образование гигантских многоядерных клеток - симпластов (вирус кори).
Основные методы индикации вирусов в культуре тканей:
3.реакция нейтрализации вирусов в культуре тканей;
4.цветная реакция Солка.
Реакция гемагглютинации– склеивание эритроцитов при добавлении вирусосодержащего материала (есть вирус – эритроциты оседают в виде “зонтика”; нет вируса – в виде “диска”).
Реакция гемадсорбции– адсорбция эритроцитов на поверхности пораженных вирусом клеток и образуют характерные скопления (вирус гриппа– вызывает агглютинацию эритроцитов островкового типа).
Цветная реакция Солка– основана на изменении цвета питательной среды. В результате жизнедеятельности клеток в питательную среду выделяются продукты клеточного метаболизма и происходит сдвиг рН в кислую сторону, о чем свидетельствует изменение цвета среды из красного в желтый. Если вирус присутствует и реплицируется в культуре, то вследствие разрушающего действия вируса клетки дегенерируются, и подавляется их метаболизм, т.е. цвет средынеизменяется.
Основные пути передачи вирусов:
воздушно-капельный (вирус гриппа, вирус натуральной оспы);
пищевой (вирус полиомиелита, вирус гепатита А);
контактно-бытовой (вирус бешенства, герпесвирусы);
трансмиссивный (вирус клещевого энцефалита);
гематогенный (ВИЧ, вирус гепатита В, С).
Методы диагностики вирусных заболеваний.
Вирусоскопический– в исследуемом материале с помощью электронной микро-скопии обнаруживаются вирионы, а с помощью светооптической – внутриклеточные включения (недостаток светооптической микроскопии – не специфичность).
Вирусологический – выделение и идентификация вирусов с использованием клеточных культур или куриных эмбрионов, заражением лабораторных животных.
Методы идентификации вирусов:
нейтрализации цитопатического действия (ЦПД);
нейтрализация реакции гемадсорбции;
торможение реакции гемагглютинации;
нейтрализация в опытах на животных.
Для идентификации применяется типоспецифические сыворотки.
4. Серологические– для обнаружения как специфических Ат, так и вирусных Аг:
реакция гемагглютинации иммунного прилипания (Аг+Ат в присутствии комплемента адсорбируется на эритроцитах);
Иммунофлуоресцентный метод(ускоренная диагностика).
Биологический метод.
Иммунохроматографический анализ.
Метод ДНК-зондов (гибридизация)в основе лежит способность однонитевых молекул нуклеиновых кислот вступать во взаимодействие с комплементарными нитями и образовывать двунитевые гибридные молекулы. Гибридизация осуществляется на нитроцеллюлозной мембране (твердая подложка). Исследуемую клеточную суспензию лизируют для высвобождения нуклеиновых кислот. ДНК денатурируют, а образовавшиеся одноцепочечные молекулы переносят на мембрану, где они ковалентно связываются с ДНК-зондом, который представляет собой меченные изотопом или ферментом денатурированные молекулы нуклеиновой кислоты. Гибридизация (спаривание) произойдет, если между зондом и нитью ДНК есть гомология.
9. ПЦР(полимеразная цепная реакция) - данный метод основан на выявлении в исследуемом образце специфического фрагмента ДНК возбудителя и на принципе естественной репликации ДНК, включающем расплетение двойной спирали ДНК, расхождение нитей ДНК и комплементарное достраивание обеих нитей.
Конкретные цели:
Трактовать морфологию и ультраструктуру вирусов.
Ознакомиться с классификацией вирусов.
Анализировать особенности взаимодействия вирусов с живыми системами.
Оценивать результаты репликации вирусов в живых системах.
Анализировать методы культивирования вирусов в лабораторных условиях.
Трактовать современные методы лабораторной диагностики вирусных заболеваний.
Проводить алгоритм репликации вирусов с различными типами взаимодействия их с живыми системами.
Оценить цветную пробу Солка, реакцию гемагглютинации и гемадсорбции.
Проводить микроскопию препаратов культуры клеток с разными видами ЦПД вирусов с помощью иммерсионного микроскопа.
Теоретические вопросы:
1. Общая характеристика вирусов, их основные свойства.
Морфология и ультраструктура вириона.
Классификация вирусов. Принципы, положенные в основу.
Методы культивирование вирусов.
Методы индикации и идентификации вирусов (характер ЦПД в культуре ткани, реакция гемадсорбции и гемагглютинации и др.)
Современные методы лабораторной диагностики вирусных заболеваний.
Практические задания, которые выполняются на занятии:
1. Микроскопия интактных пробирочных культур фибробластов и пораженных различными вирусами клеток.
2. Овоскопия куриных эмбрионов.
3. Зарисовка демонстрационных препаратов с ЦПД вирусов в протокол занятия.
Медицинская микробиология, вирусология и иммунология: Учебник /Под ред. А.А. Воробьёва.– М.: МИА, 2004.– 691с.: ил.
Букринская А.Г. Вирусология.– М.: Медицина, 1986.– 336 с.: ил.
Тимаков В.Д., ЛевашевВ.С., Борисов Л.Б. Микробиология /Учебник.-2-е изд., перераб. и доп.-М.:Медицина, 1983,- 512с.
Пяткин К.Д. Кривошеин Ю.С. Микробиология с вирусологией и иммунологией.- Киев: Вища школа, 1992.- 431с.
Медицинская микробиология /Под редакцией В.И. Покровского.- М.: ГЕОТАР-МЕД, 2001.- 768с.
Черкес Ф.К., Богоявленская Л.Б., Бельскан Н.А. Микробиология. /Под ред. Ф.К. Черкес.– М.: Медицина, 1986.– 512 с.
Дополнительная литература:
2. Тiтов М.В. Iнфекцiйнi хвороби.- К., 1995.– 321с.
3. Шувалова Е.П. Инфекционные болезни.- М.: Медицина, 1990.- 559 с.
4. Павлович С.А. Медицинская микробиология в графах: Учеб. пособие для мед. ин-тов.– Мн.: Выш. шк., 1986.– 255 с.
Цель занятия: ознакомить студентов с методами отбора куриных эмбрионов для культивирования вирусов.
Оборудование и материалы: куриные эмбрионы 9-12 дневного возраста инкубации, овоскоп, спиртовые тампоны, подставки для эмбрионов, пинцеты, ножницы, лейкопластырь, иглы, шприцы, простые карандаши, пробойники, иголочки, таблицы, схемы, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Методика проведения занятия и методические указания по теме.
Объяснение преподавателя. Культивирование вирусов на куриных эмбрионах наиболее доступный и удобный метод для первичного выделения вируса. Практика применения этого метода заражения показала ряд преимуществ перед другими методами. Для заражения используют эмбрионы 5-12 дневной инкубации.
7.1 Достоинства и недостатки куриных эмбрионов как биологических объектов. Культивирование вирусов в куриных эмбрионах – наиболее доступный и удобный метод как для первичного выделения вирусов от больных животных и из объектов внешней среды, так и для последующего культивирования вирусов в лаборатории. Этот метод широко применяется для идентификации вирусов и антител, а также для приготовления вакцин и диагностикумов. Практика применения показала ряд преимуществ этого метода перед культивированием вирусов на лабораторных животных. Известно, что белые мыши, которых широко используют при вирусологических исследованиях, могут быть спонтанно заражены рядом вирусных инфекций: эктромелией, лимфоцитарным хориоменингитом, энцефалитом Тейлора, вирусной пневмонией, вирусом Сендай и другими, что крайне осложняет работу и нередко приводит к ошибочным выводам при оценке получаемых результатов. Культивирование вирусов на куриных эмбрионах в значительной мере устраняет указанные выше трудности. Наряду с этим от куриного эмбриона можно получить значительно большее количество вируса, чем от лабораторных животных. Куриный эмбрион обладает большей жизнеспособностью и устойчивостью к разного рода воздействиям, неизбежным при введении исследуемого материала. При известном навыке работы с эмбрионами и соблюдении правил асептики гибель их незначительна. Наибольший отход эмбрионов бывает при введении материала в амниотическую полость и желточный мешок, но и в этих случаях она не превышает 10–15%, если соблюдены необходимые условия инкубирования.
Куриные эмбрионы как живая система вошли в вирусологическую практику в 30-х годах XX в. Их использование расширило спектр культивируемых в лабораторных условиях вирусов, позволило более успешно решать стоящие перед вирусологией задачи в связи с тем, что куриные эмбрионы имеют ряд преимуществ перед лабораторными животными: 1)скорлупа и подскорлупная оболочка надежно защищают эмбрион от бактериального заражения со стороны внешней среды; 2) важным преимуществом эмбрионов является также их высокая чувствительность к широкому спектру вирусов, что объясняется недостаточным развитием защитных механизмов; 3) куриные эмбрионы легкодоступный объект в связи с развитием широкой сети птицефабрик и инкубаториев; 4) куриные эмбрионы экономичны, не требуют ухода и кормления.
Основными недостатками являются: 1) невозможность полностью гарантировать стерильность этой живой системы, так как эмбрионы могут нести в своем содержимом вирусы и другие патогенные агенты (вирусы инфекционного бронхита кур, ньюкаслской болезни, гриппа, лейкоза, хламидии и микоплазмы). Их присутствие может искажать результаты исследования; 2) куриные эмбрионы чувствительны не ко всем вирусам.
7.2 Цели использования куриных эмбрионов. Используют куриные эмбрионы в вирусологии в основном для тех же целей, что и лабораторных животных, а именно:
– обнаружения в патматериале активного вируса биопробой;
– первичного выделения вируса. Эффективно выделяют и культивируют на куриных эмбрионах вирусы, вызывающие заболевания у птиц, а также некоторые вирусы млекопитающих;
– поддержания вирусов в лаборатории;
– накопления вируса для лабораторных исследований и получения вакцин;
– как тест-объект в реакции нейтрализации.
7.3 Требования к куриным эмбрионам. Яйца необходимо получать из благополучных по вирусным болезням хозяйств. В оплодотворенных яйцах даже от клинически здоровых кур могут находиться различные встречающиеся у этих птиц вирусы: ньюкаслской болезни, инфекционного бронхита, инфекционного ларинготрахеита, энцефаломиелита, парагриппа-2, полиартрита, оспы, арбовирусы, аденовирусы и др. Присутствие этих вирусов может, с одной стороны, привести к диагностическим ошибкам, а с другой, на основе явления интерференции, – к подавлению размножения вируса, находящегося в исследуемой пробе. Эмбрионы, не содержащие вируса, но полученные от кур, бессимптомно зараженных определенными вирусами, также могут быть менее чувствительны или абсолютно нечувствительны к действию данного вируса благодаря наличию специфических антител, полученных от матери с желтком. Для удачного выделения вируса необходимо, чтобы куры, эмбрионы которых используют в работе, не были вакцинированы против болезни, возбудителя которой ищут. Скорлупа яиц должна быть непигментированной, чистой (мыть нельзя). Возраст эмбриона должен соответствовать избранному методу заражения.
Для обеспечения нормального развития зародышей в оплодотворенных яйцах в период инкубации необходимо соблюдать определенную температуру и влажность. Развивающиеся эмбрионы переносят перегрев значительно хуже, чем охлаждение. Поэтому кратковременная (в течение нескольких часов) поломка в системе обогрева не приносит большого вреда. При более длительном перерыве необходим подогрев.
Инкубируемые яйца нуждаются в свободном доступе свежего воздуха, который поступает через отдушины. Они должны быть всегда открытыми. Одно яйцо, как принято считать, расходует 1 л кислорода в день, что неудивительно, если вспомнить о бурном развитии зародыша в течение 21 дня инкубации. Именно поэтому яйца нельзя класть вплотную, а также одно на другое. Для инкубации яиц непригодны обычные термостаты. Лишь в случае крайней необходимости их можно использовать для этих целей, но при этом часто проветривать и поставить внутрь сосуд с водой для обеспечения требуемой влажности.
Заложенные на инкубацию яйца через 3–5 дней просвечивают с помощью специальной настольной или ручной (если яйца не вынимают из лотка инкубатора) лампы, чтобы отобрать неоплодотворенные. Наиболее удобны для вирусологических работ яйца леггорнов, так как их тонкая белая скорлупа позволяет лучше рассмотреть содержимое. Неоплодотворенные или содержащие погибших зародышей яйца из инкубатора удаляют. Доля оплодотворенных яиц колеблется в значительных пределах в зависимости от многих факторов, в том числе от времени года: весной она самая высокая, зимой самая низкая.
Второй раз зародыши просвечивают в день запланированного заражения. Срок этот зависит от вида вируса, а также пути его введения. На скорлупе обычным (не чернильным) карандашом отмечают место заражения.
7.4 Строение куриного эмбриона. Обычно курица откладывает оплодотворенное яйцо, в котором зародыш находится на стадии бластулы или ранней гаструлы. При нагревании яйца до температуры, близкой к температуре тела курицы, происходит дальнейшее развитие зародыша (рис. 14). В период с 5-го по 12-й день инкубации куриные эмбрионы могут быть использованы для заражения вирусами.
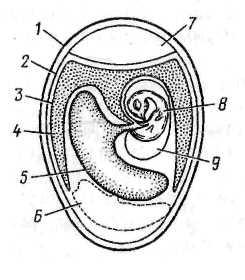
Яйцо с развивающимся куриным эмбрионом покрыто снаружи твердой пористой скорлупой, к которой плотно прилегает подскорлупная оболочка. Последняя в тупом конце яйца разделяется на два листка, между которыми образуется воздушная камера. Тело зародыша лежит в яйце эксцентрично, спиной ближе к скорлупе, голова направлена в сторону воздушной камеры. Зародыш погружен в околоплодную жидкость, заполняющую амниотическую полость, и пуповиной связан с желтком. Желток также располагается эксцентрично и относительно зародыша как бы по другую сторону продольной оси.
Непосредственно под подскорлупной оболочкой находится аллантоисная полость, покрывающая амнион и желточный мешок, а к 10-11-му дню замыкающаяся в остром конце яйца. В процессе развития аллантоисная оболочка срастается с хорионом, образуя единую хорионаллантоисную оболочку (ХАО). В остром конце яйца находится остаток белка.
Заражение в ту или другую часть эмбриона проводится в период ее максимального развития, когда количество чувствительных клеток будет наибольшим.
В процессе инкубации меняются размеры зародышевых структур, что во многом объясняется их функциональным назначением и определяет оптимальный для заражения возраст эмбриона.
Так, желточный мешок как резервуар питательных веществ имеет наибольший объем в начале инкубации, а затем (после 12-го дня) по мере развития зародыша он уменьшается. Заражают в желточный мешок с 5-го по 7-й день инкубации.
Амниотическая полость, являясь буферной средой развития зародыша, покрывает его уже на 5-й день инкубации. Среднее количество жидкости к середине периода инкубации составляет около 1 мл.
Для заражения в амниотическую полость используют эмбрионы в возрасте 6-10 дней.
Аллантоисная полость служит для сбора продуктов обмена, в ней скапливаются мочекислые соли, фосфорные и азотистые соединения. В процессе роста и развития зародыша аллантоисная жидкость приобретает кислую реакцию. Максимальных размеров аллантоисная полость достигает на 9-12-й день развития эмбриона, поэтому заражение в аллантоисную полость проводят преимущественно на 9-11-й день инкубации.
Хорионаллантоисная оболочка богата кровеносными сосудами, которые, тесно прилегая к внутренней поверхности пористой скорлупы, насыщаются кислородом и снабжают им тело зародыша, выполняя функцию органа дыхания эмбриона. Максимального развития ХАО достигает на 11-13-й день. Заражение на хорионаллантоисную оболочку проводят на 10-12-й день инкубации.
7.5 Подготовка куриных эмбрионов к заражению. Эмбрионы доставляют из инкубатория, не допуская их охлаждения в пути. В лаборатории эмбрионы инкубируют в термостате при температуре 37 °С и влажности 60-70 %, что достигается установлением в термостате открытых широкогорлых сосудов с водой. Вентиляционные отверстия термостата должны быть открыты. Эмбрионы размещают воздушной камерой вверх в специальных штативах. Рекомендуется до момента заражения дать возможность эмбрионам в течение суток адаптироваться к новым условиям и нормализовать свои функции после транспортного стресса. Если лаборатория располагает собственным инкубаторием, то снесенные курицей оплодотворенные яйца пригодны для закладки в него в течение 10 дней.
Подготовка куриных эмбрионов к заражению включает овоскопирование и дезинфекцию скорлупы, а также соответствующую подготовку рабочего места. Овоскопирование представляет собой просмотр яиц против достаточно яркого источника света (овоскоп), в результате чего на неосвещенной стороне скорлупы образуются тени от внутренних структур (рис. 15). Овоскопирование проводят в затемненном помещении. При этом на скорлупе графитным карандашом отмечают границу воздушной камеры, место расположения зародыша и участок бессосудистой зоны размером 0,5x0,5 см. Эти отметки служат ориентиром при выборе места введения вируссодержащего материала. При овоскопировании также определяют, жив зародыш или погиб. Зародышей, проявляющих активные движения при хорошей кровенаполненности сосудов ХАО, считают живыми.
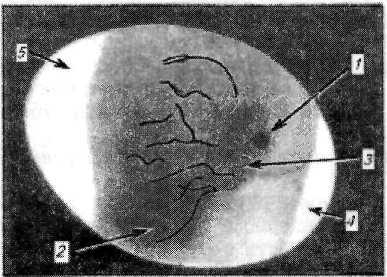
Рисунок 15. Овоскопирование куриного эмбриона на 10-е сутки инкубации. Видны тени:
1 – зародыша; 2 – желточного мешка; 3 – кровеносных сосудов ХАО; 4 – воздушной камеры; 5 – белка
Куриные эмбрионы заражают в асептических условиях (лучше в боксе). В предбокснике скорлупу эмбрионов обрабатывают йодированным спиртом, затем уже в боксе повторно протирают, а иногда еще и фламбируют – обрабатывают пламенем смоченного спиртом тампона.
Эмбрионы фиксируют в специальных подставках, установленных в эмалированной кювете на 3–4-слойной марлевой салфетке, смоченной дезинфицирующим раствором.
В работе используют инструменты, стерилизованные кипячением. Их ставят в баночку со спиртом и обжигают пламенем горелки перед каждым повторным использованием.
Демонстрация: а) клинических признаков заболевания у зараженных лабораторных животных; б) методов умерщвления лабораторных животных; в) техники вскрытия (обращают внимание студентов на состояние внутренних органов) и приемов получения вируссодержащего материала; г) техники изготовления отпечатков мозга; д) действий по обеззараживанию рабочего места и трупа после вскрытия зараженного животного.
Самостоятельная работа студентов: а) распознавание по цветной метке зараженных каждым из студентов мышей, анализ их клинического состояния, умерщвление, фиксация в кювете с восковым (парафиновым) дном, вскрытие; б) анализ патологоанатомических изменений, получение вируссодержащего материала (паренхиматозных органов), приготовление послойных отпечатков мозга
1.Изучить строение куриного эмбриона.
2.Провести овоскопию куриного эмбриона, определить его жизнеспособность и отметить границы теней естественных образований.
3. Подготовить куриные эмбрионы к заражению.
Самостоятельная работа студентов
Студенты проводят овоскопию куриного эмбриона, определяют его жизнеспособность и отмечают границы теней естественных образований.
факторы роста. Клетки чрезвычайно чувствительны к изменению рН среды. Для контроля рН в среды добавляют индикатор. Большинство клеточных:, культур растет в виде монослоя (пласта, состоящего из одного слоя клетк), прочно прикрепляясь к поверхности контейнера для культивирования — пробирки, пластикового планшета или матрас) (флакон 4-гранной формы). Некоторые типы клеток способы расти также в суспензии.
Приготовление первичной культты клеток включает несколько последовательных этапов: измельчение ткани, разъединение клеток путем трипспозиции отмывание полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост (например, среде 199 с добавлением телячьей сыворотки крови). При оседании клетки довольно прочно прикрепляются к стенке пробирки или флакона, по которой распространяются в виде Монослоя. После получения монослоя жизнеспособной культуры клеток ее заражают материалом, содержащим вирусы. Упомянутые микробы проникают внутрь клеток, где и размножаются. В культурах клеток удается культивировать большинство вирусов, вызывающих заболевания человека.
Внутриклеточные паразиты оказывают цитопатическое действие (ЦПД) на клетки, в которых происходит их репродукция. ЦПД может проявляться деструкцией (лизисом) зараженных клеток, изменением их морфологии (изменением размеров и формы самой клетки, появлением вакуолей или включений, представляющих собой внутриклеточные скопления вирусов, образованием ощцития) и нарушением их функций.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Они пригодны для некоторых вирусов, патогенных для человека.
Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а. также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие большого количеству белков и других соединений, затрудняющих последующую очистку возбудителя при изготовлении различных препаратор
Для заражения куриных эмбрионов исследуемый материал вводят в аллантоисную и амниотическую полости, на хорион-аллантоисную оболочку или в желточный мешок куриного эмбриона (рис.). Для заражения в аллантоисную полость в скорлупе над воздушной камерой (границы ее заранее обводят карандашом при просвечивании яйца) проделывают небольшое отверстие с помощью ножниц, скальпеля или специального буравчика. Шприцем вводят 0,1—0,2 мл вируссодержащего материала на глубину 2—3 мм ниже границы воздушной камеры. Отверстие в скорлупе заливают расплавленным парафином. Вскрытие зараженных эмбрионов производят в сроки максимального накопления вируса (через 48—72 ч инкубации при 37 °С). После обработки спиртом и 2 % раствором йода скорлупу рассекают ножницами немного выше очерченной карандашом границы воздушной камеры, наклоняя яйцо так, чтобы избежать попадания скорлупы в полость. Скорлупу отбрасывают, осторожно снимают ее оболочку и рассматривают хорион-аллантоисную оболочку вокруг места заражения, отмечая наличие или отсутствие очагов поражения — геморрагии, бляшек и др. Затем пастеровской пипеткой прокалывают хорион-аллантоисную оболочку в участке, свободном от сосудов, и отсасывают аллантоисную жидкость. После этого извлекают хорион-аллантоисную оболочку, дважды промывают ее изотоническим раствором хлорида натрия, помещают в чашку Петри и отмечают на черном фоне наличие специфических поражений.
Лабораторные животные. Видовая чувствительность животных, их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки к вирусам Коксаки). Преимущество метода культивирования облигатных внутриклеточных паразитов в организме лабораторных животных перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре клеток или эмбрионе. К его недостаткам относятся высокая вероятность контаминации организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой культуры данного вируса, что увеличивает сроки исследования.

Методы индикации вирусов. Для демонстрации присутствия вируса в клеточной культуре используют несколько методов.
I. О размножении (репродукции) вирусов в культуре клеток судят по цитопаттескому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток.
а) Часть таких клеток погибает и отслаивается от стенок пробирки. б)Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки.
Характер ЦПД, вызванного разными вирусами, неодинаков. При репродукции одних вирусов (парамиксовиру-сы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) — сморщивание и деструкция клеток, третьих (аденовирусы) — агрегация клеток. ЦПД вирусов оценивают в динамике, просматривая культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. Некоторые вирусы (энтеровирусы, герпесвирусы) вызывают ЦПД в течение 1—2 сут, другие — в более поздние сроки (на 4^-6-й день). Характер ЦПД используют как для обнаружения вирусов (индикации), так и ориентировочной идентификации, т.е. определения их видовой принадлежности.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Форма включений различна, а размеры колеблются от 0,25 до 25 мкм. Они представляют собой места скопления вирусных частиц и могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных флюорохромами. В последнем случае используют люминесцентную микроскопию.
Для исследования морфологии контаминированных клеток используют специальный инвертированный микроскоп, у которого осветитель располагается сверху, а объективы — снизу от предметного столика. С помощью такого прибора можно оценивать морфологию клеток, растущих в виде монослоя на поверхности контейнера для культивирования. Морфологические изменения клеток выявляют при микроскопическом исследовании культуры с помощью объектива 8х или 40х. При сравнении клеточного монослоя, инфицированного вирусом, с незараженными клетками в контрольной пробе отмечают полное или островковое разрушение пласта клеток либо другие изменения, которые характеризуют ЦПД вируса. Для более детального изучения ЦПД в контейнер для культивирования помещают покровное стекло, на котором образуется монослой. В дальнейшем стекло извлекают, зараженные клетки фиксируют и готовят микроскопический препарат, который окрашивают флюорохромами и т.д.) и изучают иммерсионным методом.
ЦПД вирусов можно также продемонстрировать с помощью "цветной пробы": метаболически активные клетки культуры в ходе жизнедеятельности выделяют кислые продукты, что вызывает изменение цвета индикатора, присутствующего в культуральной среде. При репродукции вируса клетки утрачивают способность к метаболизму и погибают, поэтому окраска среды с течением времени не меняется.
II. Реакцию гемадсорбции применяют для индикации гемаг-глютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
III. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Гемагглютинацию — "склеивание" эритроцитов разных видов животных (кур, гусей, морских свинок) — вызывают вирусы, содержащие в оболочке гемагглютинин.Для постановки реакции гемагглютинации к исследуемому материалу добавляют взвесь эритроцитов. В присутствии вирусов происходит агглютинация эритроцитов.
После вскрытия куриного эмбриона аллантоисную жидкость отсасывают и разливают по 0,5 мл в пробирки или лунки плексигласовой пластины (для контроля берут 0,5 мл такой же жидкости незараженного эмбриона). Затем добавляют по 0,2 мл 1 % суспензии отмытых куриных эритроцитов и выдерживают при комнатной температуре. Результаты реакции учитывают через 40 мин после оседания эритроцитов: (++++) — выраженная гемагглютинация — тонкая пленка склеившихся эритроцитов на дне пробирки, имеющая вид зонтика, (+++) — наличие просветов в пленке, (++) — наличие пленки с фестончатыми краями из склеившихся эритроцитов, (+) — хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов, (—) — резко очерченный осадок эритроцитов, неотличимый от контроля. Наличие гемагглютинации в опытных пробирках при ее отсутствии в контрольных указывает на содержание вируса в исследуемой жидкости. Для определения титра РГА ставят реакцию с разведениями вируссодержащей жидкости 10" 1 , 10~ 2 , 10~ 3 и т.д. За титр РГА принимают максимальное разведение, при котором наблюдается гемагглютинация (++). Титр РГА характеризует активность вируса и используется при постановке РТГА.
Для количественного обнаружения вирусных частиц используют методы титрования.Титр вируса можно определить в реакции гемагглютинации с 10-кратными разведениями культуральной среды, или материала из куриного эмбриона, или по ЦПД в культуре клеток. В последнем случае клетки культуры заражают 10-кратными разведениями материала, содержащего вирус. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических (инфекционных) доз (ИД5о)
-Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Культуру клеток заражают вирусом и покрывают тонким слоем агара. После инкубирования посевов в течение нескольких суток на поверхности агара появляются просветленные участки определенной формы (бляшки), представляющие собой участки погибших клеток в сплошном монослое культуры клеток. Каждая бляшка образуется при размножении одной вирусной частицы и хорошо заметна в виде круглого светлого участка на красном фоне клеток, прижизненно окрашенных нейтральным красным. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Размеры, морфология и сроки появления бляшек различаются не только у разных видов вирусов, но и у отдельных штаммов одного и того же вида. Перечисленные признаки используют для селекции штаммов и получения так называемых чистых линий вирусов.
Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.4). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9-10, оспо вакцины - в 12, паротита - в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
Строение куриного эмбриона и способы его заражения: 1 - в амнион; 2 - в аллантоисную полость; 3 - в желточный мешок. (Микробиология и иммунология. Под редакцией Воробьева А.А. - М. - 1999).
Самая наружная внезародышевая оболочка, примыкающая к скорлупе или материнским тканям и поэтому служащая местом обмена между зародышем и окружающей его средой, называется Хорионом. У видов, откладывающих яйца, основная функция хориона — осуществление дыхательного газообмена. У млекопитающих хорион участвует в дыхании и питании, выделении, фильтрации и синтезе веществ. У примитивных организмов хорион – вторичная оболочка, а у продвинутых – оболочка плода. Полость между хорионом и амнионом – хорионамниотическая.
Амнион (греч. Amnion), Амниотический мешок или Водная оболочка — одна из зародышевых оболочек у эмбрионов пресмыкающихся, птиц, млекопитающих.
Аллантоис (от греч. allantoeid?s — колбасовидный) — эмбриональный орган дыхания высших позвоночных животных; зародышевая оболочка, развивающаяся из задней кишки эмбриона. Кроме того, аллантоис участвует в газообмене зародыша с окружающей средой и выделении жидких отходов. Аллантоис, вкупе с другими эмбриональными оболочками — амнионом и хорионом, является определящим признаком высших позвоночных животных — млекопитающих, птиц и рептилий.
У яйцекладущих птиц и рептилий аллантоис развивается вокруг эмбриона вдоль стенок скорлупы. В своём внешнем слое, называемым мезодермой, он создаёт разветвлённую сеть кровеносных сосудов, с помощью которых происходит взаимодействие с внешней средой. У млекопитающих аллантоис входит в состав пуповины.
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка.
На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05 - 0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 часов инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).

Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5 - 10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
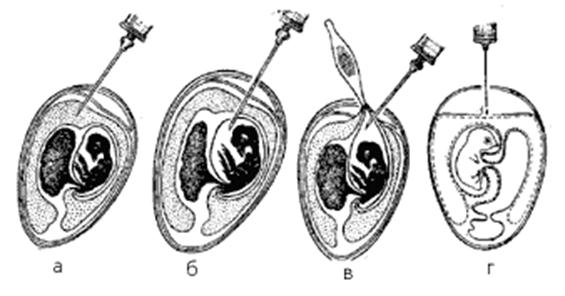
Куриный эмбрион, инфицированный вирусным материалом, ставят в инкубатор на 2-3 дня, в зависимости от характера внесенного вируса. Для развития вирусов из проб, взятых у больного (например, смывов из носоглотки, использующихся при диагностировании гриппа), куриный эмбрион представляет хорошую среду. По типу изменений, скажем в тканях хорионаллантоисной оболочки, можно непосредственно определить, с каким вирусом мы имеем дело. Очень характерные изменения дают вирусы оспы и герпеса. Некоторые вирусы очень интенсивно размножаются в различных тканях куриного эмбриона и дают исходный материал для приготовления вирусных антигенов, необходимых при лабораторной диагностике вирусных заболеваний. Вирусы, размноженные в курином эмбрионе, были использованы как исходный материал для получения восемнадцати видов прививочных вакцин.
Читайте также:

