Методы обнаружения вирусов на культуре клеток
Обновлено: 24.04.2024
Для выявления (индикации) вирусов применяются следующие методы.
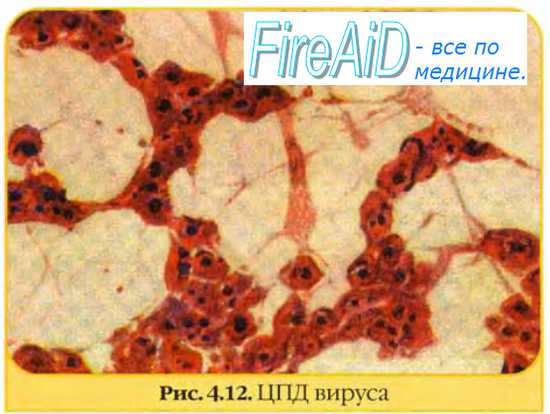
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла. Частичная дегенерация культур клеток может протекать по следующим типам:
гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х200
Индикация вирусов с помощью реакции гемадсорбции (РГад). Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе. Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям. Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому- Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявление вирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).

Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах. Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри.
При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов -поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке. Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
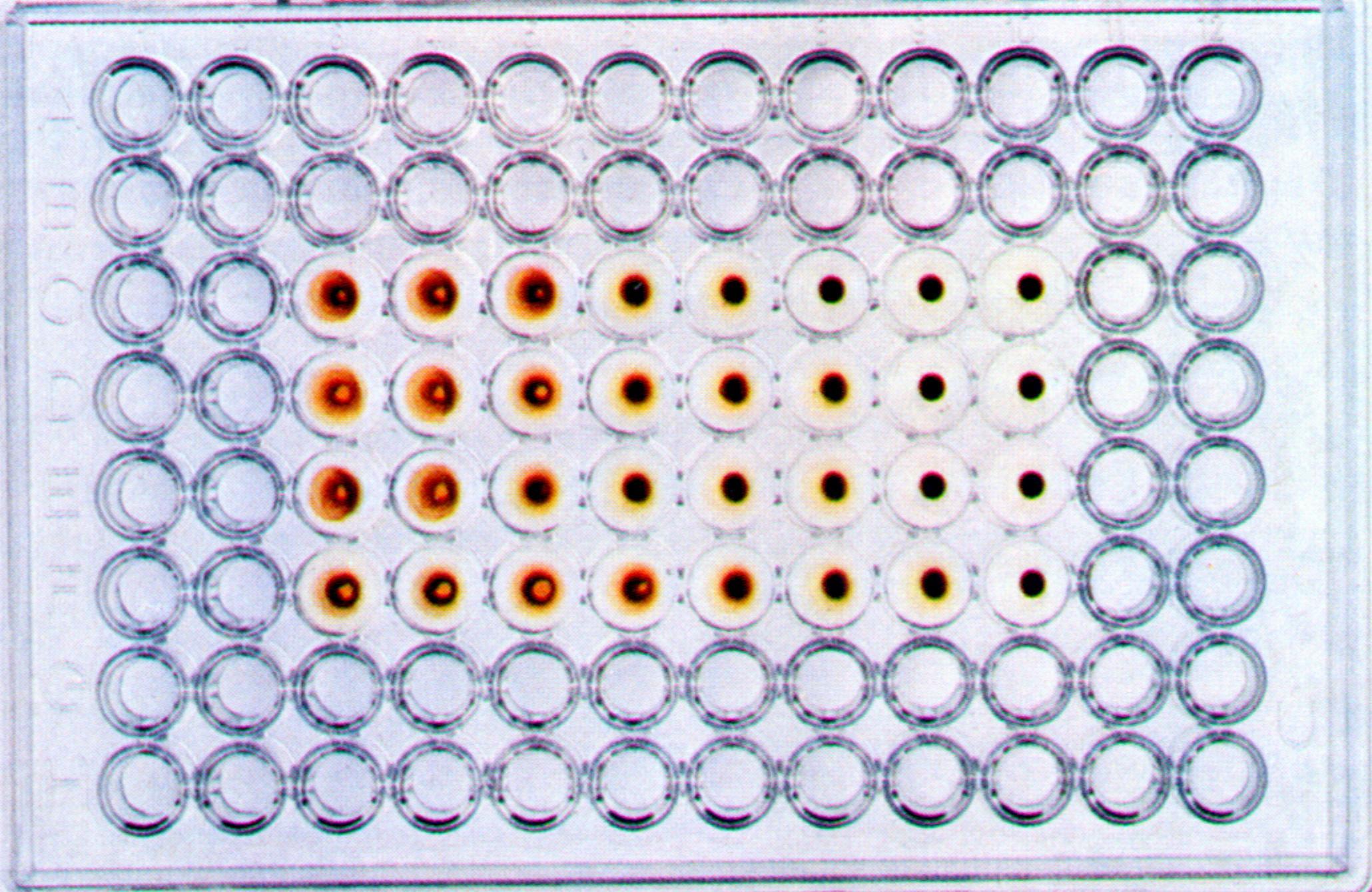
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
ИФА. В настоящее время уже появились коммерческие наборы для выявления Аг некоторых возбудителей, позволяющие их идентифицировать в течение 5-10 мин. Для выявления Аг на твёрдой фазе сорбируют известные AT и добавляют сыворотку, содержащую Аг; после инкубирования несвязанный Аг декантируют, систему промывают и вносят меченые AT, специфичные к сорбированным AT. Повторяют процедуру инкубирования и отмывания, вносят хромогенный субстрат, положительный результат фиксируют при изменении окраски системы.
Гибридизация ДНК — высокоспецифичный метод, позволяющий идентифицировать геном вируса после его гибридизации комплементарными молекулами ДНК. В качестве маркёра применяют ферменты и изотопы. Метод определяет способность вирусной ДНК гибридизиро-ваться с меченой комплементарной ДНК; специфичность метода прямо пропорциональна длине комплементарной цепочки. Перспективен метод гибридизации нуклеиновых кислот in situ. Для постановки реакции меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпстайна-Барр и др.
ПЦР. Метод значительно увеличивает чувствительность метода гибридизации, повышая содержание вирусной ДНК в материале, полученном от больного, а также ускоряет время получения результата.
Методы диагностики микозов ( грибковых заболеваний )
Микроскопия — один из основных методов выявления возбудителей микозов. Позволяет проводить экспресс-диагностику микозов и получать результат в течение 1—2 ч, тогда как для выделении культуры возбудителя необходимы недели. Для экспресс-диагностики препараты часто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
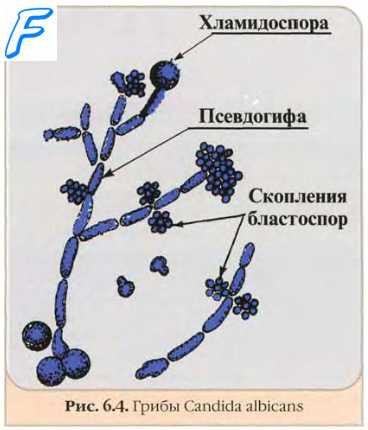
Неокрашенные препараты грибов
Микроскопия методом висячей или раздавленной капли. Метод позволяет выявить структуры грибов в клинических образцах без предварительного окрашивания.
Обработка 10% едким калием (КОН). Метод используют в первую очередь для визуализации структур возбудителей в фрагментах кожи и её придатках (ногти, волосы), отделяемом очагов поражения и влагалища. В указанных образцах содержится большое количество клеток, в которых КОН разрушает кератин, оставляя неизменёнными клетки грибов.
Окрашенные препараты грибов. Окраска мазка грибов.
• Окраска мазка грибов по Граму. В мазках из клинического материала грибы представлены грамположительными клетками. Клетки Cryptococcus neoformans плохо воспринимают красители, что можно использовать как дифференциально-диагностический признак при микроскопии окрашенных мазков СМЖ.
• Окраска мазка грибов нигрозином или тушью по Бурри мазков СМЖ позволяет выявить капсулированные клетки Cryptococcus neoformans. Для идентификации этого микроорганизма можно использовать муцикармин или конго красный.
• Окраска мазка грибов по Романовскому-Гимзе или Райту мазков крови и костного мозга позволяет выявить дрожжевую форму Histoplasma capsulatum в цитоплазме фагоцитов.
• Окраска мазка грибов метенаминовым серебряным по Гомори. Метод включает предварительную обработку гистологических препаратов хромовой кислотой с последующим нанесением красителя (клетки грибов тёмно-серые или чёрные).
• Окраска мазка грибов по Гридли. Метод включает предварительную обработку препаратов хроматом лейко-фуксина с последующим нанесением фуксинового альдегида и метанилового жёлтого (клетки грибов розово-пурпурные на жёлтом фоне).
• Окрашивание перйодной кислотой и реактивом Шиффа (по Мак-Манусу). 1,2-Гликольные группировки полисахаридов клеточных стенок грибов сначала окисляются перйодной кислотой до альдегидов, реагирующих с сульфитом лейкофуксина реактива Шйффа; клетки окрашиваются в насыщенно розовый или красный цвет.
Иммунофлюоресцентная микроскопия грибов
Наибольшее распространение нашла РИФ. Применяют AT, меченные флюоресцеинами; для выявления грибковых Аг реагент наносят на гистологический препарат, инкубируют и проводят люминесцентную микроскопию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Животные модели для обнаружения вирусов. Идентификация вирусов. Качественное определение вирусов. Цитопатические эффекты вирусов. Бляшкообразование вируса. Тельца включений вирусов.
При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях. j
Идентификация вирусов
Цитопатические эффекты вирусов оценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью. Размножение вирусов в культурах клеток сопровождается нарушениями морфологии клеток монослоя. Некоторые вирусы вызывают характерные цитопатические изменения, что (с учётом клинической картины заболевания) позволяет быстро поставить предварительный диагноз. Например, размножение парамиксовирусов (вирусы кори, паротита, PC-вирус) сопровождается появлением характерных гигантских многоядерных клеток; аденовирусы вызывают образование скоплений больших круглых клеток, а при репродукции герпесвирусов клетки округлой формы диффузно располагаются по всему монослою.
Бляшкообразование вирусов
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1. Методика получения первично трипсинизированных культур клеток по методу Дюльбекко и Фогт.
2. Сущность трипсинизации, техника проведения.
3. Для чего посуду закрывают резиновыми пробками.
Цель занятия: ознакомление с методикой заражения клеточных культур вируса. Изучение методов индикации вирусов в культурах клеток.
Оборудование и материалы: микроскопы, культуры клеток с предыдущего занятия, фиксированные культуры клеток, фотографии, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
12.1 Подбор культур клеток. Не всякая клетка чувствительна к любому вирусу. Вирус к первичной культуре обычно успешно адаптируется при условии, если культура получена из органов животного, естественно восприимчивого к данному вирусу. Однако адаптация вируса к перевиваемым клеткам более сложна, а в ряде случаев неосуществима. Для культивирования некоторых вирусов до сих пор неизвестно ни одной клеточной системы. Для культивирования вируса используют обычно молодые клетки, т. е. в первый день формирования монослоя, а в некоторых случаях (для парвовирусов свиней) клетки заражают при их посеве, так как вирус интенсивно размножается при наличии делящихся клеток (когда они находятся в стадии логарифмического роста).
12.2 Заражение клеток. Для этого отбирают пробирки (или матрасы) со сплошным клеточным монослоем, просматривая их под малым увеличением микроскопа. Ростовую питательную среду сливают, клетки 1–2 раза промывают раствором Хенкса, чтобы удалить сывороточные антитела и ингибиторы. В каждую пробирку вносят по 0,1–0,2 мл вируссодержащего материала и покачиванием распределяют его равномерно по слою клеток. В таком виде пробирки (матрасы) оставляют от 1 до 2 ч при 22 или 37 °С для адсорбции вируса на поверхности клеток. Затем вируссодержащий материал удаляют из пробирок (матрасов) и наливают поддерживающую среду (в пробирку 1–2 мл, в матрасы около 10 % его объема). При выделении вируса из патологического материала некоторые пробы (фекалий и др.) могут оказывать токсическое действие на клетки, поэтому после адсорбции вируса монослой клеток отмывают 1–2 раза раствором Хенкса (или питательной средой) и затем наливают поддерживающую среду.
Все пробирки выдерживают монослоем вниз 1-2 часа при комнатной температуре (для адсорбции вирусов на клетках).
12.3 Культивирование вируса. Пробирки (матрасы) закрывают герметически резиновыми пробками и ставят на инкубацию в термостат при 37 °С. Наиболее широко применяют стационарное инкубирование. При этом матрасы кладут в горизонтальном положении, пробирки – под углом 5° так, чтобы монослой клеток оказался под питательной средой (чертой вверх). В ряде лабораторий зараженные культуры клеток инкубируют на вращающейся системе – роллерах. Используя этот метод, удается получать большой выход вируса, имеющего более высокий инфекционный титр, чем при стационарном культивировании.
На следующий день заменяют питательную среду. При необходимости ставят контроль на токсичность вируссодержащей суспензии.
Для каждой пробы материала обычно используют не менее 4–10 пробирок с культурой клеток. Для контроля оставляют 4–6 пробирок с незараженной культурой клеток, в которых заменяют ростовую среду на поддерживающую.
В культурах клеток, зараженных вирусом, питательную среду можно не менять в течение 7 дней, а рН среды (6,9–7,4) поддерживать с помощью 7,5%-ного раствора бикарбоната натрия. При более длительном культивировании инфицированных клеток (аденовирусы и др.) среду меняют.
Все пробирки (матрасы) после заражения клеток ежедневно исследуют под малым увеличением микроскопа, сравнивая культуры клеток, зараженные вирусом, с контрольными.
В термостате адсорбировавшиеся на клетках вирусные частицы проникают внутрь их и начинается их репродукция. Новые вирусные частицы покидают (полностью или частично) клетки, в которых они образовались, проникают в непораженные клетки, репродуцируются в них, переходят в новые клетки и поражают их. Так продолжается до тех пор, пока есть живые неповрежденные клетки. В результате этого процесса практически все клетки в матрасе или пробирке поражаются вирусом, хотя абсолютно все почти никогда не поражаются.

Вирус накапливается в основном в культуральном жидкости, но часть вирионов может оставаться и внутри не разрушенных вирусом клеток. Чтобы оставшийся в клетках вирус освободить, клетки тщательно разрушают или многократным замораживанием – оттаиванием (2–3 раза), или с помощью ультразвука.
12.4 Индикация (обнаружение) вируса в культуре клеток. Существуют следующие основные методы индикации вируса в культуре клеток: по цитопатическому эффекту или цитопатическому действию (ЦПЭ, ЦПД); по положительной реакции гемадсорбции (РГАд); по образованию бляшек; по обнаружению внутриклеточных включений; по выявлению вирусов в реакции иммунофлуоресценции (РИФ); по обнаружению интерференции вирусов; по подавлению метаболизма клеток (цветная проба); электронной микроскопией и др.
ЦПД. Наиболее широко и часто о размножении вируса в культуре клеток судят по цитопатическому эффекту или цитопатическому действию. ЦПД называются любые изменения клеток в культуре клеток под влиянием размножающегося в них вируса. Физиологические изменения клеток установить довольно сложно, а морфологические изменения обнаруживаются довольно легко. Для этого достаточно положить на предметный столик микроскопа пробирку или матрас слоем клеток вверх и, используя малое увеличение (объектив х8–10, окуляр х7–10), осмотреть слой. Полезно сравнить клетки, зараженные вирусом, с такими же клетками в пробирке, не подвергавшимися заражению. В этом случае практически любые наблюдаемые в микроскоп отличия зараженной культуры клеток от контрольной можно считать проявлением ЦПД. Эти отличия могут захватывать весь монослой или отмечаться только в виде небольших очажков измененных клеток в слое нормальных клеток. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом. Хотя общепринятой системы оценки интенсивности ЦПД нет, ее часто оценивают в крестах или баллах. Так, если изменению (по сравнению с контролем) подвергся весь монослой в пробирке или матрасе, ЦПД оценивают на четыре креста, если 3 /4– на три, если 1 /2– на два креста, 1 /4– на один крест. Но эти оценки весьма условны.
Наиболее существенно различаются между собой три формы ЦПД: фрагментация клеток, округление клеток, симпластообразование.
Фрагментация – разрушение клеток на отдельные фрагменты, которые отделяются от стекла и переходят в культуральную жидкость в виде клеточного детрита (вирус везикулярного стоматита).
Округление – потеря клетками способности прикрепляться к стеклу, вследствие чего клетки, обычно распластанные по стеклу, принимают шаровидную форму, отделяются от стекла и свободно плавают в культуральном жидкости, где и погибают (энтеровирусы, аденовирусы и др.).
Симпластообразование – растворение клеточных оболочек, вследствие чего цитоплазмы соседних клеток сливаются, образуя одно целое, в котором располагаются (главным образом по периферии) ядра клеток. Такие образования из цитоплазматической массы с многими клеточными ядрами называются симпластами (гигантские многоядерные клетки).
РГАд.Гемадсорбция – соединение эритроцитов с поверхностью пораженных вирусом клеток – впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатических изменений в инфицированных клетках.
Методика РГАд состоит в следующем. На 3–4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2–3 капли 0,5%-ной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5–10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной.
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
– эритроциты расположены на слое клеток очагами или скоплениями (вирус гриппа);
– эритроциты расположены на слое клеток диффузно (вирус парагриппа).
Каждый вирус способен адсорбировать эритроциты крови животных определенных видов.
Самостоятельная работа студентов.
1) Студенты проводят микроскопию клеточных культур (живая культура клеток, фиксированная).
2) Изучают методы обнаружения вирусов в зараженных клеточных культурах (по ЦПД, по гемадсорбции эритроцитов на монослое, по обнаружению бляшек, по обнаружению телец-включений).
Метод образования бляшек.Этот метод обнаружения вирусов технически сложнее других и применяется главным образом для титрования вирусов.
Дальбекко и Фогт в 1954 г. впервые предложили методику получения бляшек под агаром в культуре куриных фибробластов с вирусом западного лошадиного энцефаломиелита. В последующие годы многие авторы с успехом применяли этот метод при изучении различных вирусов – ящура, везикулярного стоматита, ньюкаслской болезни, чумы птиц, полиомиелита, Коксаки и др. Метод бляшек стали широко применять в вирусологии для получения чистых популяций вируса, особенно при изучении их генетических свойств. Методику получения бляшек, предложенную Дальбекко и Фогт, модифицировали, и в настоящее время есть целый ряд отличных друг от друга методов, связанных с изучением различных вирусов.
Метод бляшек основан на образовании вирусом в однослойных культурах, залитых агаровой средой, содержащей витальный краситель – нейтральрот, негативных колоний или бляшек.
Бляшки представляют собой обесцвеченные участки культуры, состоящие из погибших под действием вируса клеток. Кроме агара в целях предотвращения переноса вируса на другие места можно использовать крахмал и метилцеллюлозу. Некоторые вирусы дают бляшки без покрытия слоем агара, например вирус чумы крупного рогатого скота, осповакцины, некоторые представители вирусов герпеса и др. На клетки, промытые средой или раствором Хенкса, наносят вирус в определенных разведениях и обеспечивают контакт вируса с клетками при периодическом покачивании в точно установленный отрезок времени (1–2 ч) при 37–38 °С. Неадсорбировавшийся вирус удаляют путем промывания раствором Хенкса или отсасывают пастеровской пипеткой, затем на слой клеток наносят специальное агаровое покрытие. Выбор среды покрытия определяется видом клеток и вируса.
После застывания (30–60 мин) с поверхности агара сливают конденсированную влагу, флаконы переносят в термостат и инкубируют клетками вверх. Время инкубации и температура должны быть оптимальными для бляшкообразования, вызываемого данным вирусом. Наблюдение за появлением бляшек проводят в течение нескольких дней. За это время вирусы, адсорбировавшиеся на клетках, проникают в последние, проходят цикл репродукции, выходят из клеток и поражают соседние клетки. В сплошном слое живых клеток возникают островки мертвых, погибших вследствие репродукции в них вируса клеток. Раствор красителя окрашивает только живые клетки. Поэтому в матрасе на ровном красновато-розовом фоне появляются бесцветные пятна, которые и называются негативными пятнами Дальбекко или бляшками. Каждая бляшка соответствует островку мертвых клеток.
Цветная проба.Цветную пробу для лабораторных исследований впервые предложили Солк, Янгнер и Уорд в 1954 г. Предпосылкой для разработки данного метода явились наблюдения Эндерса, Уэллера и Роббинса, которые отметили, что в незаряженных тканевых культурах под влиянием продуктов метаболизма рН среды сдвигается в кислую сторону, что улавливается по пожелтению фенолрота, добавленного в питательную среду. В то же время жидкость в тканевых культурах, зараженных вирусом, убивающим живые клетки, сохраняла свой красный цвет.
Наиболее отчетливые результаты дают вирусы с высокой скоростью размножения при культивировании их на медленнорастущих клетках.
Так как метод цветной пробы не отличается высокой достоверностью, его в практике используют редко.
Обнаружение внутриклеточных включений.При многих вирусных заболеваниях в клетках (в цитоплазме или ядре) различных органов и тканей появляются особые образования, называемые тельцами-включениями. Их классифицируют по локализации в клетке, составу нуклеиновой кислоты, тинкториальным свойствам и гомогенности. Вирусные тельца-включения хорошо обнаруживаются в препаратах, окрашенных гематоксилин-эозином. Для этого фиксированные на покровных стеклах клетки промывают в дистиллированной воде и погружают на 5–15 мин в раствор гематоксилина (гематоксилин Майера, Эрлиха, Карацци и др.).
Обнаружение вирусов в реакции иммунофлуоресценции.В том случае, если размножение вируса в культуре клеток не сопровождается цитопатическим эффектом, гемадсорбцией, его присутствие можно обнаружить с помощью флуоресцирующих антител. Этот метод широко используют при диагностике классической чумы свиней, парвовирусной инфекции свиней и других болезней.
Обнаружение вирусов с помощью иммунопероксидазной реакции (иммуноферментного анализа).Методика изложена в специальном разделе
Обнаружение вирусов с помощью электронного микроскопа.Методика изложена в специальном разделе.
Метод, основанный на интерференции вирусов.Построен на том, что некоторые вирусы в культуре клеток снижают способность размножаться в ней других вирусов. Например, вирус чумы свиней снижает инфекционную активность вируса ящура, вирус ньюкаслской болезни – вируса везикулярного стоматита и т. д.
Читайте также:

