Методы очистки и концентрации вирусов
Обновлено: 17.04.2024
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
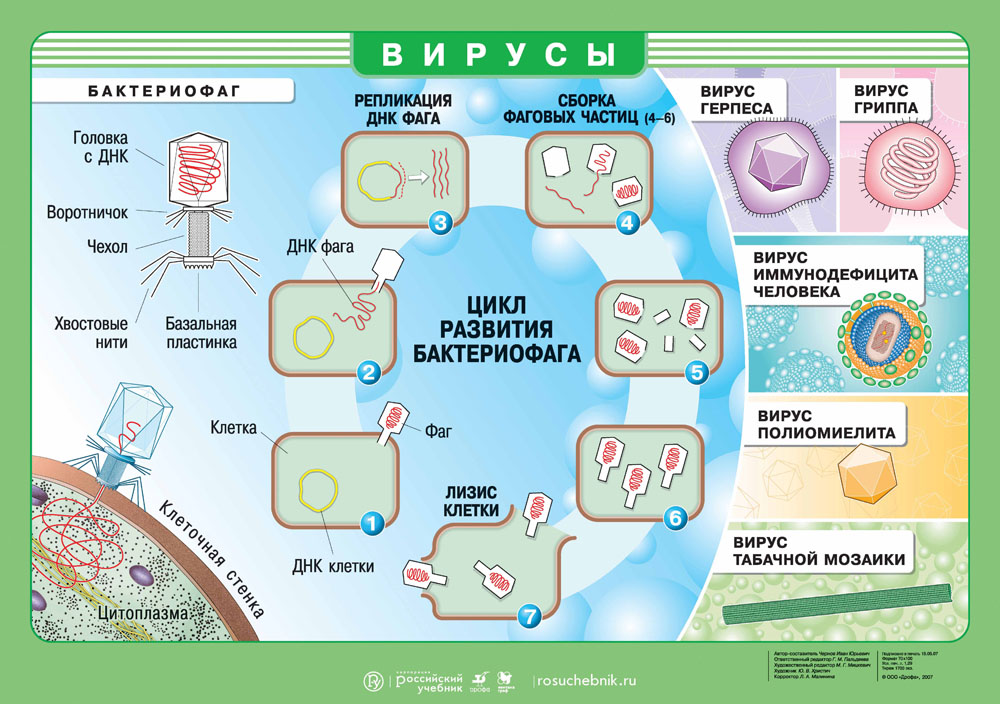
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.

В процессе репродукции вируса в клетках происходит накопление его в тканях и жидкостях организма животных, однако в вируссодержащем материале доля вируса незначительна. Поэтому при проведении вирусологических исследований иногда приходится использовать специальные методы для очистки вируса от баластных веществ (остатков тканей, разрушенных клеток, микробов и т. д.), а иногда и концентрировать вирусы.
Вложенные файлы: 1 файл
Меоды очистки вирусов.doc
Методы очистки и концентрации вирусов.
В процессе репродукции вируса в клетках происходит накопление его в тканях и жидкостях организма животных, однако в вируссодержащем материале доля вируса незначительна. Поэтому при проведении вирусологических исследований иногда приходится использовать специальные методы для очистки вируса от баластных веществ (остатков тканей, разрушенных клеток, микробов и т. д.), а иногда и концентрировать вирусы.
Очистку и концентрацию вирусов проводят с целью:
а) изучить морфологию вирусов;
б) получить очищенные антигены для серологических реакций;
в) получить высококачественные и эффективн ые вакцины.
Различают следующие методы очистки и концентрации вирусов:
I. Физические методы:
1. Термолизис. Применяется для очистки вирусов от тканевых
элементов и бактерий, широко используется в процессе подготовки
вируссодержащих суспензий из органов для вирусологических
исследований. С помощью этого метода освобождают вирусы из
клеток. Вначале готовят из органов суспензию растиранием в ступке
со стерильным песком, затем переносят в центрифужные пробирки
и несколько раз замораживают при низких температурах (-20, -
50° С) с последующими оттаиваниями при температуре 36-37° С в
термостате или при комнатной температуре. После последнего
оттаивания суспензию центрифугируют при 3-4 тыс. оборотов в
минуту 20-30 минут. Вирус будет находиться в надосадочной
жидкости. В дальнейшем из такой вируссодержащей жидкости
вирус можно концентрировать другими методами (например,
методом дифференциального центрифугирования и
ультрацентрифугированием).
2. Фильтрация вируссодержащего материала через
керамические, асбестовые и мембранные (градоколовые) фильтры.
При этом методе сначала материал фильтруют через различные бактериальные фильтры (Зейтца Шамберлана, Беркефельда) и очищают его от балластных веществ (бактерии, обрывки клеток и других частиц).
Затем фильтруют через мембранные фильтры с малыми размерами
пор. При этом вирусы остаются на фильтре (если размер пор меньше
размера вирусов). Затем фильтр измельчают или растирают с небольшим количеством стерильногофизраствора (или буфера), а затем центрифруют для осаждения частичек фильтра. Вирус будет сконцентрирован в надосадочной жидкости.
3. Дифференциальное центрифугирование. Методы центрифугирования основаны на разделении частиц по их массе. Обычно для центрифугирования используют охлажденный вируссодержащий жидкий материал и центрифуги с охлаждением. При дифференциальном
центрифугировании сначала центрифугируют материал при 3-4 тыс. оборотов в минуту 30 минут, надосадочную жидкость собирают в другую пробирку и вновь центрифугируют при более высоких оборотах (5-6 тыс.), жидкость сливают и для осаждения вируса центрифугируют уже затем при 30-60 тыс. оборотов в минуту. Осадок после этого центрифугирования ресуспендируют в небольшом количестве среды и используют в работе.
4. При центрифугировании в градиенте плотности используют разделение частиц по скорости седиментации в вязкой среде (обычно используют 20-60 % сахарозу и др.) и при этом образуются зоны, состоящие из .частиц одного типа.
5. Методы адсорбции вируса с последующей элюцией. Этот метод
основан на способности вирусов адсорбироваться, на поверхности
некоторых веществ или клеток, а в последующем удаляться
(элюировать) с сорбента при изменении условий (температуры,
рН среды и т. д.). В качестве сорбентов применяют гидроокись алюминия
гипс, некоторые бактерии (например, беспигментные штаммы
чудесной палочки), эритроциты.
В вирусологических лабораториях для очистки и концентрации
некоторых вирусов, таких как вирус гриппа в качестве сорбента используют эритроциты животных и птиц. На поверхности эритроцитов вирусы способны адсорбироваться при низкой температуре (+2, +4° С), а при повышении температуры до 37° С элюируют с поверхности эритроцитов в жидкость.
Обычно на эритроцитах адсорбируется до
95% вируса из среды, а элюирует 90-100%.
II . Химические методы
Методы осаждения вирусов химическими веществами :
I) Осаждение метанолом, который добавляют к охлажденной вирус-
содержащей жидкости при низких температурах до конечной Концентрации 35 %. Смесь оставляют на 4 часа при +4° С,
[Центрифугируют для осаждения, а затем растворяют в буферном растворе.
2) Осаждение вирусов в изоэлектрической точке.
Изоэлектрические точки большинства известных вирусов лежат в
диапозоне рН 3,5-6,5, т. к. вирусные белки в основном кислые. При этом
методе к вируссодержащей жидкости медленно при постоянном
помешивании добавляют 1 н раствор соляной кислоты при
температуре +4°С и доводят рН среды до изоэлектрической точки
данного вируса, смесь выдерживают на холоде несколько часов,
затем центрифугируют для осаждения 20-30 минут при 3-4 тыс.
оборотов, надосадочную жидкость сливают и осадок разводят в
слабощелочном буфере.
3) Осаждение солями и полиэтиленгликолем. Для осаждения вирусов обычно используют сернокислые соли магния, натрия и аммония. Наиболее широко применяется сульфат аммония.
К охлажденной вируссодержащей суспензии добавляют насыщенный раствор сернокислого аммония до определенной концентрации 35 %, а полиэтиленгликоля до концентрации 7,5 %,
перемешивают и оставляют на холоде на 16 часов, центрифугируют и осадок растворяют в фосфатном буфере.
4. Метод Ильенко: с использованием хлороформа или эфира. Метод пригоден для очистки вирусов от липидов и липоидов и применяется чаще для очистки нейротропных вирусов от мозговой ткани.
Из мозговой ткани готовят суспензию и к ней добавляют равный объем хлороформа или эфира, закрывают резиновой пробкой и тщательно встряхивают для хорошего перемешивания, выдерживают 2 часа в холодильнике при +4° С и центрифугируют 20-30 минут при 3-4 тыс. оборотов в минуту.
Если был добавлен эфир, вирус будет внизу, выше мозговая ткань и липиды, вверху эфир.
При добавлении хлороформа он будет находиться внизу, выше мозговая ткань и в верхнем слое вируссодержащая жидкость. Применяют этот метод для очистки только тех вирусов, которые являются нечувствительными к хлороформу и эфиру.
Физико-химическое изучение любого вируса, как правило, начинается с разработки метода его выделения и очистки. Обычно исходный материал представляет собой культуральную жидкость, тканевый экстракт и т.д. Во всех этих случаях вирус находится в смеси с большим количеством разнообразных балластных веществ – белков, пигментов, структурных компонентов клеток и т.п. Без удаления этих примесей невозможно проводить биохимические исследования вирусов.
Для очистки большинства вирусов с успехом применяют дифференциальное ультрацентрифугирование. Центрифугирование в градиенте плотности сахарозы делает возможным более тонкое разделение частиц, седимен- тационные свойства которых незначительно отличаются друг от друга. Методом равновесной седиментации в градиентах плотности цезиевых солей можно разделить частицы, обладающие различной плотностью.
В случае, если вирусы приходится выделять из больших объемов биологических жидкостей, прибегают к высаливанию сернокислым аммонием, осаждению органическими растворителями, осаждению в изоэлектрической точке. Наряду с этим используется ионообменная хроматография, гельфильтрация и т.д. Короче говоря, большинство методов, используемых для очистки белков, применимо и к вирусам. Однако существует и ряд специфических методов, применяемых для очистки только вполне определенных вирусов.
Например, миксовирусы можно очистить, используя их способность адсорбироваться на эритроцитах.
Общей схемы, пригодной для очистки любого вируса, в настоящее время не существует. Поскольку свойства вируса, так же как и химические свойства примесей, могут значительно варьировать у различных вируссодержащих материалов, то и выбор приемов очистки будет зависеть от каждого конкретного случая.
Высокоочищенные вирусы можно получить только благодаря применению целого ряда методов.
Идеальным методом выделения вирусов был бы тот, который обеспечил бы сохранение их биологической активности при полном разрушении клеточных компонентов и мембран. Однако такого метода нет. В зависимости от характера исходного материала и природы вируса приемы извлечения вирусов различны.
Выделение вирусов из зараженных клеток
Размалывание. Этот способ широко применяется в тех случаях, когда приходится работать с большим количеством вируссодержащего материала. Наиболее простым и почти универсальным приспособлением для размельчения нативной животной ткани является обычная или электрическая мясорубка.
Обработка ультразвуком. Очень широко используется также дезинтеграция клеток, зараженных вирусами, при помощи ультразвука. Если обрабатывать жидкость ультразвуком, то при определенной интенсивности звука (около 20 кГц/с) в среде возникает явление кавитации. Благодаря очень быстрому чередованию давления и разрежения возникает большое число крошечных воздушных пузырьков, которые, разрываясь, образуют вокруг себя область с интенсивной ударной волной. При этом возникает мгновенный жесткий локальный градиент давления, который и разрушает клетки.
На практике часто обработка ультразвуком сочетается с другими способами дезинтеграции, такими, как осмотический шок в дистиллированной воде (протопласты бактерий и грибов), многократное замораживание и оттаивание (ткани животных), гомогенизация, что значительно уменьшает время обработки ультразвуком. Последнее благоприятно сказывается на выходе инфекционных вирусных частиц, поскольку ультразвуковая обработка приводит к значительному разогреву озвучиваемой суспензий.
Концентрирование и очистка вирусов
Осаждение солями. Вирусы, подобно белкам, осаждаются из водных растворов при определенных концентрациях солей, которые разрушают взаимодействие между молекулами воды и полярными группировками оболочки вируса. Вирус агрегирует и выпадает в осадок. Наиболее часто для этого применяют сульфат аммония.
Несмотря на простоту и дешевизну, метод высаливания сульфатом аммония обладает двумя недостатками. Во-первых, он неспецифичен для вирусов, поскольку вместе с ними высаливаются и белки клетки-хозяина, во-вторых, при этой процедуре происходит деструкция некоторых вирусов.
Осаждение в изоэлектрической точке. Большинство вирусов преципитирует в кислой зоне pH, поскольку их изоэлектрические точки лежат в пределах 3,5-6,5.
Осаждение в изоэлектрической точке – наиболее простая и доступная операция из всех применяемых методов концентрирования и очистки вирусов. Однако при pH ниже 5,0 также выпадают в осадок многие белки клетки-хозяина, что ограничивает возможность применения этого метода. К тому же подобная процедура не всегда желательна при очистке некоторых лабильных вирусов.
Осаждение спиртами. При добавлении к вируссодержащей суспензии охлажденного метанола или этанола вирус преципитирует вследствие уменьшения (как и в рассмотренном выше случае обработки сульфатом аммония) степени гидратации его белковой оболочки. Оптимальная концентрация спирта для каждого вируса подбирается эмпирически. Эта величина колеблется от 15 до 35% . Процедура проводится при максимально возможных низких температурах для избежания денатурации вирусных частиц. Метанол более выгодно использовать, чем этанол, так как, применяя его, можно работать при более низких температурах.
Однако этот метод так же, как и метод высаливания сульфатом аммония, имеет недостатки. Он неспецифичен для вирусов (осаждается значительное количество балластных белков) и не может быть использован для некоторых вирусов животных, которые не устойчивы к спиртам (сложные вирусы, содержащие липопротеидные оболочки).
Обработка ферментами. Благодаря особой структурной организации вирионов, большинство вирусов, несмотря на их нуклеопротеидную природу, устойчиво к действию протеолитических ферментов и нуклеаз, в то время как клеточные нуклеиновые кислоты и белки легко разрушаются этими ферментами. Используя эту различную чувствительность вируса и клеточных примесей к ферментам, можно при помощи ферментов провести частичную очистку вирусов.
Ультрафильтрация. Метод концентрирования и очистки вирусов с помощью мембранных ультрафильтров имеет преимущества перед другими методами, как один из наиболее мягких и щадящих. Мембранные фильтры изготавливают из этерифицированной целлюлозы. Размер пор у фильтров разных типов варьирует от 0,01 до 8 мк. Фильтры устойчивы к температуре (до 125°С), к воздействию разбавленных кислот и щелочей и неполярных растворителей. В идеале, используя последовательную ультрафильтрацию через две мембраны с убывающим размером пор (одна задерживает частицы более крупные, чем вирус, а вторая – только вирус), можно получить в чистом виде любой вирус. Недостатком метода является то, что часто происходит засорение фильтра или адсорбция вируса на фильтре.
Скорость осаждения частиц, приведенная к единице центробежного ускорения (коэффициент седиментации, S), является специфической характеристикой макромолекул и выражается формулой

где х – расстояние от оси вращения, см; t – время, с; ω – угловая скорость, рад/с.
Коэффициент седиментации имеет размерность времени, так как со имеет размерность, обратную времени (радиан – величина безразмерная). Значения коэффициента седиментации для различных макромолекул имеют величины порядка 10 -14 -10 -13 с. Для удобства величина 10 -13 принята за единицу коэффициента седиментации. Эту величину обозначают S (единица Сведберга).
Коэффициент седиментации обычно зависит от концентрации изучаемого вещества. На практике бывает необходимым знать седиментационные характеристики веществ при оседании в сравнимых и идеальных условиях, т.е. условиях, когда взаимодействие между частицами отсутствует. Для этого величина коэффициента седиментации, измеренная в воде при 20°С, рассчитывается для бесконечного разведения раствора и обозначается как S°20,w – константа седиментации.
В современных ультрацентрифугах достигается скорость вращения ротора 60 000 об/мин и выше. Для частиц, находящихся на расстоянии 5-6 см от оси вращения, эта скорость соответствует центробежной силе, превышающей силу тяжести в 250 тыс. раз.
Ядра клетки оседают при 800 g, митохондрии – при 10 000 g9 а большинство вирусов – при 30 000-100 000 g за 0,5-3 ч. При низкоскоростном центрифугировании из вируссодержащей суспензии удаляются обломки клеток и их компоненты. Затем при центрифугировании над осадка при 100 000 g осаждают вирусные частицы, а основная часть белков и других низкомолекулярных соединений остается в надосадочной жидкости. Таким образом, с помощью цикла дифференциального центрифугирования удается разделить вирусную суспензию на ряд фракций, содержащих однородные по скорости седиментации частицы.
Следует отметить, что для большинства вирусов использование только одного метода дифференциального центрифугирования недостаточно, чтобы получить высо- коочищенную вирусную суспензию. Как правило, конечный препарат содержит некоторые нормальные компоненты клеток, имеющие очень близкие с вирусами седиментационные характеристики. К сожалению, многие вирусы, особенно палочкообразные, могут образовывать после центрифугирования осадки, которые затем очень трудно вновь суспензировать.
Ультрацентрифугирование в градиенте плотности. Это понятие относится к скоростному центрифугированию частиц в столбе жидкости с плотностью, увеличивающейся по направлению от оси ротора. Такой градиент плотности может быть образован с помощью, например, сахарозы, глицерина, фиколла или солей тяжелых металлов (цезия, рубидия).
Существуют две наиболее важные разновидности метода:
- метод зонального ультрацентрифугирования;
- метод изопикнического (или равновесного) ультрацентрифугирования.
Метод зонального ультрацентрифугирования для разделения частиц в зависимости от коэффициента седиментации применяется с 1953 г. При этом исследуемую суспензию наслаивают на преформированный градиент. Градиент обычно готовят пологим, и если центрифугирование продолжать длительно, то все частицы могут осесть. Поэтому центрифугирование надо прекращать до момента оседания частиц. Но вместе с тем времени должно быть достаточно для того, чтобы частицы могли мигрировать через градиент. В результате указанной процедуры в центрифужной пробирке формируются зоны, каждая из которых состоит из частиц с близкими седиментационными свойствами.
Для извлечения вируса из центрифужной пробирки содержимое ее фракционируют. Обычно это осуществляется путем прокалывания дна пробирки и последовательного сбора фракций.
Рассмотрим принцип работы самоустанавливающегося изоплотностного градиента (рис. 2.1).

Рис. 2.1. Схематическое изображение разделения двух вирусов с различной плавучей плотностью путем равновесного ультрацентрифугирования в градиенте плотности CsCl
Левую центрифужную пробирку наполняют водным раствором CsCl (р = 1,28 г/мл), в котором суспензируется некоторое количество вируса осповакцины и вируса гриппа. После центрифугирования в течение 20 ч при 41 000 об/мин молекулы CsCl концентрируются на дне пробирки, образуя градиент плотности. При этом вирионы из нижней части градиента всплывают (так как они легче, чем находящийся здесь раствор CsCl), а вирионы из верхней части градиента, наоборот, осаждаются – до зоны, которая имеет ту же плотность, что и частицы вируса. В данном случае это зоны с плотностью 1,28 г/мл (вирус осповакцины) и 1,25 г/мл (вирус гриппа).
Разрешение, достигаемое при ультрацентрифугировании в градиентах плотности CsCl и Cs2SО4, очень велико. Например, при помощи этого метода удается легко разделить частицы бактериофагов, отличающиеся друг от друга по плотности всего на 0,05 г/мл. Этому различию в плотности соответствует относительное различие в содержании ДНК порядка 1%.
Адсорбционная хроматография. Метод основан на различной степени адсорбции вирусов и примесей при фильтровании через слой твердого адсорбента. Решающее значение имеют поверхностные свойства вирусной частицы и адсорбента, а также состав буфера, в котором суспензирован вирус. При элюировании соответствующим буфером вирусные частицы могут быть отделены от примесей. В качестве адсорбентов в вирусологической практике обычно используются фосфат кальция, гидроксилапатит, фосфат алюминия, цеолит.
Хроматография на молекулярных ситах (гельфильтрация). Метод основан на способности пористых материалов разделять смесь веществ по размеру и молекулярной массе компонентов. Молекулярные сита не обладают сорбционным сродством к фракционируемым веществам. Обычно в качестве таких пористых материалов применяют гранулированные гели полисахаридов (сефадексы, агароза), полиакриламид (биогели) и пористое порошковое стекло.
Схематически процесс гельфильтрации можно представить следующим образом (рис. 2.2). Молекулы более крупные, чем размер пор в гранулах, не проникают внутрь них и поэтому движутся по колонке с жидкой фазой вне гранул. Мелкие молекулы проникают внутрь гранул и движутся относительно медленнее. Степень проникновения зависит от размера и формы молекул. Вследствие этого элюирование молекул из слоя гранул геля происходит в порядке уменьшения размера молекул. Когда из колонки элюируются все молекулы, она вновь готова к следующему эксперименту. Эта автоматическая регенерация – одно из преимуществ гельфильтрации.

Рис. 2.2. Схема фракционирования вируса и примеси на колонке с молекулярным ситом
Метод гельфильтрации нашел широкое применение в вирусологической практике, так как он наиболее безвреден для лабильных вирусов. Кроме того, он очень удобен при использовании на последней стадии очистки многих вирусов, поскольку при этом можно удалить из препаратов сульфат аммония и другие низкомолекулярные вещества (например, использующиеся для формирования градиентов плотности).
Ионообменная хроматография. Ионообменниками называют такие соединения, которые содержат фиксированные заряженные функциональные группы и подвижные противоионы. Последние могут обратимо обмениваться с другими ионами того же заряда, не изменяя физических свойств нерастворимой матрицы. Ионообменниками могут быть органические и неорганические соединения – алюмосиликаты, синтетические смолы, полисахариды, целлюлоза и т.д.
Тип ионообменника определяется активностью групп в матрице. Введение фенольных, карбоксильных или сульфогрупп придает матрице катионообменные свойства, а введение алифатических или ароматических аминогрупп – анионообменные свойства (табл. 2.1).
Разделение компонентов при этом виде хроматографии осуществляется не за счет разницы в их размерах, а за счет различий в их зарядах. Фракционирование вируссодержащих смесей, нанесенных на колонки, осуществляется пропусканием через колонку буферных растворов с возрастающей ионной силой или же растворов с возрастающей (или убывающей) величиной pH.
Применяя ионообменники, удается сравнительно легко и быстро проводить препаративную очистку и концентрирование различных вирусов. В то же время имеются сообщения и о неудачах при использовании метода ионообменной хроматографии для очистки вирусов. Некоторые вирусы при элюции с ионообменников теряют до 90% активности.
Таблица 2.1. Основные типы целлюлозных ионообменников

Критерии чистоты вирусных препаратов
Вирусный препарат можно считать чистым, если в нем не обнаруживаются какие-либо посторонние примеси. Определение степени загрязненности зависит от чувствительности применяемых методов исследования. Следует помнить, что применяя какой-либо один метод, нельзя доказать гомогенность препарата.
Важным критерием чистоты считается кристаллизация. Часто как доказательство чистоты вирусного препарата используется наличие спектра поглощения в ультрафиолете, характерного для нуклеопротеидов.
Важнейшим методом оценки гомогенности вирусной суспензии является наблюдение за скоростью седиментации частиц при ультрацентрифугировании в градиенте плотности сахарозы. Требованием для гомогенного препарата является симметричность соответствующего ему пика на седиментационной диаграмме.
Еще более чувствительным критерием гомогенности служит наличие одного пика при равновесном ультрацентрифугировании в градиенте плотности CsCl или Cs2SC>4.
Применение метода электронной микроскопии для выявления примесей целесообразно, если этот материал имеет достаточный размер и по внешнему виду отличается от вируса.
Примесь клеточных веществ, которые способны диффундировать и обладают антигенными свойствами, можно выявить с помощью очень чувствительных серологических методов, таких, как иммунодиффузия и иммуноэлектрофорез.
Для вирусов с хорошо установленным элементарным составом (например, ВТМ) такие методы, как определение отношения фосфора к азоту, позволяют обнаружить примеси, содержащие азот или фосфор, если они присутствуют в значительном количестве. При определенных обстоятельствах могут быть применены также более сложные химические методы, например анализ концевых групп белков, позволяющих обнаружить всего-навсего одну аминокислоту.
Из вышеизложенного следует, что для вирусных препаратов нет одного вполне удовлетворительного метода определения чистоты. Поэтому в практической работе используют и критически сопоставляют результаты, полученные при помощи как можно большего числа разнообразных методов.
Использование: медицина, в частности санитарная вирусология. Сущность: предложен способ концентрации и очистки вирусов из водных сред с добавлением к ним сорбента, при этом в качестве сорбента применяют сапонит.
Формула изобретения
СПОСОБ КОНЦЕНТРАЦИИ И ОЧИСТКИ ВИРУСОВ, включающий добавление к водной среде, содержащей вирус, сорбента с дальнейшим интенсивным перемешиванием и отделением осадка, отличающийся тем, что в качестве сорбента используют сапонит.
Описание изобретения к патенту
Изобретение относится к санитарии и гигиене, в частности к способам концентрации и выделения вирусов из различных сред.
Целью изобретения является повышение эффективности извлечения вирусов из водных сред и учета результатов их индикации.
Указанная цель достигается использованием в качестве сорбента вирусных частиц природного минерала сапонита.
Способ осуществляется следующим образом.
К водной среде, содержащей вирусные частицы, добавляют порошок сапонита, перемешивают путем периодического интенсивного встряхивания. Сорбент отделяют от водной среды центрифугированием. В надосадочной жидкости определяют содержание вирусных частиц по эффекту бляшкообразования с последующим замером величины бляшек. По разности содержания вирусов до и после введения в водную среду сорбента определяют сорбционную активность природного дисперсного минерала.
П р и м е р. К водной среде, содержащей вирусные частицы, добавляют сапонит, приготовленный следующим образом. Природный минерал измельчают, смачивают дистиллированной водой, гомогенизируют и взмучивают в дистиллированной воде. После отстаивания из верхнего слоя дисперсной среды центрифугированием отделяют мелкодисперсную фракцию минерала, высушивают и стерилизируют (например, при 160 о С в течение 1 ч). Как и сорбенты из прототипа, сапонит смешивают с водной средой, содержащей вирусные частицы, интенсивно встряхивают в течение 30 мин, центрифугируют при 3000 об/мин в течение 10 мин. В недостаточной жидкости определяют инфекционный титр вируса и по разности концентраций до и после введения в водную среду сорбента определяют его сорбционную активность. Результаты сорбционной активности природных дисперсных минералов приведены в табл. 1.
Сорбционная активность сапонита к вирусу полиомиелита П типа, в зависимости от дозы сорбента, представлена в табл. 2.
Инфекционная активность очищенных препаратов вирусов дана в табл. 3.
Из данных табл. 1-3 следует, что сапонит обладает наивысшей способностью связывать вирусы, введение сапонита в виде 1-2%-ной взвеси в водной среде сопровождается наиболее полным осаждением вирусных частиц. Очистка и концентрация вирусных частиц сапонитом сопровождается увеличением диаметра вирусных бляшек, тем самым повышается чувствительность метода индикации вирусов в водных средах.
Очистка и концентрация вирусов природными дисперсными минералами показана в табл. 4.
Из данных табл. 4 следует, что по сравнению с прототипом в предлагаемом способе эффективность очистки и концентрации вирусов увеличивается в 4 раза.
Изобретение относится к области биотехнологии и касается способа концентрации вирусов из жидких сред. Способ включает адсорбцию вируса на гидрогеле метакриловой кислоты в концентрации не менее 2,0 мг/мл, сорбции при рН 5,0 от 20 минут до 24 часов при температуре от 4°С до 22°С и далее комплекс вирус-сорбент центрифугируют и вирус элюируют. Преимущество изобретения заключается в сокращении числа стадий и уменьшении времени концентрирования. 1 з.п. ф-лы, 3 табл.
Формула изобретения
1. Способ концентрации вирусов в жидких средах, включающий сорбцию вирусов из жидких сред на сорбенте в течение временного интервала с последующим отделением комплекса вирус + сорбент центрифугированием и элюцией вирусов, отличающийся тем, что в качестве сорбента используют гидрогель метилкремневой кислоты в концентрации не менее 2 мг/мл сорбента, сорбцию проводят при рН 5,0 от 20 мин до 24 ч при температуре от +4 до +22°С.
2. Способ концентрации вирусов по п.1, отличающийся тем, что используют гидрогель метилкремниевой кислоты, в концентрации не менее 30,0 мг/мл, который обладает способностью адсорбировать не менее 96% вирусных частиц из водных сред, при рН 5,0.
Описание изобретения к патенту
Изобретение относится к области медицины, а именно вирусологии и биотехнологии, и может быть использовано для концентрации вирусов из воды, водных растворов, биологических сред; для выявления вирусов в воде питьевой, сточной, воде открытых водоемов, которые используются как источники водоснабжения, водопроводной воде, воде подземных источников, питьевой воде бутылированной, воде морской и пресных водоемов, которые используются для рекреационных целей, воде плавательных бассейнов; для очистки вирусных суспензий, используемых для изготовления вирусных антигенов и вакцин, очистки вирусов, полученных из тканевых культур, от клеточного детрита.
Известен способ концентрации энтеровирусов из водопроводной и речной воды при помощи ионообменных смол АВ-17, АВ-17-8, АВ-17-2П, 1К (искусственные сорбенты, представленные анионитами, а именно аминосмолами, полученными из формальдегида с мочевиной, анилином, гуанидином). / Методические рекомендации по санитарно-вирусологическому контролю объектов окружающей среды. // Москва, 1982, 75 с., п.3.1.3.2, - с.14/. Концентрация вирусов при помощи ионообменных смол осуществляется следующим образом. Сухую ионообменную смолу замачивают в течение 3 суток в дистиллированной воде. Потом воду сливают и смолу обрабатывают смесью равных по объему, приготовленных непосредственно перед использованием растворов 2% HCl и 10% NaCl. Продолжительность обработки 24 часа. После этого смолу отмывают дистиллированной водой до нейтрального рН=7,0. Перед концентрацией рН исследуемой пробы воды (5 или 10 л) доводят до значений 5,5-6,0. Затем заполняют колонку диаметром 1,2-1,3 см подготовленным слоем сорбента толщиной 10-12 см. Колонку уравновешивают раствором суспензии смолы с рН=5,6-6,0. Пробу воды (5 л) пропускают через колонку со скоростью 10-12 мл/мин. Продолжительность концентрации - 12-16 ч. После завершения концентрации осуществляют десорбцию вирусов из смолы при помощи фосфатного буфера. Недостатками этого способа являются длительность подготовки сорбента, дополнительное использование колонки, продолжительность процесса концентрации - 12-16 ч, использование большого объема воды - 5 л.
Наиболее близким к заявляемому способу является способ концентрации вирусов из воды при помощи природных сорбентов, а именно 5% геля бентонита (Широбоков В.П., Гирин В.Н., Якименко А.И. и др. Применение бентонита для выявления энтеровирусов у человека и во внешней среде. // Методические рекомендации. Киев, 1986, 23 с.) Схема концентрации энтеровирусов из водной среды представлена в таблице 1. Способ осуществляется следующим образом. Сухой бентонит диспергируют в деионизированной воде. Для преобразования бентонита в натриевую форму к суспензии добавляют углекислый натрий. Смесь оставляют на сутки при комнатной температуре для набухания, после чего смесь кипятят в течение 1 часа. Охлажденную смесь центрифугируют 10 минут при 3000 об/мин, надосадочную жидкость сливают, а осадок ресуспендируют в 1 л дистиллированной воды и центрифугируют при 4000 об/мин в течение 20 минут. Надосадочную жидкость удаляют. Отбирают приблизительно 2/3 верхней части осадка, содержащей суспензию геля бентонита, остаток суспензии ресуспендируют в 1 л деионизированной воды и снова центрифугируют в течение 20 минут при 4000 об/мин. Отмытый осадок бентонита заливают 3 л воды и встряхивают в штудтельаппарате 3-4 часа. После этого суспензию центрифугируют в течение 5 минут при 1000 об/мин, 2/3 верхней части осадка отбирают, еще раз суспендируют в воде, надосадок декантируют. Отбирают 2/3 однородной части геля бентонита, которую суспендируют в 0,14 М раствора хлористого натрия и снова осаждают, как указано выше. Фракционирование повторяют трижды, увеличивая продолжительность центрифугирования и удаляя нижнюю часть осадка. После такой обработки бентонит представляет собой мелкодисперсную суспензию. Ее суспендируют в 95 объемах деионизированной воды, получая 5% суспензию геля бентонита. Полученный гель автоклавируют при 136°С в течение 20 минут. Срок хранения такого геля не ограничен. Полученный 5% гель бентонита используют для концентрации вирусов из воды, водных растворов, культуральной жидкости.
| Таблица 1. Схема концентрации вирусов из водной среды | ||
| Этап | Исследуемый материал | Обработка |
| Адсорбция | Сточная вода (250 мл) | 1) вносят 3,0 г NaCl до 0,1 М концентрации; 2) вносят 0,5 мл 5% геля бентонита; 3) вносят 1 М HCl раствор до рН=4,5-5,0; 4) встряхивание 4-5 мин; 5) центрифугирование при 1000 об/мин 7-10 мин |
| Обессоливание | Осадок (комплекс вирус + бентонит) | 1) вносят 10 мл дист. воды (рН-1,5); 2) встряхивание 4-5 мин; 3) центрифугирование при 3000 об/мин 7-10 мин; |
| Элюция | Осадок (комплекс вирус + бентонит) | 1) вносят 1 мл 0,05 М раствора трис-буфера (рН-8,2-9,0); 2) встряхивание 4-5 мин; 3) центрифугирование при 3000 об/мин 7-10 мин; 4) отбирают элюат, деконтаминируют и исследуют на наличие в нем вирусов или вирусных антигенов. |
Известный способ включает помещение сорбента в пробу жидкой среды, выдерживание временного интервала с последующим центрифугированием исследуемой пробы, удаление надосадочной жидкости, получение комплекса вирус + сорбент и последующую элюцию вирусов. Недостатками способа являются продолжительность и трудоемкость приготовления геля бентонита, нестандартизированностъ сорбента, которая зависит от места его добычи.
В основу изобретения поставлена задача усовершенствования способа концентрации вирусов из жидких сред, в котором применение гидрогеля метилкремниевой кислоты сокращает продолжительность и трудоемкость способа и повышает процент выявления вирусов при исследовании различных жидких сред.
Поставленная задача решается тем, что в способе концентрации вирусов из жидких сред, который включает помещение сорбента в пробу жидкой среды, выдерживание временного интервала с последующим центрифугированием исследуемой пробы, удаление надосадочной жидкости, получение комплекса вирус + сорбент и последующую элюцию вирусов, согласно изобретению в качестве сорбента используют гидрогель метилкремниевой кислоты (ГГМКК), который обладает адсорбционными свойствами по отношению к биологическим объектам вирусной природы, временной интервал выдерживают от 20 минут до 24 часов при температуре от +4°С до +22°С, а получение комплекса вирус + сорбент осуществляют без проведения этапа обессоливания.
Согласно изобретению ГГМКК, способный в концентрации не менее 30 мг/мл адсорбировать не менее 96% вирусных частиц из водных сред, помещают в пробу водной среды, при этом исследуемую пробу подкисляют раствором кислоты до рН=5,0.
Согласно изобретению ГГМКК, который способен в концентрации не менее 2 мг/мл адсорбировать не менее 90% вирусных частиц из биологических сред, помещают в пробу биологической среды.
Заявители изобретения являются изобретателями и заявителями способа получения сорбента на основе гидрогеля метилкремниевой кислоты (заявка № а 2006 10083), в котором, благодаря новому способу получения, указанный сорбент имеет объем пор не менее 0,8 см 3 /г и обладает высокой адсорбционной активностью в отношении веществ с большой молекулярной массой (5-900 кД) и различных биологических объектов, в том числе вирусной природы. Гидрогель метилкремниевой кислоты - это новый эффективный сорбент, который имеет глобулярную структуру пористой кремнийорганической матрицы. На ее поверхности присутствуют гидроксильные группы, благодаря чему поверхность глобул и пор активно сольватируется полярными молекулами воды, и метильные группы, обусловливающие гидрофобные свойства и сродство к тканям и биосубстратам организма. Сорбент ГГМКК безопасен, имеет высокую селективность, адсорбционная емкость по конго красному достигает 3,0-3,5 мг/г (или 4,5-5,0 мкмоль/г). Используется как сорбент в различных отраслях медицины и ветеринарии.
Цель изобретения состоит в повышении эффективности концентрации вирусов из проб жидких сред, уменьшении стадий в процедуре выполнения, сокращении времени концентрации, создании возможности концентрации вирусов из минимальных объемов жидких сред, использовании для концентрации готового вещества (сорбента), состав и качество которого гарантируется соответствующими ФС и ТУ.
Способ осуществляется следующим образом. ГГМКК, полученный способом, заявленным в № а 2006 10083, имеющий адсорбционные свойства относительно биологических объектов вирусной природы, помещают в пробу жидкой среды, выдерживают от 20 минут до 24 часов при температуре от +4°С до +22°С. ГГМКК, способный в концентрации 30 мг/мл адсорбировать не менее 96% вирусных частиц из водной среды, помещают в пробу водной среды, а также в пробу биологической среды, загрязненные вирусами. Проводят адсорбцию вирусов, после чего ГГМКК концентрируют центрифугированием и удаляют надосадочную жидкость. Затем осуществляют элюцию вирусов и отделяют ГГМКК от раствора центрифугированием. В надосадочной жидкости осуществляют индикацию и идентификацию вирусов.
Пример 1. Концентрация вирусов из проб сточной воды.
Способ осуществляется как описано в п.п.1.2, при этом пробу воды (500 мл предварительно осветленной сточной воды) подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу помещают сорбент ГГМКК в количестве 1 г и выдерживают 20 минут при температуре 20°С. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин. в течение 20 минут. Надосадочную жидкость удаляют и получают комплекс вирус + сорбент, процесс обессоливания отсутствует.
Пример 2. Концентрация вирусов из проб питьевой воды.
Способ осуществляется как описано в п.п.1.2, при этом пробу воды подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу (10 л питьевой воды) помещают сорбент ГГМКК в количестве 20 г и выдерживают до 20 часов при температуре 20°С, надосадок осторожно сливают через край, оставляя на дне стеклянного сосуда 200 мл неплотного белого осадка. Полученный осадок (осадок + небольшое количество надосадка) встряхивают и переносят в стаканы или флаконы для центрифугирования по 250 мл и центрифугируют при 1000 об/мин в течение 20 минут. Образовавшийся белый осадок также не плотный, поэтому надосадочную жидкость снова сливают через край, оставляя на дне флакона 20 мл. Этот осадок встряхивают, переносят в две пробирки для центрифугирования и повторно центрифугируют. После второго центрифугирования плотный осадок формируется на дне пробирок, надосадочную жидкость удаляют пастеровской пипеткой и получают комплекс вирус + сорбент, процесс обессоливания отсутствует.
Пример 3. Концентрация вирусов из проб воды открытых водоемов и подземных источников.
Способ осуществляется как описано в п.п.1.2, при этом пробу воды (2 л) подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу помещают сорбент ГГМКК в количестве 4 г и выдерживают до 20 минут при температуре 20°С. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин в течение 20 минут. Надосадочную жидкость удаляют и получают комплекс вирус + сорбент, процесс обессоливания отсутствует.
Пример 4.1. Концентрация вирусов из проб культуральной жидкости.
Способ осуществляется как описано в п.п.1.3, при этом в культуральную вирусосодержащую жидкость (КВЖ), содержащую ротавирус обезьян SA-11 с инфекционным титром 7,5 lg ТЦД 50 /мл, добавляют сорбент ГГМКК из расчета 2 мг на 1 мл жидкости. Формирование комплекса ротавирус + сорбент осуществляют при температуре 20°С в течение 10 часов, периодически перемешивая. Образовавшийся комплекс ротавирус + сорбент выделяют низкоскоростным центрифугированием. В надосадочной жидкости отсутствие вируса контролируют, определяя инфекционный титр ротавируса титрованием по ЦПД в чувствительной культуре клеток. Результаты осуществления способа представлены в таблице 2.
Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 1,5 мг/мл. Результаты выполнения способа представлены в таблице 2.
Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 2,5 мг/мл. Результаты выполнения способа представлены в таблице 2.
Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 5,0 мг/мл. Результаты выполнения способа представлены в таблице 2.
Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 10 мг/мл. Результаты выполнения способа представлены в таблице 2.
Способ выполняют как в примерах 4.1-4.5, но используют культуральную жидкость, которая содержит вирус полиомиелита II типа штамм Себина с инфекционным титром 10,5 lg ТЦД 50 /мл. Результаты выполнения способа представлены в таблице 2.
Примеры 5.1-5.5. Концентрация вирусов из проб плазмы крови человека.
Способ осуществляют как в п.3 и примерах 4.1.-4.5, но вместо вирусосодержащей жидкости используют плазму крови человека, которая содержит вирус везикулярного стоматита (ВВС), штамм Индиана. Результаты осуществления способа представлены в таблице 2.
Пример 6. Способ концентрации вирусов-колифагов из проб питьевой воды.
Способ осуществляется как описано в п.п.1.2 и в примере 2, только концентрируемые вирусы являются колифагами Т2 (бактериофаг эшерихии Т2), а ГГМКК вносят из расчета 50 мг/мл. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин в течение 20 минут, надосадочную жидкость удаляют и получают комплекс колифаг Т2 + сорбент, процесс обессоливания отсутствует.
Примеры осуществления способа с элюцией вирусов.
Способ осуществляют как в примере 7.1, но элюцию проводят при рН=8,0. Результат выполнения способа представлен в таблице 3.
Способ осуществляют как в примере 7.1, но элюцию проводять при рН=9,0. Результат виполнения способа представлен в таблице 3.
Способ осуществляют как в примере 7.1, но элюцию проводят при рН=9,3. Результат выполнения способа представлен в таблице 3.
Способ осуществляют как в примере 7.1, но элюцию проводят в 0,05 М трис-буферном растворе при рН=8,5. Результаты выполнения способа представлены в таблице 3.
Способ осуществляют как в примере 7.5, но элюцию проводят при рН=8,0. Результаты выполнения способа представлены в таблице 3.
Способ осуществляют как в примере 7.5, но элюцию проводят при рН=9,0. Результаты выполнения способа представлены в таблице 3.
Способ виполняют как в примере 7.8, но элюцию проводят в 0,05 М трис-буферном растворе при рН=8,5. Результаты виполнения способа представлены в таблице 3.
Предлагаемый способ обеспечивает сокращение стадий в процессе выполнения, уменьшение времени концентрирования, возможность концентрации вирусов из минимальных объемов жидких сред, благодаря чему увеличивается точность и повышается процент выявления вирусов при исследовании различных жидких сред.
Читайте также:

