Микроскоп для изучения вирусов
Обновлено: 18.04.2024
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.

Влияние вирусов на население огромно, поскольку они могут вызывать серьезные эндемические и даже пандемические заболевания, такие как испанский грипп (вирус гриппа H1N1), СПИД (вирус иммунодефицита человека ВИЧ), лихорадка денге (вирус денге DENV) или недавний Covid-19 (коронавирус SARS-CoV-2).
Изучение вирусов, их взаимодействие с клетками-хозяевами и формирование иммунного ответа помогает разработать вакцины и методы лечения вирусных патогенов. Таким образом, вирусология часто тесно связана с иммунологией.
В клинической практике существует множество лабораторных методов обнаружения вирусных инфекций. С появлением молекулярных методов и повышением чувствительности серологического анализа вирусология быстро изменяется при использовании большого разнообразия образцов для вирусологических испытаний.
Многие вирусы можно вырастить в клеточной культуре в лаборатории. Для этого вирусолог добавляет образцы вирусов к подходящим клеткам-хозяевам. В результате этого процесса, называемого адсорбцией или инокуляцией, клетки инфицируются и производят больше копий вируса. Для некоторых вирусов требуется определенный тип клеток для репликации, поэтому существуют клеточные культуры, которые поддерживают рост большого разнообразия вирусов. В их числе клетки почек африканской зеленой мартышки (клетки Vero), фибробласты легких человека (MRC-5) и клетки эпидермоидной карциномы человека (HEp-2).
Один из способов узнать, успешна ли репликация вируса, — обнаружить изменения в морфологии клетки или программируемую гибель клеток (апоптоз), изучив клеточную культуру с помощью инвертированного микроскопа. Эти индуцированные морфологические изменения называются цитопатическим действием (CPE).
Световая микроскопия также является важным инструментом для быстрого и эффективного наблюдения за цитопатологическими изменениями, такими как типичная агрегация вируса внутри клеток в так называемых цитоплазматических тельцах-включениях. Один из ярких примеров — тельца Бабеша-Негри, которые представляют собой более крупные патогномические клеточные включения, наблюдаемые, как правило, при окрашивании гематоксилин-эозином в различных нервных клетках для определения инфекций бешенства, вызванных лиссавирусом.
Флуоресцентная микроскопия приобретает всё большую важность в вирусологии. Одним из методов диагностики и количественной оценки некоторых вирусных инфекций является иммунофлуоресценция. Развитие методов флуоресцентной микроскопии открывает дальнейшие возможности для более точных исследований взаимодействия между хозяином и вирусом, распространения вируса и его репликации, например, посредством совместной локализации между клеточными компартментами и вирусом. Повышенная чувствительность, улучшенное разрешение и автоматизация современных микроскопических систем обеспечивают основу для скрининга. Такие инструменты позволяют исследователям получать большое количество информации об инфицированных вирусом клетках, например, при медикаментозном воздействии.
Для изучения ультраструктуры и идентификации определенных вирусов широко используется электронная микроскопия. В частности, корреляция световой и электронной микроскопии (CLEM) может дать уникальное понимание взаимодействия между вирусом и хозяином.
Требования к микроскопам
Незаменимым инструментом для надежного цифрового документирования при наблюдении и поддержании клеточных культур являются компактные, оснащенные высококачественной оптикой и светодиодной флуоресценцией, удобные в использовании инвертированные световые микроскопы. Иммунофлуоресцентный анализ позволяет быстро обнаруживать вирусные агенты прямым (пМФА) и непрямым (нМФА) методами, том числе с помощью наборов антител к вирусу простого герпеса (HSV), вирусу гриппа А и другим респираторным вирусам и энтеровирусам.
Для лабораторных условий с высоким потоком образцов лучше всего подходят автоматизированные корпусные микроскопы со встроенной системой калибровки и контроля среды, а также функцией флуоресценции. Они позволяют проводить как двух-, так и трехмерный полностью автоматический скрининг клеточных культур и тканей. Конфокальные микроскопы позволяют вирусологам подробно изучать клеточную инвазию и готовить пробу к дальнейшему изучению методами иммуноэлектронной микроскопии.
Новейшие разработки в области сканирующей электронной микроскопии (СЭМ) позволили добиться разрешения и качества изображения, необходимого для вирусологических исследований. Режим визуализации с широким полем обзора в сочетании с корреляционной световой микроскопией и автоматизированным рабочим процессом позволяет сэкономить ценное время при поиске нужного вируса и получить быстрый результат даже с трехмерными изображениями.






Световые микроскопы ZEISS для вирусологии

Инвертированный микроскоп ZEISS Primovert идеально подходит для универсальных задач в клинической работе, например, для наблюдения и поддержания лабораторной клеточной культуры. Он устанавливается непосредственно в ламинарный бокс и позволяет быстро и эффективно исследовать неокрашенные клетки с помощью фазового контраста и GFP-меченные клетки – при помощи флуоресценции.
Изучение карбапенем-резистентной энтеробактерии (CRE) и анализ количества живых и мертвых клеток проводятся достаточно просто. С помощью специализированной цифровой камеры можно использовать приложение ZEISS Labscope для iPad для совместного обсуждения изображения на мониторе в группе. На микроскопе можно делать снимки, добавлять аннотации и составлять отчеты, а также передавать их по беспроводной сети.

ZEISS Axio Vert.A1 — это идеальный инструмент как для базовых, так и для сложных задач вирусологии и иммунологии. Он предоставляет возможность выбора между основными стандартными методами контрастирования, включая дифференциально-интерференционный контраст (DIC), а также DIC для работы с пластиковой посудой.
ZEISS Axio Vert.A1 оснащается флуоресценцией и рекомендуется для выполнения иммунофлуоресцентных наблюдений для обнаружения вирусов, исследования CRE или проведения анализа соотношения живых/мертвых клеток. Он позволяет получать высококачественные изображения в процессе исследований, обладает большим диапазоном функций, при этом достаточно компактен и займет совсем немного места рядом с инкубатором.
ZEISS Labscope — это приложение для визуализации, которое позволяет без труда получать многоканальные флуоресцентные изображения с помощью iPad или компьютера, работающего на ОС Windows.
Оптимальный инструмент для решения задач вирусологии и иммунологии >>

Ученым нужны изображения наилучшего качества с четким контрастом и высоким разрешением вне зависимости от предмета исследований. Это особенно важно в вирусологии. Также большое значение имеет максимальная чувствительность для неповреждающей визуализации живых или фиксированных образцов.

ZEISS Celldiscoverer 7 сочетает удобство использования автоматизированного корпусного микроскопа с качеством изображения и гибкостью классического инвертированного биологического микроскопа. ZEISS Celldiscoverer 7 калибруется самостоятельно, автоматически обнаруживает образцы и фокусируется на них. Надежная автоматизированная платформа для визуализации живых клеток позволит собрать больше информации за более короткий срок при работе с клеточными культурами или фрагментами тканей в 2D или 3D.
Высокая пропускная способность и скрининг с высоким разрешением очень важны в прикладном вирусологическом исследовании или при изучении клеточного ответа на определенные лекарства. ZEISS Celldiscoverer 7 также можно оснастить новым модулем ZEISS LSM 900 Airyscan 2 для неповреждающей динамической визуализации живых образцов с высокой частотой кадров в режиме сверхразрешения.
Автоматический микроскоп для визуализации живых клеток >>

ZEISS GeminiSEM 500 позволяет работать с вирусными патогенами с высоким разрешением и с широким полем обзора. Оптика Gemini зарекомендовала себя временем и более 20 лет используется в автоэмиссионной сканирующей электронной микроскопии (FESEM) ZEISS. Визуализация вирусов осуществляется в проходящих электронах с высоким разрешением с помощью детектора aSTEM.
Это сравнимо с визуализацией в трансмиссионном электронном микроскопе (ТЭМ), но со всеми преимуществами более простых процедур подготовки образцов, простоты работы и более высокой автоматизацией. С помощью корреляционной световой и электронной микроскопии (CLEM) можно получить уникальные данные о взаимодействии вируса и хозяина.
Визуализация проб с нанометровым разрешением >>
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об авторе
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
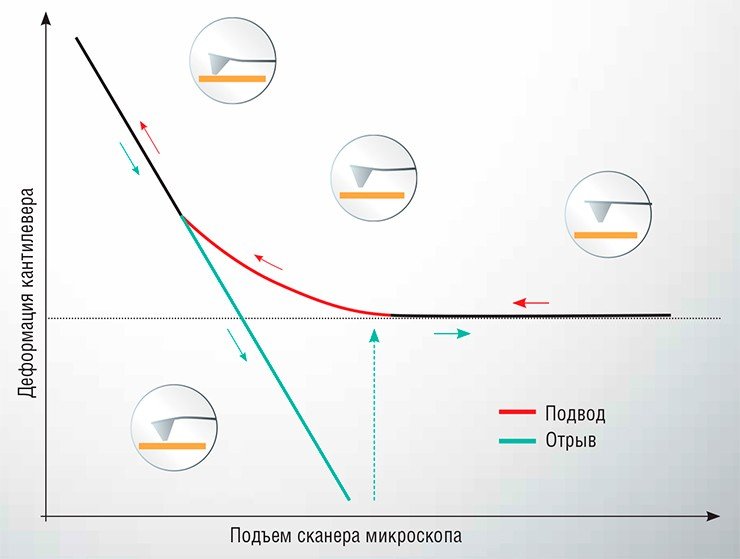
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего — микроскопа. Одна из основных его характеристик — набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.

Детёныш улитки. Увеличение 40×
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10–20 до 900–1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.

Лист клевера. Увеличение 100×. Некоторые клетки содержат тёмно-красный пигмент

Лист земляники. Увеличение 40×
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве — конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых — методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу. При этом через оптически прозрачные детали препарата свет распространяется в объектив, а в непрозрачных он поглощается и рассеивается. На белом фоне получается тёмное изображение, отсюда и название метода. С тёмнопольным конденсором всё иначе. Световой пучок, выходящий из него, имеет форму конуса, лучи в объектив не попадают, а рассеиваются на непрозрачном препарате, в том числе и в направлении объектива. В итоге на тёмном фоне виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных малоконтрастных объектов. Поэтому, если вы планируете расширить набор методов наблюдения, стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсора тёмного поля, тёмнопольной диафрагмы, устройств фазового контраста, поляризаторов и т. п.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция — это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани — несколько слоёв клеток создают нечёткое сумбурное изображение.

Крыло жучка бибиониды. Увеличение 400×
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т. п.
Что смотреть
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного — например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10–15 минут, после чего промыть под струёй воды.

Кожица лука. Увеличение 1000×. Окраска йодом. На фотографии видно клеточное ядро

Кожица лука. Увеличение 1000×. Окраска азур-эозином. На фотографии в ядре заметно ядрышко
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5–10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.

Картофель. Синие пятна — зёрна крахмала. Увеличение 100×. Окраска йодом

Плёнка на спине таракана. Увеличение 400×

Чешуйки с крыльев моли. Увеличение 400×
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Крыло бабочки боярышницы. Увеличение 100×
Не менее интересный объект для наблюдения — кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.

Кожура сливы. Увеличение 1000×
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.

Хлоропласты в клетках травы. Увеличение 1000×
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей — мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.

Хлоропласты в клетках водоросли. Увеличение 1000×
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов — азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: эозинофил на фоне эритроцитов
Продолжая тему исследования крови, следует упомянуть камеру Горяева — устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.

Мазок крови. Окраска азур-эозином по Романовскому. Увеличение 1000×. На фотографии: слева — моноцит, справа — лимфоцит
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
Словарик к статье

Микроскопы серии ECLIPSE Ci предназначены для клинических и лабораторных исследований и отвечают требованиям эргономичности и простоты использования для обеспечения удобного положения при работе и легкой настройки параметров.



Nikon ECLIPSE Ci
Микроскопы серии ECLIPSE Ci предназначены для клинических и лабораторных исследований и отвечают требованиям эргономичности и простоты использования для обеспечения удобного положения при работе и легкой настройки параметров.


E200 - компактный микроскоп для клинических, лабораторных, фундаментальных и образовательных исследований. Эргономичная и предотвращающая образование плесени конструкция обеспечивает многолетнюю комфортную и стабильную эксплуатацию даже в условиях повышенной температуры и влажности



Nikon ECLIPSE E200
E200 - компактный микроскоп для клинических, лабораторных, фундаментальных и образовательных исследований. Эргономичная и предотвращающая образование плесени конструкция обеспечивает многолетнюю комфортную и стабильную эксплуатацию даже в условиях повышенной температуры и влажности


Микроскопы серии ECLIPSE Ni отличаются широкими возможностями визуализации. Микроскоп Ni является надежной основой биологических исследований, предлагая гибкость системы при выборе конфигурации и возможностей автоматизации.



Nikon ECLIPSE Ni
Микроскопы серии ECLIPSE Ni отличаются широкими возможностями визуализации. Микроскоп Ni является надежной основой биологических исследований, предлагая гибкость системы при выборе конфигурации и возможностей автоматизации.

Инвертированный микроскоп Nikon Eclipse Ts2 для рутинных работ – это преемник модели Nikon Eclipse TS100 с улучшенной функциональностью и эффективностью при сохранении высокой надежности и качества исполнения оптики Eclipse TS100. Новый метод рельефного контрастирования (Emboss Contrast), разработанный компанией Nikon, легок в использовании и позволяет наблюдать клетки более эффективно, расширяя возможности для проведения фундаментальных исследований в области медицины и биологии


Nikon Eclipse Ts2
Инвертированный микроскоп Nikon Eclipse Ts2 для рутинных работ – это преемник модели Nikon Eclipse TS100 с улучшенной функциональностью и эффективностью при сохранении высокой надежности и качества исполнения оптики Eclipse TS100. Новый метод рельефного контрастирования (Emboss Contrast), разработанный компанией Nikon, легок в использовании и позволяет наблюдать клетки более эффективно, расширяя возможности для проведения фундаментальных исследований в области медицины и биологии

ВЫПУСК ПРЕКРАЩЕН

Компактная и эргономичная модель TS100 обеспечивает возможность проведения наблюдений в различных областях: культивирование клеток, проведение контрольных тестов и научных исследований. Микроскоп идеально подходит для наблюдения тканевых культур, измерений тромбоцитов и определения группы крови. Компактный корпус прочен и устойчив к вибрациям, что обеспечивает безопасность проведения исследований.



Nikon Eclipse TS100/TS100-F
Компактная и эргономичная модель TS100 обеспечивает возможность проведения наблюдений в различных областях: культивирование клеток, проведение контрольных тестов и научных исследований. Микроскоп идеально подходит для наблюдения тканевых культур, измерений тромбоцитов и определения группы крови. Компактный корпус прочен и устойчив к вибрациям, что обеспечивает безопасность проведения исследований.

Eclipse Ti2 обеспечивает уникальное поле зрения 25 мм. При таком большом поле зрения в Ti2 максимально увеличена площадь матрицы крупноформатных CMOS камер без какого-либо ухудшения качества, а также существенно повышена производительность


Nikon Eclipse Ti2
Eclipse Ti2 обеспечивает уникальное поле зрения 25 мм. При таком большом поле зрения в Ti2 максимально увеличена площадь матрицы крупноформатных CMOS камер без какого-либо ухудшения качества, а также существенно повышена производительность

Инвертированный микроскоп Nikon Eclipse Ts2R – это новая модель в линейке Nikon. Микроскоп удобен в использовании и имеет большой выбор аксессуаров, что делает его незаменимым для решения задач в области медицины и биологии


Nikon Eclipse Ts2R
Инвертированный микроскоп Nikon Eclipse Ts2R – это новая модель в линейке Nikon. Микроскоп удобен в использовании и имеет большой выбор аксессуаров, что делает его незаменимым для решения задач в области медицины и биологии
ВЫПУСК ПРЕКРАЩЕН
Микроскопы серии ECLIPSE Ti являются инструментами, имеющими решающее значение для передовых исследований в биологии, медицине и фармацевтике. Продуманная автоматика и применение модульной концепции Nikon делают Ti идеальным для таких задач, как конфокальная микроскопия, FRET и фотообесцвечивание/фотоактивация для изучения взаимодействия флуоресцентных молекул белка в живых клетках и тканях. Микроскоп Ti поддерживает различные виды регистрации изображений и методы его анализа, такие как многомерная регистрация изображений через заданные интервалы времени для получения временной, пространственной и спектральной информации о быстрых, динамичных процессах в живых клетках
Nikon Eclipse Ti
Микроскопы серии ECLIPSE Ti являются инструментами, имеющими решающее значение для передовых исследований в биологии, медицине и фармацевтике. Продуманная автоматика и применение модульной концепции Nikon делают Ti идеальным для таких задач, как конфокальная микроскопия, FRET и фотообесцвечивание/фотоактивация для изучения взаимодействия флуоресцентных молекул белка в живых клетках и тканях. Микроскоп Ti поддерживает различные виды регистрации изображений и методы его анализа, такие как многомерная регистрация изображений через заданные интервалы времени для получения временной, пространственной и спектральной информации о быстрых, динамичных процессах в живых клетках
Читайте также:

