Могут ли вирусы вызывать онкологические заболевания
Обновлено: 18.04.2024
ДНК-вирусы как причина развития рака - вирусный канцерогенез
В канцерогенезе также могут участвовать ДНК-содержащие вирусы. Наиболее крупные ДНК-содержащие вирусы принадлежат к группе герпесвирусов. Первым вирусом, выделенным из культуры опухолевых клеток, был вирус Эпштейна-Баррра (ЭБВ).
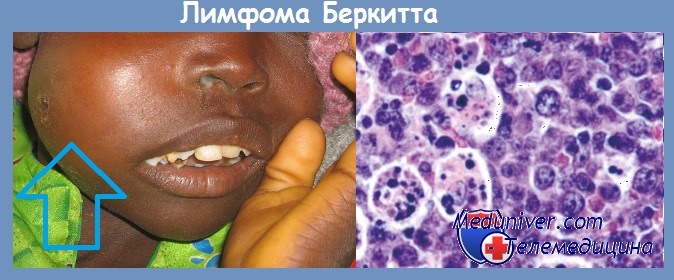
Вирус был получен из культуры опухолевых клеток больных лимфомой Беркита. В культуре in vitro ЭБВ вызывает бесконечную пролиферацию человеческих В-лимфоцитов. Вирусные гены, встраиваясь в геном этих клеток, инициируют пролиферацию путем активации клеточных генов-регуляторов роста (онкогенов).
В крови больных лимфомой Беркита обнаруживается более высокий, чем у здоровых людей, титр антител к антигенам вирусной оболочки и к мембранным антигенам. В то же время в африканских странах среди множества детей, инфицированных этим вирусом, лимфома развивается только в единичных случаях.
Механизм онкогенеза этого заболевания не может быть объяснен только вирусным заражением. К тому же, за пределами африканского континента регистрируются случаи заболевания лимфомой Беркита, абсолютно не связанные с инфицированием вирусом ЭБВ. По-видимому, ЭБВ также может принимать участие в патогенезе карциномы носоглотки, так как клетки этой опухоли экспрессируют вирусные антигены EBNA-1.
При исследованиях саркомы Капоши, развивающейся у больных СПИДом, в 1994 г. из ее клеток был выделен новый герпесвирус. Первоначально вирус получил название герпес-вируса саркомы Капоши (ГСК), впоследствии он был переименован в герпесвирус человека серотип 8 (ГВЧ 8). Вирус обнаруживается в веретеновидных клетках саркомы Капоши практически при всех случаях заболевания.
ГВЧ 8 был также найден в опухолевых клетках первичной эффузионной лимфомы и в клетках многоочаговой болезни Кастлемана. Данный вирус кодирует синтез циклина, который является промотором клеточного деления, чем и объясняется высокая пролиферативная активность инфицированных клеток.
Человеческие папилломавирусы (ПВЧ) вызывают кожные бородавки и ряд доброкачественных папиллом. Это весьма обширный класс вирусов, и некоторые его представители могут в той или иной степени участвовать в развитии злокачественных опухолей. Большинство вирусов вызывает лишь ограниченную пролиферацию клеток, но ряд серотипов может вызвать и развитие злокачественных новообразований.
Наибольшую опасность с точки зрения онкологии представляют серотипы 16, 18, 31 и 33. Более 90% опухолей карциномы шейки матки in situ обнаруживают в своих клетках генные последовательности вирусов ПВЧ. Эти вирусы также играют значительную роль в возникновении инвазивных и многоочаговых плоскоклеточных раков кожи, которые часто развиваются у больных после долгосрочных курсов иммуносупрессивной терапии.
Механизмы вирусного канцерогенеза в этом случае изучены недостаточно. В исследованиях доказано, что существует вероятность включения вирусной ДНК в клетки базального эпителия. Обычно в клеточную ДНК внедряются восемь ранних и два поздних гена. Ранние гены Е6 и Е7 вызывают пролиферацию клеток.
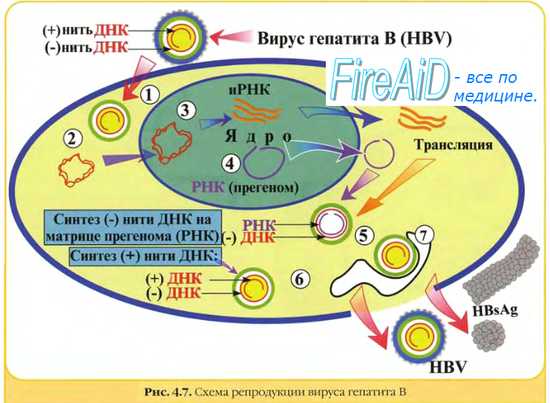
Вирус гепатита В четко связывают с развитием печеночно-клеточного рака. Риск развития этого заболевания у инфицированных вирусом в 200 раз превышает таковой у неинфицированных людей. Механизмы зарождения рака не до конца понятны: считается, что вирус вызывает бесконечную пролиферацию клеток, хотя зараженные вирусом клетки уничтожаются иммунной системой организма. Возможно, что пролиферирующие клетки становятся чувствительными к другим канцерогенам, например к афлатоксину.
Подытоживая вышесказанное, можно заключить, что основным механизмом канцерогенного воздействия является повреждение молекул ДНК и нарушения процессов ее репарации. Если не происходит исправления первичных повреждений ДНК, ошибки со временем начинают накапливаться, что ведет к дестабилизации структуры хромосом и к соматическим мутациям. Большинство таких мутаций летальны для клетки.
Однако, если часть клеток выживает, происходит постепенное накопление клеточной массы с опухолевым фенотипом, что в итоге приводит к клиническим проявлениям. Большой вклад в понимание этого процесса внесли современные исследования механизмов регулировки клеточного цикла и недавнее открытие регуляторных белков, которые запрещают клетке делиться, если ее геном сильно поврежден.
Для развития опухоли может быть недостаточно единичных мутаций в генах-регуляторах деления, но накопление массы ошибок в регуляторных генах может привести к фатальным последствиям. Особенно критичны мутации в генах, регулирующих клеточное деление, так называемых онкогенах. Очень опасны также мутационная инактивация генов, подавляющих клеточное деление — генов-подавителей опухоли, и мутации в генах, кодирующих белки, запрещающие деление при повреждении клеточного генотипа.
Накопление числа жизнеспособных мутаций по одному или нескольким из этих генов приводит к общей клеточной дезорганизации и к потере контроля над клеточным делением. В следующем разделе мы рассмотрим механизмы действия онкогенов и наиболее важные моменты контроля над клеточным циклом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
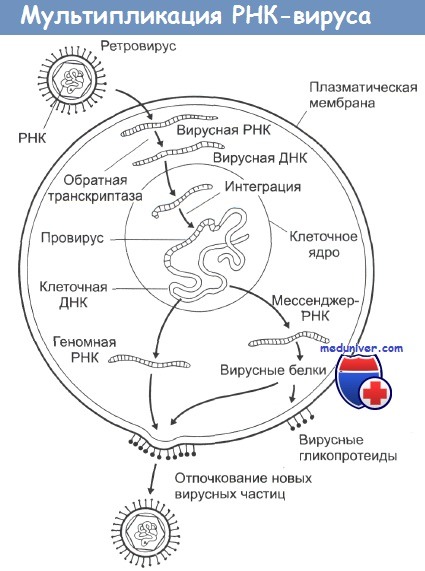
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
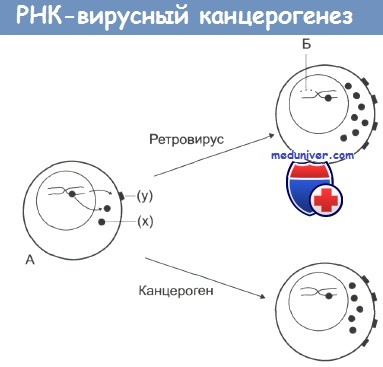
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
21% злокачественных заболеваний вызваны вирусами и другими микроорганизмами.
Мы недооценивали роль вирусов и других микроорганизмов в нашей жизни. Оказывается, они вызывают не только инфекции, но и многие онкологические заболевания. Что это за болезни и как их избежать, рассказывают врачи.
Берегите печень
80% всех случаев рака печени вызваны вирусами, предупреждает врач-гастроэнтеролог, доктор медицинских наук, специалист по заболеваниям печени, профессор Первого Московского государственного медицинского университета им. Сеченова (Сеченовский университет) Алексей Буеверов:
– Вирусы, вызывающие гепатиты В и С, считаются онкогенными. Это значит, что они могут вызывать развитие рака печени. Механизмы развития этого процесса разные, но самый высокий риск такой опухоли существует при циррозе, вызванном гепатитами В и С, – он повышается до 1000 раз. Нередко при этих гепатитах рак возникает ещё до того, как развился цирроз. Этому способствуют активный воспалительный процесс и фиброз (повышенное развитие в печени соединительной ткани).
Частота развития рака при гепатитах В и С примерно одинакова и составляет 2–6% в год. Это значит, что в течение года среди 100 больных хроническими гепатитами будет диагностировано порядка 4 случаев рака печени. Соответственно в течение 10 лет он будет выявлен уже у 40% больных. Это очень большие цифры.
Стоит упомянуть и гепатит D, который тоже может стать причиной рака. Но заболевание протекает настолько агрессивно, что пациенты часто не доживают до этого и погибают раньше. Это особая инфекция, которая при заражении вирусом гепатита D развивается только у тех пациентов, которые уже больны гепатитом В. То есть это заболевание всегда сочетанное. Именно поэтому вакцина против гепатита В будет одновременно защищать как от рака печени, связанного с этим заболеванием, так и с гепатитом D. Для профилактики рака у больных гепатитами очень важно активное лечение, прежде всего противовирусное. Гепатит С сегодня уже полностью излечивается, а при гепатите В обычно удаётся подавить активность вируса, и болезнь переводится в стойкую ремиссию. Конечно, если пациенты выполняют все рекомендации по лечению. Ещё крайне важно лечение цирроза, поскольку он является самостоятельным фактором риска рака печени.
Код вставки на сайт

21% злокачественных заболеваний вызваны вирусами и другими микроорганизмами.
Мы недооценивали роль вирусов и других микроорганизмов в нашей жизни. Оказывается, они вызывают не только инфекции, но и многие онкологические заболевания. Что это за болезни и как их избежать, рассказывают врачи.
Берегите печень
80% всех случаев рака печени вызваны вирусами, предупреждает врач-гастроэнтеролог, доктор медицинских наук, специалист по заболеваниям печени, профессор Первого Московского государственного медицинского университета им. Сеченова (Сеченовский университет) Алексей Буеверов:
– Вирусы, вызывающие гепатиты В и С, считаются онкогенными. Это значит, что они могут вызывать развитие рака печени. Механизмы развития этого процесса разные, но самый высокий риск такой опухоли существует при циррозе, вызванном гепатитами В и С, – он повышается до 1000 раз. Нередко при этих гепатитах рак возникает ещё до того, как развился цирроз. Этому способствуют активный воспалительный процесс и фиброз (повышенное развитие в печени соединительной ткани).
Частота развития рака при гепатитах В и С примерно одинакова и составляет 2–6% в год. Это значит, что в течение года среди 100 больных хроническими гепатитами будет диагностировано порядка 4 случаев рака печени. Соответственно в течение 10 лет он будет выявлен уже у 40% больных. Это очень большие цифры.
Стоит упомянуть и гепатит D, который тоже может стать причиной рака. Но заболевание протекает настолько агрессивно, что пациенты часто не доживают до этого и погибают раньше. Это особая инфекция, которая при заражении вирусом гепатита D развивается только у тех пациентов, которые уже больны гепатитом В. То есть это заболевание всегда сочетанное. Именно поэтому вакцина против гепатита В будет одновременно защищать как от рака печени, связанного с этим заболеванием, так и с гепатитом D. Для профилактики рака у больных гепатитами очень важно активное лечение, прежде всего противовирусное. Гепатит С сегодня уже полностью излечивается, а при гепатите В обычно удаётся подавить активность вируса, и болезнь переводится в стойкую ремиссию. Конечно, если пациенты выполняют все рекомендации по лечению. Ещё крайне важно лечение цирроза, поскольку он является самостоятельным фактором риска рака печени.

Обзор
Тасманийский дьявол с лицевой опухолью
Автор
Редакторы
Давно известно, что некоторые виды рака могут вызываться онкогенными вирусами, например, человеческим папилломавирусом, T-лимфотропным вирусом человека, вирусом Эпштейна—Барр и вирусом саркомы Капоши. А могут ли сами раковые клетки выступать в роли инфекционных агентов и передаваться от одной особи к другой, вызывая онкологические заболевания? Оказывается, могут, хотя пока нам известно лишь несколько примеров: лицевые опухоли тасманийского дьявола, трансмиссивная венерическая опухоль собак и лейкемия двустворчатых моллюсков. Каковы же механизмы заразного рака и почему подавляющее большинство раковых клеток не может передаваться от одной особи к другой? Ответам на эти вопросы и посвящена наша статья.
Трансмиссивная венерическая опухоль собак
Первым известным случаем заразного рака стала трансмиссивная венерическая опухоль собак (canine transmissible venereal tumor, CTVT). Помимо собак, заболевание обнаружено у волков, койотов и шакалов. Возможность передачи этой опухоли от одной особи к другой экспериментально продемонстрировали в 1876 году. Однако это не доказывает, что передающаяся опухоль представлена клетками единственной однажды возникшей линии, а не развивается каждый раз заново у разных собак. Идентичность клеток CTVT стала очевидной после выявления одинаковых хромосомных перестроек, а также обнаружения интеграции ретротранспозона LINE1 перед геном c-myc у всех клеток опухоли. Стоит отметить, что вообще-то почти все клетки любого многоклеточного организма немного отличаются друг от друга [3], и наличие одинаковых мутаций свидетельствует об общности происхождения двух клеток. Передача опухоли (плотного образования до 10 см в диаметре) происходит при половом контакте, и у новой особи опухоль, как правило, развивается на гениталиях. Любопытно, что клетки CTVT постоянно заимствуют митохондриальные геномы своих хозяев. Вероятно, митохондриальные геномы опухолевых клеток быстро приходят в негодность из-за многочисленных мутаций. Как правило, CTVT в течение нескольких месяцев после активного роста регрессирует, не приводя к гибели собаки, однако в некоторых случаях регрессии опухоли не происходит. Описаны даже случаи метастазирования CTVT. Орган или ткань, от которых произошли клетки CTVT, неизвестны [4–6].
По оценкам, CTVT появилась очень давно — от 10 тысяч до 12 тысяч лет назад, что делает ее самой древней самоподдерживающейся линией клеток (первой искусственной самоподдерживающейся линией стала HeLa, произошедшая от клеток рака шейки матки [7]). Она обнаружена на всех континентах, кроме Антарктиды [5]. Предполагают, что CTVT привела к гибели древнейших американских домашних собак, прибывших на континент вместе с первыми поселенцами около 15 тысяч лет назад. Судя по анализу древних геномов, клетки CTVT генетически гораздо ближе к первым американским собакам, чем к современным животным, из-за чего иммунная система первых не была в состоянии эффективно отторгать опухоль [8].
Лицевые опухоли тасманийского дьявола
Впервые лицевая опухоль тасманийского дьявола (devil facial tumor disease 1, DFTD1) была описана в 1996 году на северо-востоке Тасмании. Передача этой крайне агрессивной опухоли происходит при укусах, которые служат важным средством социального общения животных. Трансмиссивный характер опухоли стал очевиден после обнаружения уникальных хромосомных перестроек во всех опухолевых клетках (рис. 1), а также после полного секвенирования геномов клеток двух различных опухолей [9].

Рисунок 1. Кариотипы нормальных клеток самки тасманийского дьявола (а) и клеток лицевой опухоли (б). Кариотип нормального дьявола включает 14 хромосом, из которых 12 — аутосомы. В клетках лицевой опухоли утрачены хромосомы второй пары и половые хромосомы. Хромосома 5 подверглась перестройке, сопровождающейся полной делецией длинного плеча, причем делетированный фрагмент переместился в одну из новых (маркерных) хромосом. В длинном плече хромосомы 1 произошло несколько делеций, а к хромосоме 6, наоборот, добавился новый материал. Также имеются 4 неидентифицируемые маркерные хромосомы.
[9], рисунок с изменениями
В 2014 году на юго-востоке Тасмании обнаружили другую линию раковых клеток лицевых опухолей тасманийского дьявола (DFTD2). Пока выявлено 5 особей с DFTD2, причем все они самцы. Родоначальником DFTD1 была самка, в то время как DFTD2 появилась у самца. Возможно, самки каким-то образом распознают клетки DFTD2 как чужеродные и избавляются от них, однако делать какие-либо заключения преждевременно в силу недостатка данных. Эпидемиология DFTD2 еще не изучена, но проявления DFTD1 и DFTD2 очень схожи: оба заболевания сопровождаются ростом опухолей до 10 см в диаметре на лице и шее животных. Со временем опухоли подвергаются некрозу и воспаляются, приводя к значительным изменениям анатомии челюсти животного. Кроме того, в 65% случаев лицевая опухоль метастазирует.
Генетические маркеры и кариотипы указывают, что DFTD1 и DFTD2 возникли у разных особей. Клетки DFTD1 произошли от шванновских клеток, образующих миелиновую оболочку периферических нервов, а происхождение клеток DFTD2 еще неизвестно. В отличие от опухоли собак, DFTD всегда приводит к летальному исходу, что представляет серьезную угрозу для тасманийского дьявола как вида. Описаны только 6 животных, у которых развился иммунный ответ на клетки опухоли [4–6].
Трансмиссивная лейкемия двустворчатых моллюсков
По меньшей мере 15 видов двустворчатых моллюсков подвержены смертельной трансмиссивной лейкемии. Опухолевые клетки при этом заболевании происходят от гемоцитов — клеток, циркулирующих в гемолимфе. Первые случаи заболевания описаны в 1970-х годах, и с тех пор болезнь начала быстро распространяться по восточному побережью Северной Америки. Иногда происходят вспышки заболевания, когда более 90% популяции оказываются зараженными. Клетки разных видов трансмиссивной лейкемии характеризуются значительным увеличением числа копий ретротранспозонов в одних и тех же участках генома.
Возможно, перемещение ретроэлементов запускается факторами внешней среды, такими как перенаселенность, загрязнение, изменение температуры воды. К настоящему времени трансмиссивная лейкемия детально изучена у песчаной мии (Mya arenaria), мидий (Mytilis trossulus), съедобной сердцевидки (Cerastoderma edule) и полититапеса золотистого (Polititapes aureus), и у каждого вида имеется своя независимая линия трансмиссивной лейкемии. У сердцевидки обнаружены две независимые трансмиссивные лейкемии, как у тасманийского дьявола (рис. 2).

Рисунок 2. Препарат гемолимфы сердцевидки. Стрелка указывает на клетку лейкемии.
Интересно, что лейкемия Polititapes aureus была получена им от другого вида двустворчатых моллюсков — Venerupis corrugate, — который в настоящее время лейкемии не подвержен, несмотря на общность местообитания с P. aureus. Вероятно, ему удалось приобрести резистентность к этому заболеванию. Передача раковых клеток происходит через морскую воду, которая проникает в организм моллюска при фильтрации. Со временем раковые клетки распространяются по всем органам и тканям зараженного животного [4–6].
Есть ли заразный рак у человека?
Передача раковых клеток от одного человека к другому — чрезвычайно редкое явление. Как правило, она происходит при пересадке органов, так как иммунная система реципиента искусственно угнетается с целью предотвратить отторжение трансплантата. Другие случаи относятся к передаче раковых клеток от матери плоду, перемещению лейкемийных клеток между близнецами в утробе матери, а также передаче клеток внеплодной хориокарциномы от плода матери [10]. Недавно описали заражение пациента со СПИДом раковыми клетками обитающего в его кишечнике карликового цепня. Во всех этих случаях целостность физических и иммунных барьеров организма была нарушена.
Известно всего лишь несколько случаев передачи чужеродных раковых клеток людям с нормальным иммунитетом. Один хирург случайно занес себе в руку раковые клетки во время операции. Другой случай произошел с исследователем, который по неосторожности занес себе иглой клетки из линии аденокарциномы, что привело к образованию небольшой опухоли. В этих двух случаях опухоли успешно удалили без дальнейших рецидивов [5].
Как клетки заразного рака противостоят иммунной системе
Предполагают, что тасманийские дьяволы не развивают эффективного иммунного ответа против опухоли в силу низкого разнообразия MHC. Дело в том, что в начале XX века численность популяции дьяволов резко сократилась, что привело к снижению генетического разнообразия. Впрочем, в экспериментах по трансплантации кожи одного дьявола другому отторжение трансплантата все-таки происходило. Оказалось также, что клетки DFTD тоже понижают экспрессию MHC, как и клетки опухоли собак. У людей перенос раковых клеток от матери к плоду возможен, потому что эмбрион имеет одну аллель MHC от матери, и, если опухолевые клетки потеряют ту аллель, которой у эмбриона нет, они не будут распознаны плодом как чужеродные. У двустворчатых моллюсков, как и у всех беспозвоночных, MHC нет. Однако какой-то механизм распознавания своего и чужого у них все-таки существует, так как их лейкемии, как правило, связаны с одним конкретным видом. Возможно, это достигается при помощи того же механизма, что препятствует слиянию колоний оболочников разных видов [4], [5].
Стоит отметить, что клетки CTVT и DFTD сохраняют способность к экспрессии генов MHC, а не утрачивают ее необратимо. Например, если обработать клетки DFTD1 интерфероном γ, экспрессия генов MHC резко возрастет, а также восстановится способность к процессингу и презентации антигенов. Вышеупомянутые шесть тасманийских дьяволов, развившие иммунный ответ против опухоли, имеют антитела к опухолевым клеткам, синтезирующим MHC, и у двух животных даже произошла спонтанная регрессия опухоли. У одного из дьяволов в опухоль проникли CD4+ и CD8+ T-лимфоциты. Неизвестно, сформировалась ли у этих животных иммунологическая память к опухолевым клеткам [4], [5].
Регрессия CTVT, которая наблюдается у большинства собак, начинается с увеличения доли опухолевых клеток, экспрессирующих MHC. Вместе с этим CD4+ и CD8+ T-лимфоциты начинают проникать в опухоль и оказывают на ее клетки цитотоксическое действие. Вероятно, интерлейкин 6 и интерферон γ, вырабатываемые Т-лимфоцитами в опухоли, запускают образование MHC в раковых клетках [5].
Опухолевые клетки, не экспрессирующие MHC, могут стать жертвами других клеток иммунной системы — натуральных киллеров. Чтобы избежать этого, клетки CTVT выделяют цитокины, подавляющие иммунный ответ, такие как TGF-β (tumor growth factor β, фактор роста опухоли β). Секреция TGF-β наблюдается в фазе роста опухоли и на первых этапах стационарной фазы. Когда T-лимфоциты начинают синтезировть интерлейкин 6 и интерферон γ, развивается более мощная воспалительная реакция, нивелирующая эффект TGF-β. Рост DFTD, по всей видимости, от TGF-β не зависит [5].
Эволюция линий клеток заразных опухолей
В принципе, процесс метастазирования, то есть смены местообитания раковых клеток в пределах одного организма, схож с передачей раковых клеток от одной особи к другой. В обоих случаях раковые клетки эволюционируют по Дарвину, приобретая мутации, которые потом отбраковываются естественным отбором сообразно условиям окружающей среды. Кроме того, и те, и другие клетки вынуждены изобретать разнообразные ухищрения, чтобы избежать уничтожения иммунной системой хозяина [5].
Клетки CTVT характеризуются уникальной для опухолевых клеток стабильностью. В них почти не происходят мутации и хромосомные перестройки, и клетки в пределах опухолей удивительно однородны. На основании этого ученые заключили, что эволюция клеток CTVT, вначале сопровождавшаяся многочисленными мутациями и перестройками, в данный момент вышла на плато. Клетки CTVT достигли тонкого равновесия со своим хозяином: с одной стороны, они не убивают его, однако долгое время, вплоть до полной регрессии опухоли, собака-хозяин служит в роли переносчика опухолевых клеток. Клетки DFTD, напротив, находятся на ранних этапах эволюции и еще далеки от равновесия со своим хозяином [6].
Активация ретротранспозонов в клетках, ставших впоследствии клетками лейкемии двустворчатых моллюсков, вероятно, стала следствием чрезвычайной геномной нестабильности. Эти клетки содержат больше ДНК, чем нормальные клетки, и нередко являются анеуплоидными или тетраплоидными. Более того, клетки лейкемии в пределах одного организма могут различаться числом некоторых микросателлитов и заменами в митохондриальной ДНК [6].
К сожалению, наши знания о заразных раковых опухолях очень скудны и ограничиваются лишь отдельными примерами, кажущимися результатом роковой случайности. Поэтому и создать общую концепцию заразного рака на данном этапе невозможно. Нам остается лишь с нетерпением ждать новых данных, которые прольют свет на механизмы, лежащие в основе этого заболевания.
Читайте также:

