Молекулярная биология вируса гепатита с
Обновлено: 19.04.2024
Белки и антигены вируса гепатита С. Диагностика ВГС
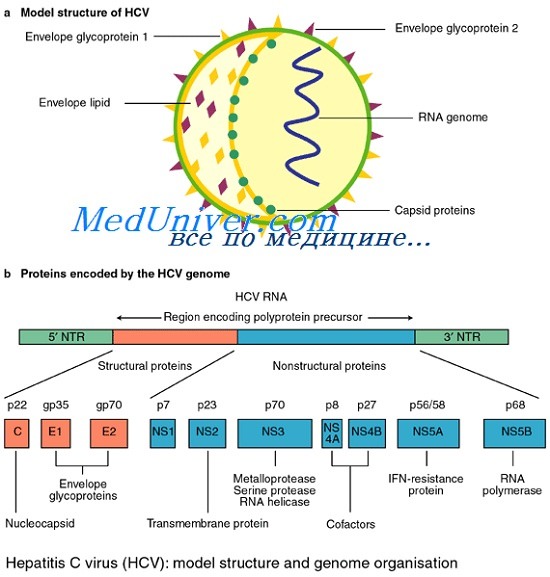
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Вирус гепатита С (HCV) представляет собой небольшой вирус, покрытый липидной оболочкой, содержащей одноцепочечную РНК. HCV относится к флавивирусам, роду семейства тогавирусов. Между 5' и 3' терминальными участками генома вируса располагаются структурные и неструктурные гены (рис. 1). 6 Структурные гены (С - core, Е1, Е2) кодируют ядерный и оболочечные гликопротеиды, в то время как неструктурные гены (NS2, NS3, NS4, NS5) - ферменты, участвующие в репликации вируса. Внутри генома имеются вариабельные и гипервариабельные участки, 6, 7 и в зависимости от их строения выделяют по крайней мере 6 различных генотипов HCV (возможно, их 12 или больше). 5, 8, 9 Генотипы вируса, по-видимому, различаются по иммуногенности, географическому распределению и, вероятно, влияют на течение HCV-инфекции и результаты лечения (см. также "Зависимость тяжести течения от генотипа HCV", "Ответ на лечение ИФН альфа-2b, влияние генотипа HCV"). 5, 7, 8 Вариабельность генома также может снижать чувствительность имеющихся диагностикумов для тестирования донорской крови и осложнять разработку вакцин против вируса. 10 (В настоящее время все усилия направлены на разработку вакцин на основе core региона, являющегося относительно стабильным участком у всех генотипов). 11, 12
Разные генотипы могут выявляться на протяжении инфекции у одного и того же больного. 13, 14 Исходя из этого было предположено, что наличие более вариабельных участков генома может отражать стратегию ускользания вируса от механизмов защиты хозяина. 5, 13, 15 По мнению других исследователей, данный феномен не имеет значения для репликации вируса. 13
Рис. 1 Организация генома HCV (По Van der Poel и соавт., 6 воспроизведено с разрешения)
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ HCV-ИНФЕКЦИИ
Anti-HCV и HCV РНК
По мере расширения представлений о структуре HCV методы выявления вируса становятся все более чувствительными. В настоящее время нет тест-систем для прямого определения антигенов HCV и больные тестируются на антитела к вирусу (anti-HCV). Скрининговым тестом обычно является иммуноферментный анализ (ELISA) (описан ниже). Положительные результаты контролируются более чувствительными методами рекомбинантного иммуноблоттинга (RIBA). По возможности необходимо исследование HCV РНК (с помощью полимеразной цепной реакции или метода амплификации разветвленной ДНК) для подтверждения наличия или отсутствия вируса в сыворотке.
Скрининговые тесты. Первые тест-системы для выявления anti-HCV основывались на обнаружении антител к вирусному антигену c 100 (anti-c100) с помощью ELISA первого поколения (табл. 1). 16 Однако anti-c100 могут появляться через много лет после инфицирования HCV; при этом наблюдается высокая частота ложноположительных результатов в популяциях низкого риска (таких как доноры), 14, 17-20 при исследовании длительно хранившихся образцов крови и у больных с гипергаммаглобулинемией. 21-23
Второе поколение тест-систем ELISA является более чувствительным, позволяя обнаруживать антитела к другим вирусным белкам, включая с22 и с33 (табл. 1). 24-26 Антитела к данным антигенам обнаруживаются чаще, чем anti-c100, и появляются в более ранние сроки. Они могут использоваться в диагностике как острой, так и хронической HCV-инфекции. 26-28
Третье поколение тест-систем ELISA сейчас широко используется для скрининга донорской крови, является более чувствительным и специфичным по сравнению с тест-системами ELISA предыдущих поколений 29-30 и дает почти 100% гарантию предотвращения заражения реципиентов донорской крови. Однако антитела могут быть не обнаружены у больных, инфицированных менее 6 месяцев назад, и у больных с иммуносупрессией. Возможны ложноположительные результаты (часто среди доноров). В связи с этим положительные результаты ELISA должны подтверждаться дополнительными тестами.
Табл. 1 Методы выявления антител к вирусу гепатита С (anti-HCV)
| Метод | Выявляемые антитела (кодирующий ген) |
| Скрининговые тесты | |
| I поколения ELISA | anti-c100 (NS4) |
| II поколения ELISA | anti-c22(C), anti-c33+anti-c100[anti-c200] (NS3/NS4) |
| II поколения ELISA | (С, NS3, NS4, NS5) |
| Дополнительные тесты | |
| I поколения RIBA | anti-c100 (NS4), anti-5-1-1 (белки NS3/NS4 регионов) |
| II поколения RIBA | anti-c22(C) ,anti-c33 (NS3), anti-c100 (NS4), anti-5-1-1 (NS3/NS4) |
| II поколения RIBA | (С, NS3, NS4, NS5) |
*Полимеразная цепная реакция (ПЦР), позволяющая выявить, клонировать и определить последовательность генома вируса, имеет наибольшую чувствительность из принятых тестов, позволяя определять РНК вируса даже при низком уровне виремии. ПЦР пока не доступна для широкого применения, имеет ограничения, связанные с возможностью загрязнения и количественным определением; в то же время амплификация вирусного генома дает большое преимущество в выявлении низких концентраций вируса и различий в нуклеотидной последовательности между разными генотипами. Количественное определение HCV РНК стало возможным благодаря адаптированию ПЦР с использованием метода серийных разведений или коамплификации РНК. 5 Новейший метод количественного определения основан на амплификации разветвленной ДНК (bDNA, Chiron). 36-39 Данный метод, выявляющий линейную корреляцию между тест-сигналом и титром вируса (более 3-4 log), более прост в исполнении, 40 но менее чувствителен, 5, 37 чем ПЦР. Результаты исследования могут различаться в зависимости от генотипа вируса. 38 Указанные тесты имеют важное значение при установлении связи титра HCV РНК с инфекциозностью, уровнем аминотрансфераз, тяжестью заболевания и ответом на противовирусную терапию.
HCV РНК. Тест-системы для прямого определения антигенов HCV в сыворотке еще не разработаны, и в настоящее время HCV РНК является лучшим маркером виремии, инфекциозности и активности болезни (см. "Хронический гепатит С. Биохимические показатели, сывороточные маркеры HCV"). Тестирование на HCV РНК проводится в основном в специализированных центрах, однако недавно появились коммерческие наборы для ПЦР. 32 Выявление HCV РНК с помощью ПЦР может подтвердить наличие виремии при отрицательных результатах исследования anti-HCV методами ELISA и RIBA. HCV РНК появляется в крови гораздо раньше других маркеров, обнаруживаясь спустя несколько дней после инфицирования. 33, 34 Следует, однако, отметить, что при циркуляции вируса в низких, подпороговых концентрациях HCV РНК может периодически не определяться. Поэтому суждение об отсутствии виремии на основании единичного отрицательного результата ПЦР не является окончательным.
HCV-инфекция представляется в настоящее время одной из актуальных проблем общественного здравоохранения в связи с ее распространенностью в популяции, высокой частотой формирования цирроза печени и гепатоцеллюлярной карциномы, развитием внепеченочных проявлений, определяющих трудности диагностики заболевания и его лечения. Вирус гепатита С является причиной 20% всех случаев острого гепатита, а хроническая HCV-инфекция ответственна за развитие 70% случаев хронического гепатита, 40% всех наблюдений терминального цирроза печени, 60% гепатоцеллюлярной карциномы и в 30% является причиной направления пациента на трансплантацию печени.
Отличительной особенностью вируса гепатита С является его значительная изменчивость с образованием множества одновременно существующих, иммунологически различающихся антигенных вариантов, обладающих значительными возможностями адаптации и способностью избегать иммунную систему хозяина.
В патогенезе поражения органов при HCV-инфекции обсуждаются прямой цитопатический эффект вируса и вызванные им иммунологические реакции, обуславливающие повреждение печени и других органов и тканей: репликация вируса вне печени - в тканях лимфоидного и нелимфоидного происхождения. Размножение вируса в иммуно-компетентных клетках (лимфоцитах) приводит к нарушению их иммунологической функции.
Для диагностики HCV-инфекции используются иммуноферментный метод (ELISA) и рекомбинантный иммуноблоттинг (RIBA) 1, 2, 3-го поколений, а также полимеразная цепная реакция - PCR.
Основным методом диагностики хронического гепатита С является морфологическое исследование печени, позволяющее уточнить стадию (наличие цирроза) и активность процесса, не всегда коррелирующую с уровнем трансаминаз и гаммаглобулинов сыворотки крови. Применение методов молекулярной биологии, исследование HCV РНК в ткани печени и других органов позволяют приблизиться к пониманию патогенеза острой и хронической HCV-инфекции.
Персистирование HCV дает широкий спектр клинико-морфологических вариантов: от стойких признаков активного заболевания и продолжающегося повреждения печени с развитием в дальнейшем клиники многосистемного страдания до состояния клинического выздоровления (от острой инфекции) с очень низким уровнем вирусной репликации и непрогрессирующим характером гистологических изменений.
Особенности течения хронического гепатита С определяются, наряду с уровнем виремии, генотипом вируса, дополнительными факторами, повреждающими печень: наличием двойной, тройной вирусной инфекции (HBV, HDV, вирусы герпесгруппы), злоупотреблением алкоголем, приемом ряда лекарств, вызывающих повреждение печени. Особый интерес представляют варианты хронического гепатита С с нормальным уровнем аланиновой и аспарагиновой аминотрансфераз в сыворотке крови. При данной форме гепатита не выявляется корреляция с уровнем виремии и генотипом HCV, в гистологической картине преобладают минимальная или умеренная активность процесса, дискутабельным остается вопрос о лечении подобных вариантов поражения печени.
У 40-45% больных наряду с печеночными проявлениями наблюдаются разнообразные внепеченочные проявления (табл.), нередко выходящие на первый план в клинической картине и в ряде случаев определяющие прогноз заболевания.
Таблица. Внепеченочные проявления хронической HCV-инфекции (1)
| Эндокринные | Гипертиреоз Гипотиреоз Тиреоидит Хашимото Сахарный диабет |
| Гематологические | Смешанная криоглобулинемия Идиопатическая тромбоцитопения Неходжкинская В-лимфома* Макроглобулинемия Вальденстрема Апластическая анемия |
| Поражение слюнных желез и глаз | Лимфоцитарный сиалоаденит* Язвы роговицы Mooren Увеит |
| Кожные | Кожный некротизирующий васкулит* Поздняя кожная порфирия Красный плоский лишай Мультиформная эритема* Узловатая эритема* Малакоплакия Крапивница* |
| Нейромышечные и суставные | Миопатический синдром* Периферическая полинейропатия* Синдром Гийена-Барре Артриты, артралгии* |
| Почечные | Гломерулонефрит* |
| Аутоиммунные и другие | Узелковый периартериит Интерстициальный легочный фиброз* Легочный васкулит* Гипертрофическая кардиомиопатия CRST-синдром Антифосфолипидный синдром Аутоиммунный гепатит 1 и 2 типа Синдром Бехчета Дерматомиозит |
Статистический анализ позволяет считать доказанной связь с хронической HCV-инфекцией таких внепеченочных проявлений, как смешанная криоглобулинемия, мембранопролиферативный гломерулонефрит, поздняя кожная порфирия, аутоиммунный тиреоидит. Предположительной считается связь HCV-инфекции с идиопатической тромбоцитопенией, красным плоским лишаем, язвами роговицы Mooren, синдромом Шегрена (лимфоцитарным сиалоаденитом) и В-клеточной лимфомой. В отношении других внепеченочных проявлений нет доказательств их тесной взаимосвязи с HCV-инфекцией, однако необходимы дальнейшие исследования, которые позволят, по-видимому, дополнить представленный перечень.
Из внепеченочных проявлений ХГС смешанная криоглобулинемия обнаруживается наиболее часто, особенно у женщин среднего и пожилого возраста с длительно текущей инфекцией (в среднем в течение 10,7 лет), при наличии цирроза печени. В зависимости от диагностических методов криоглобулинемия выявляется у 42-96% больных. У 10-42% больных имеются клинические проявления криоглобулинемии: слабость, артралгии, пурпура, периферическая полинейропатия, синдром Рейно, артериальная гипертония, поражение почек. В составе криопреципитатов выявляют HCV РНК и lgG anti-HCV к структурным и неструктурным белкам HCV (core, E2/NS1, NS3, NS4, NS5), lgM anti-HCV к core-белку; С3-фракцию комплемента. Концентрация HCV РНК в криопреципитатах в 103-105 раз выше, чем в сыворотке. HCV РНК при криоглобулинемии выявляется также в костном мозге, мононуклеарах периферической крови, кератиноцитах, эпителии протоков и эндотелиоцитах. Ряд больных с клиническими признаками криоглобулинемии имеют минимальные гистологические признаки поражения печени. Роль HCV-инфекции в развитии криоглобулинемии подтверждается исчезновением клинических проявлений криоглобулинемии в результате противовирусной терапии интерфероном альфа.
Идиопатическая тромбоцитопения, возможно, обусловлена HCV-инфекцией в большей части случаев, чем считалось ранее.
Сиалоаденит встречается у 14-57% больных ХГС, однако в большинстве случаев типичная картина синдрома Шегрена (клинические, гистологические признаки, серологические маркеры) отсутствует.
Разнообразные поражения кожи описаны в сочетании с ХГС, из них кожный некротизирующий васкулит с папулезными или петехиальными высыпаниями, обусловленный отложением криоглобулинов, наиболее четко ассоциирован с HCV-инфекцией. Несмотря на то, что HCV РНК выявляется в коже и кератиноцитах, в патогенезе некротизирующего васкулита рассматривается больше роль криоглобулинемии, чем репликации вируса в стенке сосудов.
Нейромышечные и суставные внепеченочные проявления хронической HCV-инфекции разнообразны и в большинстве случаев обусловлены криоглобулинемией. Мышечная слабость, миопатический синдром, миалгии, единичные наблюдения миастении упоминаются в связи с ХГС. В дебюте ОВГС описан синдром Гийена-Барре, но чаще хроническая HCV-инфекция сочетается с периферической полинейропатией в рамках криоглобулинемии.
Системность поражения, наблюдаемая при HCV-инфекции, отражает генерализованный характер гепатита С с вовлечением в патологический процесс многих органов и тканей, что затрудняет своевременную диагностику и лечение хронического гепатита.
Вирус гепатита С и его геном
Вирус гепатита С (HCV) идентифицирован в 1989 году американскими исследователями под руководством М. Houghton, когда была выделена нуклеиновая кислота при экспериментальном заражении шимпанзе и в дальнейшем получена ДНК-копия, которую использовали для создания библиотеки клонов. Скрининг образцов из этой библиотеки позволил выявить клон, экспрессирующий антиген, который реагировал с антителами из сывороток людей, больных посттрансфузионным гепатитом ни А ни В.
Далее был получен рекомбинантный белок, который содержал последовательность из 363 аминокислотных остатков вирусного белка. Эту последовательность обозначили как С-100-3 и использовали в качестве антигена при создании иммуноферментной тест-системы.
Геном вируса гепатита С представлен однонитевой позитивной линейной молекулой РНК, состоящей из 9379 оснований и кодирующей полипротеин из ЗОН аминокислот, который под действием вирусных и клеточных протеаз нарезается на отдельные вирусные белки. Таксономический анализ выявил принадлежность вируса гепатита С к семейству Flaviviridae самостоятельному роду Hepacivirus.
Проведенный анализ нуклеотидных последовательностей изолятов вируса гепатита С различных частей его генома сделал возможным классификацию этого вируса. Наиболее удобной в настоящее время является номенклатура P. Simmonds et al, 1993, основанная на анализе последовательностей области NS5. Эта классификация, а также разработанная примерно в это же время система Н. Okamoto et al., 1992 стала общепринятой. К наиболее распространенным в мире генотипам вируса гепатита С относят: la, lb, 2а, 2b и 3а. Эти генотипы распространены в странах Западной Европы и в Америке, причем преобладающим является генотип lb.
Совсем другое распределение генотипов HCV в странах центрального Востока и Северной и Центральной Африки. Генотип 4, главным образом 4а, доминирует в Египте, Йемене, Кувейте, Ираке, Саудовской Аравии, Заире, Бурунди, Габоне. На юге Африке наиболее часто встречается генотип 5а, который в других частях мира находили исключительно редко. Генотип 3 выявлен в странах Западной Европы, в Сингапуре, Таиланде, Мьянме и Восточной Индии. Всего выделено 9 подтипов третьего генотипа HCV.
В России также проведены исследования по определению структуры генотипов ВГС, циркулирующих в различных ее регионах. Наиболее часто — 60-70 % случаев определен генотип HCV lb. Далее следуют генотипы За, 1а, и 2а. Так, в 1998 году Е. В. Лисицина во Владимирской области выявила следующую структуру генотипов HCV: lb — 72,9 %, 2а — 2,9 %, 2Ь — 2,9 % и За — 15,7 %. В 5,7 % случаев с имеющимся набором праймеров генотип определить не удалось.
При этом было отмечено, что у лиц различного возраста структура генотипов различается. У лиц в возрасте 7-14 лет генотип It и За выявлен с одинаковой частотой —42,9%. Среди лиц старше 50 лет генотип lb выявлен в 90% случаев, тогда как За не определен вовсе.
Гепатит С. Вирус гепатита С. Диагностика гепатита С. Лечение гепатита С. Профилактика гепатита С.
Гепатит С обычно протекает хронически и характеризуется преимущественным развитием хронических форм гепатита с исходом в цирроз и первичную карциному печени. Вирус гепатита С включён в состав рода семейства Flaviviridae.
Резервуар возбудителя гепатита С — инфицированный человек. Основной путь передачи вируса гепатита С — парентеральный. Основное отличие от эпидемиологии вируса гепатита В — более низкая способность вируса гепатита С к передаче от беременной к плоду и при половых контактах.
Больной выделяет вирус гепатита С за несколько недель до появления клинических признаков и в течение 10 нед после начала проявлений. Заболевание чаще регистрируют в США (до 90% всех трансфузионных гепатитов) и Африке (до 25%).
Для клинической симптоматики вирусного гепатита С характерны изменение консистенции и размеров печени. При активном процессе печень обычно увеличена и болезненна при пальпации, её консистенция умеренно плотная. Другие проявления включают спленомегалию, диспепсический и астенический синдромы, желтуху, артралгии и миалгии, кардиты, васкулиты, лёгочные поражения, анемии и др. Осложнения хронического процесса — цирроз и первичная карцинома печени.

Принципы микробиологической диагностики гепатита С
Маркёры репликации вируса гепатита С — AT [IgM) к Аг вируса гепатита С и вирусная РНК. Маркёры гепатита С выявляют методами ИФА и ПЦР.
Показание для поиска AT или РНК вируса гепатита С — любое воспалительное заболевание печени. Вирусспецифические AT появляются в среднем через 3 мес и указывают на возможное инфицирование вирусом гепатита С или на перенесённую инфекцию. В серонегативный период выявляют РНК вируса гепатита С. Для подтверждения результатов ИФА, а также при обследовании пациентов, не относящихся к основным группам риска, применяют метод рекомбинантного иммуноблотинга, позволяющий эффективно исключить ложноположительные результаты ИФА.
Лечение и профилактика гепатита С
Средства этиотропной терапии гепатита С отсутствуют; при хронических инфекциях можно использовать а-ИФН. На фоне терапии ИФН у 40-70% больных отмечают стихание воспалительного процесса (на что указывает снижение содержания концентрации аминотрансфераз в сыворотке), однако по окончании курса у 40-50% пациентов наблюдают рецидив воспаления.
Средства специфической иммунопрофилактики гепатита С не разработаны.
Читайте также:

