Молекулярная модель вируса гриппа
Обновлено: 22.04.2024
Вирус гриппа — это широко распространенный, легко передающийся и быстро эволюционирующий возбудитель заболевания. Симптомы гриппа могут напоминать признаки обычной простуды, однако болезнь чревата осложнениями, которые особенно опасны для маленьких детей, пожилых людей и тех, кто страдает хроническими заболеваниями. Новые штаммы гриппа возникают ежегодно. Штаммы — это разновидности вируса, отличающиеся друг от друга двумя поверхностными белками, которые быстро накапливают изменения и тем самым увеличивают их разнообразие. В случае одновременного заражения организма разными штаммами белки могут попадать в формирующиеся в этом процессе новые частицы в произвольных сочетаниях, что вновь ведет к росту разнообразия вирусов. Это, в свою очередь, вызывает дополнительные проблемы с лечением инфекции и увеличивает риск межвидового заражения.
Грипп встречается не только у людей, но и среди животных. Циркулируя в их популяциях, вирус нередко приобретает наиболее неприятные для человека свойства.
История эпидемий гриппа
Успехи в разработке противовирусных препаратов и профилактических мер, а также активный мониторинг распространения и возникновения новых штаммов гриппа позволяют сокращать число жертв и интенсивность эпидемий. Однако и сейчас в результате вызываемых им осложнений погибает от 250 до 500 тысяч человек в год.
Международный проект компании Visual Science"Зоопарк вирусов" — первая успешная попытка создать модели наиболее распространенных и опасных вирусов человека с разрешением до атомов.
Задача построения научно достоверной 3D-модели вируса не так тривиальна, как кажется на первый взгляд. Ни один из имеющихся на сегодняшний день научных подходов, будучи применён по отдельности, не позволяет получить изображение целой вирусной частицы в атомном или даже молекулярном разрешении. На молекулярном уровне вирусы представляют собой структуры огромного размера: один вирус — это комплекс сотен макромолекул (белков,нуклеиновых кислот, в ряде случаев липидов). Несмотря на это, вирусы слишком малы для того, чтобы их можно было досконально изучить, используя электронную и тем более оптическую микроскопию: эти инструментальные методы хорошо подходят для исследования строения существенно более крупных биологических объектов, например клеток. В частности, электронная микроскопия даёт возможность получить грубые изображения, на которых видны лишь контурывириона (этот метод не всегда позволяет увидеть даже крупные поверхностные белки).
Для изучения отдельных белков широко используются методы рентгеноструктурной кристаллографии и ядерного магнитного резонанса. Полученные с их помощью данные представляют собой пространственные координаты атомов, входящих в состав молекулы, в наиболее энергетически выгодном положении из возможных. В контексте задачи визуализации структуры вириона недостатки этого метода связаны с невозможностью исследования с его помощью более массивных объектов (он неприменим даже к небольшим комплексам нескольких белков) и трудностью изучения подвижных и связанных с мембранами компонентов вируса.
Таким образом, задача создания научно достоверных 3D-моделей напоминает сборку паззла, где в исходном наборе не хватает значительной части фрагментов, отдельные фрагменты являются неполными, а иллюстрация результата, к которому стремятся собирающие паззл исследователи, груба, и потому даёт только общее представление о конечной картине. Тем не менее, сотни работ разных авторов со всего мира проливают свет на многие вопросы структуры и морфологии компонентов вирионов, а также их взаимодействия. При тщательном анализе всех научных работ, с учетом мнений признанных экспертов из мировых научных центров и помощи специалистов Отдела молекулярного моделирования компании Visual Science, устраняющих пробелы в имеющихся исследованиях по молекулярной биологии, вирусологии и кристаллографии, появляется возможность создать максимально точные и достоверные модели вирусов, которые и представлены в проекте Viral Park.
Компоненты вируса: более 200 тысяч молекул 11 типов
Вирион гриппа имеет форму удлинённой по одной из осей сферы диаметром 80-120 нанометров, что в тысячи раз меньше толщины человеческого волоса. Продолговатую форму вируса определяет слой структурного белка — матрикса. С внешней стороны матрикс окружён мембраной с поверхностными белками (гемагглютинином и нейраминидазой) и ионными каналами. Геном вируса — это восемь молекул РНК в составе спиральных комплексов. Он, как и белки, необходимые для полноценной работы вируса в зараженной клетке, находится внутри частицы.
— Гемагглютинин связывается с рецепторами на поверхности клетки, позволяя частице слиться с мембраной клеточной везикулы, проникнуть внутрь нее и доставить геном вируса в цитоплазму.
— Нейраминидаза нужна для того, чтобы только что сформированные вирионы могли отделяться от клеточной мембраны и заражать другие клетки.
— Белок матрикса — одна из основных структурных молекул вируса. Именно с этим белком связана характерная форма вирусной частицы и расположение в ней внутренних компонентов (что, в свою очередь, детерминирует правильность распаковки и процесса заражения), он же определяет её размеры. Молекулы белка матрикса связываются как с поверхностными белками, так и с нуклеопротеиновыми комплексами вируса, позволяя всем компонентам попадать в частицу.
— Белок M2 образует каналы, через которые внутрь частицы проникают ионы водорода после того, как та оказывается в клетке. Это запускает разборку вируса и высвобождение его генома.
— Нуклеопротеин упаковывает фрагменты вирусного генома в компактные спирально закрученные комплексы геномной РНК и белка NP — рибонуклеопротеиды (РНП),которые помещаются внутри вирусной частицы.
— Белок ядерного экспорта обеспечивает транспорт копий РНК генома из ядра, где они образовались, к месту сборки новых частиц вируса у поверхности зараженной клетки.
— Полимеразный комплекс необходим для создания копий РНК вируса, одна часть которых нужна для того, чтобы синтезировать структурные белки, а другая — чтобы упаковываться в новые вирусные частицы. Геном вируса несет информацию, необходимую для синтеза вирусных белков. Он представлен восемью молекулами РНК, отличающимися длиной и набором кодируемых белков.
— Мембрана вируса формируется из мембраны клетки, в которой он образовался. В ее состав входят молекулы фосфатидилхолина, фосфатидилэтаноламина, сфингомиелина и холестерина — в характерных для клеток человека пропорциях.
Процесс создания научно достоверных 3Д моделей вирусов
Пространственные структуры некоторого количества белков, входящих в состав вирионов (этадоля варьируется от 25 до 50%), описаны не полностью: проблемы возникают из-за того, что не все белковые молекулы или отдельные их фрагменты возможно кристаллизовать (а это является условием проведения рентгеноструктурного анализа). Обычно в структурах недостаёт подвижных фрагментов молекул, а также трансмембранных участков и гликозильных остатков поверхностных белков. В то же время для комплексов и ансамблей белков в большинстве случаев неизвестно, какие поверхности компонентов формируют контакты друг с другом, а какие — нет. Предсказание и описание таких взаимодействий необходимо при построении любой вируснойчастицы (для большей части входящих в неё молекулярных комплексов и структур).
Эти проблемы позволяет решить структурная биоинформатика, основанная на вычислительных методах: в данном подходе используется предсказание пространственной структуры исследуемой молекулы на основе структур схожих или родственных протеинов и исходной последовательности аминокислот, которая в большинстве случаев известна заранее. Кроме того, подобные методы позволяют рассчитать меж- и внутримолекулярные взаимодействия. В компании Visual Science эту задачу решает Отдел молекулярного моделирования и динамики: работающие в нем специалисты — молекулярные биологи и биоинформатики, обладающие научными степенями. Они проводят анализ опубликованных ранее кристаллографических данных (параллельно оценивая точность описания похожих белков), осуществляют моделирование недостающих фрагментов и в результате проводят сборку полных достоверных моделей всех компонентов и комплексов вирусной частицы, комбинируя известные данные с теми, что получены ими в Отделе. Подобный уровень сотрудничества с научным сообществом, а также столь высокая степень вовлечения в этот процесс структурных биологов из числа сотрудников Отдела молекулярного моделирования компании на данный момент недоступны ни одной студии научной и медицинской визуализации в мире — кроме Visual Science.
Дополнительные материалы: научный обзор и панорама 3Д модели вируса гриппа.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Георгий Александрович Базыкин — кандидат биологических наук, заведующий сектором молекулярной эволюции в Институте проблем передачи информации им. А. А. Харкевича РАН, ведущий научный сотрудник лаборатории эволюционной геномики факультета биоинженерии и биоинформатики МГУ им. М. В. Ломоносова. Занимается изучением различных вопросов биологической эволюции с использованием методов геномики и биоинформатики.
Юрий Эдуардович Стефанов — кандидат биологических наук, научный сотрудник Института молекулярной биологии РАН им. В. А. Энгельгарта и научный консультант студии научного дизайна Visual Science. Область научных интересов — эволюция мобильных генетических элементов, трехмерное компьютерное моделирование вирусных частиц.
В общественном сознании закрепилось довольно легкомысленное отношение к гриппу. Действительно, зачастую его симптомы не тяжелее простудных, да и беспокоит он нас не дольше недели, причем проходит обычно без всякого лечения. Однако история взаимодействий человека и вируса гриппа требует более серьезного подхода к этому патогену. Достаточно вспомнить, что одни из самых страшных пандемий прошлого века были вызваны этим вирусом * . Да и обычный сезонный грипп далеко не безвреден: по оценкам Всемирной организации здравоохранения, ежегодно от него и связанных с ним осложнений умирают сотни тысяч человек (в первую очередь, пожилые люди, младенцы и страдающие хроническими заболеваниями), а в годы тяжелых пандемий — миллионы. По числу унесенных жизней среди инфекционных заболеваний грипп уступает, пожалуй, только ВИЧ. Основная проблема профилактики и лечения гриппа связана с тем, что вирус очень быстро меняется, и каждый год мы имеем дело с его новыми формами, поведение которых далеко не всегда можно предсказать. Очередным шагом на пути к пониманию изменчивости вируса гриппа стал компьютерный анализ последовательностей аминокислот в белках вируса и нуклеотидов в его геноме.
Первая в мире полная достоверная модель вируса гриппа A/H1N1 с атомным разрешением, созданная в рамках проекта Viral Park компании Visual Science при участии Национального центра биотехнологии в Мадриде. Цель проекта — построение научно достоверных 3D-моделей распространенных вирусов человека с максимальной детализацией. Специалисты Visual Science собирают воедино данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии вирусов, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании. Модель в значительной степени построена на основе данных, опубликованных исследовательскими коллективами под руководством: Хуана Ортина (Испанский национальный центр биотехнологий, Мадрид, Испания), Такеши Нода (Университет Токио, Япония), Роба Ригро (Отдел взаимодействий вируса и клетки, Гренобль, Франция) и Питера Розенталя (Национальный институт медицинских исследований, Лондон, Великобритания). Точное строение генома вируса гриппа удалось смоделировать благодаря сотрудничеству с Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания), группа которого добилась уникальных результатов в описании упаковки вирусного генетического материала. Создатели модели: Иван Константинов (руководитель проекта), Юрий Стефанов (научный консультант), Анастасия Бакулина (ведущий молекулярный моделлер), Дмитрий Щербинин (молекулярный моделлер), Александр Ковалевский (3D-моделлер)
Сегментированный геном
Общая длина генома вируса гриппа составляет приблизительно 13 500 нуклеотидов [2]. Три самых крупных (примерно по 2300 нуклеотидов) его сегмента (PA, PB1 и PB2) кодируют вирусную полимеразу — белок, копирующий РНК и состоящий из трех крупных субъединиц. Четвертый по длине (около 1750 нуклеотидов) сегмент (HA) отвечает за синтез гемагглютинина. Этот белок заякорен в липидной оболочке вируса и отвечает за его проникновение в клетку, связываясь с рецептором на поверхности клеточной мембраны [3]. В зависимости от того, какой именно вариант гемагглютинина несет вирус, связывание может быть более или менее крепким. После этого клетка поглощает вирус, помещая его в мембранный пузырек внутри цитоплазмы. Большинство макромолекулярных комплексов, поглощаемых таким образом, перевариваются клеткой. Однако вирус избегает этой участи: его мембрана сливается с мембраной пузырька, в результате чего ее содержимое оказывается в цитоплазме. В этом процессе гемагглютинин также играет важную роль. Затем геном вируса проникает в ядро, где с него может начать считываться информация.
Сегмент размером около 1550 нуклеотидов (NP) кодирует нуклеопротеин — белок, необходимый вирусу для упаковки РНК. Множество копий такого белка распределяется по каждому из геномных сегментов, связываясь с молекулой нуклеиновой кислоты. В результате фрагменты генома образуют нуклеопротеидные тяжи, сложенные пополам и закрученные в спираль, к каждому из которых прикрепляется своя копия полимеразного комплекса [4].
Сегмент M1/M2 длиной 1000 нуклеотидов, в соответствии со своим названием, кодирует сразу два белка — М1 и М2. Из молекул первого из них образован слой (матрикс), подстилающий вирусную липидную оболочку. Обычно М1 играет ключевую роль в формировании вирусных частиц, поскольку он взаимодействует одновременно с поверхностными белками вируса и внутренними компонентами вирусной частицы. Задача матриксного белка — собрать все составляющие воедино [6]. Белок М2 выполняет роль ионного канала. Он расположен в липидной оболочке вируса и способствует его распаковке в цитоплазме клетки [7].
Последний, самый короткий (из 865 нуклеотидов) сегмент РНК вируса гриппа отвечает за синтез двух белков, которые не попадают в зрелую вирусную частицу. Эти белки называются NS1 и NEP. Первый необходим вирусу, в частности, для того, чтобы блокировать считывание информации с клеточных молекул РНК [8]. Благодаря ему клетке приходится синтезировать преимущественно вирусные белки, оставляя свои собственные нужды. Второй белок, NEP, обеспечивает транспорт новообразованных геномных комплексов вируса из ядра к клеточной мембране, где происходит сборка вирионов [9].
Новые штаммы и поиск реассортаций
Классификация штаммов вируса гриппа основана прежде всего на том, какие именно варианты гемагглютинина и нейраминидазы входят в его состав. Широко известные комбинации букв H и N в сочетании с порядковыми номерами (например, H3N2) как раз и обозначают подтип вируса: гемагглютинин 3, нейраминидаза 2. Таких подтипов десятки, однако человека заражают лишь немногие — обычно те, у которых не слишком большие номера N и H. Наиболее давние хозяева вируса гриппа — птицы, от которых новые штаммы время от времени передаются домашнему скоту и, прямо или опосредованно, людям [10]. Чем более долгий период коэволюции провели вместе патоген и хозяин, тем менее болезненным становится их совместное существование. Птичьи штаммы вируса зачастую оказываются очень опасными после передачи новым хозяевам [11].
Известно, что именно реассортации сегментов РНК привели к возникновению штаммов, которые вызвали пандемии азиатского и гонконгского гриппа в 1957 и 1968 гг., унесшие около 2,5 млн жизней [12]. Возможно, что и испанский грипп начала прошлого века, число жертв которого шло на десятки миллионов, тоже появился в результате такой эволюционной схемы [13].
Подобное исследование можно провести с использованием геномов вируса гриппа, опубликованных в свободном доступе. Избрав в качестве объекта штаммы H3N2, можно составить выборку из 1376 сегментированных геномов, а затем сравнить между собой филогенетические деревья для этих вирусов, построенные в отдельности по каждому из геномных сегментов [15].
В результате такого сравнения оказалось, что число реассортаций примерно сопоставимо для разных сегментов: в ходе эволюции гриппа в популяции человека каждая пара сегментов в недавнем прошлом реассортировала около 50 раз.
Последствия реассортаций
После того как ветви, в которых произошли реассортации, были обнаружены, стало возможным оценить их влияние на накопление в сегментах вирусного генома точечных замен. Для этого можно сравнить время, прошедшее между каждой такой заменой и ближайшей предшествующей ей реассортацией, с тем, которое бы ожидалось из компьютерной модели, если бы реассортации не влияли на замены. Проведенный анализ показал, что по крайней мере в пяти из восьми сегментов генома мутации ускоренно накапливаются после реассортации. Наиболее ярко эффект проявился для нейраминидазы и белка PB1. Ускорение аминокислотных замен после реассортаций вирусных геномов указывает на то, что в такие периоды эволюции вируса гриппа прежде всего происходит адаптация белков к новому генетическому окружению. Из-за того, что вирусные белки взаимодействуют между собой, молекулы из разошедшихся штаммов вынуждены какое-то время изменяться, приспосабливаясь друг к другу.
Интересно, что у нейраминидаз наблюдалось 30 замен, расстояние от которых до ветви, несущей реассортацию, меньше того эволюционного расстояния, на котором мы бы ожидали встретить одну случайную синонимичную замену в гене данного белка. Такой результат свидетельствует о том, что все эти 30 мутаций произошли и закрепились необычайно быстро, и что необходимость быстрой адаптации возникла именно благодаря тому, что соответствующий сегмент генома попал в новое генетическое окружение.
Реассортация — это резкое эволюционное изменение, которое поначалу может снижать общую приспособленность вируса к условиям окружающей среды и к организму-хозяину. Однако иногда оказывается, что из-за такой перетасовки белков из разных штаммов новая форма патогена оказывается более приспособленной, чем штаммы-предшественники, получая возможность эффективнее распространиться [18]. Похоже, что за коррекцию первичного вредного эффекта от реассортации как раз и отвечают быстро закрепляющиеся адаптивные мутации.
Предсказания, полученные только статистическими методами, — путем анализа последовательностей белков и кодирующих их генов, — конечно, не могут иметь стопроцентную точность. Действительно ли взаимодействуют две определенные аминокислоты, можно проверить экспериментально. Однако каждый белок вируса состоит из сотен аминокислот, так что возможны десятки тысяч разных взаимодействий. Постановка такого числа экспериментов практически неосуществимы. Биоинформатический анализ позволяет расставлять приоритеты: выбирать и анализировать только те аминокислоты, которые участвуют во взаимодействиях, экономя время и силы экспериментаторов. Кроме того, такой подход позволяет понять, насколько взаимодействия, приводящие к вредности реассортаций, распространены на уровне всего генома.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 13-04-02098) и Министерства образования и науки Российской Федерации (проект 11.G34.31.0008).
Литература
1. Steinhauer D. A., Domingo E., Holland J. J. Lack of evidence for proofreading mechanisms associated with an RNA virus polymerase // Gene. 1992. V. 22. № 2. P. 281–288.
2. Teng Q., Hu T., Li X. et al. Complete genome sequence of an H3N2 avian influenza virus isolated from a live poultry market in Eastern China // J. Virol. 2012. V. 86. № 21. P. 11944. DOI: 10.1128/JVI.02082-12.
3. Carr C. M., Kim P. S. A spring-loaded mechanism for the conformational change of influenza hemagglutinin // Cell. 1993. V. 73. № 4. P. 823–832.
4. Arranz R., Coloma R., Chichуn F. J. et al. The structure of native influenza virion ribonucleoproteins // Science. 2012. V. 338. № 6114. P. 1634–1637. DOI: 10.1126/science.1228172.
5. Kamali A., Holodniy M. Influenza treatment and prophylaxis with neuraminidase inhibitors: a review // Infection and Drug Resistance. 2013. № 6. P. 187–198. DOI: 10.2147/IDR.S36601.
6. Nayak D. P., Hui E. K., Barman S. Assembly and budding of influenza virus // Virus Res. 2004. V. 106. № 2. P. 147–165.
7. Lear J. D. Proton conduction through the M2 protein of the influenza A virus; a quantitative, mechanistic analysis of experimental data // FEBS Lett. 2003. V. 552. № 1. P. 17–22.
8. Hale B. G., Randall R. E., Ortнn J. et al. The multifunctional NS1 protein of influenza A viruses // J. Gen. Virol. 2008. V. 89. № 10. P. 2359–2376. DOI: 10.1099/vir.0.2008/004606-0.
9. Robb N. C, Smith M., Vreede F. T. et al. NS2/NEP protein regulates transcription and replication of the influenza virus RNA genome // J. Gen. Virol. 2009. V. 90. № 6. P. 1398–1407. DOI: 10.1099/vir.0.009639-0.
10. El Zowalaty M. E., Bustin S. A., Husseiny M. I. et al. Avian influenza: virology, diagnosis and surveillance // Future Microbiol. 2013. V. 8. № 9. P. 1209–1227. DOI: 10.2217/fmb.13.81.
11. Kaplan B. S., Webby R. J. The avian and mammalian host range of highly pathogenic avian H5N1 influenza // Virus Res. 2013. V. 178. № 1. P. 3–11. DOI: 10.1016/j.virusres.2013.09.004.
12. Kilbourne E. D. Influenza pandemics of the 20th century // Emerg. Infect. Dis. 2006. V. 12. № 1. P. 9–14.
13. Suzuki Y. A phylogenetic approach to detecting reassortments in viruses with segmented genomes // Gene. 2010. V. 464. № 1–2. P. 11–16. DOI: 10.1016/j.gene.2010.05.002.
14. Nagarajan N., Kingsford C. GiRaF: robust, computational identification of influenza reassortments via graph mining // Nucleic Acids Research. 2011. V. 39. № 6. e34. DOI: 10.1093/nar/gkq1232.
15. Neverov A. D., Lezhnina K. V., Kondrashov A. S., Bazykin G. A. Intrasubtype Reassortments Cause Adaptive Amino Acid Replacements in H3N2 Influenza Genes // PLoS Genet. 2014. V. 10. № 1. e1004037. DOI: 10.1371/journal.pgen.1004037
16. Wolf Y. I., Viboud C., Holmes E. C. et al. Long intervals of stasis punctuated by bursts of positive selection in the seasonal evolution of influenza A virus // Biol. Direct. 2006. V. 1. P. 34.
17. Kryazhimskiy S., Dushoff J., Bazykin G. A. et al. Prevalence of epistasis in the evolution of influenza A surface proteins // PLoS Genet. 2011. V. 7. № 2. e1001301. DOI: 10.1371/journal.pgen.1001301.
18. Li K. S., Guan Y., Wang J. et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia // Nature. 2004. V. 430. № 6996. P. 209–213.
19. Ferguson N. M., Fraser C., Donnelly C. A. et al. Public health. Public health risk from the avian H5N1 influenza epidemic // Science. 2004. V. 304. № 5673. P. 968–969.
20. Yong E. Influenza: Five questions on H5N1 // Nature. 2012. V. 486. № 7404. P. 456–458. DOI: 10.1038/486456a.
21. Herfst S., Schrauwen E. J., Linster M. et al. Airborne transmission of influenza A/H5N1 virus between ferrets // Science. 2012. V. 336. № 6088. P. 1534–1541. DOI: 10.1126/science.1213362.
22. Imai M., Watanabe T., Hatta M. et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets // Nature. 2012. V. 486. № 7403. P. 420–428. DOI: 10.1038/nature10831.
23. Russell C. A., Fonville J. M., Brown A. E. et al. The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host // Science. 2012. V. 336. № 6088. P. 1541–1547. DOI: 10.1126/science.1222526.
Вирусы гриппа передаются воздушно-капельным путём и могут сохранять жизнеспособность в течение 2-8 часов на одежде и бумаге, а на металлических поверхностях — даже до суток (8 и 9). Инфекция легче распространяется зимой, и некоторые исследователи связывают это с тем, что в условиях холодного и сухого воздуха вирус дольше сохраняет вирулентность. Дополнительный фактор — то, что температура в верхних дыхательных путях человека в этот период больше подходит для размножения вируса (10).
Чаще всего от осложнений, вызываемых гриппом, погибают пожилые люди старше 65 лет, дети до двух лет, а также люди с хроническими заболеваниями. Однако следует отметить, что от пандемии свиного гриппа 2009 года погибло аномально большое число молодых людей. Этот факт объясняют тем, что у пожилых людей мог сохраниться иммунитет к схожим штаммам гриппа, которые циркулировали в популяции значительно раньше (11 и 12).
При переходе от одного штамма к другому вирулентность и уровень смертности от гриппа сильно варьируются. Так, птичий грипп H5N1, вызвавший региональную эпидемию в Восточной Азии в 1997 году, отличался крайне высоким уровнем смертности среди заболевших (до 50%), однако передавался он весьма неэффективно, и количество заражённых не превысило нескольких сотен человек (18).
Морфология и структурные белки
Вирусы семейства Orthomyxoviridae имеют липидную оболочку, образованную частью мембраны хозяйской клетки (19 и 20). В мембрану включены поверхностные белки. У вирусов гриппа их два — гемагглютинин (H), необходимый для того, чтобы связываться с клеточными рецепторами и проникать внутрь клетки хозяина, и нейраминидаза (N), которая отрезает новообразованную частицу вируса от клеточных рецепторов и дает ей возможность переместиться к новой клетке. Также мембрана вируса содержит образованные белком М2 каналы — они служат для распаковки частицы в цитоплазме. Под мембраной вируса находится слой матрикса, сформированный структурным белком М1. В центре частицы располагается генетический материал, представленный восемью молекулами РНК, каждая из которых соединена со структурными белками NP (nucleoprotein) и полимеразным комплексом, ответственным за их копирование (5, 21, 22).
Вирусы гриппа могут иметь как сферическую, так и филаментную форму (23). Диаметр сферических частиц сопоставим с диаметром ВИЧ — 80-120 нм. Вариации в форме разных типов и штаммов обусловлены различиями в строении белков матрикса, который располагается непосредственно под мембраной (24 и 25). Отдельные белки вируса гриппа являются объектом исследования как вероятные мишени для противовирусных препаратов. Так, большое внимание уделяется разработке ингибиторов нейраминидазы, блокирующих работу этого фермента, что не дает новому вирусу покинуть клетку (26). По этому принципу, в частности, работают лекарства Тамифлю и Реленца (27). Разработаны также препараты, мешающие частице распаковываться в цитоплазме зараженной клетки или содержащие антитела к различным типам гемагглютинина (28).
Ключевые белковые молекулы, обеспечивающие жизнедеятельность и воспроизводство вируса гриппа — поверхностный белок гемагглютинин, энзим нейраминидаза и белки матрикса M1. По принципу строения гемагглютинин напоминает поверхностный белок вирусаЭбола (29 и 30). Этот белок является гомотримером, имеющим трансмембранную и поверхностную части, которые связаны между собой дисульфидными связями. Попадание вируса в клетку происходит после того, как гемагглютинин связывается с клеточными рецепторами, несущими сиаловую кислоту (31). Вирус попадает в цитоплазму в составе везикулы. Когда среда внутри везикулы становится более кислой, гемагглютинины меняют свою конформацию и вызывают слияние вирусной мембраны и мембраны везикулы (32). Белки М2 формируют каналы, через которые ионы водорода попадают внутрь вирусной частицы, нарушая взаимодействие между матриксом и генетическим материалом вируса и обеспечивая тем самым возможность последнему попасть в цитоплазму (33). Препараты Ремантадин иАмантадин (а также их аналоги) нацелены на ингибирование белка М2 и предотвращение распаковки вируса — однако, они менее эффективны, чем ингибиторы нейраминидазы, и сейчас их уже редко рекомендуют для лечения гриппа (27).
Работа нейраминидазы важна на завершающих стадиях жизненного цикла вируса. Этот белок состоит из четырех одинаковых субъединиц (34), а его функция заключается в отщеплении терминальных остатков сиаловой (нейраминовой) кислоты от гликозилированных рецепторов, с которыми связывается гемагглютинин. Без этого вновь образованные вирусные частицы не смогут отсоединиться от поверхности хозяйской клетки (35). Отщепление сиаловой кислоты также препятствует повторному заражению клетки другими вирусными частицами. Ингибиторы нейраминидазы, замедляющие распространение вируса в организме, являются действующим компонентом противогриппозных препаратов Занамивира и Озельтамивира (36). Впрочем, озельтамивир (действующее вещество препарата Тамифлю) перестаёт действовать, если в нейраминидазе вируса 274-я аминокислота гистидин меняется на тирозин. Занамивир (действующее вещество препарата Реленца) в этом случае не теряет активности, однако он провоцирует побочные эффекты, поэтому его рекомендуют применять только в тех случаях, когда Тамифлю не действует (27 и 37).
Белки матрикса М1 играют ключевую роль в сборке новых вирусных частиц (38 и 39). Перед формированием новых вирионов они скапливаются с внутренней стороны клеточной мембраны, взаимодействуя при этом как с поверхностными белками, так и с находящимися в цитоплазме комплексами вирусного генома, благодаря чему все компоненты будущего вируса собираются воедино. Наличие матрикса характерно для вирусов с липидной мембраной — таких, например, как ВИЧ или вирус Эбола (40 и 41). Кроме того, этим вирусам присуще почкование из специфических областей клеточной мембраны — липидных рафтов, молекулярный состав которых делает их несколько менее лабильными в сравнении с другими участками мембраны (42).
Внутри вируса: как упакован генетический материал
Основная цель любого вируса — это воспроизводство собственного генома путём создания копий. Информация обо всех структурных и функциональных компонентах вируса находится в РНК. Каждая вирусная частица содержит одну копию генома, компактно уложенную в виде восьми отдельных спиральных структур. Совокупная длина этих молекул рибонуклеиновой кислоты превышает диаметр вируса в N раз. В переносе и хранении генетической информации важную роль играет то, что РНК содержится в вирусе в составе рибонуклеиновых комплексов.
Генетический материал гриппа разделён на части, каждая из которых отвечает за синтез отдельных вирусных белков. Поэтому в случае попадания в одну клетку разных штаммов при сборке новых частиц могут образовываться гибридные штаммы, что ускоряет эволюцию вирусов и осложняет борьбу с ними (43). Сегменты РНК гриппа не равнозначны, и в частицу должен попасть фиксированный набор из восьми разных РНК, каждая из которых выполняет свою функцию. Как это достигается в природе, понятно не до конца. Видимо, между вирусными рибонуклеопротеиновыми комплексами (РНП) существует специфическое взаимодействие, обеспечивающее сборку разных частей генома в нужном составе (44).
Публикации результатов исследований, описывающих структуру вирусных РНП, стали появляться сравнительно недавно. Одну из последних и наиболее детальных работ на эту тему подготовили и опубликовали в журнале Science (45) коллективы лабораторий Хайме Мартина-Бенито и Хуана Ортина. Доктор Мартин-Бенито комментирует специфику их исследований:
Когда мы приступили к изучению структуры полного РНП нативных вирусов гриппа в Национальном центре биотехнологии в Мадриде, вся доступная информация на эту тему была ограничена данными рентгеноструктурного анализа нуклеопротеина без РНК (46 и 47) и фрагментов полимеразы (48 и 49). РНП представляют собой разные по размеру, гибкие и суперскрученные структуры (50), что очень затрудняет исследования. В этой ситуации криоэлектронная микроскопия оказывается уникальным методом, способным выдать приемлемый результат. Основные проблемы были обусловлены различием длины отдельных РНП, а также их подвижностью. Чтобы это преодолеть, мы отдельно анализировали центральные и конечные части РНП, изолированных из выделенных вирионов, после чего проводили их 3D-реконструкцию (45). Здесь наиболее трудным этапом стала классификация полученных изображений. Необходимо было получить гомогенные группы, что позволило бы сделать финальную реконструкцию. Для того чтобы сгенерировать финальную структуру, было использовано более 90 тысяч изображений. Мы потратили на это миллионы часов компьютерного времени«.
Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания)
Строение и конформации РНП, а также их взаимодействие с другими белками вируса обеспечивают им специфические свойства и функции. Геном гриппа представлен восемью молекулами РНК негативной полярности и разной длины. Такое число сегментов генома характерно для всех ортомиксовирусов (кроме тоготовирусов, содержащих по шесть молекул РНК). РНК связывается с полимеразными комплексами (48) и белком NP (51), формируя РНП (44). РНП организованы в двойные спирали из двух цепей РНК, ассоциированных с белками НП и расположенных друг против друга (45).
Различие длины разных РНП гриппа обусловлено различиями длин сегментов их РНК. Три наиболее протяженных сегмента имеют длину порядка 2500 нуклеотидов, тогда как длина самого короткого сегмента лишь немногим превышает 800 нуклеотидов. РНП обычно группируются в частице вокруг одного из наиболее длинных РНП таким образом, чтобы полимеразные концы всех РНП оказывались собранными вместе, взаимодействуя при этом с белками матрикса на одном из полюсов вириона. В эту же область попадают и белки NEP, чья функция — экспорт новосинтезированных РНП из ядра клетки к месту сборки вируса.
Одной из проблем, вызывающих сейчас активный интерес сообщества структурных вирусологов, является изучение причин специфической упаковки необходимого набора разных РНП в каждую новую частицу. Считается, что молекулы РНК в составе каждого РНП способны специфически взаимодействовать с РНК соседних сегментов. Мы отразили этот момент в нашей модели, однако конкретные механизмы такого взаимодействия — объект дальнейших исследований (44, 45, 52).
Для многих мембранных вирусов характерно присутствие в вирионах белков, захваченных из клетки хозяина. Так, внутри ВИЧ обнаруживают актин и циклофилин, а в мембране этого вируса присутствуют белки, относящиеся к главному комплексу гистосовместимости, что делает вирус менее уязвимым для иммунной системы (53, 54, 55). Наличие человеческих белков в вирусной частице гриппа на данный момент не продемонстрировано с должной достоверностью, хотя некоторые данные по этому вопросу опубликованы (56).
Высокая изменчивость и непредсказуемость вируса гриппа рано или поздно может привести к новой пандемии. Во избежание этого предпринимаются разные меры — как на глобальном, так и на локальном уровне. Всемирная организация здравоохранения (ВОЗ) и региональные организации в разных странах ведут постоянный мониторинг циркулирующих штаммов гриппа, поскольку год за годом состав сезонных штаммов меняется, пополняясь новыми потенциально опасными вариантами. Изменчивость вирусов гриппа — большая проблема для фармацевтических компаний, разрабатывающих противовирусные препараты (27 и 57). Так, в настоящее время растет процент штаммов гриппа, устойчивых к озельтамивиру.
Профилактические вакцины от гриппа совершенствуются каждый год в зависимости от преобладающих штаммов. Их разрабатывают как с использованием целых инактивированных вирионов, так и на основе фрагментированных вирусных частиц или даже отдельных поверхностных белков. Обычно вакцины направлены на профилактику заражения как штаммами типа А, так и вирусами типа В (58).
Часто присущие гриппу симптомы (повышенная температура, боль в горле и мышцах, головная боль) бывают вызваны и другими вирусами. Среди возбудителей простудных заболеваний есть коронавирусы, риновирусы и аденовирусы (59). Выявление конкретного возбудителя в таких случаях не всегда целесообразно, поэтому подобные заболевания часто относят к группе острых респираторных вирусных инфекций (ОРВИ).
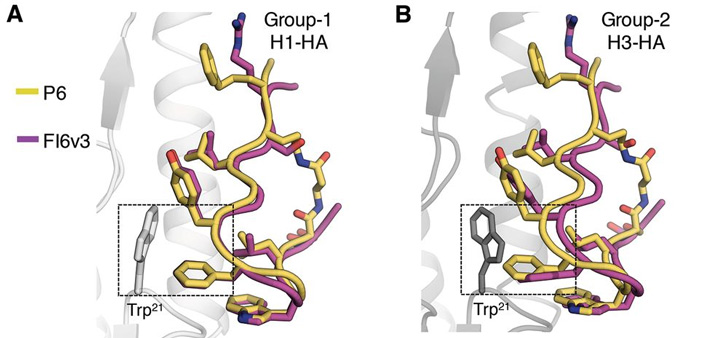
Рис. 1. Сравнение взаимодействия ранее изученного антитела человека FI6v3 и разработанного пептида с частицами вирусов гриппа. Совмещение молекул демонстрирует сходство и различия в том, как антитело (лиловое) и синтезированный пептид (желтый) связываются с гемагглютининовым рецептором вирусов H1 (А) и H3 (B). Оба типа рецепторов, характерные для различных штаммов вируса, связываются с антителом и синтетическим пептидом за счет остатка аминокислоты триптофана (Trp 21 ), положение которого в первичной структуре геммагглютининов Н1 и Н3 одинаково. Рисунок из обсуждаемой статьи в Science
Международная группа исследователей из США, Бельгии и Нидерландов разработала искусственные пептиды, способные нейтрализовать широкий спектр вирусов гриппа, включая штамм H1N1, вызвавший пандемию 2009 года, и штамм высокопатогенного птичьего гриппа H5N1. Эти пептиды могут стать новым оружием в борьбе человечества с гриппом, только сезонные эпидемии которого, по оценкам Всемирной организации здравоохранения, ежегодно приводят к 3–5 миллионам случаев тяжелой болезни и госпитализации и 250 000–500 000 случаев смерти во всем мире.
Существующие в настоящее время способы лекарственной терапии гриппа основаны на воздействии на два белка вируса — канал M2 и нейраминидазу (NA). Оба эти белка важны для нормальной организации жизненного цикла вируса. Белковый канал M2 бывает задействован на ранней и поздней стадиях репликации вируса, а нейраминидаза участвует в высвобождении дочернего поколения вирионов. Но мутации вирусов гриппа приводят (и уже привели) к появлению резистентных штаммов, против которых существующие противовирусные препараты (даже самый эффективный из существующих на настоящий момент — осельтамивир) оказываются малоэффективными. Эти обстоятельства приводят к необходимости разработки новых способов борьбы с вирусами гриппа. Предполагается, что более эффективными могут оказаться стратегии, опирающиеся на применение препаратов, молекулярной мишенью которых будут белки-гемагглютинины (НА) вируса гриппа.
Гемагглютинины — поверхностные белки вируса гриппа, обеспечивающие способность вируса присоединяться к инфицируемой клетке. Возможно, неспособность вируса внедриться в клетку-хозяина снизит вероятность образования устойчивых к противовирусным препаратам мутирующих вирусов: вирусы способны размножаться, только паразитируя в клетках, и не попавший в живую клетку вирус будет лишен возможности воспроизводить себя.
Инфицирование вирусом гриппа начинается с того, что гемагглютинины вируса связываются с поверхностью клетки-хозяина. Вирусный гемагглютинин представляет собой гликопротеид (сложный белок, в котором с цепью, состоящей из аминокислотных остатков, связан углеводный фрагмент). После контакта с клеткой гемагглютинин изменяет свое пространственное строение, фактически внедряясь в клеточную мембрану, что, в свою очередь, обеспечивает проникновение вируса внутрь клетки, где он и начинает свой цикл размножения
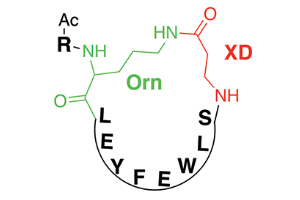
Рис. 2. Общий мотив строения синтезированных циклических пептидов. Цепь пептида состоит из протеиногенных аминокислот — лейцин (L), глутаминовая кислота (Е), тирозин (Y), фенилаланин (F), триптофан (W), серин (S), а также аминокислоты, не входящие в состав белковых молекул: орнитин (диаминовалениановая кислота, Orn) и β-аланин (XD), R — алкильный остаток. Черным цветом обозначена цепь, состоящая из протеиногенных аминокислот, зеленым и красным — участки цепи синтезированного циклического пептида, не характерные для обычных пептидных цепей. С гемагглютинином вируса гриппа циклический пептид связывается преимущественно за счет остатка фенилаланина. Рисунок из обсуждаемой статьи в Science
Ряд спроектированных структур был синтезирован, и после определения их пространственного строения и испытаний на предмет связывания с вирусами исследователи остановились на четырех циклических (обладающих замкнутой цепью, рис. 2) пептидах, каждый из которых обладает свойствами, которые позволяют говорить о его потенциальном применении в качестве блокаторов функций вирусов. Выбранная четверка пептидов демонстрирует прочное связывание с гемагглютининами широкого набора штаммов вирусов гриппа типа А. Синтетические пептиды, как и антитела человека, по образу и подобию которых они были созданы, связываются с остатком аминокислоты триптофана в структуре гемагглютинина вируса. Примечательно, что структура участка, на котором расположен этот триптофановый фрагмент практически не различается для разных штаммов гриппа, поскольку именно этот участок играет ключевую роль в проникновении вируса через оболочку клетки-хозяина.
Основное преимущество разработанных в ходе исследования пептидов по сравнению со ставшими для них образом и подобием антителами заключается в гораздо меньших размерах. Это обеспечивает и дешевизну их получения по сравнению с антителами, и сделает более эффективной усвояемость лекарства при пероральном и инъекционном приеме. Чтобы синтезированные пептиды были устойчивы к действию ферментов, способных ускорять гидролитическое расщепление веществ с аналогичной структурой в крови, в них были введены остатки β-аланина и диаминовалериановой кислоты (орнитина) — аминокислот, не кодируемых в ходе синтеза белковых цепей на рибосоме. Циклическая структура синтезированных пептидов, отсутствие у них характерных для линейных и разветвленных белковых молекул C- и N-конца также способствует устойчивости к гидролизу.
Источник: Rameshwar U. Kadam, Jarek Juraszek, Boerries Brandenburg, Christophe Buyck, Wim B. G. Schepens, Bart Kesteleyn, Bart Stoops, Rob Vreeken, Jan Vermond, Wouter Goutier, Chan Tang, Ronald Vogels, Robert H. E. Friesen, Jaap Goudsmit, Maria J. P. van Dongen, Ian A. Wilson. Potent peptidic fusion inhibitors of influenza virus // Science. 2017. DOI: 10.1126/science.aan0516.
Читайте также:

