Может быть гемолиз при гепатите
Обновлено: 12.05.2024
Гематологические изменения при остром заболевании печени будут рассмотрены ниже. Они в основном представлены гемолитической или гипопластической анемиями.
Много лет назад Wintrobe (1936), изучая частоту различных типов анемии при хроническом заболевании печени, обнаружил признаки макроцитоза у 32,6% больных, нормоцитоза — у 30,3%, отсутствие анемии — у 22,7% и микроцитарную анемию - у 14,4%.
Макроцитарная анемия может быть обусловлена дефицитом фолиевой кислоты, сопутствующим алкоголизмом или даже одновременно существующей пернициозной анемией, но обычно не связана с дефицитом какого-либо витамина; источником макроцитов являются костномозговые макронормобласты. Макроциты гораздо более однородны по форме, чем аналогичные клетки при мегалобластной анемии сходной тяжести. Объем этих макроцитов ненамного увеличен по сравнению с нормой, но они тоньше и имеют больший, чем у нормальных эритроцитов, диаметр. Такие клетки известны как лептоциты [Binghan, 1961; Werre et al., 1970] и бывают двух типов, один из которых представлен мишеневидными клетками. Мишеневидность обусловлена влиянием сывороточных факторов — нормальные клетки, введенные в кровеносное русло больных с циркулирующими лептоцитами, захватывают избыточное количество холестерина и приобретают соответствующие лептоцитам свойства, включая резистентность к солевым растворам. Такие изменения характерны для тяжелых гепатоцеллюлярных поражений, при которых некоторые клетки приобретают вид акантоцитов, наблюдаемых при a —b -липопротеинемии. Присутствие таких клеток прогностически неблагоприятно, и те больные, у которых они обнаружены, обычно умирают в течение 1—2 мес.
Очень часто, особенно если она сопутствует хроническому гепатиту или циррозу, анемия носит умеренный характер — уровень гемоглобина редко падает ниже 100 г/л. В таких неослож-ненных случаях эритроциты нормоцитарны и нормохромны.
Иногда как в крови, так и в костном мозге выявляются изменения, характерные для истинного дефицита железа. Они возникают в результате кровопотери, например кровотечения из варикозных вен пищевода, которое может осложняться геморрагическим диатезом как следствием заболевания печени.
При анемии, сопутствующей заболеванию печени, время жизни эритроцитов укорочено [Chaplin, Mollison, 1953; Cooksley et al., 1973]. Эритроциты таких больных живут меньше и будучи перелиты здоровым реципиентам; эритроциты здоровых лиц, перелитые больным с заболеванием печени, становятся коротко-живущими. Это свидетельствует, очевидно, о существовании внутри- и внеклеточного гемолитического фактора. Роль селезенки неясна, и не существует прямой корреляции между величиной последней и выраженностью гемолиза [Cooksley et al., 1973]. Спленэктомия лишь изредка улучшает состояние больных и не приводит к увеличению жизни эритроцитов. Было высказано предположение, что эритроциты повреждаются при прохождении через печень [Dacie, 1967], но Cooksley и соавт. (1973) пришли к заключению, что пассаж эритроцитов через печень не является первопричиной гемолиза и что в этом органе осуществляется только фагоцитоз уже измененных клеток. Исследования кинетики железа показали, что костный мозг не способен обычным путем компенсировать увеличенное разрушение эритроцитов. Эритропоэз действительно усиливается, но не в такой степени, чтобы предотвратить развитие умеренно выраженной анемии. Свидетельства неэффективности эритропоэза отсутствуют [Kimber et al., 1965].
Продолжительность жизни эритроцитов может быть снижена и при остром заболевании печени, но, за исключением уже упоминавшейся редко встречающейся аплазии, любое укорочение времени жизни эритроцитов надежно компенсируется, и поэтому анемия развивается редко.
Иногда тяжелая гемолитическая анемия может возникать у больных с хроническим заболеванием печени во время обострений. Одно из таких заболеваний, синдром Циве, было впервые описано в 1958 г. Оно возникает после однократного приема дозы алкоголя и проявляется в виде тяжелой гемолитической анемии, следующей за гиперлипидемией и гиперхолестеринемией. Синдром обычно сопровождается слабостью, рвотой, лихорадкой, а также болью в надчревной области или в нижних отделах грудной клетки. Тяжелая гемолитическая анемия может возникать на фоне атаки острого вирусного гепатита или развиваться вслед за Кумбс-позитивной гемолитической анемией, сопровождающей хронический активный гепатит.
Следует помнить, что прием большого количества алкоголя может приводить к мегалобластным или сидеробластным изменениям, которые будут накладываться на проявления анемии, характерные для хронического заболевания печени.
Синдром цитолиза — это клинико-лабораторный симптомокомплекс, который характеризуется повышением печеночных ферментов АЛТ и АСТ. Состояние является компонентом многих печеночных и внепеченочных заболеваний. Синдром в большинстве случаев характеризуется бессимптомным течением. Клинические проявления неспецифичны: боли и тяжесть справа в подреберье, диспепсические явления, общая интоксикация организма. Для диагностики проводятся биохимические печеночные пробы, уточнить диагноз помогают исследования маркеров вирусных гепатитов, коагулограмма, УЗИ печени. Лечение включает гепатопротекторы, этиотропные и патогенетические препараты.
МКБ-10

Общие сведения

Причины
Синдром цитолиза — полиэтиологическое состояние, которое вызывается печеночными и внепеченочными причинами. Заболевание обычно сочетается с другими патологическими синдромами — холестазом, иммунным воспалением, печеночно-клеточной недостаточностью. В клинической гастроэнтерологии выделяют несколько групп причинных факторов, провоцирующих синдром повреждения печеночных клеток с выходом внутриклеточных ферментов в кровоток:
- Инфекционные процессы.Вирусные гепатиты — наиболее распространенная причина поражения печеночной паренхимы, сопровождающегося деструкцией гепатоцитов. Цитолиз встречается как при острых воспалениях печени, так и при обострении хронического гепатита. Синдром также диагностируется при паразитарных инвазиях: амебиазе, лямблиозе.
- Жировая болезнь печени. Неалкогольная и алкогольная ЖБП — главный неинфекционный этиологический фактор цитолиза. Синдром разрушения печеночной ткани обусловлен токсичностью липопротеидов или метаболитов этанола, которые в повышенном количестве попадают в печень из системы воротной вены.
- Холестатические патологии. При задержке выделения желчи, помимо повышения уровня холестерина и щелочной фосфатазы, наблюдается синдром цитолиза. Разрушение гепатоцитов вызвано токсическим воздействием желчных кислот. Зачастую холестаз связан с желчнокаменной болезнью.
- Лекарственное поражение. Вследствие полипрагмазии значительно повысилась распространенность токсических медикаментозных гепатитов — до 2-5%. Большинство из них протекают субклинически, но в любом случае выявляется цитолитический синдром с повышением уровня печеночных энзимов.
Возрастание показателей аминотрансфераз характерно и для внепеченочных этиологических факторов. К этим причинам относят наследственные и приобретенные мышечные заболевания, травмы и некрозы мышц, нарушения кислотно-основного равновесия. Независимыми факторами риска считают гиперлипидемию, метаболический синдром, наследственные болезни накопления (Гоше, Ниманна-Пика). Поведенческие факторы включают злоупотребление жареной и жирной пищей, использование воды из неизвестных источников.
Патогенез
Аминотрансферазы относятся к универсальным ферментам, которые распространены во всех органах и тканях. Наибольшее их количество локализовано внутри гепатоцитов. Выход ферментов в системный кровоток реализуется за счет 3-х механизмов: прямой деструкции печеночных клеток, патологического повышения проницаемости клеточной мембраны и разрушения отдельных органелл.
Особое место в патофизиологии синдрома цитолиза занимает макроэнзимемия. Это состояние характеризуется повышенным выходом ферментов в кровь на фоне их связывания с иммуноглобулинами и небелковыми молекулами. Цитолитический процесс не тождественен некрозу гепатоцитов, поэтому часто имеет обратимый характер. Аминотрансферазы не являются токсичными для организма, а клинические признаки цитолиза обусловлены основным заболеванием.
Симптомы
В 70-80% случаев наблюдается бессимптомное или малосимптомное увеличение уровня ферментов. Если у человека развивается характерная клиническая симптоматика, она вызвана обострением или прогрессированием этиологического фактора цитолиза. Основной симптом — чувство тяжести и тупые боли в правом подреберье. Болевой синдром наблюдается постоянно либо провоцируется погрешностями в диете, приемом медикаментов.
Зачастую больного с синдромом цитолиза беспокоят тошнота и чувство дискомфорта в животе после еды, снижение аппетита. По утрам характерно появление горечи во рту. Реже бывает горькая отрыжка, рвота желудочным содержимым с примесями желчи. Общие симптомы представлены повышенной утомляемостью, головным болями. При длительном течении процесса возможно снижение веса.
Характерный признак гепатитов — желтушный синдром с характерным окрашиванием кожных покровов, слизистых оболочек и склер. Желтуха имеет различный оттенок: от лимонно-желтого до оранжевого или шафранового. Длительность изменений окраски кожи вследствие цитолиза варьирует от недели до месяца и более. Одновременно с желтушностью изменяется окраска кала и мочи. Испражнения приобретают светло-желтый или сероватый цвет, моча становится более темной.
Осложнения
Закономерный исход всех печеночных болезней при отсутствии лечения — развитие фиброзных изменений, обусловленных хроническим воспалением. Согласно печеночному континууму (однотипной последовательности стадий поражения органа независимо от конкретной патологии) около 30% случаев гепатитов спустя 10 лет приводят к циррозу печени. Цирротические изменения в свою очередь провоцирует асцит, варикозное расширение вен, печеночную энцефалопатию.
При прогрессирующем некрозе снижается объем функционирующих гепатоцитов, что клинически проявляется печеночной недостаточностью. Состояние сопровождается дистрофическими изменениями всех органов и тканей, кахексией. Длительное существование воспалительных процессов служит независимым фактором риска гепатоцеллюлярной карциномы, которая развивается у 2-5% больных через 10-20 лет от начала заболевания.
Диагностика
Признаком цитолитического процесса является увеличения уровня АСТ и АЛТ в печеночных пробах более 30-40 Ед/л. По степени повышения судят о биохимической активности воспаления: если количество ферментов возрастает менее, чем в 5 раз — низкая активность, в 5-10 раз — средняя, более, чем в 10 раз — высокая. Также повышается уровень ЛДГ5 и ГГТП. Для уточнения этиологии синдрома врачи-гепатологи назначают дополнительные методы диагностики:
- Анализ на маркеры гепатитов. В качестве скринингового исследования применяют ИФА для определения уровня антител к вирусам наиболее распространенных гепатитов. При позитивных результатах выполняется ПЦР для выявления генетического материала.
- Другие исследования крови. В биохимическом анализе при наличии цитолиза определяют повышение уровня прямого и непрямого билирубина. На снижение печеночных функций указывает уменьшение количества альбуминов в крови. Рекомендована коагулограмма для оценки показателей протромбинового индекса.
- УЗИ печени. Сонография — информативное неинвазивное исследование, которое проводится для визуализации состояния печеночной паренхимы у пациентов с лабораторными признаками синдрома цитолиза. На УЗИ определяется отечность и увеличение размера органа, наличие объемных новообразований. С помощью ультразвука можно обнаружить камни в желчных протоках.
Лечение синдрома цитолиза
Специфическое лечение отсутствует. Выбор терапевтической схемы продиктован характером и тяжестью основной патологии, степенью повреждения паренхимы печени. Основными направлениями терапии являются:
- Гепатопротекторы. Для терапии синдрома цитолиза активно применяются гепатопротекторы растительного, животного и синтетического происхождения: препараты на основе метионина, орнитина, флавоноидов.
- Этиотропное лечение. При инфекционных поражениях используют специфические средства — противовирусные препараты и интерфероны при хронических гепатитах, антипротозойные при амебиазе и лямблиозе.
- Патогенетические средства. Для дезинтоксикации организма проводится инфузионная терапия глюкозо-солевыми растворами. Если синдром цитолиза обусловлен печеночной недостаточностью, целесообразно назначать энтеросорбенты и лактулозу.
Прогноз и профилактика
Прогноз определяется основной нозологической формой и у большинства пациентов определяется как благоприятный. Прием гепатопротекторов и этиотропных средств позволят достичь полного выздоровления или клинико-лабораторной ремиссии. Первоочередная профилактика синдрома цитолиза — коррекция образа жизни, которая включает снижение массы тела, ограничение жирной и калорийной пищи, отказ от алкоголя.
1. Синдром цитолиза в гастроэнтерологической практике: тактика ведения пациентов в общей практике/ Вялов С.С.// Гастроэнтерология. — 2013.
2. Основные гепатологические синдромы в практике врача-интерниста/ Макарова М.А., Баранова И.А. // Consilium Medicum. — 2017.
3. Частота встречаемости различных биохимических синдромом у пациентов с хроническими диффузными заболеваниями печени и их коррекция антирадикальными препаратами/ Косенко С.Г., Ковалева Н.В., Бычкова Е.В., Подгопригорова В.Г.// Вестник Смоленской медицинской академии. — 2010.
4. Интерпретация биохимического анализа крови при патологии печени. Синдром цитолиза. Часть 1/ Ипатова М.Г., Мухина Ю.Г., Шумилов П.В.// Практика педиатра. — 2017.
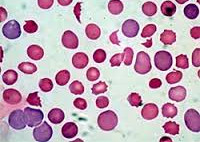
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10


Общие сведения
Гемолитическая анемия (ГА) - малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).

Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Патогенез
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии- анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические - анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом - обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
4. Клинические рекомендации по диагностике и лечению аутоиммунных гемолитический анемий/ Цветаева Н.В., Никулина О.Ф. - 2014.
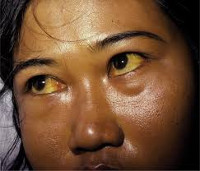
Гемолитическая желтуха — это вариант надпеченочного желтушного синдрома, обусловленный гемолизом эритроцитов. Проявляется желтушностью и бледностью кожных покровов и слизистых, спленомегалией, потемнением мочи и кала, гемолитическими кризами. Диагностируется с помощью общего анализа крови, определения концентрации непрямого и общего билирубина, УЗИ органов брюшной полости. Для лечения используют кортикостероиды, цитостатики, антибиотики, активаторы печеночных ферментов, инфузионную и фототерапию, переливание компонентов крови. По показаниям проводят спленэктомию.
МКБ-10
Общие сведения
Гемолитическая (плейохолическая) желтуха развивается при превышении уровня свободного билирубина, который может беспрепятственно конъюгироваться в печени. В обычных условиях в человеческом организме разрушается до 100-200 млн. эритроцитов за час, при этом срок жизни красных клеточных элементов крови составляет в среднем 120 дней. Из 1 г гемоглобина, выделяющегося при гемолизе, образуется 35 мг неконъюгированного пигмента (около 250-350 г/сут).
Печень обладает 3-4-кратным функциональным резервом для связывания избытка билирубина. При укорочении срока жизни эритроцитов, их ускоренном разрушении концентрация пигмента превышает предельный печеночный порог конъюгации, непрямой билирубин накапливается в крови, откладывается в тканях, что сопровождается формированием характерной клинической картины.

Причины
Заболевание развивается на фоне гемолиза с образованием большого количества непрямого билирубина, который не успевает конъюгироваться гепатоцитами. Гемолитическая форма желтухи вызывается теми же этиологическими факторами, что и патологические состояния с усиленным внутрисосудистым или внесосудистым разрушением эритроцитов. Специалисты в сфере современной гастроэнтерологии и гематологии выделяют следующие причины расстройства:
- Наследственные дефекты эритроцитов и гемоглобина. Гемолиз может быть обусловлен генетически обусловленными энзимопатиями (недостаточностью пируваткиназы, глюкозо-6-фосфатдегидрогеназы), несостоятельностью эритроцитарных оболочек (наследственным микросфероцитозом, акантоцитозом, овалоцитозом, пароксизмальной ночной гемоглобинурией). Желтуха гемолитического типа также наблюдается при гемоглобинопатиях (талассемии, серповидно-клеточной анемии и др.).
- Воздействие гемолитических плазматических факторов. Реакцию гемолиза вызывают антитела при гемолитической болезни новорожденных и переливании изонесовместимой крови, гемолизины возбудителей кори, краснухи, сепсиса, эпидемического паротита, лептоспироза, малярийные плазмодии, змеиный и другие гемотоксичные яды (сероводород, мышьяк, свинец, фосфор, анилин, нитробензол), Эритроциты разрушаются под влиянием ряда фармпрепаратов (сульфаниламидов, антипиретиков, хининов).
- Обширные кровоизлияния, инфаркты. Повышенное образование свободного билирубина связано с массивным распадом элементов крови при рассасывании крупных гематом в мягких тканях, паренхиматозных органах, полостях тела. Гемолитической надпеченочной желтухой осложняются массивные желудочно-кишечные кровотечения, расслаивающая аневризма аорты, инфаркт миокарда, легкого, геморрагический инсульт, гемоторакс. Обычно такое состояние связано с существующим заболеванием, травмой.
- Механическое разрушение эритроцитов в сосудах. Красные кровяные тельца подвергаются внутрисосудистому гемолизу при их сдавлении в периферических кровеносных сосудах, прилегающих к костным выступам (маршевая гемоглобинурия), турбуленции потока крови при дисфункции протезов сердечных клапанов. Гемолиз также возникает при прохождении эритроцитов через фибриновые депозиты в артериолах при ДВС-синдроме, гемолитико-уремическом синдроме, тромботической тромбоцитопенической пурпуре.
У части пациентов разрушение красных кровяных клеток с развитием надпеченочной желтухи наблюдается в рамках клинической картины злокачественных опухолей разной локализации, лейкозов, лимфопролиферативных заболеваний, пернициозной анемии Аддисона-Бирмера, системных патологий соединительной ткани. Гемотоксическое действие оказывают мощные ионизирующие воздействия при лучевой болезни, радиотерапии. Физиологическая желтуха возникает у новорожденных при усиленном гемолизе фетального гемоглобина на фоне низкой активности печеночных ферментов.
Патогенез
В основе механизма развития гемолитической желтухи лежит относительная функциональная недостаточность печеночных клеток, неспособных связать большое количество свободного билирубина, образовавшегося при гемолизе эритроцитов. Дополнительным патогенетическим фактором является нарушение внутриклеточного транспорта пигмента в гепатоцитах при его высокой концентрации. В результате неконъюгированный билирубин связывается с альбуминами и циркулирует в крови в виде водонерастворимых билирубин-альбуминовых комплексов, которые не могут выводиться с мочой.
Жирорастворимый свободный пигмент легко проникает через клеточные и митохондриальные мембраны, окрашивает в желтый цвет кожу и слизистые оболочки, нарушает процессы окислительного фосфорилирования, синтез белков, трансмембранный потенциал клеток. Поражение ядер головного мозга, особо чувствительных к токсическому эффекту непрямого билирубина, приводит к развитию энцефалопатии (ядерной желтухи) с выраженной неврологической симптоматикой. Связывающая способность альбуминов оказывается недостаточной при непрямой гипербилирубинемии более 260-550 мкмоль/л.
Активная конъюгация пигмента в печени сопровождается его усиленной экскрецией в просвет кишечника с образованием уробилиногена в тонкой кишке и затем стеркобилиногена — в толстой. Избыточное количество всосавшегося в кровь уробилиногена, который не может полностью элиминироваться гепатоцитами, продолжает циркулировать в крови. Высокий уровень экскретируемого с мочой стеркобилиногена, всосавшегося в геморроидальных венах, и стеркобилина в кале придает экскрементам характерную коричневую окраску. После исчерпания способности гепатоцитов выделять прямой (конъюгированный) билирубин в желчь происходит обратная диффузия связанной формы пигмента в кровь.
Классификация
Систематизация форм гемолитической желтухи учитывает этиологические факторы, под влиянием которых произошел гемолиз. Такой подход позволяет выбрать оптимальную терапевтическую тактику, максимально компенсирующую действие первопричины заболевания. Гастроэнтерологи и гематологи различают следующие типы гемолитических надпеченочных желтух:
- Гемолитические корпускулярные желтухи. Связаны с различными видами несостоятельности эритроцитов — дефицитом или недостаточной активностью ферментных систем, дефектами гемоглобина, мембранных структур. Обычно корпускулярные плейохолические желтухи вызваны генетическими аномалиями, их лечение является преимущественно симптоматическим.
- Гемолитические экстракорпускулярные желтухи. К разрушению эритроцитов приводит действие различных внешних факторов — антител, микробных токсинов, гемолитических ядов, механических нагрузок. Наряду с устранением отдельных симптомов это позволяет использовать методы, направленные на элиминацию этиопатогена и отдельные звенья патогенеза гемолиза.
- Гемолитические постгеморрагические желтухи. Возникают на фоне массивного распада эритроцитов в участках кровоизлияний. Обычно осложняют течение тяжелых травм и других неотложных состояний. Прогнозирование развития надпеченочной желтухи дает возможность назначить превентивную терапию для предупреждения дальнейших осложнений.
Симптомы гемолитической желтухи
Характерный признак заболевания — сочетание бледности кожных покровов с лимонно-желтым окрашиванием кожи, конъюнктивы глаз при отсутствии кожного зуда. У большинства пациентов с надпеченочной желтухой наблюдается потемнение мочи. Могут возникать умеренные боли в животе, диспепсические расстройства – тошнота, отрыжка, диарея. Обострение заболевания (гемолитический криз) клинически проявляется фебрильной лихорадкой, головной болью, миалгиями, интенсивными болями в левом подреберье вследствие увеличения селезенки. Если заболевание вызвано острым отравлением химическими соединениями или лекарственными средствами, присоединяются интоксикационные симптомы в виде угнетения сознания вплоть до комы, выраженной тахикардии, падения АД, расстройств дыхания и мочевыделения.
Осложнения
Наличие у пациента надпеченочной желтухи повышает риск застойных явлений в желчном пузыре, что приводит к формированию пигментных камней и обструкции желчевыводящих протоков. Осложнением гемолитической желтухи может стать токсическая нефропатия с острой почечной недостаточностью, развивающаяся при выраженных нарушениях биохимического состава крови и накоплении токсических соединений. При длительном течении заболевания возможно возникновение печеночной недостаточности, при которой происходит резкое угнетение всех функций органа, что клинически проявляется кахексией, дистрофическими изменениями, стойкими нарушениями метаболических процессов. Плейохолическая желтуха иногда осложняется билирубиновой энцефалопатией вследствие интоксикации головного мозга.
Диагностика
Постановка диагноза не представляет затруднений при наличии типичной клинической картины заболевания. Отличительный признак гемолитической желтухи — желтушное окрашивание кожи без кожного зуда и увеличения печени. Диагностический поиск направлен на выявление первопричины болезни. План обследования включает следующие инструментальные и лабораторные методы:
- Общий анализ крови. При проведении исследования определяется резкое уменьшение количества гемоглобина и эритроцитов с одновременным повышением содержания ретикулоцитов свыше 1%. При морфологической оценке могут выявляться специфические клетки, указывающие на определенный вид гемолитической анемии: сфероциты, мишеневидные, серповидные эритроциты. В остром периоде и при аутоиммунных процессах наблюдается лейкоцитоз со сдвигом формулы влево.
- Биохимический анализ крови. Патогномоничный признак надпеченочной желтухи — повышение концентрации свободного билирубина. Исследование позволяет установить степень тяжести болезни по уровню общего билирубина: до 80 мкмоль/л — легкая, 80-150 мкмоль/л — средняя, свыше 150 мкмоль/л — тяжелая форма. О гемолитической природе заболевания свидетельствует повышение содержания ЛДГ-5, выделяющейся из разрушенных эритроцитов, и снижение гаптоглобина.
- УЗИ брюшной полости. При плейохолической желтухе во время ультразвукового исследования ОБП определяется значительное увеличение селезенки при обычно нормальных размерах печени и структуре печеночной паренхимы. Также сонографически удается выявить заболевания гепатобилиарной системы, которые могут сочетаться с гемолитической патологией: желчнокаменную болезнь, холецистит, фиброзные поражения печени, изменения печеночных сосудов.
Концентрация АЛТ, АСТ, щелочной фосфатазы обычно в пределах нормы. В общем анализе мочи обнаруживается высокое содержание стеркобилиногена и уробилина, билирубинурия отсутствует. В копрограмме отмечается повышенный уровень стеркобилина. Для комплексной оценки состояния печени при желтухе может выполняться КТ, МРТ, холангиопанкреатография. Дополнительно проводится исследование осмотической резистентности эритроцитов, которая повышается при талассемии и снижается при гемолитической сфероцитарной анемии. В тесте Кумбса могут выявляться антиэритроцитарные антитела.
Дифференциальную диагностику осуществляют с синдромом Жильбера, паренхиматозной и механической желтухой, а также с заболеваниями, которые могут служить причиной указанных видов гипербилирубинемий — гепатитами, лептоспирозом, желтушной формой инфекционного мононуклеоза, псевдотуберкулезом, иерсиниозом, амебиазом, желчнокаменной болезнью, опухолями печени и Фатерова соска. По направлению врача-гастроэнтеролога при наличии показаний пациента консультирует гематолог, абдоминальный хирург и другие специалисты.
Лечение гемолитической желтухи
Рекомендована комплексная терапия, позволяющая по возможности устранить причину гемолиза, воздействовать на патогенетические звенья, купировать угрожающие жизни симптомы. Лечение гемолитической формы надпеченочной желтухи обычно является консервативным и сочетается с диетотерапией, направленной на поддержание нормальной работы печени. Показано существенное ограничение или полное исключение жирных, жареных, острых блюд, продуктов, содержащих много каротина и грубой клетчатки. С учетом возможной причины гемолитической анемии и желтухи план лечения включает:
- Кортикостероиды. Назначение иммуносупрессорной гормональной терапии оправдано при диагностике аутоиммунных расстройств, провоцирующих развитие приобретенной гемолитической анемии. У некоторых пациентов с желтухой более эффективным оказывается прием цитостатических препаратов.
- Антибиотики. Используются при гемолизе, обусловленном действием бактериальных токсинов. Рекомендуются средства, не вступающие в конкурентное вытеснение билирубина из соединений с глюкуроновой кислотой. Препараты из групп амфениколов, цефалоспоринов, сульфаниламидов применяются с осторожностью.
- Инфузионная терапия. Проводится при гемолитических процессах токсического происхождения. Введение коллоидных и кристаллоидных растворов при необходимости дополняется форсированным диурезом, энтеросорбентами, антидотами для связывания отравляющих веществ, гемосорбцией, плазмаферезом, гемодиализом.
- Индукторы ферментов печени. Активируют микросомальную ферментную систему, которая связана с цитохромом P450. В результате повышения метаболизма гепатоцитов улучшается связывание билирубина, циркулирующего в крови. Стимуляция ферментов эффективна при наличии функционального резерва печени.
- Фототерапия. Направлена на снижение гипербилирубинемии. Используется при повышении уровня билирубина до субтоксических и токсических концентраций. Способствует переводу неконъюгированного пигмента в водорастворимую изомерную форму, которая экскретируется почками и печенью без образования альбуминовых комплексов.
- Обменное переливание крови. Обычно выполняется при иммунных гемолитических состояниях с критическим для нервной системы содержанием свободного билирубина. За одну процедуру может заменяться до 70% ОЦК, благодаря чему уменьшается билирубинемия, восполняется дефицит эритроцитов, купируется гипоксия.
- Удаление селезенки. Хирургическое лечение показано при тяжелом течении гемолитической корпускулярной желтухи у пациентов с наследственными эритроцитарными ферментопатиями и мембранопатиями. Спленэктомия позволяет исключить деструкцию эритроцитов в синусах органа и их утилизацию макрофагами.
Прогноз и профилактика
Поскольку гемолитический вариант надпеченочной желтухи зачастую проявляется на фоне наследственных анемий, которые трудно поддаются лечению, прогноз заболевания считается серьезным. Полное выздоровление наблюдается у пациентов без тяжелых интеркуррентных патологий при отсутствии необратимых нарушений функций печени. Специфическая профилактика гемолитической желтухи не разработана. Для предупреждения болезни необходимо проводить своевременную диагностику и комплексную терапию гемолитических анемий, тяжелых инфекционных заболеваний, соблюдать правила совместимости крови при гемотрансфузиях, избегать полипрагмазии и назначения потенциально гемотоксичных медикаментов.
2. Дифференциальная диагностика желтух/ Самсон А.А.// Медицина неотложных состояний. – 2013 - №5(52).
3. Дифференциальная диагностика синдрома желтухи у детей: учебно-методическое пособие/ Артемчик Т. А. – 2017.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.

Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
Печеночные причины
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
•Хронические инфекции и паразитарные
заболевания (эхинококкоз, токсоплазмоз и др.)
•Неалкогольный стеатогепатит
•Аутоиммунные заболевания печени
•Злоупотребление алкоголем
•Прием лекарственных препаратов
(статины, некоторые антибиотики, противогрибковые препараты, нестероидные
противовоспалительные препараты,
глюкокортикостероиды, другие)
•Метаболические заболевания печени
(галактоземия, фруктоземия, гликогенозы,
дефицит альфа1-антитрипсина,
аминоацидопатии, нарушение цикла мочевины, нарушение окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные заболевания (болезнь
Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и др.), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и др.)
•врожденные и приобретенные дефекты
сосудов системы воротной вены (болезнь
Бадда-Киари и др.)
•Цирроз печени
•Опухоли печени
•Патология сердца (острый инфаркт
миокарда, миокардит)
•Повышенная физическая нагрузка
•Наследственные нарушения мышечного
метаболизма
•Приобретенные мышечные заболевания
•Травма и некроз мышц
•Целиакия
•Гипертиреоз
•Тяжелые ожоги
•Гемолиз эритроцитов
•Нарушение кислотно-щелочного равновесия
•Сепсис
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]
Читайте также:

