Может ли быть эндометрит из за герпеса
Обновлено: 17.04.2024
При лечении ХЭ необходимо учитывать все звенья патогенеза заболевания, поэтому оно должно быть комплексным, последовательным, этиопатогенетическим и контролируемым.
1. Прежде всего, необходимо элиминировать имеющихся возбудителей бактериальной инфекции. При наличии микозов или бактериального вагиноза, целесообразно проводить первостепенное лечение этих патологических состояний, которые затрудняют терапию любого воспалительного процесса.
Эффективным средством для лечения вагинального кандидоза (ВК) является пимафуцин (натамицин) – противогрибковый антибиотик полиенового ряда, обладающий фунгицидной активностью в отношении различных видов грибов рода Candid. Он применяется в виде крема, вагинальных свечей и таблеток для перорального применения. При остром ВК достаточно назначения пимафуцина по 1 свече на ночь в течение 6 дней. При хроническом течении ВК оптимально использовать комбинированную терапию: пимафуцин по 1 свече на ночь и пимафуцин в таблетках 2-4 раза в сутки в течение 6-9 дней. Следует отметить, что таблетированные формы пимафуцина не обладают системным действием, а лишь способствуют элиминации грибов из кишечника, поэтому их можно применять и во время беременности. Пимафуцин обладает высокой эффективностью. Достигающей 96%, отсутствием способности вызывать резистентность у различных видов грибов и отсутствием побочных эффектов.
Бактериальный вагиноз (БВ) при подготовке к беременности необходимо лечить даже при отсутствии клинических проявлений. Высокой эффективностью в терапии этого патологического состояния обладает трихопол, действующий преимущественно на анаэробную флору, гарднереллы, доминирующие при БВ, а также трихомонады. Трихопол применяется в виде вагинальных таблеток (500мг) и таблеток для перорального применения (250 мг). Трихопол легко проникает в одноклеточные организмы (простейшие, бактерии), вызывая нарушение структуры ДНК, действует на Trichomonas vaginalis, Lamblia intestinalis, Entamoeba histolytica, Balantidum col. Он активен в отношении некоторых аэробных грамотрицательных бактерий (гарднерелла), грамотрицательных и грамположительных бактерий (стрептококки, клостридии), а также простейших (трихомонады).
В настоящее время широко используются вагинальная форма трихопола. Преимуществами ее являются высокая эффективность при отсутствии отрицательного влияния на микрофлору влагалища, т.к. он не подавляет продукцию и функцию лактобацилл. Оптимальным является комбинированный прием трихопола: сочетание перорального и интравагинального путей введения препарата, что позволяет уменьшить дозу перорального трихопола и, следовательно, частоту побочных реакций. Стандартная схема применения трихопола: 1 вагинальная таблетка 1 раз в сутки в течении 7 –10 дней, в сочетании с пероральным приемом трихопола по 1 таблетке 2 раза в день.
Согласно международным рекомендациям CDC, для лечения БВ эффективна так же схема: внутрь метронидазол 500 мг 2 раза в сутки или клиндамицин 300 мг 3 раза в сутки в течение 7 дней и во влагалище клиндамицин-крем 2%-5 г 1 раз в сутки в течение 3-7 дней или клиндамицин свечи 100 мг 1 раз в сутки в течение 7 дней или метронидазол-гель 0,75% 5,0г 2 раза в сутки в течение 5 дней.
В клинической практике хорошо себя зарекомендовал вагинальный крем клиндацин, содержащий клиндамицина фосфат, который активен в отношении всех микроорганизмов, вызывающих бактериальный вагиноз и неспецифические вагиниты. Клиндацин хорошо переносится, назначается коротким курсом. Высокая эффективность клиндацина обеспечивается как действующим началом, так и особенностями основы, в состав которой входит полиэтиленоксид (ПЭО), оказывающий дегидратирующее действие, а также натрия бензоат, обладающий антимикотическим действием.
Терапия бактериальных инфекций предполагает назначение антибиотиков широкого спектра действия и высокой способностью проникновения в клетку. Таким требованиям более всего удовлетворяют макролиды последнего поколения. Среди них наибольшей эффективностью в отношении всех видов хламидий, микоплазм и других возбудителей обладает вильпрафен (джозамицин). Он назначается по 500 мг 3 раза в день в течение 10 дней. Он легко проникает через биологические мембраны и накапливается в тканях, отличаясь высокой концентрацией, поэтому его эффективность составляет 95-97% при очень низкой частоте рецидива инфекции. Достоинствами препарата в отличие от других антибиотиков является также отсутствие негативного влияния на функцию печени и метаболизм других препаратов, на нормальную кишечную флору и моторику кишечника. Кроме того, пища и другие лекарственные препараты не снижает его биодоступность. Вильпрафен значительно превосходит эритромицин по профилю безопасности, поэтому он разрешен к применению во время беременности и лактации. Кроме этого используется вильпрафен - солютаб в дозе 1000 мг. В качестве альтернативной антибактериальной терапии могут применяться новые формы антибиотиков: юнидокс солютаб (доксициклина моногидрат) 100 мг 2 раза в сутки 7-10 дней, флемоклав солютаб (амоксициллин клавуланат) 500 мг 2-3 раза в сутки, флемоксин солютаб (амоксициллин тригидрат) 500 мг 2-3 раза в сутки в течение 10 дней. По сравнению с амоксициллином (капсулы) эти препараты обладают более высокой биодоступностью, меньше влияют на микрофлору и обладают низкой вероятностью развития резистентности.
Поскольку более 80% всех урогенитальных инфекций являются смешанными, в комплексное лечение необходимо включать трихопол, который эффективен в отношении микрофлоры, нечувствительной к антибиотикам. Его применение обусловленно также способностью индуцировать синтез интерферона, обеспечивающего иммунопротективный эффект. Трихопол назначается одновременно с антибиотиками по 1 таблетке 3 раза в день в течение 10 дней.
2. Терапия рецидивирующего герпеса должна быть комплексный и этиопатогенетической, включающей не только противовирусные и иммуномодулирующие средства, но и противовоспалительные, гормональные, седативные средства и препараты, ускоряющие репарацию тканей.
Этиотропная терапия предполагает применение противовирусных средств:
- аномальные нуклеотиды;
- ингибиторы с различными механизмами действия;
- интерфероны и индукторы интерферона;
- гипериммунные и полиспецифические иммуноглобулины;
- вакцины.
Наиболее распространенными и эффективными этиотропными препаратами являются аномальные нуклеотиды, которые проникая в инфицированную клетку, фосфорилируются, благодаря действию вирусной тимидинкиназы, и блокируют синтез вирусной ДНК, замещая натуральные нуклеотиды.
На фармацевтическом рынке в настоящее время имеются 2 группы эти препаратов: ацикловир и его производные, представляющие из себя нуклеозидный аналог гуанина и фамвир, действующим компонентом которого является пенцикловир. Первая группа препаратов ингибирует преимущественно вирусную ДНК-полимеразу, вторая – тимидинкиназу. . В целом же эти препараты близки по эффективности. Особенности их действия обусловливают тот факт, что наибольшей эффективностью они обладают именно в момент обострения заболевания. Семы лечения в момент обострения индивидуальны, в среднем 5-10 дней, но могут быть и длительными (до 30 дней и более).
Ацикловир назначается по 0,2-0,4г 4-5 раз в день, валацикловир по 0,5г 2 раза в день, фамвир - 60 мг 2-4 раза в день
Назначение аномальных нуклеотидов, в том числе и длительных супрессивных схем, практически не меняют уровень иммунной защиты, что может приводить к рецидивам инфекции сразу после отмены препаратов. Поэтому в комплексной терапии вирусной инфекции необходимо применение иммуномодулирующих средств.
3. Особое значение при бактериальной и вирусной инфекции имеет применение иммуномодуляторов, особенно препаратов интерферона.
Интерфероны являются основными компонентами иммунной системы, сдерживающие развитие клинических форм герпетической инфекции и способствующие противомикробной защите.
По своей функциональной активности интерфероны подразделяются на 2 типа.
К I типу относятся ИФН α, β, σ, ω, τ, которые продуцируются в ответ на инфицирование клетки вирусами. Основной противовирусный эффект ИФН - это нарушение синтеза вирусных частиц на этапе трансляции, т.е. синтеза вирусспецифических белков в результате дискриминации вирусных информационных РНК.
II тип интерферонов представлен γ-интерфероном. Он обладает выраженной иммуномодулирующей активностью, вовлекая различные клеточные компоненты иммунной системы, в первую очередь цитотоксические клетки, в развитие иммунного ответа.
При использовании генферона интравагинально создается высокая концентрация интерферона в очаге инфекции, что способствует быстрому купированию субъективных симптомов, снижению доз и длительности курса антибиотикотерапии. Его использование не сопровождается побочными эффектами.
Лавомакс применяется в комплексе с этиотропными препаратами в течение 20-40 дней: по 125 мг 2 дня подряд и в дальнейшем каждые 48 часов. Он способствует нормализации интерферонового статуса и профилактике частоты и длительности рецидивов
Использование препаратов интрферона и индукторов интерферона показано и в межрецидивный период заболевания с профилактической целью.
4. Важным и в то же время самым сложным и длительным этапом в лечении ХЭ является восстановление обменных процессов в органах и тканях, способствующее нормализации структуры, функции и рецептивности эндометрия. С этой целью используется как лекарственные средства, так и физиотерапевтическое воздействие.
В комплексном лечении ХЭ хорошо зарекомендовал себя вобэнзим, содержащий протеолитические энзимы, которые обладают иммуномодулирующим действием по нормализации всех параметров иммунной системы, оказывает прямое стимулирующее действие на процессы фагоцитоза, секркторную активность макрофагов, естественных киллеров. Данная терапия проводилась на фоне системной энзимотерапии препаратом Вобэнзим по 5 драже 3 раза в день 1 месяц. Препарат вобэнзим содержит протеолитические энзимы, которые обладают иммуномодулирующим действием по нормализации всех параметров иммунной системы, оказывает прямое стимулирующее действие на процессы фагоцитоза, секркторную активность макрофагов, естественных киллеров.
Выраженным антиоксидантным действием обладает хофитол - препарат, основу которого составляет вытяжка из водного экстракта свежих листьев артишока. Благодаря входящим в его состав активным компонентам (каффеолиновые кислоты, флавоноиды, инулин, витамины группы А, В, С, макро- и микроэлементы, включая Fe, P, Mn и др.) хофитол является мощным антиоксидантом, улучшает реологические свойства крови, уменьшает токсико-метаболические нарушения в организме, что способствует полноценной регенерации эндометрия. Кроме того, он обладает выраженными дезинтоксикационными свойствами, нормализует липидный, белковый, азотистый и углеводный обмен, улучшает функцию печени и почек. Это очень важно при лечении пациенток с сопутствующими экстрагенитальными заболеваниями.
Для улучшения метаболических процессов в эндометрии применяются также витамины Е, группы В.
С целью восстановления рецептивности эндометрия эффективно использование физиотерапевтичских процедур, улучшающих кровообращение в органах малого таза и репаративные процессы в эндометрии: электрофорез с цинком, магнием; лазеротерапия, магнитотерапия, иглорефлексотерапия, озонотерапия.
5. Инфекционно- воспалительные процессы гениталий приводят к нарушению функции яичников, что проявляется, прежде всего, недостаточностью лютеиновой фазы. Для их реабилитации после проведенного противовоспалительного лечения показана гормональная терапия низко- и микродозированными комбинированными контрацептивами (КОК), содержащих высокоактивный гестаген. Оптимальными препаратами являются регулон (30 мкг этинилэстрадиола и 150 мкг дезогестрела) и новинет (20 мкг этинилэстрадиола и 150 мкг дезогестрела). Их назначают по 1 таблетке с 5 по 25 дни менструального цикла в течение не менее 3 месяцев. Благодаря низкому содержанию гормонов, и высокоэффективному гестагенному компоненту, эти препараты не оказывают анаболического, андрогенного действия, не влияют на липидный спектр крови и артериальное давление. Кроме того, применение регулона оказывает положительный эффект при дисменорее и предменструальном синдроме, нередко сопровождающих ХЭ.
Комплексная терапия ХЭ у пациенток с невынаиванием беременности должна завершаться оценкой ее эффективности, для того, чтобы максимально снизить риск последующих репродуктивных потерь.
Критериями эффективности лечения ХЭ являются:
- купирование клинических симптомов заболевания
- элиминации патогенной микрофлоры из полости матки, подтвержденная результатами бактериологического и ПЦР исследования.
- восстановление эхографической картины эндометрия, кровотока в овариальных и маточных артериях
- восстановление морфологической структуры эндометрия (отсутствие признаков воспаления, адекватное дню цикла состояние эндометрия), подтвержденное гистологическим исследованием эндометрия на 5-8 дни менструального цикла, полученного с помощью шприца-аспиратора Ipas MVA Plus и канюль Ipas EasyGrip диаметром 4 мм
- восстановление функционального состояния эндометрия (нормализация продукции АМГФ, определяемое в смыве из полости матки, полученных на 22-24 дни цикла с помощью шприца-аспиратора Ipas MVA Plus и канюль Ipas EasyGrip диаметром 4 мм
- нормализация менструального цикла с полноценной лютеиновой фазой
Адекватная терапия ХЭ на этапе прегравидарной подготовке женщин с репродуктивными потерями в анамнезе, способствующая элиминации всех возможных инфекционных возбудителей, а также восстановлению структуры и функции эндометрия является залогом успешной имплантации, плацентации и благополучного течения следующей беременности.
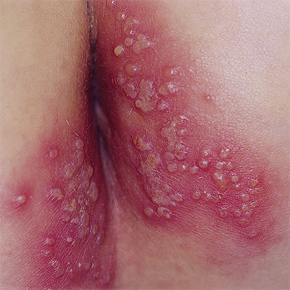
Герпетическое поражение анальной области
Спектр клинических проявлений герпетической инфекции (ГИ) весьма разнообразен. Он зависит от локализации патологического процесса и его распространенности, состояния иммунной системы больного и антигенного типа вируса. Заражение герпесом не всегда вызывает клинически выраженное заболевание, часто имеют место носительство и скрытое течение процесса.
Герпесвирусы не только способны вызывать разнообразные клинические проявления заболевания, но и провоцируют развитие частых рецидивов, а также становятся причиной осложнений. Доказано, что вирусы герпеса вызывают разнообразных нарушений в функционировании иммунной системы (иммунодефицит), которые необходимо учитывать при лечении.
Оба серотипа вируса простого герпеса (ВПГ-1 и ВПГ-2 (рус.), HSV-I и HSV-II (англ.)) могут инфицировать половые органы человека. Чаще всего герпес половых органов вызывается ВПГ-2, реже – ВПГ-1.
Первичный герпес половых органов
Первичный герпес половых органов – это первый эпизод заболевания у больного, у которого на момент проявления заболевания нет антител к ВПГ типов 1 и 2. В 20–40% случаев первичный герпес половых органов обусловлен ВПГ-1.
Первичное инфицирование может протекать бессимптомно или сопровождаться характерными признаками в местах проникновения вируса - болезненными высыпаниями на половых органах или в перианальной области, которые затем изъязвляются и сопровождаются сильной болью.
При симптомной форме заболевания первичный герпес половых органов протекает длительно (5–7 недель). В течение первой недели происходит нарастание симптоматики, затем 2-3 недели стабилизация и обратное развитие, и 2-3 недели бессимптомное слущивание (отшелушивание) участков эпителия, пораженных вирусом. Продолжительность секреции вируса при первичной инфекции может составлять до 1 месяца.
Инкубационный период обычно от 2 до 10 суток, иногда до 3 недель. Симптомы развития заболевания появляются через 3–7 дней после попадания вируса на слизистые оболочки (преимущественно половым путем): первоначально появляется локальная эритема (сильное покраснение кожи), вслед за ней – герпетические пузырьки-везикулы.
Пузырьки лопаются, образуются небольшие изъязвления, заживающие в течение несколько дней без формирования рубца. Заболевание преимущественно ограничивается входными воротами вируса и нервной тканью, иннервирующей место инокуляции.
Первичное заражение может сопровождаться увеличением лимфоузлов (лимфаденопатией), зудом и жжением при мочеиспускания (дизурией), гиперемией. При первом эпизоде заражения возможно появление общих симптомов интоксикации (среди которых повышение температуры тела, головная боль, тошнота, недомогание, миалгия, нарушения сна).
У мужчин часто встречается уретрит, сопровождающийся болью при мочеиспускании. У женщин возможен эрозивный цервицит. Возможны выделения из мочеиспускательного канала или влагалища. Нередко встречаются неврологические симптомы, обусловленные поражением крестцовых нервов (задержка мочи, запоры, парестезии). Кроме того возможны лихорадка, недомогание, головная боль, светобоязнь и ригидность затылочных мышц.
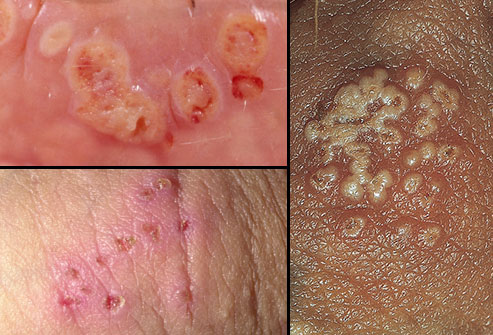
Непервичный герпес половых органов
Первый эпизод непервичного герпеса половых органов – это первый эпизод заболевания у больного, у которого на момент заболевания есть антитела к ВПГ другого типа. В большинстве случаев первый эпизод непервичного герпеса половых органов обусловлен ВПГ-2 при наличии антител к ВПГ- 1.
Первый эпизод непервичного герпеса половых органов характеризуется менее обильными высыпаниями по сравнению с первичным герпесом половых органов. В отсутствие лечения высыпания разрешаются в течение 10–14 суток. Общие симптомы при этом бывают редко. Паховый лимфаденит (воспаление паховых лимфоузлов) наблюдают редко. Выделения из мочеиспускательного канала, боль при мочеиспускании и неврологические симптомы также встречаются редко.
Рецидивирующая герпесвирусная инфекция
Герпесвирусная инфекция (ГИ) не может быть излечена полностью. Особенностью ВПГ является способность к латентному сохранению в организме после первичного инфицирования с последующей активацией и появлением клинических проявлений заболевания.
Рецидив герпеса половых органов – это второй и последующие эпизоды заболевания, обусловленные реактивацией ВПГ одного и того же типа. В большинстве случаев рецидив герпеса половых органов обусловлен ВПГ типа 2. У 90% инфицированных ВПГ-2, у которых первичный герпес или первый эпизод непервичиого герпеса проявлялся клинически, возникают рецидивы, которые также проявляются клинически.
Развитие и течение заболевания определяются состоянием иммунной системы больного. Состояние иммунодефицита увеличивает частоту рецидивов и тяжесть их протекания.
Реактивация герпетических вирусов из латентного состояния, происходящая после первичного инфицирования, проявляется при диссеминированной (генерализованной) и локализованной формах. Адекватный иммунологический ответ при этом может ограничивать инфекцию местом реактивации, а генерализованное заболевание с угрозой для жизни активно развивается на фоне иммунодефицитных состояний, особенно часто – у ВИЧ-инфицированных пациентов, реципиентов трансплантированных органов или у больных, получающих инвазивную противораковую терапию.
Рецидив герпеса половых органов характеризуется немногочисленными высыпаниями, обычно односторонними. Рецидивы, как правило, возникают на одном и том же месте. У многих больных за 1–2 суток до появления высыпаний отмечаются чувство пощипывания или жжения, покалывание, зуд, небольшие боли или чувство растяжения.
Эволюция элементов сыпи (узелок с покраснением – пузырек – гнойничок – язва – корочка) занимает 7–10 суток. Возможны атипичные язвенные высыпания. Паховый лимфаденит и неврологические симптомы бывают редко.
Бессимптомная герпесвирусная инфекция
Достаточно часто герпес половых органов (включая первичный, первый эпизод непервичного, рецидив) протекают бессимптомно, без пузырьков-везикул на коже и слизистых. При этом возможно истинное бессимптомное течение и течение с невыявленными или неправильно расцененными симптомами. У многих лиц с бессимптомным течением заболевания можно выявить минимальные или неспецифические симптомы, на которые больной не обращает внимания.
Бессимптомная инфекция встречается как у лиц, у которых никогда не было герпеса половых органов, так и у лиц, у которых уже был герпес половых органов.
- Инфекция, вызванная ВПГ-1,
- Инфекция, вызванная ВПГ-2 у лиц, инфицированных ВПГ-1,
- Нетипичная локализация (шейка матки),
- Половые особенности (у женщин чаще бессимптомные инфекции),
- Расовые отличия (у представителей негроидной расы герпес протекает легче),
- Наследственные факторы - определенные группы HLA (системы белков-антигенов).
Атипичный герпес половых органов
Выделяют атипичный герпес: в 20% всех случаев генитального герпеса специфические проявления герпетической инфекции скрыты симптоматикой сопутствующих местных инфекционных заболеваний (чаще всего кандидоза).
− рецидивирующие трещины слизистой оболочки наружных половых органов, которые самостоятельно эпителизируются в течение 4 - 5 дней;
− геморрагическая форма: единичные или множественные везикулезные элементы (пузырьки) с геморрагическим содержимым;
− абортивная форма: очаг поражения в виде зудящего пятна или папулы при отсутствии везикулезных элементов;
− субклиническая форма: кратковременное появление на слизистой оболочке наружных половых органов поверхностных трещинок, сопровождающихся незначительным зудом.
Адрес: г. Москва, Ленинский проспект, дом 82/2
Часы работы: Пн - Пт: с 10.00 до 20.00; Сб - Вс, праздники: с 11.00 до 18.00
Как нас найти (схема проезда):
Герпетические заболевания органов мочеполовой системы все чаще наблюдаются у пациентов с микст-инфекцией. Генитальный герпес в 80% случаев протекает в виде микробной ассоциации, в сочетании с хламидиями, уреа- и микоплазмой, стрепто-, стафилококками, грибковой флорой. Не исключено сочетанное поражение гениталий ВПГ, гонококком, бледной трепонемой, другими вирусами, передающимися при половом контакте. При выявлении бактериально-вирусных ассоциаций необходимо учитывать синергическое действие (взаимодействие) различных возбудителей в развитии воспалительного процесса гениталий
Вследствие сочетания инфекций и общего влияния возбудителей на организм развивается более тяжелое, иногда с атипической симптоматикой, заболевание. В этом случае необходимо тщательного обследовать пациентов для постановки точного диагноза и исключения ВИЧ-инфекции.
Рецидивирующий генитальный герпес также чаще протекает не как самостоятельное заболевание, а сопровождает другую патологию мочеполовой системы. Накапливаются данные о том, что гонококковая, хламидийная, трихомонадная инфекции могут активизировать герпетическую инфекцию, предопределяя возникновение рецидивов герпетического заболевания гениталий.
Иммунодефицитные состояния
ВПГ угнетает иммунную систему (иммуносупрессия). Клинически это выражается в частых простудах, сниженной работоспособности, быстрой утомляемости, низкой устойчивости к стрессам, апатии. Температура может повышаться до субфебрильной. По мере прогрессирования иммуносупрессии увеличивается частота возникновения рецидивов герпетической инфекции, увеличивается распространенность очагов поражения кожи и слизистой оболочки.
Психоэмоциональные осложнения

При длительно протекающей, часто рецидивирующей герпетической инфекции для больных характерно развитие психоэмоциональных нарушений, в большой степени связанных с астеническим синдромом. У некоторой части больных герпетическая инфекция вызывает диагностически значимую личностную дисгармонию, с риском развития тяжелых невротических и депрессивных состояний.
Генитальный герпес (ГГ) у женщин сопряжен с большей степенью психоэмоциональных осложнений, чем у мужчин. Так, у 48% женщин с генитальным герпесом специализированное обследование позволило установить отклонение личности, а у 11% – неврастенические, депрессивные синдромы.
Часто рецидивирующее и длительное течение генитального герпеса вызывает тяжелые физические страдания. Бичом для женщин и мужчин являются генитальный герпес с яркими высыпаниями, жжением, выделениями различного характера из половых органов.
Еще одним психологическим аспектом проблемы герпеса является социальная, т.к. инфекция нарушает нормальную половую жизнь пациентов, способствует возникновению фобий, порождает страх социальной оценки и приводит к семейным неурядицам.
ГГ как причина рака. Онкогенное влияние герпетической инфекции.
Важное значение вируса простого герпеса (ВПГ) в патологии человека – это его возможная ассоциация с некоторыми формами рака у людей.
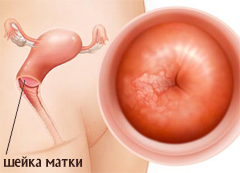
Следует отметить возможную роль ВПГ-2 (в ассоциации с паповавирусами, ЦМВ, хламидиями и микоплазмами) в развитии опухолевых процессов у человека, в частности рака шейки матки и рака предстательной железы. Считают, что в этом случае ВПГ-2 может поддерживать канцерогенез, инициируя развитие дисплазии и поддерживая ее в состоянии стабилизации.
Накапливается число клинико-экспериментальных наблюдений, подтверждающих этиологическую роль биотипов ВПГ в развитии дисплазии, карциномы in situ, рака шейки матки у женщин. Так, при эрозии и дисплазии шейки матки, ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Герпетическая инфекция (ГИ) с большей вероятностью может приводить к онкологическому заболеванию при смешанных формах инфекции. Например при наличии ассоциации ВПГ-2 с вирусами папилломы человека регистрируется значительно более высокая степень риска развития онкопоражений, когда происходит направленная индукция процессов малигнизации эпителиальных клеток.
Хроническая ГИ повышает риск развития онкозаболеваний при воздействии химических канцерогенов и мутагенов. Это происходит потому, что геномы клеток, хронически инфицированных ВПГ-2, становятся уязвимыми к действию химических канцерогенов. Как пример — курение увеличивает риск развития рака шейки матки у женщин с хронической герпетической инфекцией эндоцервикса.
Еще одним фактором в инициации и поддержании механизмов канцерогенеза у человека, может стать иммуносупрессивный эффект хронической рецидивирующей ГИ. Из-за подавления ряда звеньев клеточного (противоопухолевого) иммунитета развивается ВПГ-индуцированный иммунодефицит. Он может послужить благоприятным фоном для развития неопластического процесса из единичных мутировавших (стареющих) потенциально раковых клеток.
ГГ и ВИЧ-инфекция
Генитальный герпес способствует распространению ВИЧ-инфекции, а также других инфекций, передающихся половым путем (эпидемиологический синергизм).
• в кожных герпетических изъязвлениях содержится большое количество CD4+ лимфоцитов, которые являются идеальной мишенью для ВИЧ, вследствие чего даже при очень низкой концентрации ВИЧ возрастает вероятность инфицирования полового партнера;
• герпесвирусы способствуют экспрессии генов ВИЧ, что создает дополнительные условия для эффективной репродукции вируса
Вирусы герпеса могут активировать ВИЧ, находящийся в стадии про-вируса, и являются кофактором прогрессирования ВИЧ-инфекции и СПИДа. В этой связи герпетическая инфекция является одним из важных СПИД-индикаторных заболеваний.
Атеросклероз
Ассоциация атеросклероза с вирусной инфекцией была экспериментально обоснована в 70-е годы прошлого века. За последние 30 лет накопилось достаточно много экспериментальных и клинических данных, свидетельствующих об участии в патогенезе атеросклероза некоторых вирусов, среди которых вирус простого герпеса.
Тенденцию к ускорению процесса атеросклероза в последние годы связывают именно с огромным инфицированием ВПГ. Находит все большее подтверждение вирусная гипотеза происхождения атеросклероза, в основе которой лежит предположение об индуцирующей роли вирусов герпеса в развитии заболевания.
ВПГ, возможно, в ассоциации с цитомегаловирусом, играет значительную роль в индукции атеросклероза. Наиболее вероятной причиной изменений в атеросклеротической бляшке больных атеросклерозом является вирусное инфицирование, так как вирусы (в большинстве случаев ВПГ, ЦМВ) выявляются и в сосудистом эндотелии, и в гладкомышечных клетках сосудистой стенки. Данный факт также предполагает вероятность трансформации гладкомышечных клеток под действием ВПГ.
При аутопсии людей, погибших от случайных причин, в различных слоях артериальной стенки, в том числе эндотелии и гладкомышечных клетках, выявлены иммунологические маркёры цитомегаловируса (ЦМВ) и вируса простого герпеса (ВПГ). У больных атеросклерозом вирус простого герпеса в 90% случаях явился инфекционным агентом, причем, частота и патогенность ВПГ-1 несколько выше, чем ВПГ-2.
В атеросклеротических бляшках возможно присутствие сразу нескольких патогенов: например, ЦМВ, ВПГ-1 и других патогенных штаммов. Более того, в ряде исследований была продемонстрирована взаимосвязь между числом различных патогенов, которыми инфицирован индивидуум, и 1) распространенностью атеросклеротического процесса, 2) риском смерти вследствие сосудистых катастроф (в т.ч. и инсультов),
Вирус герпеса и болезни сердца.

Герпесвирусная инфекция повышает риск развития осложнений при сердечно-сосудистых заболеваниях, например влияет на особенности клинического течения ишемической болезни сердца (ИБС). Более тяжелое течение ИБС ассоциировано с инфицированием двумя типами вируса простого герпеса (более выраженные и продолжительные ангинозные боли, плохо купирующиеся приемом нитроглицерина или ингаляций нитроминта, одышка и чувство нехватки воздуха). При инфицировании только I типом вируса простого герпеса, в исследованиях отмечено более легкое течение ИБС.
Герпесвирусная инфекция в худшую сторону влияет и на клиническое течение инфаркта миокарда, вызывая осложнения. При инфаркте миокарда, у пациентов, имеющих высокие титры IgM и IgG к ВПГ-1 и ВПГ-2, на фоне активации хронической герпесвирусной инфекции, значительно повышается риск развитии острой сердечно-сосудистой недостаточности (в том числе отеков легких) и нарушений сердечного ритма в виде жизнеугрожающих аритмий.

Основным местом локализации первичной генитальной инфекции ВПГ у женщин является шейка матки. Чаще всего, герпетические поражения у женщин локализуются на больших и малых половых губах (68,6%), в области вульвы (41,8%), клитора (35,7%), влагалища и шейки матки (84,4%).
ВПГ был изолирован из шейки матки во время первичного заражения у 88—90 % женщин с первичной инфекцией ВПГ-2, которые имели везикулезную сыпь на наружных гениталиях, у 65 % — с повторным эпизодом инфекции ВПГ-2, и у 80 % женщин с ВПГ-1. Большинство (89 %) женщин, выделяющих вирус при первичном эпизоде заболевания, имели изменения на шейке матки.
Особенностью генитального герпеса (Herpes genitalis) женских половых органов является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки. Вовлечение в инфекционный процесс этих органов может происходить вторично, вслед за возникновением герпеса наружных гениталий, но может протекать и как изолированное поражение.
Рецидивирующая герпетическая инфекция (РГИ) может проявляться клиникой вульвовагинита и цервицита, вызывать поражения слизистой матки, труб и придатков. В 83,6 % случаев при стойких, не поддающихся терапии кольпитах, лейкоплакиях шейки матки выделяют вирус простого герпеса (ВПГ) как один из ведущих этиологических факторов заболевания.
По некоторым данным, в 66 % случаев у женщин герпетическая инфекция (ГИ) протекает атипично. Об имеющейся длительно текущей хронической ГИ можно говорить на основании особенностей клинического течения, наличия герпетического антигена в эпителиальных клетках вульвы, влагалища и периферической крови.
д) хронических часто рецидивирующих сальпингоофоритах (воспаление маточных труб и яичников) и эндометритах, не поддающихся стандартной антибактериальной терапии;
У 1–2% женщин, поступающих в гинекологическую клинику, независимо от основного заболевания, обнаруживают цитологические доказательства ВПГ-инфекции.
Герпес наружных половых органов у женщин
При рецидивирующем герпесе (РГ) наружных половых органов у женщин, очаг поражения находится в области наружных гениталий и перианальной области. Герпетические высыпания у женщин возникают на больших и малых половых губах, области лобка и промежности.
Типичная форма РГ наружных гениталий характеризуется ярко выраженными симптомами болезни, классическим развитием очага поражения (эритема, образование везикул, развитие эрозивно-язвенных элементов, эпителизация) и субъективными ощущениями (зуд, чувство жжения, болезненность, недомогание). проявляется повторяющимися пузырьковыми высыпаниями. Выраженная симптоматика позволяет врачам визуально поставить диагноз РГГ, своевременно назначить лечение и информировать больного об инфекционном характере заболевания и опасности заражения полового партнера.
Герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки
Поражение слизистых оболочек входа во влагалище, влагалища, влагалищной части шейки матки, цервикального канала, уретры, мочевого пузыря, анальной области и ампулы прямой кишки проявляется в двух клинических формах:
- очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно-эрозивных элементов,
- диффузной, при которой патологический процесс протекает по типу неспецифического воспаления.
Герпес верхнего отдела полового тракта (поражение матки, маточных труб).
Типичная клиническая картина герпетических поражений органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Неспецифические герпетические поражения внутренних половых органов проявляются эндоцервицитом, эрозией шейки матки, вагинитом. Ряд авторов цервициты без наружных язв также относят к атипичным проявлениям ГГ.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Обычно больные предъявляют жалобы на выделения из влагалища, периодически появляющиеся боли в малом тазу, области проекции матки, яичников.
Герпетические поражения шейки матки
Герпетические поражения шейки матки могут носить типичный и нетипичный характер. В типичном варианте генитального герпеса – это всегда хорошо заметные множественные, довольно мелкие, с четкими границами округлые эрозии; высыпные элементы быстро минуют везикулярную стадию, в которой, кстати, эти элементы плохо различимы без применения кольпоскопии. Проблема причастности ВПГ к развитию нетипичных герпетических изменений слизистой шейки матки в настоящее время находится в стадии исследований.
При кольпоскопии в острый период герпетической инфекции шейки матки определяют изъязвление с неровными краями с сукровицей в области дна. Эволюция этого поражения идет от изъязвления с красным дном к простой эрозии до полного исчезновения в течение 3-х недель. К предшествующим изменениям относят маленькие буллезные образования, затем округлые микроэрозии с последующим формированием простых красных пятен, которые похожи на местный пятнистый кольпит.
Исследования показали, что выделение ДНК ВПГ с поверхности эрозии шейки матки в 60 % случаев сопровождается репликативной фазой ГИ (репликация и сборка вирусных частиц в инфицированных клетках). При эрозии и дисплазии шейки матки ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Особое значение влияние герпетической инфекции на состояние эпителия шейки матки имеет у женщин, длительно принимающих оральные гормональные контрацептивы. Известно, что длительный прием комбинированных стероидов в той или иной мере усиливает процессы плоскоклеточной метаплазии, а также может вызывать эффект эндоцервикальной гиперплазии, причем этот эффект в случае его развития наблюдается как в эпителии цервикального канала, так и в участках псевдоэрозии на фоне эктропиона, в полипах слизистой цервикального канала. В связи с этим прием оральных комбинированных контрацептивов может являться кофактором в развитии рака шейки матки, особенно в сочетании с герпетической инфекцией.
Герпетический цервицит
Герпетический цервицит – это воспалительный процесс, вызванный ВПГ. Для клинических проявлений герпетического цервицита характерно разнообразие проявлений — от легкой гиперемии с небольшим количеством эрозий до тяжелого некротического поражения (под эрозией шейки матки понимают дефект эпителия в результате воспаления). Цервицит диагностируется у 70-90% женщин с герпетическим поражением половых органов. Шейка матки при герпетическом эндоцервиците отечна, часто имеет эрозии, легко кровоточит при манипуляциях.
Герпетический эндометрит
Эндометрит — это воспаление внутренней (слизистой) оболочки матки (эндометрия) с поражением как функционального, так и базального слоя. Эндометрит, вызванный вирусом простого герпеса, является следствием длительной персистенции (существования) вируса в эндометрии. Герпетический эндометрит, как правило, возникает при атипичном или бессимптомном течении ГГ, типичная форма отмечается редко (~20% случаев). Клинические симптомы при вирусном поражении эндометрия чаще всего отсутствуют или проявляются нетипично, что приводит к ошибкам в диагностике и позднему началу лечения.
При герпетическомпоражении ткани нарушаются факторы местного и общего иммунитета, целостность поверхности эпителия, что приводит к созданию благоприятных условий для развития других инфекционных процессов .
Клинически герпетический эндометрит чаще проявляется во второй фазе менструального цикла или во время беременности, что, возможно, обусловлено повышением уровня простагландинов в этот период или супрессией Т-клеточного звена иммунитета, способствующих реактивации ВПГ, персистирующего в эндометрии. Субклиническая латентная внутриматочная герпетическая инфекция является важным фактором невынашивания беременности. Эндометриты ВПГ-этиологии встречаются нечасто, но эти заболевания очень опасны и могут вызвать гибель женщины и плода.
Герпес уретры и мочевого пузыря (герпетический уретрит)
Герпетический уретрит у женщин субъективно проявляется болями и резями в начале мочеиспускания, частыми позывами к мочеиспусканию. У 4,8% женщин имеет место очень болезненное мочеиспускание, или задержка мочеиспускания в результате инфекции уретры и слизистой оболочки мочевого пузыря. Нормализация функции мочевого пузыря у больных с задержкой мочеиспускания обычно происходит в течение 6–10 дней.
При осмотре наблюдаются гиперемия наружного отверстия уретры, наличие скудных слизистых выделений; при уретроскопии в передней части уретры иногда удается обнаружить мелкие поверхностные эрозии, катаральное воспаление.
Герпетический цистит
Ведущими симптомами герпетического цистита являются цисталгия, появление болей в конце мочеиспускания, дизурические явления. При герпетическом цистите появляются гематурия (кровь в моче), появление болей в конце мочеиспускания, боли в области мочевого пузыря. У женщины это может быть первым и единственным признаком ВПГ-инфицирования мочеполовой сферы. Он нередко возникает в первые 1-3 месяца после начала половой жизни или после смены полового партнера.
Герпес анальной области и прямой кишки
Очаг поражения в анальной области обычно представляет собой рецидивирующую трещину, что нередко является поводом для диагностических ошибок. Такие больные с ошибочным диагнозом "трещина заднего прохода" попадают к хирургам. Зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов, также трудны для диагностики.
Поражение анальной области может возникнуть первично как самостоятельное заболевание или вторично – в результате затекания отделяемого влагалища и мацерации слизистой оболочки ануса при наличии у пациентки герпетического кольпита, сопровождающегося обильной экссудацией.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. При ректоскопии определяется катаральное воспаление, иногда эрозии.
Герпес внутренних гениталий - субклиническая и бессимптомная формы.
Для субклинической формы герпеса внутренних гениталий (влагалища, матки, яичников и т.д.) типично отсутствие у пациентки жалоб, иногда имеются указания на периодически появляющиеся необильные слизистые выделения из влагалища. При гинекологическом осмотре симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого канала шейки матки, влагалища и уретры периодически выявляется повышенное количество лейкоцитов (до 200–250 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса. При вирусологическом исследовании мазков методом иммунофлюоресценции в лейкоцитах определяется антиген ВПГ.
Бессимптомная форма герпеса внутренних гениталий характеризуется отсутствием у больных каких-либо жалоб на половую сферу, объективных клинических данных, подтверждающих воспаление. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет. Бессимптомная форма герпеса внутренних гениталий выявляется у 20–40% женщин, страдающих РГГ ягодицы и бедра. Это важное обстоятельство необходимо учитывать при планировании беременности у женщин с этой формой РГГ в связи с существующей вероятностью развития во время беременности осложнений ВПГ-инфекции.
Согласно данным литературы, у 83,6% женщин, страдающих не поддающимися терапии кольпитами и лейкоплакией шейки матки, ВПГ является одним из факторов заболевания. Доказано, что ВПГ может быть причиной развития эндометрита и сальпингоофорита.
Герпетический вульвовагинит
У женщин часто встречаются герпетический вульвовагинит, особенностью течения которого является нередкое присоединение отека пораженной области. Вирус герпеса могут изолированно поражать вульву и влагалище. Заражение происходит от больных. Герпетический вульвовагинит проявляется мелкими пузырьками на гиперемированной вульве. Пузырьки содержат прозрачную, а при присоединении вторичной инфекции — гнойную жидкость. Через 5—7 дней пузырьки вскрываются с образованием эрозий и язвочек, которые покрываются струпом. В начале заболевания выражены жжение, боли и зуд в области вульвы. Общие симптомы включают головную боль, озноб, повышение температуры тела.
Генитальный герпес во время беременности
Заболевание ВПГ женщин во время беременности может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Тяжелейшие формы неонатального герпеса развиваются при инфицировании новорожденного вирусом простого герпеса в родах. При первичном ГГ у матери инфицируется от 30% до 80% детей, при рецидивирующем герпесе – 3–5%. Инфицирование плода во время родоразрешения, если у матери в конце беременности имели место герпетические высыпания, происходит у 50% женщин, больных РГГ; при этом у 60–80% инфицированных детей развивается энцефалит.
Герпес менструальный
Менструальный герпес — это генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением, характеризующийся ежемесячными обострениями инфекционного процесса до, во время или после менструации. Такое течение заболевания может стать для женщины сильнейшим психотравмирующим фактором, ограничивающим ее социальную активность и снижающим качество жизни.
Этот вариант ГИ является сложным для лечения. Поэтому разработка адекватных и эффективных способов лечения и профилактики рецидивов у больных с данными формами ГГ остается актуальной. Европейские стандарты лечения пациенток предусматривают длительную (годами) супрессивную терапию противовирусными препаратами , что не исключает повторного рецидирования ГГ и бессимптомного вирусовыделения, появления побочных эффектов и резистентности вирусов герпеса к лекарственной терапии.
Хронический эндометрит (ХЭ) – клинико-морфологический синдром, при котором в результате персистирующего повреждения эндометрия инфекционным агентом возникают множественные вторичные морфофункциональные изменения, нарушающие циклическую биотрансформацию и рецептивность слизистой оболочки тела матки.
Факторами риска развития хронического эндометрита являются:
- инвазивные манипуляции в полости матки (аборты, гистероскопия, диагностическое выскабливание, биопсия эндометрия, гистеросальпингография, введение внутриматочных контрацептивов, инсеминация, экстракорпоральное оплодотворение и др.),
- инфекционно-воспалительные осложнения после родов,
- инфекционные процессы во влагалище
- воспалительные и анатомические изменения шейки матки,
- бактериальный вагиноз,
- оперативные вмешательства на органах малого таза
Клинически бессимптомный воспалительный процесс в эндометрии представляет собой наличие ассоциаций облигатно-анаэробных микроорганизмов, а также персистенцию условно-патогенной флоры и персистенцию вирусов. По данным многих исследователей, наиболее характерным при хроническом эндометрите у женщин является наличие ассоциаций 2-3 видов облигатно-анаэробных микроорганизмов и вирусов [26, 31, 39, 44, 48, 62, 85, 105, 126 и др.].
Спектр генитальной инфекции, выявленной при ПЦР диагностики отделяемого из цервикального канала и полости матки у пациенток с ХЭ включет: хламидиоз – 14,9%, генитальный герпес – 33,6%, уреаплазмоз – 37,8%, микоплазмоз – 11,6%, цитомегаловирус – 18,9% СероваО.Ф., Овчинникова В.В., 2006).
В большинстве случаев инфицированность носит смешанный характер, причем у женщин с хроническим эндометритом в 1,5 раза чаще инфекция выявляется в полости матки, чем в цервикальном канале.
Среди персистирующих вирусов наибольшее значение имеют: герпес-вирусные инфекции (вирус простого герпеса, герпес-зостер), цитомегаловирус, энтеровирусные инфекции (Коксаки А, В), аденовирусы [13, 30, 31, 33, 42, 45, 47, 49, 58, 80, 87, 92, 107, 133, 157]. В литературе описан ряд клинических ситуаций, когда в ткани эндометрия в качестве моноинфекции выявляли вирусы простого герпеса (ВПГ), цитомегалии и др. Особое место занимает герпетическое поражение эндометрия. Герпетический эндометрит, как правило, возникает у женщин, страдающих атипичными или бессимптомными формами генитального герпеса и вызван длительной персистенцией ВПГ в эндометрии [31, 45, 49, 69, 101, 131].
Хроническое течение воспаления с персистированием в тканях инфекции, является источником постоянного антигенного раздражения, своего рода пусковым и поддерживающим воспалительную реакцию механизмом, а с другой стороны, иммунные нарушения в организме усугубляют течение инфекционного процесса [19, 24, 35,49,].
В условиях постоянного присутствия повреждающего агента в ткани не происходит завершения заключительной фазы воспаления – регенерации, нарушается тканевый гомеостаз и формируется целый каскад вторичных повреждений. Нарушение микроциркуляции в эндометрии приводит к ишемии и гипоксии ткани, активированные макрофаги в очаге воспаления являются источником активных форм кислорода и перекиси водорода и запускают процесс перекисного окисления липидов и повреждение клеточных мембран.
Длительная, часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, ее рецепторном аппарате, вызывает дисбаланс цитокинов, что в свою очередь нарушает синтез стероидной сульфатазы и биологическую активность эстрогенов в эндометрии. В результате в нем нарушаются процессы пролиферации и циклической трансформации. Эти изменения усугубляются нарушением эндокринной системы вследствие патологической афферентации в отделы ЦНС, регулирующие гипоталамо-гипофизарно-яичниковые взаимоотношения, а также иммунной и в ряде случаев - системы гемостаза. Гормональные нарушения у пациенток с ХЭ характеризуются, чаще всего, гипопрогестеронемией.
Как известно, локальные факторы защиты в цервикальном канале способствуют поддержанию стерильности эндометрия. В матке аналогичную функцию выполняет эндометрий, препятствующий проникновению микроорганизмов, благодаря периодическому отторжению его функционального слоя. Однако при ХЭ воспалительные изменения наблюдаются и в базальном слое эндометрия [21, 35, 43, 52, 103].
Структурные изменения в эндометрии сопровождаются нарушением его функции, в частности, продукции эндометриальных белков, отражающих полноценность секреторных преобразований эндометрия в лютеиновую фазу цикла и необходимых для поддержания успешной беременности: •альфа-2-микроглобулина фертильности (АМГФ) - показателя функциональной активности маточных желез и плацентарного альфа-1 микроглобулина (ПАМГ) - показателя децидуализации эндометрия. Это еще раз свидетельствует о том, что у женщин на фоне хронического эндометрита отмечается неполноценность эндометрия, включающая недоразвитие железистого и стромального компонентов, являющаяся основой недостаточности лютеиновой фазы цикла (НЛФ).
На фоне хронического эндометрита наблюдается ослабление экспрессии эстрогеновых и, особенно, прогестероновых рецепторов в эпителиальных и стромальных клетках. Это снижает их чувствительность к стероидам, поэтому отмечается неполноценность циклических превращений даже при удовлетворительном синтезе эстрогенов и прогестерона [69, 86, 99, 175].
Кроме того, при склерозе кровеносных сосудов, происходящем при тяжелой форме хронического эндометрита, затрудняется обмен между кровью и тканями, в том числе и проникновение гормонов к клеткам эндометрия, реагирующим на их действие, что усугубляет НЛФ.
Все эти изменения в эндометрии при ХЭ препятствуют нормальной имплантации и плацентации и формируют патологический ответ на беременность, что обусловливает ранние репродуктивные поттери (В.М.Сидельникова, 2002, И.Б.Манухин, 2001, Серова О.Ф., 2003; А.П.Милованов, 2004S.Glasser, J.Aplin, 2002; A.Sharkey, 2003).
Читайте также:

