Может ли быть гепатит при удаленном желчном пузыре
Обновлено: 19.04.2024
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Баку, Азербайджанская Республика
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Республика Азербайджан, Баку
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Республика Азербайджан, Баку
Лапароскопическая холецистэктомия у больных циррозом печени
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(3): 11‑16
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Баку, Азербайджанская Республика
Цель. Оценка возможности и надежности лапароскопической холецистэктомии у больных с циррозом печени. Материал и методы. За период с августа 2001 г. по декабрь 2015 г. лапароскопическая холецистэктомия выполнена нами 46 больным циррозом печени класса А и В по классификации Child—Pugh. Показаниями к операции служили острый калькулезный холецистит у 21 (45,6%) больного и хронический калькулезный холецистит у 25 (54,4%) больных. Результаты. Продолжительность операции составила в среднем 75 мин. Конверсия в открытую операцию потребовалась в 2 наблюдениях. Послеоперационные осложнения, включающие кровотечение, нарушение функции печени, развитие асцита, раневые проблемы, наблюдали у 11 (23,9%) больных. Летальных исходов не было. Средний срок пребывания больных в стационаре составил 2,5 дня. Вывод. Лапароскопическая холецистэктомия может быть успешно выполнена при тщательном отборе пациентов с компенсированным циррозом печени. Преимуществами миниинвазивного метода у этой категории больных являются меньшие кровопотеря, продолжительность операции и длительность нахождения больных в стационаре.
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Баку, Азербайджанская Республика
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Республика Азербайджан, Баку
Кафедра хирургических болезней №2 Азербайджанского медицинского университета, Республика Азербайджан, Баку
Желчнокаменная болезнь встречается приблизительно у 1/3 пациентов с циррозом печени (ЦП) [1]. Повышенный литогенез у таких больных предположительно связан с увеличением секреции неконъюгированного билирубина, снижением содержания желчных кислот и фосфолипидов в желчи, гипомоторикой желчного пузыря [2]. Камни в желчном пузыре у больных ЦП мигрируют редко, в связи с чем желчнокаменная болезнь у большинства из них протекает бессимптомно [3]. Необходимость в холецистэктомии у больных ЦП возникает, как у пациентов без ЦП, при появлении симптомов желчной колики, острого холецистита [4].
Общеизвестно, что ЦП с портальной гипертензией увеличивает риск развития интраоперационных и послеоперационных осложнений при любом виде хирургического вмешательства, особенно при операциях на билиарном дереве [5].
В хирургических публикациях 80-х годов прошлого века сообщалось о высокой частоте осложнений (от 5 до 23%) и летальных исходов (от 7 до 20%) при открытых оперативных вмешательствах на желчном пузыре и желчных протоках у больных ЦП, при этом основными причинами неблагоприятных исходов были чрезмерная потеря крови, послеоперационная печеночная недостаточность и сепсис [6, 7].
Изначально ЦП с портальной гипертензией считался противопоказанием к лапароскопической холецистэктомии (ЛХ) из-за потенциальных рисков кровотечения [8].
С накоплением опыта в лапароскопической хирургии этот миниинвазивный подход стал использоваться в ряде сложных ситуаций, связанных с желчным пузырем, в том числе при желчнокаменной болезни у больных ЦП.
Вместе с тем в публикациях последних лет [9] сообщалось о довольно широком разбросе показателей послеоперационных осложнений (6,6—47,3%) и смертности (0—4,3%) при ЛХ у больных ЦП.
В настоящем исследовании мы попытались на основании собственного опыта дать оценку целесообразности и надежности ЛХ при лечении холецистолитиаза у больных ЦП.
Материал и методы
Ретроспективному анализу были подвергнуты истории болезни 46 больных ЦП, перенесших ЛХ в клинических базах кафедры хирургических болезней № 2 Азербайджанского медицинского университета за период с июня 2001 г. по декабрь 2015 г. Учитывали возраст пациентов, пол, этиологию цирроза, характер заболевания желчного пузыря, продолжительность операции, интраоперационные и послеоперационные осложнения, частоту конверсии в лапаротомию, длительность пребывания в стационаре.
Женщин было 30 (65,2%), мужчин — 16 (34,8%), их средний возраст составил 56,6±12,5 года (диапазон 23—74 года). Гепатит С был причиной цирроза у 15 (32,6%) больных, гепатит В — у 12 (26%), гепатит В и С — у 5 (10,9%), злоупотребление алкоголем — у 5 (10,9%), жировая дистрофия печени — у 7 (15,2%) больных. Этиологию цирроза установить не удалось у 2 пациентов.
Тяжесть ЦП была классифицирована по Child—Pugh, согласно которой в класс, А включены 34 (73,9%), в класс В — 12 (26,1%) больных. Больных декомпенсированным ЦП (класс С Child—Pugh) в нашем исследовании не было (табл. 1).

Таблица 1. Характеристика больных циррозом печени, которым выполнена лапароскопическая холецистэктомия
В соответствии с классификацией ASA (American Society of Anesthesiologists) в группу ASA-I вошли 30, в группу ASA-II — 16 больных.
Дооперационное обследование больных включало лабораторные анализы, абдоминальное ультразвуковое исследование, гастродуоденоскопию, магнитно-резонансную холангиографию.
Сопутствующие заболевания, в том числе гипертоническая болезнь, сахарный диабет, ишемическая болезнь сердца, варикозное расширение вен нижних конечностей в отдельности или в сочетании, отмечены у 27 (58,7%) больных. ЦП до операции был диагностирован у 31 (67,4%), во время операции — у 15 (32,6%) пациентов.
Асцит присутствовал у 8 больных, спленомегалия — у 32, варикозное расширение вен пищевода — у 17, желтуха — у 11 пациентов. Некоторым больным желтухой выполнена магнитно-резонансная холангиография. При этом патологических изменений общего желчного протока не обнаружено ни в одном наблюдении.
Диагноз ЦП был подтвержден интраоперационной визуальной оценкой внешнего вида печени и результатами гистологического исследования биоптатов печени, взятых во время операции. Показаниями к ЛХ явились острый калькулезный холецистит у 21 (45,6%) пациента и хронический калькулезный холецистит у 25 (54,4%) больных.
Экстренно были оперированы 12 (26,7%), в плановом порядке — 34 (73,9%) пациента.
Специальную предоперационную подготовку с использованием гепатопротекторов, раствора альбумина, диуретиков в течение 2—4 нед проводили у пациентов, поступивших с явлениями желтухи и асцита (класс В Child—Pugh). Этих больных оперировали после устранения у них асцита и коррекции показателей функции печени.
ЛХ выполняли под общим обезболиванием, в стандартной комплектации, четырехпортным методом, в американском варианте с некоторыми модификациями.
Размещение портов у больных с не диагностированным до операции ЦП проводили, как у больных без ЦП. В случае установленного ЦП первый троакар вводили субумбиликально, три других троакара — под лапароскопическим контролем через бессосудистые участки брюшной стенки, при этом субксифоидальный порт размещали несколько правее срединной линии во избежание повреждения сосудов в круглой связке печени.
Давление в брюшной полости старались поддерживать в пределах 8—10 мм рт.ст., учитывая его возможное отрицательное влияние на гемодинамику печени [14].
Спайки с желчным пузырем, которые у ряда больных были сильно васкуляризированы, рассекали путем электрокоагуляции с использованием крючкообразного электрода, диссектора или ультразвукового скальпеля. Диссекции тканей тупым путем по возможности избегали с целью минимизации кровотечения.
У 5 пациентов был введен пятый, дополнительный 5-миллиметровый троакар в правом подреберье для отведения гипертрофированного сегмента левой доли печени, прикрывающего поле зрения видеокамеры.
По интраоперационной визуальной оценке печени макронодулярный цирроз отмечен у 15, микронодулярный цирроз — у 31 больного. Изменения в желчном пузыре, как катаральный холецистит, были расценены у 40 больных, как флегмонозный — у 5, как гангренозный — у 1 больного. Скопление мутной серозной жидкости в небольшом количестве в зоне операции отмечено у 4 больных.
Расширение сосудов на спайках с желчным пузырем и печенью имело место у 14 больных, в том числе у 6 и в области гепатодуоденальной связки. При наличии увеличенного напряженного желчного пузыря производили его опорожнение путем толстоигольной пункции или вскрытия просвета и эвакуации содержимого электроотсосом.
Пузырный проток и пузырную артерию выделяли с помощью крючкообразного электрода или диссектора, подключенного к электрокоагулятору. Разделение тканей тупым путем осуществляли здесь с помощью диссектора или наконечника отсоса, убедившись в отсутствии расширенных сосудов. Удаление пузыря начинали обычно от шейки. Рассечение тканей в области треугольника Кало производили малыми порциями ближе к желчному пузырю после их идентификации и клипирования. Выделение желчного пузыря из ложа в печени производили по возможности субмукозно, что позволяло избежать значительного кровотечения.
При расположении большей части желчного пузыря в ткани печени или при плотных сращениях его стенки с печенью производили субтотальную холецистэктомию с оставлением участка стенки пузыря на печени (у 6 больных). Использование при этом ультразвуковых ножниц давало возможность произвести рассечение стенки пузыря почти бескровно. Слизистую оболочку оставленной стенки пузыря подвергали мукоклазии при хроническом холецистите, выскабливанию с помощью марлевого шарика, смоченного йодным раствором, при остром холецистите.
Кровотечение из ложа пузыря останавливали электрокоагуляцией, прижатием марлевой полоски или гемостатической губки. В конце операции иссекали кусочек печени для гистологического исследования. Перед удалением портов в течение 3—5 мин контролировали надежность гемостаза.
Брюшную полость дренировали во всех наблюдениях. Порты удаляли под визуальным контролем для исключения кровотечения из точек прокола.
Результаты
Попытка ЛХ, предпринятая у 46 больных ЦП, удачно завершена у 44 из них. В 2 наблюдениях потребовался переход в открытую операцию. Причиной конверсии в одном наблюдении явилось сильное кровотечение из ложа пузыря, не поддающееся остановке эндоскопическим путем, в другом — выраженная воспалительная инфильтрация в области шейки пузыря (табл. 2).

Таблица 2. Интраоперационные и послеоперационные осложнения при лапароскопической холецистэктомии у больных циррозом печени
Кровотечение в процессе ЛХ возникло у 7 (15,2%) пациентов. Кровопотеря при этом не превышала в среднем 50 мл (10—200 мл). Сильное кровотечение из ложа пузыря произошло у одного больного. Переливание компонентов крови понадобилось в 1 наблюдении. Продолжительность Л.Х. составила в среднем 75,5±14,4 мин (диапазон 30—130 мин). Дренажные трубки удаляли на 2—3-и сутки. У 2 пациентов из-за истечения кровянистой асцитической жидкости они были извлечены на 5-е и 6-е сутки.
Продолжительность пребывания больных в стационаре составила в среднем 2,5 дня (1—6 дней). Больных обычно выписывали из клиники на 2—3-и сутки после операции, за исключением тех, у которых отмечались явления печеночной недостаточности или просачивание асцитической жидкости из послеоперационной раны. Эти больные находились на стационарном лечении в течение 4—6 дней после операции.
Холецистэктомия является наиболее распространенным хирургическим вмешательством у больных ЦП [15]. Она может быть опасной при заболевании печени в терминальной стадии и при портальной гипертензии из-за большей вероятности возникновения серьезных осложнений и прежде всего кровотечения и гепатоцеллюлярной недостаточности. Возможно, по этой причине ЛХ изначально была противопоказана больным Ц.П. Позже, по мере накопления опыта, а также улучшения оборудования в лапароскопической хирургии миниинвазивный метод постепенно заменил открытую холецистэктомию в этой группе больных и стал предпочтительным вмешательством при желчнокаменной болезни. В публикациях последних лет подтверждена безопасность и хорошая переносимость ЛХ больными с компенсированным циррозом печени [12—14]. Преимуществами Л.Х. при ЦП являются снижение частоты послеоперационного кровотечения, инфекции, печеночной недостаточности и летальных исходов [10, 11].
В настоящем исследовании мы представили собственный опыт ЛХ, выполненной 46 больным с компенсированным ЦП, уделяя особое внимание показаниям к этой операции, технике вмешательства и осложнениям.
Причиной цирроза у большинства наблюдавшихся нами больных был гепатит В и С. У значительной части пациентов этой серии (32,6%) цирроз печени оказался неожиданной операционной находкой. Диагноз раннего ЦП до операции при ЛХ не устанавливают, по данным некоторых авторов, в 18,5—40% наблюдений [16, 17].
Ультразвуковое исследование как наиболее доступный неинвазивный метод высокоинформативен при далеко зашедших формах ЦП, в то время как его значение при диагностике раннего цирроза все еще дискутабельно. Возможно, с введением относительно нового неинвазивного метода оценки фиброза печени ультразвуковой эластографии (Fibro Scan) удастся восполнить пробел в этой области.
Длительность операции, частота осложнений и коэффициент конверсии при ЛХ у больных ЦП значительно больше, чем у пациентов, не имеющих этого заболевания [10, 11].
Продолжительность ЛХ в наших наблюдениях составила в среднем 75 мин, что мало отличается от аналогичных показателей, приводимых другими авторами [18]. В 4,34% наших наблюдений потребовался переход в открытую операцию. В последних отчетах частота конверсии в лапаротомию при ЛХ составила от 0 до 15,7% [14]. Абсолютными показаниями к изменению способа операции при ЛХ у больных ЦП являются неостанавливаемое эндоскопическим путем кровотечение и опасность манипуляций в воротах печени из-за варикозного расширения сосудов, анатомических сложностей.
Несмотря на значительное снижение частоты летальных исходов при ЛХ у больных ЦП, послеоперационные осложнения у этих больных остаются на довольно высоком уровне (7,8—35%) [8]. Наиболее часто после этих операций отмечаются печеночная недостаточность, кровотечение, развитие асцита, раневая инфекция.
В общей сложности осложнения отмечены нами у 23,9% больных. В большинстве наблюдений они были незначительными, лишь у одного больного осложнение оказалось серьезным, потребовался переход в открытую операцию.
После операции частота летальных исходов при ЛХ в группе больных ЦП колеблется, по данным литературы, от 0 до 4,3%, составляя в среднем 0,45% [14]. В большинстве опубликованных исследований сообщается об отсутствии летальных исходов при компенсированном ЦП [19]. Не было летальных исходов и в наших наблюдениях.
ЛХ, безусловно, является лучшим вариантом операции при ЦП прежде всего благодаря отличной фокальной видимости и увеличенному изображению, предоставляемому монитором, позволяющим ясно видеть расширенные сосуды, а также наличию соответствующих эндоскопических гемостатических инструментов (ультразвуковые ножницы, аргоноплазменный коагулятор).
Кроме того, при эндоскопическом способе значительно снижен риск заражения операционной команды вирусами гепатита В и С, которые могут быть у больных ЦП, вследствие травмы колющими и режущими инструментами. После Л.Х. почти отсутствуют спайки в брюшной полости, что, вероятно, может быть важным в перспективе при пересадке печени этим больным.
Вместе с тем существуют некоторые технические трудности ЛХ при Ц.П. Узловатость, твердость цирротической паренхимы могут помешать отведению желчного пузыря за дно в краниальном направлении, что является необходимым маневром при Л.Х. Кроме того, у больных ЦП часто наблюдается гипертрофия левой доли печени, которая прикрывает ворота печени. Для устранения этих неудобств мы, как и другие авторы [8, 12], пользуемся дополнительным 5-миллиметровым троакаром или введением ретрактора.
Особую опасность при ЛХ у больных ЦП представляет кровотечение из расширенных венозных коллатералей, расположенных в воротах печени. Использование ультразвуковых ножниц позволяет произвести рассечение относительно бескровно. При отсутствии уверенности в безопасности работы в области треугольника Кало некоторые авторы предлагают пользоваться вариантами субтотальной холецистэктомии [17].
Результаты нашего исследования и данные других авторов показывают, что ЛХ больше всего подходит для лечения симптоматического холецистолитиаза и острого холецистита у пациентов с ЦП легкой и умеренной степени (класса, А и В по Child—Pugh).
В то же время холецистэктомия у больных с декомпенсированным ЦП (класс С Child—Pugh) является сложной задачей из-за очень высокого риска кровотечения и печеночной недостаточности, часто приводящих к неблагоприятному исходу [19, 20].
По общепринятому мнению исследователей, плановой холецистэктомии в этой группе больных следует избегать, а экстренные операции выполнять по чрезвычайным показаниям при отсутствии эффекта от консервативной терапии при прогрессирующем холецистите [14].
В нескольких опубликованных исследованиях у таких больных показана эффективность чрескожно-чреспеченочной холецистостомии [21].
Были предприняты даже попытки эндоскопического стентирования пузырного протока в качестве альтернативы холецистэктомии у больных ЦП [22].
ЛХ у больных ЦП отличается некоторыми особенностями, которые следует учесть при выполнении этой операции. Во-первых, необходим строгий отбор пациентов с учетом оценки операционного риска по Child—Pugh или модели конечной стадии заболевания печени (MELD). Во-вторых, нужна хорошая хирургическая техника, чтобы умело обойти трудности и осложнения, к которым особенно склонны больные ЦП. В-третьих, следует пользоваться современным оборудованием, таким как ультразвуковой скальпель или аргоноплазменный коагулятор, позволяющими минимизировать кровотечение из рассеченных тканей. И, наконец, необходимо большое терпение при выполнении этой операции, чтобы благополучно завершить ее лапароскопическим путем, поскольку переход в открытую операцию не всегда может оказаться успешным при некоторых осложнениях, например при кровотечении, обусловленном коагулопатией.
Таким образом, лапароскопическая холецистэктомия может быть успешно произведена при тщательном отборе больных компенсированным циррозом печени. Целесообразно выполнение этой операции опытным лапароскопическим хирургом в специализированных центрах гепатобилиарной хирургии.
Оптимальный метод лечения желчекаменной болезни
На сегодня золотой стандарт — это лапароскопическая холецистэктомия. Выполняется через три или четыре небольших разреза (прокола) с помощью специальной видеокамеры и инструментов. Есть вариант выполнения через один несколько больший разрез в области пупка, вовсе без разреза (через желудок), и даже с помощью робота, но широкого распространения они не получили (преимущества не очевидны, а стоимость выше).
В подавляющем большинстве случаев срок пребывания в клинике — два дня: госпитализация в день операции, выписка на следующий день после контроля анализов, УЗИ. Безусловно, решение о выписке всегда совместно, если пациенту спокойнее подольше побыть под наблюдением, всегда поддержим.

В течение недели после операции обычно рекомендуем щадящий режим, несмотря на вполне хорошее самочувствие. Первые два–три дня могут беспокоить ноющие боли в плече, связано этой с остаточным газом в брюшной полости и бывает после любой лапароскопической операции.
Диета после холецистэктомии
Вопрос очень дискутабельный, на самом деле. На мой взгляд, слухи о необходимости строгой диеты сильно преувеличены.

Про осложнения холецистэктомии
Все осложнения можно разделить на два вида: возникающие непосредственно во время или в ближайшее время после операции; и отдаленные (пресловутый постхолецистэктомический синдром).
Серьезных осложнений во время операции, по большому счету, четыре – это кровотечение, травма желчных протоков, тромбоэмболия легочной артерии и резидуальный холедохолитиаз.
Несмотря на отработанную методику лапароскопической холецистэктомии, исключить их полностью пока не удается даже в клиниках, где накоплен большой опыт выполнения этих операций.
Кровотечение
С кровотечением понятно — оно может возникнуть во время любой операции. При плановой холецистэктомии риск минимальный.
Повреждение желчных протоков

Следующее осложнение — это тромбоэмболия легочной артерии
К счастью, довольно редко при лапароскопической холецистэктомии и правильной профилактике, хотя на 100 % предотвратить его до сих пор невозможно. Очень много факторов влияют, в том числе время операции, объем кровопотери, состояние свертывающей системы, наличие варикозной болезни, возраст. Все это учитывается, определяются риски и подбор оптимального варианта профилактики.

Отдаленные последствия удаления желчного пузыря или постхолецистэктомический синдром (ПХЭС)
Надо сказать, что мифов и страшилок по этому поводу довольно много. Попробую выразить свою точку зрения, основанную на собственном опыте и анализе мировой литературы.
Как следует из названия, под постхолецистэктомическим синдромом подразумевают любые проблемы со стороны желудочно-кишечного тракта после удаления желчного пузыря.
Если не принимать во внимание ранее описанные осложнения в ходе операции, к реальным отдаленным последствиям холецистэктомии можно отнести две проблемы: послеоперационную диарею и дисфункцию сфинктера Одди.
Послеоперационная диарея
Мнения по поводу причин ее появления разные, большинство экспертов отводит ведущую роль отсутствии резервуарной функции желчного пузыря. При недостаточном обратном всасывании постоянно поступающей желчи, она в большем, чем обычно количестве поступает в толстую кишку, что и провоцирует диарею. Надо сказать, что при желчекаменной болезни функция пузыря уже нарушена, и часть пациентов жалуются на диарею и до операции.

Есть мнение, подтвержденное экспериментальными исследованиями, что при сохраненном сфинктерном аппарате, общий желчный проток в течение нескольких месяцев частично компенсирует резервуарную функцию желчного пузыря.
Дисфункция сфинктера Одди или ДСО
Проявляется эпизодами довольно интенсивных болей в правом подреберье, напоминающие боли при желчной колике. Причина — в спазме сфинктера Одди (он регулирует поступление желчи из общего желчного протока в 12-перстную кишку).
ДСО бывает двух типов:
- Тип 1 — боли в правом подреберье с расширенными жёлчными протоками и повышенными трансаминазами (АЛТ и АСТ).
- Тип 2 — боли сопровождаются чем-то одним: или расширенные протоки или повышенные трансаминазы.
Тип 1 очень эффективно лечится папиллотомией (рассечением большого дуоденального соска)
Эффективность папиллотомии при 2-м типе ДСО намного меньше (около 40 %), но все таки достаточно, чтобы возможность проведения этой процедуры была очень тщательно рассмотрена.
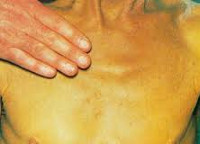
Холестатический гепатит – это заболевание, в развитии которого ключевое значение имеет затруднение тока желчи, а также накопление составляющих ее компонентов в печени. Клинически болезнь проявляется зудом, дискомфортом в зоне правого подреберья, интенсивной желтухой, диспепсией, увеличением печени и появлением ксантелазм на коже. В диагностике основное значение имеют общеклиническое и биохимическое исследования крови с определением печеночных проб, УЗИ печени и желчного пузыря, сонография поджелудочной железы, МРТ органов брюшной полости. Терапия направлена на улучшение оттока желчи и нормализацию функции органа.
МКБ-10
Общие сведения
Холестатический гепатит представляет собой достаточно редкую патологию, в основе патогенеза которой лежит внутрипеченочный холестаз с ухудшением экскреторной функции клеток и повреждением протоков. Частота выявления заболевания не превышает 10% среди всех гепатитов с хроническим течением. Холестатический гепатит преимущественно встречается у людей пожилого возраста.
Несмотря на свою относительно низкую распространенность, заболевание плохо поддается лечению в связи с тем, что не всегда возможно четко установить его причину. Изучением этиологии и патогенеза, а также разработкой новых методов терапии холестатического гепатита занимается клиническая гастроэнтерология.

Причины
Данная патология может быть обусловлена внутрипеченочным или внепеченочным застоем желчи. В первом случае нарушение оттока желчи возможно как на уровне клеток печени, так и на уровне внутрипеченочных протоков. Причинами внутрипеченочного холестаза с последующим развитием гепатита может выступать:
- переход острого вирусного гепатита В, С или других типов в хроническую форму;
- поражение печени вирусами Эбштейна-Барра, герпеса, цитомегаловирусом, микоплазменная инфекция;
- прием различных препаратов, таких как аминазин, некоторые диуретики, антибиотики, анаболические стероиды, контрацептивы;
- воздействие токсинов, алкоголя, ядов;
- эндокринные заболевания.
Внепеченочный холестаз является следствием обструкции крупных протоков. В этом случае его возможными причинами служат:
- закупорка камнем общего желчного протока;
- хронический калькулезный холецистит;
- хронический панкреатит;
- рак головки поджелудочной железы и опухоли других органов гепатобилиарной системы.
На фоне холестаза в печени происходит деструкция гепатоцитов с последующим нарушением функции органа. В некоторых случаях установить причину развития заболевания не удается, что трактуется как идиопатический холестатический гепатит.
Симптомы холестатического гепатита
Симптоматика холестатического гепатита похожа на проявления других хронических заболеваний печени. Отличительными особенностями являются более выраженная желтуха и кожный зуд, который часто выступает первым проявлением болезни. Зуд в данном случае обусловлен попаданием в кровь желчных кислот вследствие застоя желчи в печени. Также у больных холестатической формой гепатита часто возникают ксантомы, которые имеют вид желтых пятен.
Цвет кала, как правило, становится более светлым, а моча темнеет. Пальпаторно определяется увеличение размеров и повышение плотности печени без спленомегалии. В период обострения возможно повышение температуры и неяркие симптомы интоксикации. Тяжесть клинической картины зависит от выраженности холестаза.
Диагностика
В диагностике заболевания важную роль играют лабораторные и инструментальные методы исследования. Из лабораторных методик основным для постановки диагноза холестаза считают биохимический анализ крови.
- Печеночные пробы. При биохимическом исследовании отмечается увеличение уровня билирубина за счет прямой фракции, повышение уровня трансаминаз, щелочной фосфатазы (более чем в 5 раз), гамма-глутаминтрансферазы и холестерина. Также можно определить повышенное количество в крови фосфолипидов, В-липопротеидов и желчных кислот.
- Серологическая и ПЦР-диагностика. Для подтверждения вирусной этиологии заболевания проводится исследование специфических маркеров методами ИФА и ПЦР. Характерным серологическим маркером внутрипеченочного холестаза является определение антимитохондриальных антител.
Из инструментальных методов используется эхографическая, рентгеновская, магнитно-резонансная, инвазивная диагностика:
- УЗИ печени и желчного пузыря. При ультразвуковом исследовании выявляются признаки хронического гепатита. УЗИ желчных путей, желчного пузыря и поджелудочной железы позволяет подтвердить или исключить внепеченочный холестаз.
- Рентгенография. При наличии сложностей в диагностике холестаза проводится ретроградная холангиопанкреатография, чрескожная чреспеченочная холангиография или холецистография, которые позволяют обнаружить камни в желчных путях в тех случаях, когда они не видны на УЗИ.
- МРТ. Современными неинвазивными методами выявления причин холестатического гепатита являются МР-панкреатохолангиография и МРТ гепатобилиарной зоны.
- Биопсия с гистологией. Для изучения морфологических изменений может проводиться пункционная биопсия печени, хотя она и не играет решающей роли в диагностике холестаза.
Лечение холестатического гепатита
Лечение хронического гепатита с холестатическим синдромом должно быть основано на устранении причины, которая привела к холестазу. Если причиной заболевания является воздействие токсических факторов или медикаментозных препаратов, то необходимо прекратить их поступление в организм. Всем больным рекомендуется придерживаться диеты №5, которая предусматривает исключение острой, жирной и жареной пищи. Обязательно минимизировать употребление алкоголя, который негативно влияет на клетки печени. Также рекомендовано полноценное питание с достаточным содержанием белка.
Медикаментозная терапия
На любой стадии заболевания желателен прием жирорастворимых витаминов А, Е, а также В12. Для улучшения функции гепатоцитов могут назначаться гепатопротекторы, эссенциальные фосфолипиды и липоевая кислота. При наличии внутрипеченочного холестаза с высокой активностью воспалительного процесса показано назначение небольших доз преднизолона для уменьшения выраженности патологических изменений.
Если больного беспокоит сильный зуд, необходимо применение препаратов для нейтрализации желчных кислот, таких как холестирамин или лигнин. Самым эффективным средством для лечения внутрипеченочного холестаза считается урсодезоксихолевая кислота, которая улучшает отток желчи. Препарат рекомендован всем больным с холестатическим гепатитом.
Хирургическое лечение
Если гепатит вызван внепеченочным холестазом, необходимо устранить его причину. Для этого используются различные оперативные методы:
- лапароскопическая или открытая холецистэктомия;
- резекция головки поджелудочной железы;
- экстракция конкрементов желчных протоков при РПХГ;
- эндоскопическая баллонная дилатация сфинктера Одди и др.
Прогноз и профилактика
При правильном лечении и устранении причины холестаза прогноз при холестатическом гепатите в целом благоприятный. Профилактика заболевания сводится к прекращению поступления в организм алкоголя и других гепатотоксических веществ, а также своевременному лечению патологии печени.
В статье представлены данные о нарушении билиарного статуса у пациентов с хроническими гепатитами В и С. При хронических гепатитах В и С имеют место выраженные изменения функционального состояния билиарного тракта, как в работе сфинктерного аппарата, так
The article presents data on disorders in biliary status in patients with chronic hepatitis B and C. In chronic hepatitis B and C, there are pronounced changes in the functional state of the biliary tract, both in the sphincter apparatus and in the gallbladder, as well as duodenal hypertension and increased hepatic choleresis. The revealed changes in the microscopic composition of bile also indirectly indicate the presence of inflammatory process in the biliary tract in patients with chronic hepatitis B and C.
В глобальном масштабе вирусный гепатит перешел на седьмое место причин смертей в 2013 г., по сравнению с 10-й ведущей причиной в 1990 г. [1]. Во всем мире вирусный гепатит А, по оценкам, поражает 1,4 млн человек в год [2]. Около 2 млрд человек в мире имеют доказательства прошлой или текущей инфекции гепатита В (HBV), из них 240 млн хронических носителей HBsAg [3]. Гепатит В, наряду с ассоциированной инфекцией вирусом гепатита D, является одним из наиболее распространенных патогенов, поражающих людей [4]. HBV ежегодно приводит к 650 000 смертей в результате гепатита, вызванного этим вирусным поражением печени [3].
Невозможно оценить ежегодную распространенность острой инфекции гепатита С (HCV) в мире, поскольку она протекает чаще бессимптомно. По оценкам экспертов, около 71 млн человек хронически инфицированы HCV во всем мире [2]. 55–85% этих людей имеют хроническую прогрессирующую HCV-инфекцию с 15–30-процентнным риском развития цирроза печени в течение двух десятилетий [5]. Китай, США и Россия имеют самую большую популяцию потребителей инъекционных наркотиков, которые инфицированы HCV.
HCV-инфекция характеризуется высокой частотой и разнообразием внепеченочных поражений. По результатам исследования 230 больных с хроническим гепатитом С (ХГС) в клинике им. Е. М. Тареева 47% пациентов имели внепеченочные поражения, что превышало частоту таковых при HBV-инфекции — 22–35% [6]. Как известно, печень и желчевыводящие пути анатомически функционально тесно взаимосвязаны. Поэтому патология печени может сопровождаться заболеваниями желчевыводящих путей. Поражения билиарного тракта, в том числе и функциональные расстройства, в какой-то степени обусловливают клинические проявления хронических гепатитов В и С.
В зарубежных исследованиях существуют единичные работы, в которых определена взаимосвязь ХГС и поражений желчевыводящих путей. Гепатит С стал прототипическим вирусным гепатитом с холангитовыми поражениями, которые представляют собой преимущественно интраэпителиальные лимфоцитарные инфильтрации [7] и лимфоидные агрегаты или образования фолликулов, обычно без повреждения канала. Эти ассоциированные с вирусом холангитовые поражения являются обратимыми и не приводят к прогрессированию процесса или кровотечению. Прогноз и ответ на терапию не связаны с наличием желчных поражений [8].
Среди гепатотропных вирусов вирус гепатита С чаще ассоциируется с холангитом. Развившийся холангит при вирусных гепатитах В и С является обратимым и не оказывает вредного влияния на течение заболевания или на эффективность терапии. При гепатите С в основе холангита лежит интраэпителиальная лимфоцитарная инфильтрация, как правило, без повреждения протоков. Несмотря на то, что вирус-индуцированный холангит является обратимым, все же происходят структурные повреждения, в том числе формирование дивертикулов, ассоциированных с воспалением. У этих пациентов обычно не регистрируется повышение уровня щелочной фосфатазы. Развитие холангита не ухудшает ответ на противовирусную терапию. Некоторые исследователи обнаружили частицы вируса гепатита в холангиоцитах [9, 10].
При HBV-инфекции описываемые гистологические изменения в желчных протоках существенно не отличаются от таковых при вирусном гепатите С, но встречаются в меньшем проценте случаев. Примерно в 25% случаев при HBV-инфекции биопсия показала наличие лимфоидных скоплений и в менее 10% случаев выявила повреждение желчных протоков. Поверхностный и ядерный антигены вируса гепатита В также были обнаружены в холангиоцитах [8].
K. S. Kumar с соавт. (2001) подтвердили влияние хронического холангита на течение гепатита С. В исследовании участвовали 620 пациентов с ХГС с повышенным уровнем щелочной фосфатазы сыворотки крови. У больных были исключены первичный билиарный цирроз печени и первичный склерозирующий холангит. Но у части пациентов морфологически было выявлено поражение внутрипеченочных желчных протоков. Авторы считают, что наличие холангита у данной группы пациентов связано с HCV-инфекцией [11].
В ряде других исследований также можно предположить роль НСV-инфекции в развитии поражения желчевыводящей системы (ЖВС). S. S. Sharma и соавт. выявили наличие функциональных расстройств сфинктера Одди у наркоманов с продолжительным стажем внутривенного введения наркотических веществ. Моторно-кинетические нарушения сфинктера Одди были подтверждены манометрией. Маркеры вирусных гепатитов у этих пациентов исследованы не были. Однако известно, что наркоманы составляют основную группу риска инфицирования HCV- и/или HBV-инфекцией. И именно этим вирусам, по-видимому, принадлежит роль в развитии дисфункциональных нарушений сфинктера Одди у данной категории пациентов [12].
Существуют работы, посвященные изучению возможной репликации вируса в желчном эпителии. M. A. Loriot с соавт. удалось in vitro инфицировать вирусом гепатита С клетки желчного эпителия у пациентов без НСV-инфекции. Это исследование, бесспорно, расширяет представление о клеточном тропизме вируса гепатита С и доказывает чувствительность желчного эпителия к данному вирусу [13].
К выводу о том, что билиарная система тесно связана с HCV-инфекцией и что желчь также инфицирована, как и сыворотка крови, пришли японские ученые. У 12 больных хроническим гепатитом С (у 8 была выявлена HCV PHK методом полимеразной цепной реакции) во время операции была аспирирована желчь тонкой пункционной иглой из желчного пузыря. У 5 больных с высоким содержанием РНК в сыворотке крови была обнаружена HCV PHK и в желчи. При сравнении уровней содержания вируса в сыворотке и желчи выявлено, что уровни РНК были одинаковыми. С помощью иммунопатологических исследований обнаружен вирус гепатита С в эпителиальных клетках у этих больных. В то же время у больных с отрицательной реакцией на HCV PHK вирус не был обнаружен ни в желчи, ни в желчных протоках [14].
Некоторые отечественные авторы также придерживаются точки зрения, что основной причиной расстройств ритмической деятельности билиарной системы являются воспалительные процессы в печени, приводящие к нарушению синтеза желчи, заметному уменьшению давления в протоковой системе и желчном пузыре, а в связи с этим и к постоянному спастическому сокращению сфинктера Одди [15–17].
По данным Н. Б. Волошиной (2004) у 89,6% пациентов с хроническим гепатитом В (ХВГ) диагностируются функциональные нарушения билиарного тракта. Среди них у 46,3% выявлено сочетание дисфункции сфинктера Одди по билиарному типу и гиперкинезии желчного пузыря, у 18,7% — изолированный гипертонус сфинктера Одди, 12,6% — имели гиперкинез желчного пузыря, 2,7% — гипокинез желчного пузыря и 1,6% — гипотонус сфинктера Одди. Было установлено, что функциональные нарушения билиарного тракта не зависят от типа вируса и ассоциированы с уровнем биохимической активности процесса [18].
Согласно исследованию В. А. Неронова (2010), у больных с хроническим HBV-поражением печени выявлен синдром хронической билиарной недостаточности, клинически проявляющийся жалобами на дискомфортные и (или) болевые ощущения в правом подреберье, непереносимость жирной пищи, метеоризм и обстипацию. Со стороны моторики билиарного тракта нарушен процесс работы сфинктерного аппарата желчевыводящих путей (гипертонус сфинктера Одди в 65,2% случаев — в стадии репликации, в 46,9% — в фазу интеграции вируса; гипертонус сфинктера Люткенса у 58,1% в фазу репликации и 47,2% в фазу интеграции вируса), также изменены физико-коллоидные свойства желчи с повышением плотности пузырной и печеночной порций, нарушен биохимический состав желчи, в виде снижения суммарного дебита холевой кислоты и фосфолипидов, а также холатохолестеринового и фосфолипидно-холестеринового коэффициентов. Что касается больных с хроническим HCV-поражением печени, билиарная недостаточность также имеет клинические проявления в виде непереносимости жирной пищи, метеоризма и обстипации. Со стороны моторики билиарного тракта выявлены следующие изменения: гипертонус сфинктера Одди в 79,6% у пациентов с высоким уровнем репликации и в 73,7% у пациентов с минимальной активностью. Гипертонус сфинктера Люткенса у 67,6% и у 69,3% соответственно. При изучении физико-коллоидных и биохимических свойств порций желчи установлены изменения в виде снижения дебита холевой кислоты и холатохолестеринового коэффициента. Выявлено, что хроническая билиарная недостаточность у больных с вирусными поражениями печени не специфична по отношению к возбудителю, а степень ее тяжести носит прямо пропорциональный характер степени активности вирусного процесса [19].
В работе В. Л. Останко (2010) проведено исследование состояния желчевыводящей системы (ЖВС) у пациентов с ХГС. Выявлено, что у 99% пациентов с ХГС наблюдаются изменения функционального состояния ЖВС в виде дисфункции желчного пузыря (гипотонически-гипокинетический тип у 82% и у 18% — гипертонически-гиперкинетический тип) и сфинктерного аппарата (гипертонус сфинктера Одди выявлен у 55,5% пациентов с гипертоническим типом дисфункции и у 1/3 пациентов при гипотонической дисфункции; также выявлены единичные больные с дисфункцией сфинктера Одди по гипокинетическому типу — 4%), сочетающиеся с нарушением коллоидного состава желчи в виде повышения степени литогенности (у 100% пациентов с ХГС). Причем обнаружена прямая корреляционная связь между стадией фиброза и риском развития желчекаменной болезни [20].
В своей работе К. В. Жданов и соавт. обследовали лиц молодого возраста с ХГС. У всех пациентов с помощью ультразвукового исследования, дуоденального зондирования, томографии было подтверждено наличие хронического холецистита. У 80% больных в желчи обнаружена патогенная микрофлора. В результате выполнения данной работы авторы сделали вывод, что успешная противовирусная терапия хронического гепатита С возможна только после проведения санации билиарного тракта [21].
Материалы и методы исследования
В нашей работе получены данные обследования 119 человек с хроническими гепатитами В и С в возрасте от 18 до 61 года (средний возраст составил 36,94 ± 11,2 года). Среди них — 45 женщин (37,8%) и 74 мужчины (62,2%). Согласно задачам исследования все пациенты разделены по этиологии заболевания на две группы: 1-я группа — 63 пациента с ХГС, 2-я группа — 56 пациентов с ХГВ. Контрольную группу составили 30 практически здоровых добровольцев аналогичного пола и возраста.
Всем больным проведено клиническое обследование, включающее сбор жалоб, анамнеза, объективный осмотр пациента. Клиническое обследование включало: общий анализ крови, общий анализ мочи, биохимический анализ крови, исследование уровней тканевых магния и цинка (в ногтях) методом масс-спектрометрии, иммунологическую диагностику маркеров вирусных гепатитов методами иммуноферментного анализа, полимеразной цепной реакции, эзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости, электрокардиографию. Моторная функция ЖВС исследовалась путем проведения фракционного хроматического минутированного дуоденального зондирования с исследованием полученной желчи по методике В. А. Максимова [22].
Исследование проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (в редакции 2000 г. с разъяснениями, данными на генеральной ассамблее ВМА, Токио, 2004), с правилами Качественной клинической практики Международной конференции по гармонизации (ICH GCP), этическими принципами, изложенными в Директиве Европейского Союза 2001/20/ЕС и требованиями национального российского законодательства. Протокол исследования был одобрен Комитетом по этике ФГБОУ ВО КемГМУ МЗ РФ; процедуры рассмотрения и одобрения исследования соответствовали требованиям национального законодательства. Каждый больной подписал информированное согласие на участие в исследованиях.
При характеристике качественных показателей строились таблицы сопряженности и вычислялись частоты, для количественных показателей рассчитывались средние величины и стандартное отклонение (M ± SD). При оценке различий качественных показателей использовался хи-квадрат Пирсона, критерий Z Стьюдента. При оценке связи между двумя количественными показателями использовался ранговый корреляционный анализ Спирмена. Для изучения влияния нескольких факторов на зависимую переменную (степень фиброза печени, индекс гистологической активности) применялся линейный регрессионный анализ. Достоверность различий абсолютных и относительных показателей оценивалась с использованием критериев Манна–Уитни, Крускалла–Уоллеса. Различия между параметрами сравнения считались статистически значимыми при р ≤ 0,05.
Моторно-эвакуаторная функция билиарного тракта у пациентов с хроническими гепатитами В и С оценивалась путем анализа данных, полученных при проведении фракционного хроматического минутированного дуоденального зондирования. Результаты хроматического минутированного дуоденального зондирования пациентов с хроническими гепатитами В и С представлены в табл. 1.
Учитывая выявленные нарушения моторно-эвакуаторной функции билиарного тракта, были выделены следующие группы больных (табл. 2).
Клинические проявления функциональных нарушений ЖВС у пациентов с ХВГ соответствовали хорошо известным признакам. Так, гипомоторная дисфункция ЖП сопровождалась болью тупого характера, чувством давления, распирания в правом подреберье, эпигастральной области, усиливающихся при смене положения тела, возникающих после погрешности в питании (жирная, жареная пища). При гипермоторной дисфункции ЖП больные жаловались на коликообразные боли в правом подреберье с иррадиацией в спину, под правую лопатку, правое плечо, эпигастральную область. Боли провоцировались приемом жирной, жареной пищи, физической нагрузкой, а также стрессовой ситуацией. Часть больных отмечала чувство горечи, особенно в утренние часы, тошноту, метеоризм.
Всем пациентам с ХВГ проведено исследование микроскопического состава желчи, результаты отражены в табл. 3.
Анализируя данные, представленные в табл. 3, видно, что у пациентов с ХВГ регистрировались изменения микроскопического состава желчи во всех порциях, что косвенно указывало на наличие воспалительного процесса в ЖВС. Так, в группе ХГС выявлены следующие изменения микроскопического состава желчи: слизь в порции А обнаружена у 57 человек (90,5%), в порции В — у 46 (73%) и в порции С — у 55 человек (87,3%). Эпителий цилиндрический в большом количестве в порции А встречался у чуть более половины группы (55,5%), в порции В — у 1/3 группы (20 человек), в порции С — у 28 человек (44,4%). Присутствие лейкоцитоидов более 10 в поле зрения в порции А выявлено у 10 человек (15,8%), в пузырной порции — у 6 человек (9,5%) и в печеночной порции — у 12 человек (19%). Обнаружение цилиндрического эпителия и слизи в значительном количестве, а также избыточного количества лейкоцитоидов свидетельствовало о наличии воспалительного процесса ЖВС. У небольшой части пациентов выявлены желчные соли в большом количестве: в порции А — у 3 человек (4,8%), в порциях В и С — у 6 человек в каждой (9,5%), что указывало на высокую литогенность желчи. Паразиты и простейшие не выявлены ни в одном случае.
В группе ХГВ регистрировались следующие изменения в микроскопическом составе желчи: в порции А слизь обнаружена у 38 человек (67,8%), в порции В — у 29 (51,8%), в порции С — у 39 (69,6%). Эпителий в значительном количестве выявлен в порции А — у 24 человек (42,8%), в порции В — у 12 (21,4%) и в порции С — у 5 человек (8,9%). Лейкоцитоиды более 10 в поле зрения присутствовали в порции А у 7 человек (12,5%), в порции В — у 6 человек (10,7%) и в порции С — у 5 человек (8,9%). Желчные соли в избыточном количестве выявлены в порции А у 8 человек (14,3%), в пузырной порции — у 4 (7,1%), в порции С желчные соли встречались единичные у пятой части группы (21,4%). Паразитов и простейших также, как и в группе ХГС, выявлено не было.
Выводы
Итак, анализируя данные, полученные в результате хроматического минутированного дуоденального зондирования, можно сделать вывод, что при хронических гепатитах В и С имеют место выраженные изменения функционального состояния билиарного тракта как в работе сфинктерного аппарата, так и в работе ЖП, а также дуоденальная гипертензия и повышение печеночного холереза. Выявленные изменения микроскопического состава желчи также косвенно указывают на наличие воспалительного процесса в ЖВС у пациентов с хроническими гепатитами В и С. Данные изменения билиарного статуса часто требуют уточнения и коррекции, но игнорируются лечащими врачами, снижая качество жизни пациентов.
Литература
Е. Ю. Плотникова* , 1 , доктор медицинских наук, профессор
М. С. Карягина**
М. А. Шамрай**
Е. Н. Баранова*, кандидат медицинских наук
* ФГБОУ ВО КемГМУ МЗ РФ, Кемерово
** ГАУЗ КО ОКБСМП им. Подгорбунского, Кемерово
После удаления желчного пузыря организм восстанавливается постепенно. Чтобы избежать развития осложнений, необходимо принимать лекарственные препараты. Обязательно назначают диету для предотвращения развития застоя желчи, возникновения воспалительных процессов.

Лекарственные препараты после холецистэктомии
Желчный пузырь синтезирует желчь, которая, попадая в двенадцатиперстную кишку, способствует выработке желудочного сока. После холецистэктомии это процесс нарушается, что приводит к сбоям в работе пищеварительной системы. Для устранения нехватки желчи, боли в животе, приступов тошноты назначают лекарственные препараты. Основные группы лекарств:
- ферменты;
- спазмолитики;
- желчегонные препараты.

Некоторые средства необходимо принимать курсами по 2-6 месяцев. Другие препараты - на протяжении всей жизни. Обязательно следует соблюдать дозировку и другие рекомендации по приему лекарств.
Сразу после оперативного вмешательства назначают курс антибиотиков продолжительностью 7-10 дней. Это помогает избежать развития гнойных и воспалительных процессов. Эффективные препараты - Фуразолидон, Цефазолин, Бисептол.
Лекарственные средства с ферментами
Эти препараты помогают нормализовать работу пищеварительной системы при недостаточном количестве желчи. Эти лекарства помогают разлагать белки, жиры и углеводы, способствуют лучшему усвоению питательных веществ. Дополнительно средства оказывают легкое обезболивающее действие. Список ферментов:
- Мезим. Содержит панкреатин, амилазу, липазу, протеазы. Способствует восполнению дефицита ферментов поджелудочной железы, улучшает пищеварения, препятствует возникновению метеоризма и расстройства кишечника. Дозировка - 1-2 таблетки или капсулы во время еды. Не разжевывать, запивать 200 мл воды.



Ферменты редко вызывают побочные реакции. Чаще всего беспокоит слезотечение и сыпь, расстройства со стороны пищеварительной системы. Лекарства нельзя принимать при гиперчувствительности, остром или хроническом панкреатите в стадии обострения, непроходимости кишечника, тяжелых патологиях печени.
Спазмолитические лекарственные средства
Способствуют расслаблению гладкой мускулатуры, устраняют спазмы в желчных протоках. Чаще всего назначают в таблетках, при сильном болевом синдроме - в виде внутримышечных инъекций. Лекарства начинают действовать в течение 20 минут. Название препаратов:
-
Но-шпа. Основное действующее вещество - дротаверин. Суточная дозировка - 3-6 таблеток, разделить на 2-3 приема. Прием пищи не влияет на эффективность лекарства. Возможные побочные реакции - снижение давление, нарушение сна, головная боль, диспепсические расстройства.



Спазмолитики нельзя принимать при повышенной чувствительности к составляющим лекарства. Основные противопоказания - тяжелые формы почечной и печеночной недостаточности, синдром низкого сердечного выброса. Пить лекарства можно регулярно, или только при возникновении болей.
Желчегонные лекарственные средства
Назначают после холецистэктомии для защиты печени от застоя желчи, предотвращения развития воспалительных процессов. Дополнительно препараты препятствуют диарее и вздутию живота, способствуют усвоению полезных микроэлементов из пищи. Лекарства имеют небольшое количество противопоказаний и побочных эффектов.

Аллохол
Средство на основе сухой желчи крупного рогатого скота, экстракта крапивы и чеснока. В качестве сорбента содержит активированный уголь. Это вещество предотвращает развитие процессов гниения и брожения в кишечнике. Аллохол обладает комплексным действием:
- нормализует работу печени и кишечника;
- улучшает секрецию и отток желчи;
- устраняет метеоризм, предотвращает вздутие живота;
- уменьшает боль в области правого подреберья.

Принимать по 2 таблетки трижды в день после еды. Минимальный курс - 3-4 недели. Продолжить прием можно после трехмесячного перерыва.
Противопоказания - острый гепатит, непроходимость желчных протоков, подострая и острая дистрофия печени. Нельзя принимать лекарство при остром панкреатите, язвенных поражениях органов ЖКТ. Возможные побочные эффекты - разнообразные аллергические реакции, диарея.
Холензим и Холосас
Холензим содержит порошок из слизистой тонких кишок и поджелудочной железы животных, сухую желчь. Лекарство обладает желчегонным действием, улучшает процесс пищеварения, увеличивает уровень желчных кислот, снижает холестерин. Во время лечения не исключено появление аллергических реакций в виде слезотечения, чихания, сыпи и покраснения кожи.

Дозировка - по 1 таблетке 2-3 раза в день. Принимать после еды не разжевывая, запивать достаточным количеством жидкости. Продолжительность терапии - 1-2 месяца.
Препарат нельзя принимать при непереносимости составляющих. Основные противопоказания - острая стадия панкреатита или период обострения хронической формы заболевания, обтурационная желтуха, язвенная болезнь, острый гепатит. Лекарство можно принимать беременным женщинам.
Сироп Холосас содержит экстракт плодов шиповника. Эффективное желчегонное, противовоспалительное и гепатопротекторное средство, насыщает организм витаминами A, C ,E, P, группы B. Лекарство активизирует неспецифический иммунитет, принимает участие в метаболизме углеводов.
Дозировка - по 1 ч. л. 2-3 раза в день за полчаса до приема пищи. Холосас нельзя принимать при аллергии, с осторожностью - при сахарном диабете. Во время лечения могут возникнуть различные аллергические реакции.

Средства для улучшения работы печени
Гепатопротекторы препятствуют образования камней в желчных протоках. Лекарства эффективно помогают в послеоперационный период, улучшают общее состояние организма. Дополнительно обладают спазмолитическим, желчегонным действием, защищают печень.
Гепатопротекторы на основе урсодезоксихолевой кислоты растворяют желчные камни, снижают уровень холестерина. Лекарства предотвращают застой желчи, усиливают выведение секрета. Дополнительно стимулируют секрецию и обновление Т-лимфоцитов.

Карсил
Лекарство содержит сухой экстракт плодов пятнистой расторопши. Препарат оказывает комплексное действие - благотворно влияет на работу печени, мочевыделительной и пищеварительной системы, выводит токсины, нормализует состав желчи. Во время лечения улучшается аппетит и общее самочувствие, исчезают диспепсические расстройства.
Принимать по 1-2 таблетки трижды в день, запивать 100-150 мл воды. Прием пищи не влияет на процесс всасывания активных веществ. Средняя продолжительность курса - 3 месяца.
Карсил снижает эффективность оральных средств контрацепции, усиливает действие антикоагулянтов и антигистаминных препаратов.
У Карсила практически нет противопоказаний, лекарство нельзя принимать при аллергии и острой интоксикации любого происхождения.

Побочные реакции - тошнота, зуд и сыпь, нарушения в работе вестибулярной системы. Возникают преимущественно у людей с повышенной чувствительностью.
Эссенциале Форте Н и Энерлив
Капсулы содержат полиненасыщенные жирные кислоты, которые ускоряют процесс восстановления гепатоцитов. Фосфолипиды бобов сои регулируют жировой обмен, снижают вязкость желчи, за счет чего ускоряется отток секрета в кишечник. Лекарство назначают для предотвращения развития патологий печени после удаления желчного пузыря. Оба препарата имеют схожее терапевтическое действие и правила приема.
Дозировка - по 2 капсулы трижды в день. Принимать во время еды, запивать большим количеством воды. Продолжительность курса лечения неограниченна, но пить лекарство нужно не менее 2 недель.
Основное противопоказание - повышенная восприимчивость к компонентам лекарственного средства, наличие антифосфолипидного синдрома в анамнезе.

Препараты хорошо переносятся. Редко во время лечения беспокоит дискомфорт в животе и диарея, аллергические реакции, кровотечения в средине цикла у женщин. Доступные аналоги - Фосфонциале.
Урсосан, Урдокса, Урсофальк
Препараты на основе урсодезоксихолевой кислоты. Защищают клетки печени, стимулируют отток желчи, оказывают иммуномодулирующее действие. Дополнительно лекарства растворяют холестериновые желчные камни, предотвращают образование новых конкрементов. Правила приема:
- оптимальная дозировка - 10 мг/кг;
- принимать лекарство раз в сутки перед сном;
- продолжительность терапии - не менее 6 месяцев.

Противопоказания - гиперчувствительность, хронический гепатит и панкреатит, цирроз печени. Урсосан и аналоги нельзя принимать при заболеваниях желчных протоков, воспалительных процессах в тонком и толстом кишечнике, почечной и печеночной недостаточности. Возможные побочные эффекты - рвота, тошнота, расстройство стула, аллергические реакции. Иногда во время лечения наблюдается обострение псориаза, развивается обратимая алопеция. Некоторые антациды уменьшают степень всасывания активных веществ лекарственного средства.
Рекомендации по питанию после холецистэктомии
После удаления желчного пузыря последствия и жизнь во многом зависит от питания. Мужчинам и женщинам после холецистэктомии необходимо придерживаться специальной диеты на протяжении всей жизни. Можно ли тыкву после удаления желчного пузыря, и другие овощи и фрукты, основные правила приема пищи расскажет врач. Цель правильного питания - предотвратить застой желчи в протоках. Основные правила диеты при удаленном желчном пузыре:
- Кушать 5-6 раз в день через равные промежутки времени.
- Порции должны быть небольшими, чтобы не спровоцировать запоры и тяжесть в желудке. Оптимальный размер - с горсть.
- Любые фрукты перед употреблением очищать от кожуры, особенно в первый месяц после холецистэктомии.
- Необходимо полностью исключить из рациона животные жиры - для их расщепления требуется желчь.

Основа рациона - отварные, тушеные и паровые блюда, полусырых продуктов быть не должно. Если желчный пузырь удален, следует придерживаться в питании стола номер 5. Это позволит избежать развития осложнений, при этом организм не будет страдать от недостатка питательных веществ. Через 1-1,5 года допускается переход на стол №15.
Правила питания в первую неделю
В первую неделю после операции питание направлено на адаптацию организма к новым условиям. Основа рациона - жидкая еда, она легче всего усваивается, не нагружает пищеварительную систему. В первые сутки после холецистэктомии нельзя пить и есть.
Диета на первую неделю:
- Вторые сутки. Можно пить небольшими порциями теплый несладкий отвар из плодов шиповника, щелочную воду без газа. Суточный объем жидкости - до 1 л. В рацион вводят нежирный кефир, кисель, компот и чай без сахара.
- 3-5 день. Разрешается есть картофельное пюре, паштет из отварной рыбы, протертые овощные супы. Пищу принимать с интервалом 3-4 часа. Объем порции - 150 г.
- 6-7 день. В меню добавляют сухой хлеб, каши из измельченных круп на воде или молоке, паровые котлеты или тефтели, нежирные кисломолочные продукты, пюре из овощей.
Для улучшения работы печени обязательно нужно пить лечебную минеральную воду - Нарзан, Ессентуки, Боржоми. Перед употреблением обязательно выпустить газ, немного подогреть. Употреблять по 30-50 мл за полчаса до еды 3-4 раза в день. Продолжительность курса - 4 недели, затем нужно сделать перерыв на 2-3 месяца.
Разрешенные и запрещенные продукты
Твердую пищу можно употреблять через 2 недели после холецистэктомии. Новые продукты нужно вводить в рацион постепенно, не более 1-2 в день, чтобы отследить реакцию организма. О непереносимости какой-либо пищи свидетельствует тошнота, диарея, боль и вздутие в животе.
- жареные и острые блюда, специи, копчености, жирные бульоны;
- маринады, соленья, любые консервы, кетчуп, горчица, майонез;
- спиртные, сладкие газированные напитки;
- чеснок и лук, редис, редька, репа;
- томаты, грибы, бобовые овощи, свежая и квашеная белокочанная капуста;
- шпинат, щавель;
- жирные сорта мяса и рыбы, колбасные изделия, полуфабрикаты;
- сдоба, выпечка с кремом;
- шоколад и другие продукты с какао;
- хурма, цитрусовые плоды, гранат, другие фрукты с вяжущим или кислым вкусом.
- постное мясо;
- овощи;
- сезонные сладкие фрукты, бананы, натуральные соки;
- растительные масла;
- любые каши;
- яйца всмятку, не чаще 2 раза в неделю - паровой омлет;
- рыба - не менее 2 раз в неделю;
- молочные и кисломолочные продукты;
- сливочное масло - не более 30 г в день;
- подсушенный отрубной хлеб;
- некоторые приправы - лавровый лист, корица, куркума;
- сухофрукты - предварительно замочить в кипятке.

Если сложно совсем отказаться от сладостей, в небольшом количестве можно употреблять зефир, мармелад, мед, галетное печенье. Но только в первой половине дня. В сутки выпивать не менее 2 л воды, не считая другой жидкости.
Наиболее полезные овощи после удаления желчного пузыря тыква, морковь, кабачки, картофель, свекла. В рационе обязательно должны присутствовать натуральные кисломолочные продукты. Но выбирать следует продукцию средней жирности - при употреблении полностью обезжиренного кефира, йогурта, простокваши не усваивается кальций.

Примерное меню на день
Первое время после удаления желчного пузыря бывает непросто переключиться на правильное питание. Чтобы упростить задачу, нужно сразу составлять меню на неделю. Так можно следить за разнообразием рациона, рассчитать его калорийность.
Варианты полезных блюд:
- некрепкий чай;
- подогретый компот.
- салат из овощей или винегрет;
- каша на воде с небольшим количеством молока, без сахара;
- пюре или отварной картофель;
- отварное мясо, рыба;
- белковый паровой омлет.
- любые овощные салаты;
- легкий суп-пюре из тыквы, других овощей, или суп с рыбой, фрикадельками;
- постный борщ;
- тушеное или отварное мясо с гарниром из овощей.
- запеканка или пудинг из творога;
- духовые сырники или вареники с творогом;
- запеченное яблоко и кусочек свежего неострого сыра;
- паровой белковый омлет с зеленью или овощами.
В течение дня можно пить молоко, чай, сок, очищенную или лечебную воду. Перед сном можно выпить стакан кефира или простокваши. Кисломолочные продукты на ночь очень полезны при склонности к запорам.

Что нужно запомнить?
Холецистэктомия - не приговор, жить без желчного пузыря можно. На качество и продолжительность жизни после операции влияет питание, психологический настрой. Для поддержки нормальной работы органов пищеварительной системы необходимо принимать лекарства - ферменты, гепатопротекторы, желчегонные средства.
Диета после удаления желчного пузыря необходима. При неправильном и нерегулярном питании желчь застаивается. В результате этого развиваются воспалительные процессы, образуются камни, нарушается работа кишечника, печени, поджелудочной железы.
Читайте также:

