Может ли герпес вызывать снижение иммунитета
Обновлено: 24.04.2024
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции. Вирусами герпеса инфицировано 65-90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+. Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости. В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.

1. Воробьев А.А. Иммунология и аллергология. / А.А. Воробьев, А.С. Быков, А.В. Караулов. – 2006. – 287 с.
2. Герпесвирусные инфекции человека: руководство для врачей / В.А Исаков, Е.И. Архипова, Д.В. Исаков / под ред. В.А. Исакова – СПб.: СпецЛит, 2006. – 303 с.
4. Камбачокова З.А. Состояние клеточного и гуморального иммунитета у больных рецедивирующим генитальным герпесом // Медицинский вестник Башкорстана 2012. – № 1 (7). – С. 46–49.
5. Нагоев Б.С., Камбачокова З. А. Состояние клеточного иммунитета у больных герпесвирусными инфекциями // Вестник новых медицинских технологий. – 2011. – № 3 (18). – С. 325–327.
6. Синдром хронической усталости: диагностика и лечение / под ред. Ю.В. Лобзина. – СПб.: СпецЛит, 2005. – 79 с.
7. Соколова Т.Ф., Минакова Е.Ю., Долгих Т.И. Изучение иммунофенотипа лимфоцитов у пациентов с микст-инфекцией, вызванной вирусами семейства HERPESVIRIDAE // Медицинская иммунология. – 2010. – № 4–5 (12). – С. 433–436.
8. Черевко Н.А., Попова И.С., Климов В.В. и др. Особенности изменения популяционного иммунитета населения на фоне гепрес-инфицирования // Российский аллергологический журнал. – 2010. – № 1 (1). – С. 207–208.
9. Fatahzadeh M., Schwartz R.A. Human herpes simplex virus infections: epidemiology, pathogenesis, symptomatology, diagnosis, and management // J. Am. Acad. Dermatol. – 2007. – № 57 (5). – Р. 737–63; quiz 764–6.
10. Loutfy S.A., Alam El-Din H.M., Ibrahim M.F., Hafez M.M. Seroprevalence of herpes simplex virus types 1 and 2, Epstein-Barr virus, and cytomegalovirus in children with acute lymphoblastic leukemia in Egypt Kundi // Saudi Med J. – 2006. – № 27 (8). – Р. 1139–45.
11. Koelle D.M., Corey L. Herpes Simplex: Insights on Pathogenesis and Possible Vaccines // Annu Rev Med. – 2008. – № 59. – Р. 381–395.
12. Manchini, G. Immunochemical quantitation of antigens by single radical immunodiffusion / G. Manchini, A.O. Carbonara, J.F. Heremas // Immunochemistry. – 1965. – Vol. 2. – P. 235–254.
13. Wozniak M.A., Mee A.P., Itzhaki R.F. (January). Herpes simplex virus type 1 DNA is located within Alzheimer’s disease amyloid plaques // J Pathol. – 2009. – № 217 (1). – Р. 131–8.
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции [1, 2, 9]. Вирусами герпеса инфицировано 65–90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма [1, 9, 10]. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть, чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения [3, 4, 11, 12]. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+ [5,10].
Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм [1, 9]. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости [6, 13].
В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.
Целью настоящей работы явилось изучение особенностей иммунного ответа при хронической герпетической инфекции и оценка эффективности сочетанной противовирусной и иммуномодулирующей терапии (Панавир и Глутоксим).
Материалы и методы исследования
Основную группу составили 30 пациентов обоего пола с хронической рецидивирующей инфекцией, вызванной вирусом простого герпеса (ВПГ), вирусом Эпштейна-Барр (ВЭБ), цитомегаловирусом (ЦМВ) или их сочетанием (микст-инфекция) возрастом от 20 до 50 лет. Отбор больных в группы осуществлялся методом сплошного наблюдения при обращении в консультативную поликлинику Красноярской краевой клинической больницы. Анализ результатов проводился при обострении заболевания.
Контрольную группу составили 36 практически здоровых на момент обследования человек, идентичных по полу и возрасту, без острых патологических процессов в течение 2-х месяцев, предшествующих обследованию, а также хронических заболеваний в анамнезе.
Для иммунологического исследования в утренние часы натощак согласно стандартной методике у всех пациентов проводилось взятие периферической крови из локтевой вены в вакуумные пробирки Green Vac-Tube (Южная Корея) с консервантом, содержащим раствор Li-гепарин и этилендитетрамин (ЭДТА).
Определение концентрации циркулирующих иммунных комплексов проводилось после инкубации сыворотки крови с раствором ПЭГ-6000 и последующим учетом результатов на фотоэлектроколориметре фильтр № 1 (длина волны 315 нм). Концентрация сывороточных иммуноглобулинов IgA, IgM, IgG измерялась методом Mancini [12]. Определение количественных показателей фагоцитарного звена производилась методом латексной агглютинации [7].
Статистическая обработка результатов исследования проводилась с помощью непараметрического критерия Манна–Уитни (T) [8].
Результаты исследования и их обсуждение
Все пациенты с хронической формой герпесвирусной инфекции при осмотре предъявляли жалобы на наличие у них без видимых причин выраженной утомляемости, усталости и снижения работоспособности, которые отмечались в течение последних 1–3 лет. У 7 больных (23,33 %) на протяжении этого срока отмечалась постоянная температура до 37,2–37,5 °С с периодическими повышениями до 38 °С и ознобами. Значительная часть обследованных (21 человек; 70,00 %) предъявляли жалобы на эпизоды повышения температуры до 38°С, повторяющиеся 2–4 раза в год и продолжающиеся до 2–3 недель. Практически все пациенты (93,33 %) отмечали частые периодические боли в горле или повторные ОРВИ (5 и более раз в год). У большинства имели место разной степени выраженности головные боли, нарушения сна и ухудшение памяти (17 человек; 56,67 %), миалгия (66,67 %), артралгия (26,67 %) и мышечная слабость с быстрой утомляемостью (83,33 %). При осмотре у 22 больных (73,33 %) определялись увеличение и легкая болезненность лимфатических узлов, чаще – шейных, затылочных и нижнечелюстных, а у 7 человек (23,33 %) установлено наличие гепатоспленомегалии. Учитывая данную симптоматику, больным был выставлен диагноз СХУ (по МКБ 10 – G93.3).
В качестве стандартной терапии назначался Панавир – высокомолекулярный полисахарид, относящийся к классу гексозных гликозидов, обладающий противовирусным действием за счёт индукции интерферонов всех субклассов, а также Глутоксим, являющийся иммуномодулятором и системным цитопротектором за счёт влияния на внутриклеточные процессы тиолового обмена.
После лечения субфебрильная температура тела и боли в горле сохранялись лишь у 5 пациентов (16,7 %). Лимфаденопатия отмечалась всего у 8 пациентов (26,7 %), миалгии – у 7 (23,3 %), слабость, утомляемость – у 10 (33,3 %), а нарушения памяти и расстройства сна – у 9 (30 %).
Таким образом, после комбинированной противовирусной и иммуномодулирующей терапии отмечается значительная регрессия основных симптомов заболевания.
По сравнению с контрольной группой отмечалось уменьшение содержания IgА в сыворотке крови и увеличение уровня ЦИК, уровни же других классов иммуноглобулинов достоверно не различались. Также было отмечено уменьшение количества активно-фагоцитирующих клеток и подавление их поглотительной способности.
После лечения в группе больных с хронической герпесвирусной инфекцией наблюдалось стремление к нормализации иммунорегуляторного индекса за счёт роста процентного содержания CD4 и снижения уровня CD8, что связано с уменьшающейся вирусной нагрузкой. Отмечалась тенденция к увеличению уровня IgА в сыворотке крови и достоверное увеличение уровня IgG по сравнению с группой контроля, несколько уменьшался уровень ЦИК. По фагоцитарному звену отмечена нормализация показателей поглотительной активности (фагоцитарный индекс достоверно с контролем не различался).
По маркёрограмме герпесвирусных инфекций при сравнении групп между собой (табл. 2) значительно снижалось содержание Ig G EBNA к ВЭБ, практически не встречались маркёры активации ВЭБИ (Ig G EA к ВЭБ – у 3,33 %, Ig M VCA к ВЭБ – у 3,33 %), увеличивалась авидность Ig G VCA к ВЭБ. Отмечено снижение титра IgG к ВПГ и ЦМВ и увеличение авидности этих антител.
Показатели иммунного статуса больных хроническими герпесвирусными инфекциями до и после лечения (M ± m)
Штамм вируса герпеса 6 типа (ВГЧ-6 или HHV-6) был открыт еще в 1986 году. В 2012 году произошло сенсационное открытие: оказывается, вирус герпеса 6 типа у взрослых может никак себя не проявлять, но при этом может вызывать болезненное состояние
Откуда он берется?
По разным данным около 80% людей инфицированы вирусом герпеса 6 типа. Чаше всего встреча с инфекцией происходит в раннем детстве — в возрасте с 6 месяцев до 2 лет. Это связано с утратой ребенком материнского иммунитета и высокой распространенностью вируса. Первая встреча может протекать в форме розеолы — резкого повышения температуры, после чего через 3-4 дня появляется сыпь. Это единственное специфическое проявление у детей, по которым можно заподозрить ВГЧ-6.
Увы, попав в организм, любой вирус герпеса его не покинет. У большинства людей иммунная система достаточно успешно подавляет развитие вирус герпеса 6 типа. Продолжая жить в организме, но ни на что не влияет. Но так происходит не у всех.
Вечно без сил
Часто возникают нарушения сна, депрессия, раздражительность, трудности с концентрацией внимания, ухудшение памяти и интеллекта. Иногда пропадает аппетит, человек резко худеет или толстеет, возникают проблемы в желудке, кишечнике, мочевыделительной системе. Более того, могут появиться симптомы аллергии или чувствительность к яркому свету, алкоголю, лекарствам и т.п.
Как узнать?
На этапе постановке диагноза или для его уточнения врачи назначают лабораторный тест Антитела к вирусу герпеса VI типа (Herpes simplex virus VI), IgG. Его можно сдать и самостоятельно, если вас беспокоит сниженная работоспособность, а по итогам обратиться к врачу. Для него достаточно сдать кровь в лаборатории через 3 часа после приема пищи или утром натощак.
Спровоцировать ВГЧ-6 к активности может любое снижение иммунитета. Чаще всего его запускают стресс, грипп, обострение хронической инфекции. Зачастую люди связывают устало-депрессивное состояние с последствием заболевания или стресса, а на самом деле они стали триггером для активации вируса. Активный вирус живет и размножается за счет лимфоцитов — главных клеток иммунной системы. Поэтому и возникают симптомы инфекции и поражения нервной системы, которая тесно связана с иммунной. При активации вируса HHV6 его можно обнаружить методом ПЦР в соскобе из ротоглотки или в моче. Если есть высыпания на коже и повышение температуры, то можно выявить вирус герпеса 6 типа в крови.
Кому пригодится?
Врачи выделяют несколько групп пациентов, которым необходимо исследование Антитела к вирусу герпеса VI типа (Herpes simplex virus VI), IgG или выявление вирусов группы герпеса в мазке из ротоглотке Это те люди, которых беспокоят:
- проблемы с памятью, невозможность сосредоточиться на деле;
- беспричинные боль и першение в горле;
- болезненность лимфоузлов на шее и под ушами по непонятной причине;
- боли в мышцах, не связанные с физической нагрузкой;
- боли в суставах, не имеющие объективных причин (травма, остеохондроз и т.п.);
- головные боли, которых раньше не бывало;
- проблемы со сном;
- слабость и истощение после физической нагрузки, явно не соответствующие затратам сил;
- частые простудные заболевания
- ощущение лихорадки или озноба при нормальной температуре
Как лечить?
Несмотря на все это, вирус герпеса 6 типа — не приговор. С ним вполне можно жить, как только ваш иммунитет сможет взять его под контроль. Как ни удивительно, большую помощь в этом может оказать здоровый образ жизни. Обязательно надо наладить сон: у тех, кто спит менее 6 часов в сутки, риск проявлений СХУ выше в несколько десятков раз.
Вирусы герпеса поражают не только человека, но и других млекопитающих, а также птиц, рептилий, амфибий и рыб. В настоящее время открыто около 200 видов герпесвирусов. Отличительным признаком вирусов этого семейства является нахождение вируса в клетках латентно, персистируя, бесконечно длительное время, без клинических проявлений.
 |
- тропность к эктодермальным тканям;
- короткий репродуктивный цикл;
- быстрое распространение;
- литический цикл размножения;
- латенция преимущественно в нервных ганглиях
вирус простого герпеса 1 типа (син.: ВПГ-1, herpes simplex virus 1, HSV-1)
- врожденный и неонатальный герпес;
- острый герпетический стомататит;
- герпес кожи лица и верхних конечностей;
- офтальмогерпес;
- менингоэнцефалит
- герпетический стоматит;
- многоформная эксссудативная эритема;
- офтальмогерпес;
- менингоэнцефалит
вирус простого герпеса 2-типа (син.: ВПГ-2, herpes simplex virus 2, HSV-2)
- врожденный и неонатальный герпес;
- генитальный герпес;
- герпес кожи нижних конечностей;
- менингоэнцефалит
- герпес гениталий;
- герпес кожи бедер, ягодиц, нижних конечностей;
- миелит, энцефалит
вирус ветряной оспы (син.: вирус герпеса человека 3-го типа, HHV-3, herpes zoster, varicella zoster virus, VZV)
- тропность к лимфоидным и железистым тканям;
- длительный репродуктивный цикл;
- увеличение зараженных клеток;
- длительная персистенция;
- латенция
цитомегаловирус (син.: вирус герпеса человека 5-го типа, HHV-5, cytomegalovirus, CMV)
- тератогенные эф фекты;
- врожденная инфекция;
- иммунодефицит;
- патология органов дыхания;
- язвенно- некротический гингивостоматит;
- диссеминированная инфекция
- ретинит;
- колит;
- стоматит;
- энцефалит
- лимфотропность (специфичность к Т- или В-лимфоцитам);
- пролиферация тканей и онкогенез;
- латенция
вирус герпеса человека 6-го типа (син.:HHV-6)
- кофактор ВИЧ;
- синдромом хронической усталости;
- оральная карцинома;
- цервикальная карцинома
- системная патология при пересадке органов и тканей;
- гистиоцитоз из клеток Лангерганса
вирус герпеса человека 7-го типа (син.: HHV-7)
- инфекционный мононуклеоз;
- В-лимфопролиферативные заболевания;
- карцинома;
- лимфоэпителиома слюнной железы
- назофарингеальная карцинома;
- лимфома Беркитта;
- идиопатическая лимфоцитарная пневмония;
- лейкоплакия
 |
- необычно продолжительный (месяцы и годы) инкубационный период;
- медленно прогрессирующий характер течения;
- необычность поражения органов и тканей;
- высокая летальность.
Особенную клиническую проблему представляют собой проявления герпес-вирусных заболеваний у больных с измененным иммунным ответом – иммунодефицитных больных, к числу которых следует относить пожилых людей, онкологических больных, ВИЧ-инфицированных и больных СПИДом, наркоманов с большим стажем и реципиентов трансплантации органов и тканей. После установления диагноза и проведенного курса специфической терапии эти больные нередко остаются под наблюдением только соответствующих специалистов амбулаторной службы, и в таком случае все проблемы диагностики и лечения их герпес-вирусных заболеваний становятся уделом их лечащих врачей.
 |
Особенности иммунного ответа на герпес-вирусы
При нормальной функции иммунной системы в результате инфицирования герпес-вирусами создается мощный долговременный или даже пожизненный иммунитет по отношению к конкретному типу герпес-вируса (примеры: пожизненный иммунитет против цитомегалии, ветряной оспы и инфекционного мононуклеоза, вызываемых соответственно ЦМВ, ВВЗ и ВЭБ). Многократное попадание новых штаммов герпес-вирусов в организм иммунологически полноценного (иммунокомпетентного) человека, как правило, не имеет какого-либо патологического значения, так как это – нормальное эпидемиологическое явление, которое обогащает репертуар его противогерпетического иммунитета.
 |
 |
Лишь недавно было доказано, что в основе специфического противогерпетического иммунодефицита лежит уникальная способность активных и реплицирующихся герпес-вирусов (в особенности ВПГ) вырабатывать белки, блокирующие рецепторы I и II классов системы гистосовместимости, что приводит к разрушению каскада передачи сигналов пролиферации и дифференцировки во всей системе специфического иммунного ответа, включая подсистемы антителогенеза, γ -интерферона и гаплотипоспецифических цитотоксических лимфоцитов с фенотипом CD8+ 4 . Так было показано, что Т-лимфоциты контролируют репликацию ВПГ, посредством выделения γ -интерферона как в активной фазе проявлений инфекции так и в скрытой фазе течения (без клинических проявлений) 5 . Причем CD4+ T-лимфоциты ответственны за контроль над ВПГ в коже и слизистых, а CD8+Т-лимфоциты – при поражении герпесом тканей ЦНС 6 . Была отмечена также четкая зависимость между уровнем CD8+Тлимфоцитов и фазами течения поражении гениталий ВПГ2 7 .
 |
 |
 |
 |
Кроме того, роль различных интерферонов в защите от ВПГ неравнозначна. Так, α - и β -интерфероны хотя и имеют специфические рецепторы практически на всех клетках, однако без γ -интерферона не способны эффективно подавлять ВПГ, а вот в присутствии γ -интерферона их активность возрастает в десятки раз 8 . α - и β -ИФ не эффективны по отношению к ВПГ в экспериментах in vitro, хотя их введение при лечении ВПГ ускоряет выздоровление. В тоже время, в отдельных случаях α - и β -ИФ неэффективны, например, при герпетическом поражении глаз у человека 9, 10 .
В то же время, предварительное сочетанное введение лабораторным мышам β - и γ -интерферонов предупреждает развертывание обширной картины гепетического поражения слизистых оболочек глаз и окружающих тканей, моделируемое последующим заражением ВПГ-1. Кроме того, совместное введение β - и γ -интерферонов по своей ингибируюещей активности сравнимо с высокими дозами ацикловира.
4 Nash A. A., and Lohr J. M. 1992. Pathogenesis and immunology of herpesvirus infections of the nervous system, p. 155–175. In S. Spector, M. Bendinelli, and H. Freidman (ed.), Neuropathogenic viruses and immunity. Plenum Press, New York.
5 Cantin E. M., Hinton D. R., Chen J., Openshaw H. Gamma Interferon Expression during Acute and Latent Nervous System Infection by Herpes Simplex Virus Type 1// Journal оf Virology , Aug. 1995, Vol. 69, No. 8, p. 4898–4905
6 Simmons, A., and D. C. Tscharke. 1992. Anti-CD8 impairs clearance of herpes simplex virus from the nervous system: implications for the fate of virally infected neurones. // J. Exp. Med. 175:1337–1344.
7 Smith, P. M., R. M. Wolcott, R. Chervenak, and S. R. Jennings. 1994. Control of acute cutaneous herpes simplex virus infection: T cell-mediated viral clearance is dependent upon interferon-gamma (IFN-γ). // Virology 202 :76–88.
8 Sainz, Jr. B., Halford W. P. Alpha/Beta Interferon and Gamma Interferon Synergize To Inhibit the Replication of Herpes Simplex Virus Type 1// Journal оf Virology, Nov. 2002, Vol. 76, No. 22, p. 11541–11550
9 Cantell, K. 1995. Development of antiviral therapy with alpha interferons:promises, false hopes, and accomplishments. Ann. Med. 27 :23–28.
10 Ho, M. 1990. Interferon as an agent against herpes simplex virus. J. Investig. Dermatol. 95 (Suppl. 6):158S–160S.
Таким, образом γ -интерферон является ключевым обязательным звеном противогерпетического иммунитета, без которого система α - и β -интерферонов при герпесе не эффективна.
Иммунотерапия герпеса
Все разнообразие методов профилактики и лечения герпес-вирусных инфекций в конечном счете сводится к трем главным подходам: иммунотерапии, химиотерапии, комбинация этих способов. Как следует из самого названия, целью иммунотерапии является воздействие на иммунитет. Теоретически мишенями иммунотерапии могут быть: системный иммунитет (т.е. вся совокупность механизмов иммунного ответа на генетически чужеродные антигены), но также и специфический противогерпетический иммунитет, а кроме того – типоспецифический иммунитет (т.е. отдельный, например, высокоселективный противо- ВПГ-, или ВВЗ-, или ЦМВ-иммунитет к конкретным штаммам герпес-вирусов).
Открытие ИФ оказало огромное влияние на борьбу со многими заболеваниями, однако интерфероны – это белковые препараты, которые вызывают значительное количество побочных эффектов при системном введении. Именно поэтому их назначают только, если потенциальный риск от их применения, гораздо меньше пользы, что далеко не всегда оправдано при поражении ВПГ. В большинстве случаев побочные эффекты возникают при парентеральном применении. Во время курса лечения интерферон вызывает побочные эффекты как со стороны центральной нервной и сердечнососудистой систем, так и со стороны желудочно-кишечного тракта, органов чувств, кроветворения и других. Со стороны органов чувств вполне возможно развитие таких побочных эффектов как: ишемическая ретинопатия, паралич нервов, которые отвечают за движение глаз, а также значительное нарушение зрения. Со стороны кожи возможны крапивница, зуд, жжение, сухость кожи, фурункулез, а также различные сыпи кожного покрова.
Эти обстоятельства способствовали поиску препаратов-индукторов эндогенных ИФ. Первый индуктор ИФ был синтезирован группой Тома Меригана (Tom Merigan) из Стенфордского Университета, на основе сополимеров малеиновой кислоты в 1967 году, который продемонстрировал способность индуцировать ИФ сначала в экспериментах на мышах 12 , а затем и у человека 13 . Эта работа стимулировала интерес к индукторам ИФ и способствовала появлению целого ряда изысканий в этой области, в частности поиску индукторов ИФ на основе синтетических полинуклеотидов с различными небиогенными сополимерами.
 |
11 Pestka S (July 2007). “The interferons: 50 years after their discovery, there is much more to learn”. J. Biol. Chem. 282 (28): 20047–51.
12 Merigan TC. Induction of circulating interferon by synthetic anionic polymers of known composition. // Nature 1967 ; 214:416–7.
13 Merigan TC, Regelson W. Interferon induction in man by a synthetic polyanion of defined composition.// N Engl J Med 1967 ; 277:1283–7.
14 Mayer, G. D., and R. F. Krueger. 1970. Tilorone hydrochloride: Mode of action. Science 169:1214-1215.
В 1974 году по просьбе директора института проблем онкологии АН УССР Р.Е. Кавецкого в Физикохимическом институте АН УССР по инициативе его директора – академика АН УССР А.В. Богатского – были начаты работы по ресинтезу тилорона и получению его аналогов. Этот цикл исследований был поручен сотруднице института к.х.н. Литвиновой Людмиле Александровне с сотрудниками. К 1975 г амиксин был синтезирован, причем с улучшением методики получения 18, 19 . В 1980 году этим веществом заинтересовались д.б.н. Ф.И. Ершов (Институт вирусологии им. Д.И. Ивановского АМН СССР, Москва) и д.м.н. Н.П. Чижов (Военно-медицинская академия МО СССР, Ленинград). Начатое ими широкомасштабное изучение тилорона как индуктора интерферона, обладающего противовирусной активностью, привело к осознанию целесообразности внедрения его в медицинскую практику. В связи с этим в ФХИ им. А.В. Богатского АН УССР в 1980 – 1985 годах начался процесс подготовки всего необходимого пакета НТД, разработки основных технологических схем получения и аналитических методов контроля качества. В рамках этой работы Л.А. Литвиновой было предложено новое название субстанции и лекарственной формы – АМИКСИН – 2,7-бис-[2(диэтиламино)этокси]флуоренона-9 дигидрохлорид.
Так как при ВПГ-1,2 ассоциированном поражении слизистых оболочек рта, носогубного треугольника, половых органов наблюдаются выраженные сдвиги системы ИФ (снижение продукции ИФ- α , - β , - γ ), то включение Амиксина ® ІС в терапию этого заболевания является оправданным 20 . Основными продуцентами интерферона в ответ на введение Амиксина ® ІС являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, нейтрофилы и гранулоциты. После приема внутрь максимум продукции интерферона определяется в следующей последовательности: кишечник → печень → кровь (через 4-24 ч).
Недавние исследования Т.В. Чабан и соавторов показали, что назначение Амиксина ® ІС в сочетанной терапии с ацикловиром при терапии ВПГ-1,2 ассоциированных поражений слизистых оболочек, кожи и половых органов приводило к сокращению периода обострения заболевания (4,5±1,2) дня по сравнению группой пациентов, получавшей только ацикловир. Амиксин® ІС назначали по 125 мг 1 раз в день, 2 дня в неделю, в течение 4 недель. Также наблюдали более интенсивное уменьшение и исчезновение таких жалоб как общая слабость, зуд, боль в участках сыпи, ускорялся процесс элиминации элементов сыпи у больных. В сыворотки крови пациентов, получавших Амиксин® ІС наблюдали увеличение ИФ- α и ИФ- γ . Таким, образом, Амиксин® ІС обладает выраженными противовирусными свойствами и способен позитивно влиять на иммунопатогенез герпетической инфекции.
Следует помнить, что поражения слизистых и кожи, вызванные вирусами герпеса, являются проявлением системного инфекционного процесса, а поэтому требуют обязательной системной терапии. Причем, учитывая что Амиксин® ІС обладает как прямым ингибирующим влиянием на процесс размножения вирусов так и стимулирует систему интерферонов, его можно отнести как к этиотропным так и патогенетическим средствам терапии (табл. 3).
Противовирусные (аномальные нуклеозиды, препараты угнетающие вирусную ДНК- полимеразу - Амиксин® ІС )
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Герпес: причины появления, симптомы, диагностика и способы лечения.
Определение
Герпесом, или герпетической инфекцией, называют несколько заболеваний, вызываемых вирусами отряда Herpesvirales семейства Herpesviridae.
Все они характеризуются поражением кожи, слизистых оболочек с локализацией либо в области глаз, носа и губ, гениталий, а также нервных волокон.
У лиц с иммунодефицитом могут наблюдаться генерализованные формы инфекции с вовлечением в процесс других органов и тканей.

Среди известных науке восьми типов герпеса самым распространенным является вирус герпеса простого типа (Herpes simplex virus).
Простой вирус герпеса достаточно неустойчив во внешней среде. В условиях комнатной температуры сохраняется до 24 часов, на металле — до 2 часов. Под действием температуры выше 50°C погибает за 30 минут, под действием спирта и хлорсодержащих веществ - в течение нескольких минут, при замораживании сохраняется до пяти суток.
Причины герпетической инфекции
Источником инфицирования всегда служит человек. Он заразен в любую фазу болезни или носительства, но преимущественно при обострении.
Возбудитель может передаваться воздушно-капельным, контактно-бытовым или половым путем, а также от матери плоду через плаценту, во время родов или грудного вскармливания.
К вирусу восприимчивы все люди, хотя у многих отмечаются бессимптомные формы заболевания. Попадая через слизистую рта, половых органов или дыхательные пути в организм человека, герпесная инфекция остается в нем навсегда. Вирус, скрытый внутри клетки-хозяина, не доступен для иммунных клеток, уничтожающих возбудителей. Вирус активизируется при ослаблении иммунитета в результате переохлаждения, перегрева, простудного заболевания, недостатка витаминов, переутомления, стресса, нехватки сна. Рецидив инфекции могут вызвать травмы, оперативные вмешательства, а также половой контакт при условии повреждения слизистой оболочки. Использование лекарственных и косметических средств, содержащих стероидные гормоны, также способствует манифестации вируса герпеса.
Классификация герпеса
В МКБ-10 (Международной классификации болезней) выделяют две группы заболеваний, связанных с вирусом простого герпеса:
- Инфекционные герпетические заболевания:
- герпетическая экзема (экзема Капоши);
- герпетический везикулярный дерматит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический энцефалит;
- офтальмогерпес;
- диссеминированная герпетическая болезнь (герпетический сепсис);
- другие формы герпетических инфекций;
- неуточненная герпетическая инфекция.
- Генитальные герпетические инфекции:
- герпетические инфекции перианальных кожных покровов и прямой кишки;
- неуточненная аногенитальная герпетическая инфекция.
По клинической картине и локализации высыпаний:
- Типичные формы:
- герпес кожи — с поражением губ, крыльев носа, лица, рук, ягодиц и других частей тела;
- герпес глаз — иридоциклит, кератит, конъюнктивит, неврит зрительного нерва;
- герпес слизистых оболочек желудочно-кишечного тракта — стоматит, гингивит, фарингит, эзофагит;
- герпес половых органов — поражение слизистой оболочки полового члена, влагалища, вульвы, цервикального канала;
- герпес внутренних органов — гепатит, пневмония, панкреатит, трахеобронхит;
- герпес нервной системы — неврит, менингит, менингоэнцефалит, поражения бульбарных нервов, энцефалит;
- генерализованный простой герпес — висцеральная форма (пневмония, гепатит, эзофагит) и диссеминированная форма (сепсис).
- Атипичные формы:
- герпетиформная экзема Капоши — обширные сливающиеся высыпания по всему телу;
- абортивный герпес — почти незаметные папулы на грубой коже или дискомфорт без высыпаний;
- язвенно-некротический герпес — с развитием некроза тканей;
- эрозивно-язвенный герпес — с образованием язв и эрозий;
- геморрагический герпес — с кровянистым пропитыванием высыпаний и тканей;
- отечный герпес — с отеком тканей и болью в области губ и век;
- зостериформный простой герпес — с локализацией по ходу нервного ствола;
- диссеминированный герпес — с тенденцией перехода в генерализованную форму при ВИЧ;
- рупиоидный герпес — возникает на лице с присоединением вторичной бактериальной флоры;
- мигрирующий герпес — с тенденцией к изменению локализации высыпаний.
- латентная стадия — носительство с отсутствием симптомов;
- локализованная стадия — наличие одного очага поражения;
- распространенная стадия — наличие не менее двух очагов поражения;
- генерализованная стадия — висцеральная, диссеминированная.
При заражении герпесом детей в возрасте от 6 месяцев до 3 лет чаще всего развивается герпетический стоматит, для которого характерно острое начало с симптомами интоксикации и подъемом температуры.
На слизистой оболочке полости рта появляются сгруппированные пузырьки с прозрачным содержимым, на месте которых после вскрытия образуются болезненные эрозии. У детей старшего возраста первичный герпес характеризуется появлением зудящих пузырьков на красной кайме губ и коже носогубного треугольника. После их вскрытия остаются неглубокие язвочки, которые покрываются корочками. Корочки, отпадая, не оставляют следов на коже.
При первичном заражении взрослых вирусом простого герпеса симптомы более выражены, чем при дальнейших рецидивах. Больной испытывает озноб, головные боли, повышенную утомляемость, у него отсутствует аппетит, может наблюдаться расстройство сна. Покраснение, а затем характерные пузырьки появляются на губах, возле крыльев носа. В некоторых случаях увеличиваются подчелюстные лимфоузлы.
Герпетические нейроинфекции сопровождаются наиболее тяжелым течением, особенно если вирус поражает оболочки или ткань головного мозга.
В этих случаях симптомы включают головные боли, подъем температуры тела, напряжение затылочных мышц, психомоторное возбуждение (болезненное состояние, при котором наблюдается беспокойство и двигательная активность различной степени выраженности, вплоть до судорог). При несвоевременной диагностике заболевания существует риск летального исхода.
Офтальмогерпес сопровождается покраснением глаза, развитием блефаро- или кератоконъюнктивита, эрозиями роговицы.
Диагностика герпеса
Типичные случаи герпетической инфекции выявляются на основании клинической картины и анамнеза заболевания. Характерно его волнообразное течение со сменой периодов обострения и ремиссии.
Косвенным признаком служит склонность к простудным заболеваниям, чувствительность к переохлаждению, периодически возникающие состояния, сопровождаемые подъемом температуры, усталостью, депрессией.

При атипичных формах герпетической инфекции необходимы дополнительные обследования: клинический анализ крови, биохимический анализ крови (общий белок, белковые фракции, С-реактивный белок, АЛТ, АСТ, ЛДГ, креатинин, электролиты: калий, натрий, хлор, кальций) и клинический анализ мочи - для выявления поражения внутренних органов и предупреждения осложнений.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Генитальный герпес – хроническое рецидивирующее заболевание вирусной этиологии, передающееся преимущественно половым путем. Герпес считается крайне распространенным эрозивно-язвенным заболеванием половых органов - ежегодно в мире регистрируется 500 000 новых случаев обращений по этому поводу. В Российской Федерации у лиц старше 18 лет инфицированность вирусом, вызывающим генитальный герпес, составляет 17,2 случая на 10 000 населения.
В 70% случаев заболевание протекает бессимптомно, что и обусловило широкое распространение этой патологии.
Причины появления генитального герпеса
Генитальный герпес вызывает вирус простого герпеса (ВПГ) I и/или II типов. Вирус герпеса I типа чаще всего поражает слизистую оболочку рта и носит название орального (лабиального) герпеса. При заражении этим вирусом очаги поражения локализуются на лице в области губ.
Вирус герпеса II типа чаще вызывает генитальный герпес, однако оба типа могут провоцировать развитие патологии оральной и генитальной локализации. Для ВПГ II типа более характерно рецидивирующее течение, чем для ВПГ I.
- Половой путь – самый часто встречающийся путь передачи генитальной герпетической инфекции.
- Передача вируса бытовым путем является самой редкой.
- Аутоинокуляция – перенос вируса с зараженных участков слизистой на здоровые самим больным.
- Трансплацентарный – через плаценту от инфицированной матери плоду.
- Перинатальный – в процессе родов.
- Контактно-бытовой (при несоблюдении правил ухода и гигиены).
- Аутоинокуляция (см. выше).
- Беспорядочная половая жизнь без использования барьерной контрацепции (презервативов).
- Нарушение правил личной и бытовой гигиены.
- Снижение иммунитета (в силу наличия длительно текущих хронических заболеваний, несбалансированного питания, подверженности частым стрессам, нарушения режима сна).
- Первый эпизод развития клинической симптоматики генитального герпеса.
- Рецидивирующая герпетическая инфекция.
- Инфекция мочеполовых органов.
- у мужчин,
- у женщин.
- Инфекция прямой кишки и перианальной кожи.
- Герпес с типичной клинической картиной.
- Атипичное течение.
Если иммунная система справляется с вирусом на этом этапе, то формируется иммунитет и носительство вируса, не исключающее рецидива заболевания при ослаблении защитных функций организма.
Если у организма нет ресурсов противостоять ВПГ, то вирус проникает во внутренние органы и фиксируется на них. При снижении иммунитета, прочих вирусных инфекциях или при обострениях хронических заболеваний ВПГ из органов вновь выходит в кровь и с ее током разносится по организму.
Симптомы генитального герпеса
При первичном инфицировании инкубационный период составляет от 1 до 10 дней, а клинические проявления длятся от 18 до 24 дней с нарастанием симптоматики в течение недели. До возникновения очагов повреждения у 50% больных появляются продромальные симптомы - парестезии, чувство жжения в генитальной области, невралгии в ягодичной, паховой бедренной областях, дизурия - и продолжаются до 24 часов. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением (образованием корочек). Симптомы общей интоксикации, свойственные любой вирусной инфекции, – недомогание, слабость, субфебрилитет, головная боль - развиваются, как правило, при первичном инфицировании, при рецидиве они минимальны.
Непервичная генитальная герпетическая инфекция протекает менее выраженно: длительность клинических проявлений составляет до 15 дней, реже наблюдается бессимптомное выделение вируса, длительность слущивания поврежденного эпителия составляет всего 4-5 дней.
Высыпания на половых органах и/или в перианальной области всегда носят пузырьковый характер, содержимое прозрачное, основание пузырьков гиперемировано (красного цвета); могут быть множественными и единичными.
Пораженная область слизистой оболочки отечная. У мужчин самая частая локализация высыпаний – мошонка, половой член, лобок, промежность, перианальная область.
У женщин – клитор, влагалище, вульва, лобок, шейка матки, перианальная область. В случае присоединения вторичной (чаще бактериальной) инфекции появляются гнойные и слизисто-гнойные выделения.
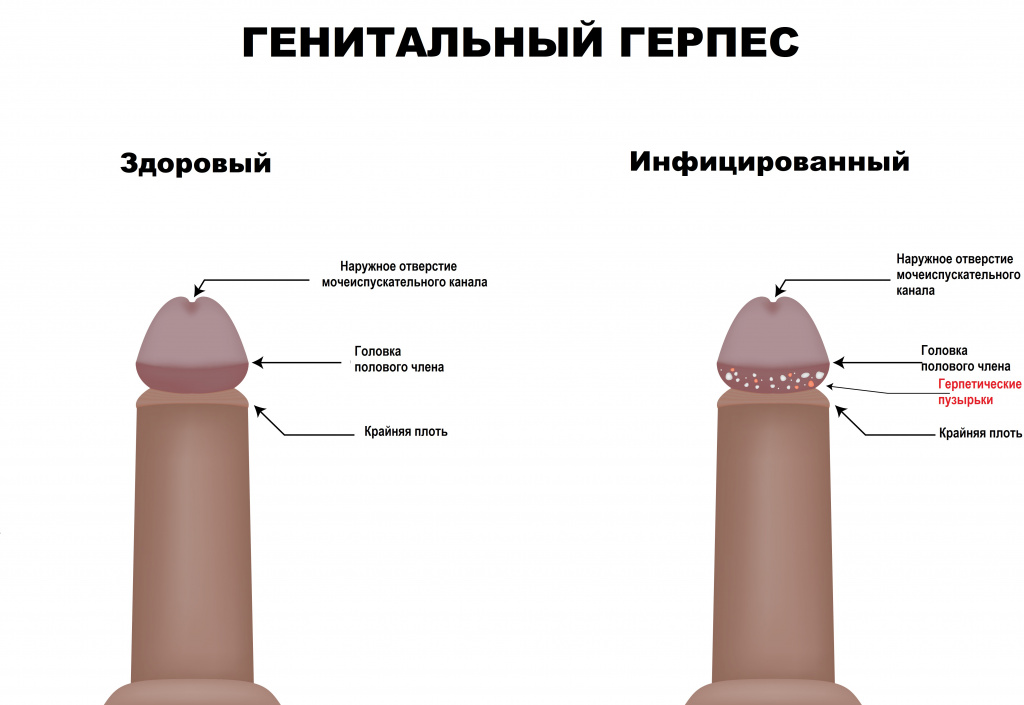
В случае обострения генитального герпеса присутствует боль при половом контакте.
Диагностика генитального герпеса
Диагностика этого заболевания строится на характерной клинической картине высыпаний и на выявлении ДНК вируса в крови или в отделяемом с пораженных тканей.
Необходимо сдать анализы крови для подтверждения инфицированности вирусом герпеса и определения активности процесса, для выявления ДНК вируса в эякуляте, секрете простаты, в соскобе клеток урогенитального тракта, а также в соскобах с конъюнктивы, кожи, слизистой оболочки носа, ротоглотки.
Раздельное определение ДНК-вируса простого герпеса 1 типа (губного или лабиального) и 2 типа (генитального) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Термин "герпес" (от древнегреч. – ползти, ползучи.
Читайте также:

