Может ли вирус заразить бактерию
Обновлено: 19.04.2024
Кем приходятся друг другу представителя микромира – вирусы и бактерии? Можно ли считать их врагами, друзьями, кровными родственниками или партнерами? Разберемся в их взаимодействии и роли в человеческом организме.
Чаще всего человек знакомится с вирусами и бактериями в сезон простуд. Острые респираторные инфекции – одни из самых распространенных заболеваний в мире. Большая часть таких болезней возникает из-за вирусов и бактерий, попадающих в организм человека вместе с вдыхаемым воздухом и оседающих на слизистых оболочках носа или рта 1 .
Для понимания процесса заражения можно привести аналогию с любым публичными заведением, которое в нашем случае является организмом человека. Через открытые двери в заведение попадают различные гости – вирусы и бактерии. Некоторые бактерии являются интеллигентной публикой и вреда не приносят, а некоторым вход категорически запрещен: они могут спровоцировать настоящий конфликт. Что касается вирусов – это, по большей части, бандиты. Не стоит ждать от них ничего хорошего.
Так в чем заключается основная разница между ними? Для начала нужно четко понять, что они представляют собой, а уже на основании этого определить разницу и принцип воздействия на организм.
Что такое вирусы
Вирус – это мельчайший организм, который способен существовать и размножаться только внутри живых клеток. Во внешней среде вирус находится в микрочастицах биологического материала, но размножается исключительно в клетках живых существ. Другими словами, вирус не активен до тех пор, пока не окажется внутри человека 2 .
А попадает он туда следующим образом:
- Воздушно-капельным путем, как и большинство респираторных инфекций
- При употреблении грязной воды, с пищей, при несоблюдении правил гигиены
- От матери к будущему ребенку
- Контактным – при тесном контакте через кожу или слизистые оболочки
- Парентеральным способом – минуя желудочно-кишечный тракт, посредством инъекций
После попадания в организм вирус вначале прикрепляется к клетке, затем доставляет в нее свой биологический геном, теряет оболочку и только потом размножается. После размножения вирус покидает клетку, а инфекционный агент распространяется вместе с кровью, продолжая тотальное заражение. Вирусы могут подавлять иммунную систему 2 .
Что такое бактерии
Бактерия представляет собой полноценный, пусть и одноклеточный организм. Она умеет размножаться благодаря делению, чем активно и занимается в природе или внутри человека 3 .
Далеко не все бактерии вызывают инфекционные заболевания. Некоторые приносят пользу и живут в органах тела. Например, молочнокислые или бифидобактерии, которые обитают в кишечнике и желудочном тракте, активно участвуют в процессе жизнедеятельности человека и фактически составляют часть его иммунной защиты 3 .
Попадание бактерий в организм повторяет пути вирусов. Но размножение бактерий осуществляется чаще вне клетки, чем внутри нее. Список болезней, которые развиваются в результате их проникновения в тело человека, чрезвычайно велик. Бактерии могут вызывать 3 :
- Респираторные болезни (чаще всего их вызывают стафилококки и стрептококки)
- Инфекции ЖКТ (провоцируются кишечной палочкой и энтерококками)
- Поражения нервной системы (бывают вызваны менингококками)
- Ряд заболеваний репродуктивной системы и др.
Размножаясь, они распространяются по кровяному руслу, что приводит к генерализации инфекции и клиническому утяжелению состояния больного. Бактерии также в состоянии подавлять иммунную систему, из-за чего организму становится тяжелее противостоять вирусам 3 .
Чем отличается вирус от бактерии
Таким образом, и вирусы, и бактерии способны поражать организм, вызывая инфекционное заражение. Ключевая разница между ними – в механизме размножения. Вирусы не могут размножаться во внешней среде, поэтому им необходимо внедриться в клетку. Бактерии размножаются делением и могут жить во внешней среде длительное время, дожидаясь попадания в организм человека. Соответственно, механизмы для противобактериальной и противовирусной защиты также должны различаться 4 .
Подведем краткие итоги. Отличия вируса от бактерии таковы 4 :
- Размер и форма существования. Вирус – простейшая жизненная форма, бактерия – одноклеточное живое существо.
- Жизнедеятельность. Вирус существует только внутри клетки и заражает её, после чего происходит размножение (клонирование). Бактерия живет полноценной жизнью, размножаясь делением, а организм для неё – лишь благоприятное место существования.
- Форма проявления. Вирусам свойственно проявлять себя повышением температуры тела, общей слабостью, мышечными и суставными болями. Бактерии проявляют себя нездоровыми выделениями (гнойные или как специфический налет).
Типичные вирусные заболевания: ОРВИ, грипп, герпес, корь и краснуха. Также к ним относятся энцефалит, гепатиты, оспа, ВИЧ и др.
Типичные бактериальные заболевания: сифилис, коклюш, холера, туберкулез, дифтерия, брюшной тиф и кишечные инфекции, ИППП.
Бывает, что и те, и другие вызывают одно заболевание совместно. Подобный симбиоз требует особого лечения. Примером могут служить: синусит, тонзиллит, менингит, пневмония и другие заболевания 5 .
Борьба с вирусами и бактериями
Иммуномодулятор ИРС®19 станет помощником на пути к здоровому и крепкому иммунитету. В его составе заключена смесь лизатов бактерий, которые представляют собой специально выделенные части бактерий-вредителей. Лизаты активируют иммунную систему и направляют ее на борьбу с бактериями и вирусами. Препарат обладает высоким уровнем безопасности и может назначаться для профилактики инфекций у взрослых и детей старше 3-х месяцев. Он был многократно протестирован и показал отличные результаты в борьбе с инфекциями, в т.ч с ОРВИ 6 .

Два новых исследования предоставляют доказательства и раскрывают механизмы этих взаимодействий, что дает новое понимание микробиологического патогенеза для разработки вакцин.
С появлением современных методов в области молекулярной микробиологии становится очевидно, что легкие не являются стерильными даже при отсутствии заболеваний. Существуют доказательства взаимодействия и коэволюции бактериальных сообществ и иммунной системы позвоночных на протяжении всей истории. Последние данные также свидетельствуют о сходном взаимодействии этих колонизирующих микроорганизмов и эволюции по отношению к патогенезу вирусов.
Это особенно актуально в случае взаимодействия между вирусом гриппа и бактерией Streptococcus pneumoniae, так как коинфекция этими двумя микроорганизмами приводит к более резкому прогрессированию заболевания и увеличению смертности, чем заражение только одним из этих патогеном.
Два новых исследования, опубликованных в Nature Microbiology, предоставляют доказательства взаимодействия между Streptococcus pneumoniae и вирусом гриппа. Это важно не только для понимания патогенеза, но и для разработки эффективных вакцин против таких инфекций.
Rowe и соавторы предоставляют косвенные доказательства физического взаимодействия между Streptococcus pneumoniae и вирусом гриппа путем их совместной седиментации и прямые доказательства связывания вируса с бактериями, используя штамм гриппа, экспрессирующий флуоресцентный белок mRuby2.
Чтобы изучить влияние прямого связывания вируса и бактерии на респираторную инфекцию, ученые продемонстрировали повышенную адгезию вирусно-бактериального комплекса к культивируемым in vitro линиям эпителиальных клеток человека и мышей, которым интраназально инокулировали только Streptococcus pneumoniae или Streptococcus pneumoniae, прединкубированных с вирусом гриппа (рис. 1, левая панель).
.
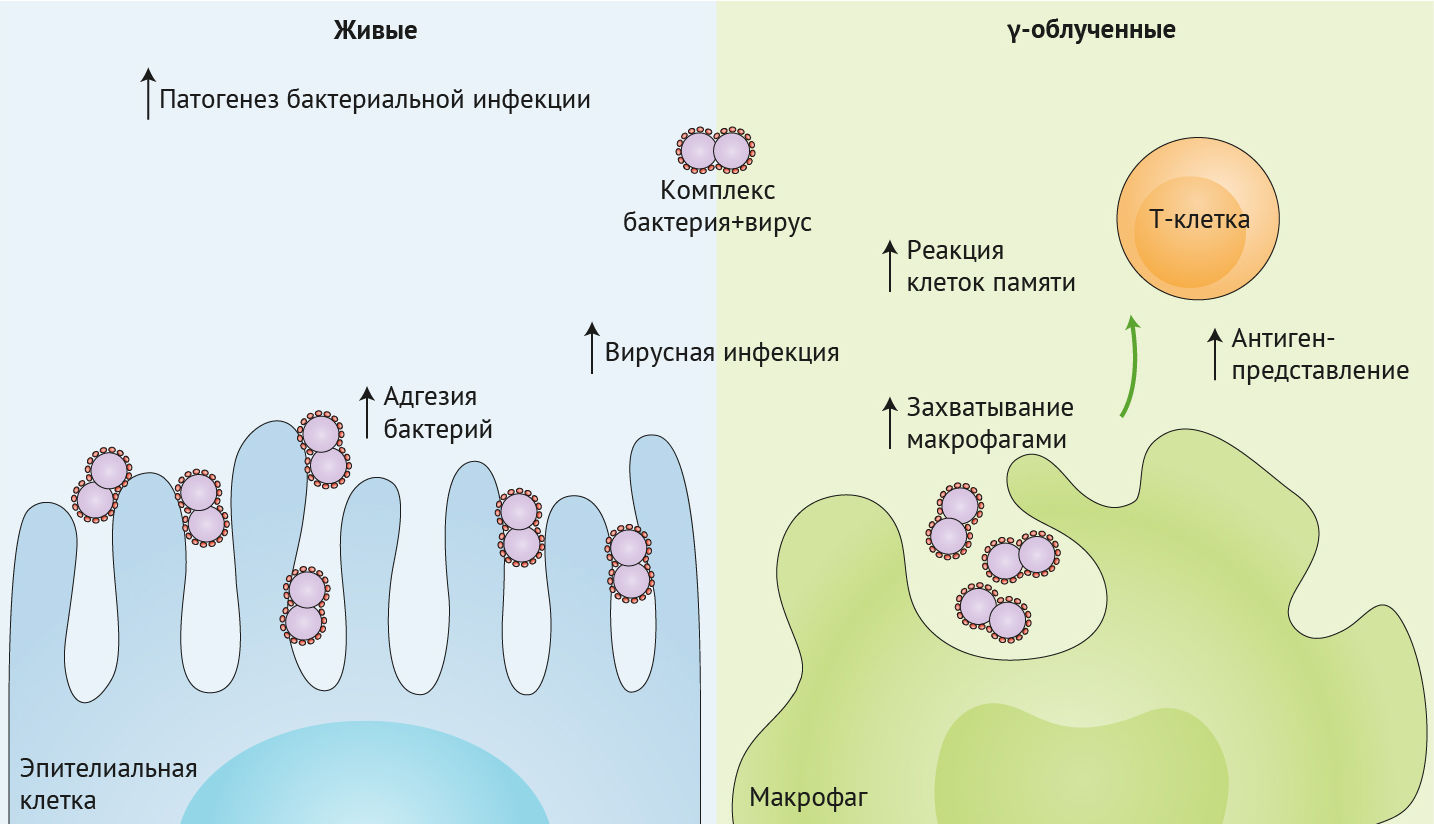
Вирус гриппа напрямую связывается с поверхностью бактерии, что приводит к увеличению адгезии бактерий к дыхательному эпителию, прогрессированию патологического процесса и смертности в мышиной модели. Это связывание вируса с бактерией независимо от жизнеспособности бактерий и использование γ-облученного Streptococcus pneumoniae также приводило к увеличению вирусной инфекции клеток MDCK (левая панель).
Когда и Streptococcus pneumoniae, и вирус гриппа были облучены γ-лучами, непосредственное связывание между этими двумя патогенами все еще было очевидно, что привело к увеличению поглощения макрофагами. Мукозальная вакцинация мышиной модели этим γ-облученным комплексом патогенов способствовала усилению резидентной памяти и действия Т-клеток легких на вирус гриппа, что, возможно, произошло в результате увеличения антиген-презентации макрофагами (правая панель).
Всего через 24 часа отмечен рост Streptococcus pneumoniae в носовых ходах и среднем ухе у мышиных моделей, которым предварительно инокулировали комплекс, включающий Streptococcus pneumoniae и вирус гриппа. В данном случае рост был более интенсивным, чем при инокулировании двух патогенов без предварительной инкубации. Вследствие этого повышенного связывания комплексных патогенов скорость развития инфекции и смертность значительно увеличились.
Интересно, что увеличение смертности не было связано с повышенной бактериемией. Это позволяет предположить, что прогрессирование заболевания может быть результатом цитокиновой бури в дыхательных путях. Но остается вопрос, как бактериально-вирусное взаимодействие приносит пользу вирусу.
David и его коллеги из Австралии решили изучить этот вопрос. Они представляют электронные микрофотографии для подтверждения факта прямого связывания гриппа с гамма-облученным штаммом Streptococcus pneumoniae и демонстрируют, что этот комплекс повышает способность гриппа инфицировать клетки Мадин-Дарби почек собак (MDCK) (рис. 1, левая панель). Ученые не выяснили, было ли это прогрессирование вирусной инфекции вызвано повышенной адгезией бактериально-вирусного комплекса к клеткам MDCK, но продемонстрировали, что комплекс способствует лучшему захвату и интернализации вируса гриппа макрофагами THP-1 (рис. 1, правая панель).
Есть предположение, что взаимодействие вируса гриппа и Streptococcus pneumoniae способствует заражению организма-хозяина обоими организмами, но можно ли использовать это взаимодействие для усиления иммуногенности к этим патогенам? Группа австралийских ученых ранее продемонстрировала, что совместная мукозальная вакцинация с помощью γ-облученного гриппа A/Puerto Rico/8/1934 (PR8) H1N1 (γ-Flu) и γ-Spn обеспечивает значительную защиту от летальной коинфекции и увеличение специфической реакции на Streptococcus pneumoniae. Данная статья посвящена исследованию специфического иммунитета против гриппа, возникающего в результате интраназальной инокуляции γ-Flu-γ-Spn.
Через три недели после вакцинации γ-Flu-γ-Spn David и соавторы провели эксперимент с заражением мышей смертельной дозой вируса гриппа штамма PR8. Неудивительно, что мыши, вакцинированные одним γ-Flu или γ-Flu-γ-Spn, были полностью защищены в течение трех недель после заражения, тогда как мыши, которые были вакцинированы только одним γ-Spn, умерли в течение первой недели. Мыши, вакцинированные только одним γ-гриппом или γ-гриппом-γ-Spn, также были защищены от последствий смертельного заражения недавним пандемическим штаммом H1N1 2009 года.
Важно отметить, что только мыши, вакцинированные γ-Flu-γ-Spn, были полностью защищены от заражения гетероподтипом H3N2, в то время, как среди мышей, вакцинированных одним γ-Flu, смертность составляла 40 %. Авторы исследования продемонстрировали, что эта совместная вакцинация не была связана с различием реакции нейтрализующих антител и циркулирующих Т-клеток. В отличие от этого, вакцинация γ-Flu-γ-Spn значительно усиливала резидентную память CD4+ и CD8+ T-клеток в легких, которые необходимы для противостояния инфекции гриппа (рис. 1, правая панель).
Такие взаимодействия не ограничиваются Streptococcus pneumoniae. Rowe и соавторы также предоставляют доказательства прямого взаимодействия вируса гриппа с другими респираторными микроорганизмами, такими как нетипируемые Haemophilus influenzae (NTHi) и Moraxella catarrhalis. Эти данные могут объяснить тот факт, что пациенты с хронической обструктивной болезнью легких, которые колонизированы NTHi, в три раза чаще испытывают обострение своего заболевания после вирусной инфекции, чем пациенты без NTHi.
В обоих исследованиях есть недостатки. Большинство наблюдений основаны на экспериментах in vitro или на моделях летальных животных, а не на моделях, которые воспроизводят человеческие заболевания. Над отчетом David и соавторов потребуется провести дополнительную работу — продемонстрировать продолжительность защиты, прежде чем транслировать в массы эти наблюдения.
Обе статьи также посвящены взаимодействию между бактериями и вирусом гриппа А, без упоминания о штаммах гриппа В, хотя штаммы В являются распространенной причиной гриппа. Но эффективность применения комбинированной вакцины впечатляющая, эти результаты можно использовать для разработки вакцины против респираторно-синцитиального вируса, который, как уже известно, непосредственно связывается с Streptococcus pneumoniae. Если перекрестная защита от гетеросубтипических штаммов подействует на риновирус, то, возможно, есть надежда создать вакцину от простуды.
Разработка вакцин — важная задача будущего, но пока наблюдения ученых должны заставить нас обратить внимание на респираторные инфекции. Несмотря на то, что заражение одним патогеном все еще может быть уместными во многих случаях, учитывая наличие микробиоты в легких, модели сочетанной инфекции, а не последовательной инфекции, ближе к реальной картине.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.

Если обратиться к статистике, то инфекции – самая частая причина обращения за медицинской помощью. Спровоцировать их могут различные патогены: вирусы, бактерии, грибки и др. Вирусы и бактерии могут стать причиной клинически схожих инфекций, но ситуации требуют разного лечения. Чем бактериальная и вирусная инфекция отличаются?
Основы микробиологии
Бактерии – одноклеточные микроорганизмы, поражающие разнообразием. Они имеют множество форм и особенностей, некоторые из них способны выживать в немыслимых условиях.
Человеческий микробиом насчитывает сотни видов бактерий и каждый выполняет определенные функции, например, сдерживают рост патогенных микроорганизмов, поддерживают обменные процессы и многое другое. Известно, что лишь 1% бактерий вызывают болезни.
Вирусы – еще меньше чем бактерии, для нормальной жизнедеятельности нуждаются в клетках хозяина, где они могут жить и развиваться. Некоторые вирусы могут уничтожать клетки, где они развиваются.
Способы передачи
В путях передачи инфекций много общего. Основной путь передачи — от человека к человеку при близком контакте, например, при поцелуях.
Контакт с биологическими жидкостями человека, например, во время полового акта, при кашле и чихании. Так передаются не только вирусные инфекции, например, ВИЧ, ОРВИ и новая коронавирусная инфекция, но и бактериальные. Некоторые вирусы и бактерии передаются при соприкосновении с зараженными поверхностями, где вирусы и бактерии живут в биологических средах. Еще один возможный путь передачи — при укусах животных и насекомых.
Клиническая картина
Вирусы и бактерии вызывают схожие болезни по симптомам: лихорадка, насморк, кашель, головная боль, слабость и снижение работоспособности. Но при детальном рассмотрении и изучении найдется и масса отличий, которые заметит только врач.
Вирусные инфекции распространены в большей степени, поэтому, при появлении симптомов, часто предполагают именно ее. Дифференцировать одно от другого помогают следующие отличия и критерии:
- Инкубационный период у вирусов более короткий, в сравнении с бактериями. Например, у бактериальных инфекций – симптомы появляются спустя 7-10-14 дней после заражения, а иногда и больше. Вирусные инфекции проявляются через 1-5 дней после заражения.
- Клиническая картина вирусных инфекций более четкая, все характерные симптомы проявляются буквально сразу или между их появлением короткий промежуток времени. Если говорить о бактериальной инфекции, то они развиваются медленнее, но с полным набором симптомов.
Вирусные инфекции могут поражать здорового человека, а вот бактериальные развиваются на фоне ослабленного иммунитета или же являются осложнением перенесенного заболевания.
Конечно, главное отличие – способы и методы специфического лечения. Антибиотики никак не действуют на вирусы, а противовирусные на бактерии.
Особенности диагностики
В медицине существует такое понятие, как дифференциальный диагноз – методы диагностики, которые помогут отличить одно заболевание от другого со схожей клинической картиной. Бактериальные и вирусные инфекции способны вызывать респираторные заболевания, и чтобы определить причину, проводят дифференциальный диагноз – анализ симптомов.
Например, выделения из носа при вирусных инфекциях жидкие, прозрачные, часто носят серозный характер. А вот при бактериальных – густые, могут иметь желтый или зеленый оттенок, что говорит о наличии гнойного процесса.
Естественной реакцией организма на проникновение вируса или бактерии является повышение температуры тела. При вирусной инфекции температура повышается резко и быстро,может держаться несколько дней. При бактериальной инфекции — постепенно и начало болезни сложно проследить.
При вирусных инфекциях сложно определить область поражения. Пациенты отмечают, что болит сразу все: горло, грудь, мышцы, голова. Однако при бактериальной инфекции легко определить область поражения: болит горло при ангине, боль в груди при бронхите, боль при мочеиспускании при циститах и др.
Длительность болезни также варьируется. Например, при вирусной инфекции улучшение наступает на 5-7 день болезни, а вот бактериальные инфекции протекают длительнее.
Особенности диагностики
В большинстве случаев, поставить предварительный диагноз удается на основе жалоб, внешнего и инструментального осмотра. Некоторые вирусные и бактериальные инфекции имеют весьма специфичные симптомы. При постановке диагноза учитывают еще и данные об эпидемиологической обстановке.
Но все же чаще при бактериальных инфекциях требуются дополнительные методы обследования, в том числе и лабораторные. В соответствии с этим, врач обязательно назначает следующие анализы:
- общий анализ крови;
- изучение слизи, выделяемой мокроты, других выделений и мазков;
- анализ мочи, стула;
- соскоб кожи;
- изучение спинномозговой жидкости при тяжелом течении болезни.
При бактериальных инфекциях такие исследования проводятся с целью определения вида возбудителя, а также его антибиотикочувствительности.
Особенности лечения
Вирусные и бактериальные инфекции – совершенно разные диагнозы, имеющие особенности клинического течения, а также лечения. И, в случае ошибки при назначении лечения, повышается вероятность осложнений, развития основного заболевания. Иногда это представляет угрозу для здоровья и жизни.
Лечение бактериальных инфекций
Антибиотики – группа лекарств, назначаемых исключительно при лечении бактериальных инфекций. Существует разные виды антибиотиков, которые направленно действуют на бактерии определенного класса или же широкого спектра. При формировании острых заболеваний с серьезным и быстрым течением могут назначаться антибиотики широкого спектра действия, а после, когда результаты по определению антибиотикочувствительности дадут результат, могут назначаться узкоспециализированные лекарства.
Неконтролируемый, необоснованный прием антибиотиков, когда пациент бросает их пить раньше срока, это может привести к формированию антибиотикоустойчивой флоры и в дальнейшем лечение окажется неэффективным.
Лечение вирусных инфекций
Для многих вирусных инфекций нет специфического лечения. Обычно разрабатывается симптоматическое, направленное на устранение симптомов, снижения температуры. Но все же лечение определяется конкретным вирусом и болезнью, которое он спровоцировал.
При вирусных инфекциях врач назначает противовирусные препараты, которые подавляют жизненный цикл некоторых вирусов.
Ну и главное, стоит помнить, что некоторые серьезные бактериальные и вирусные инфекции можно предотвратить при помощи вакцинации.
Попавшим вместе в бактериальную клетку бактериофагам приходится решать, вступать ли им друг с другом в непримиримую борьбу или же начать сотрудничать.
Бактериофагами называют вирусы, поражающие бактериальные клетки. В целом план строения у них такой же, как у прочих вирусов – это нуклеиновая кислота (чаще всего – ДНК) с записанными в ней генами вируса, заключенная в белковую оболочку-капсид.
Разные вирусы обычно специализируются на разных хозяевах, и бактериофаги – не исключение. Но часто случается так, что в одну и ту же клетку проникают два фага одной разновидности. Что происходит в таком случае? Соперничают ли они, стремясь вытеснить один другого, или же сотрудничают? Исследователи из Техасского университета A&M говорят, что бывает и так, и так, в зависимости от условий, в которых приходится жить бактериофагам.
Эксперименты ставили с кишечной палочкой и бактериофагом лямбда. Чтобы можно было следить за двумя разными фагами и их потомками, их метили четырьмя флуоресцентными метками. Две из них принадлежали белкам вирусной оболочки, и, если в клетке появлялись именно белковые метки, это означало, что фаги спешно собирают готовые частицы.
То есть фагам, оказавшимся вместе в одной клетке, приходилось решать, как жить дальше. Решение во многом зависело от внешних условий: если бактерий вокруг было много, если среда вокруг была благоприятна для роста бактериальной колонии, то вирусы вступали в гонку, стараясь подавить друг друга числом потомков. Преимущество получал тот, кто успел насинтезировать больше ДНК-копий – вирусная ДНК, как мы сказали выше, оттягивает на себя клеточные ресурсы, необходимые для собственного удвоения, поэтому тот, чьей ДНК оказалось больше, лишал ресурсов не только клетку-хозяина, но и конкурента. (Здесь немаловажно, кто когда проникает в клетку – у того, кто сделал это первым, будет определенная фора).
Если же клеток для размножения оказывалось мало, и если сама клетка жила плохо (так, что в ней нельзя было быстро наделать много вирусной ДНК), вирусы вместе укладывались спать. Причем они действительно помогали друг другу, что было видно в экспериментах с мутантными бактериофагами: если в клетку попадали два вируса с плохими мутациями в разных генах, отвечающих за встраивание в чужой геном, то для успешного внедрения они пользовались оставшимися нормальными белками друг друга – иными словами, решали проблему сообща. Будучи вместе, мутантные фаги эффективнее вставляли себя в бактериальный геном, чем если бы они попали в клетку поодиночке.
Такие совместные действия, как пишут авторы работы в Nature Communications, повышают разнообразие вирусного генома: встраиваясь в бактериальную ДНК, их гены перемешиваются, так что в перспективе, когда дело доходит до синтеза вирусных частиц, из таких сотрудничавших в прошлом вирусов могут получиться особи с новым генетическими вариантами. Короче говоря, взаимопомощь в трудные времена увеличивала генетическое разнообразие вирусов, а разнообразие – это всегда хорошо, поскольку повышает шансы на выживание.
В перспективе полученные результаты могут помочь в создании антибактериальных лекарств нового поколения. Как известно, к антибиотикам у микробов быстро появляется устойчивость, и потому сейчас часто говорят о том, чтобы пойти принципиально другим путем – например, начать использовать бактериофаги в качестве противоинфекционного средства, и чем больше мы будем знать о взаимоотношения фагов друг с другом и с бактериями, тем эффективней будут такие препараты.
Читайте также:

