Можно ли делать трансплантацию печени вич инфицированному
Обновлено: 18.04.2024
Согласно новому исследованию, ВИЧ-положительные пациенты с трансплантацией почки и печени могут рассчитывать на хорошие долгосрочные результаты после трансплантации, сравнимые с результатами соответствующих ВИЧ-отрицательных сверстников.
Перед началом работы над исследованием, авторы отметили, что трансплантация почки и трансплантация печени у ВИЧ-позитивных пациентов стали более доступны в США, но данные, касающиеся долгосрочных результатов выживаемости пациентов и трансплантатов, отсутствуют.
Команда обратилась к данным программы трансплантации UCSF, чтобы сравнить долгосрочные результаты 119 ВИЧ-положительных и 655 ВИЧ-отрицательных реципиентов почки и 80 ВИЧ-положительных и 440 ВИЧ-отрицательных реципиентов печени.
Результаты исследования.
В когорте реципиентов почки, через 15 лет после трансплантации выживаемость пациентов составила 53,6% у ВИЧ-положительных и 79,6% у ВИЧ-отрицательных реципиентов, выживаемость трансплантата составила 75,0% и 57,0% соответственно. ВИЧ-инфекция не была связана с ухудшением выживаемости трансплантата (отношение рисков 1,09; 95% ДИ 0,61–1,97).
Исследователи говорят, что снижение долгосрочной выживаемости пациентов среди когорты ВИЧ-положительных реципиентов почки, вероятно, связано с долгосрочными сопутствующими сердечно-сосудистыми заболеваниями, связанными с ВИЧ/СПИДом.
У ВИЧ-положительных реципиентов печени с хотя бы одним эпизодом острого отторжения выживаемость трансплантата составила 52,8% в течение 15 лет по сравнению с 91,8% у реципиентов без острого отторжения.
В когорте реципиентов печени через 15 лет после трансплантации выживаемость пациентов составила 60,3% у ВИЧ-положительных и 65,3% у ВИЧ-отрицательных реципиентов. ВИЧ-инфекция не была статистически значимым предиктором выживаемости пациентов (ОР 1,36; 95% ДИ от 0,83 до 2,24).
Исследование также показало улучшение результатов трансплантаций печени и трансплантации почки с момента появления препаратов прямого действия против вируса гепатита С.
Результаты работы подтверждают возможность трансплантации органов ВИЧ-положительным пациентам, что, по мнению исследовательской группы, является надлежащим использованием ресурсов трансплантации и обеспечивает равный доступ к этим ресурсам для ВИЧ-положительных пациентов.
Исследование не имело коммерческого финансирования, и авторы не сообщают о конфликте интересов.
Согласно новому исследованию ученых из Италии, пересадка печени для лечения гепатоцеллюлярной карциномы – распространенной формы рака печени – поможет улучшить выживаемость у людей, инфицированных ВИЧ.

ВИЧ-инфицированных пациентов можно спасти трансплантацией печени Согласно новому исследованию ученых из Италии, пересадка печени для лечения гепатоцеллюлярной карциномы – распространенной формы рака печени – поможет улучшить выживаемость у людей, инфицированных ВИЧ.
Согласно новому исследованию ученых из Италии, пересадка печени для лечения гепатоцеллюлярной карциномы – распространенной формы рака печени – поможет улучшить выживаемость у людей, инфицированных ВИЧ.
Вирус иммунодефицита человека не влияет на показатели выживаемости и рецидивов рака после трансплантации у ВИЧ–инфицированных пациентов с именно этой формой рака печени. Авторы исследования отметили, что гепатоцеллюлярная карцинома является более агрессивной у людей с ВИЧ, и поэтому становится одной из основных причин смерти среди этих пациентов, хотя антиретровирусная терапия и продлевает их жизнь.
В то же время трансплантация печени является допустимым вариантом для лечения гепатоцеллюлярной карциномы у ВИЧ–инфицированных пациентов. В исследовании специалистов Университета Модены приняли участие 30 ВИЧ–инфицированных пациентов и 125 пациентов, не инфицированных ВИЧ – всем им осуществили трансплантацию печени в связи с гепатоцеллюлярной карциномой в трех разных больницах северной Италии между 2004 и 2009 годами.
За период наблюдения, составивший 32 месяца, исследователи обнаружили рецидив рака печени у 6,7 % пациентов с ВИЧ и 14,4 % пациентов, которые не были ВИЧ–положительными. Исследование также показало, что выживаемость была одинакова для всех пациентов , как через 1 год после операции, так и через 3 года после операции. До трансплантации ВИЧ–инфицированные пациенты получали антиретровирусную терапию. Терапия не возобновлялась, пока на стабилизировалась после операции функции печени. Несмотря на это, ни у одного из ВИЧ–положительных пациентов не развился СПИД во время периода наблюдения.
Смотри также
Глобальный систематический обзор и мета-анализ ДКП при ВИЧ-инфекции
Балансировка риска в разработке клинических исследований по лечению ВИЧ-инфекции
Трансплантация или пересадка печени – частичная или полная замена пораженного органа реципиента (больного) здоровым донорским органом. Сегодня пересадка проводится как от мертвых, так и от живых доноров на платной или бесплатной основе.

Показания к пересадке
Трансплантация печени – радикальная мера, её назначают, когда терапевтическое лечение неэффективно.
Основные показания занесены в список национальных клинических рекомендаций:
- Рак печени. В сравнении с удалением опухоли, замена пораженного органа повышает выживаемость.
- Поликистоз. Множественное образование полостей с мертвыми клетками или жидкостью заменяет здоровую ткань, приводит к дисфункции органа. Если кисты вызваны вирусом, пересадка неэффективна.
- Муковисцидоз. Наследственное нарушение транспорта желчи, что приводит к замене желчных протоков соединительной тканью, атрофии печени и желчного пузыря.
- Печеночная недостаточность из-за отравления.
- Цирроз. Замена тканей печени фиброзной (прочной, неэластичной) соединительной тканью при гепатите С или из-за злоупотребления алкоголем. При циррозе не всегда разрешена пересадка, зависит от причины болезни.
- Билиарная атрезия – отсутствие или непроходимость желчных протоков у новорожденных. Основная причина детской трансплантации.
- Нарушение метаболизма. Заболевание Вильсона-Коновалова – накопление меди, атрофия тканей печени. Гемохроматоз – нарушение обмена железа, приводящее к дисфункции органа.
Донор печени
Донор печени – это человек, чей орган пересаживают живому, нуждающемуся пациенту. Выступить донором может живой или мертвый. В обоих случаях, помимо здоровой печени, не должно быть повреждений почек или желчных протоков.
От живого человека можно пересадить только часть железы, основные требования к донору:
- Возраст от 18, минимальный вес — 50 кг. Отсутствие беременности, если донор женщина.
- Желательно кровное родство до 4 колена включительно. Сюда входят внучатые племянники, бабушки, дедушки, тёти, дяди.
- Совместимость по группе крови. Желательно, по резус-фактору и тканевой принадлежности. Совместимость по всем параметрам даёт больше шансов на выздоровление.
- Отсутствие вирусных инфекций, перенесенных онкологических заболеваний и общее здоровье организма. Подтверждается анализами.
- Размер железы донора подходит по габаритам реципиенту.
Приоритет в трансплантации отдается печени от родственника. Орган приживется с большей вероятностью, и восстановление пройдет быстрее, так как на психологическом уровне такая пересадка переносится легче. Дополнительные преимущества – это сроки, трупную печень можно ждать до 2 лет.
От родного человека пересаживают левую часть печени: она больше по размерам и её легче изъять. Ребенку до 15 лет хватит половины этой части.
Мертвый донор – чаще это человек, умерший из-за черепно-мозговой травмы. Допустимый возраст от 2 месяцев до 55 лет. После смерти мозга, при совместимости с живым пациентом по группе крови и тканевой основе, орган изымают, помещают в стерильный контейнер и пересаживают не позже чем через 13-16 часов.
Для использования органов недавно умершего человека необходимо его прижизненное согласие на пересадку или разрешение родственников. Печень от мертвого донора можно пересадить сразу 2 пациентам: левую (большую) часть – взрослым, правую (меньшую) — детям.
Подготовка к операции
Перед пересадкой в клинике пациент проходит полное обследование, включающее в себя:
- Анализ крови на резус-фактор и группу.
- Томография брюшной полости.
- Серологический анализ на выявление ВИЧ, бруцеллеза, ЗППП или иных вирусных инфекций.
- УЗИ печени.
- Проба Манту.
- Электрокардиография.
- Заключение стоматолога.
- Заключение гинеколога.
- Сбор крови на случай обширного кровотечения во время ходе операции.
В течение полугода до операции (если она несрочная) пациент посещает нарколога и психиатра, придерживается здоровой диеты, ни в коем случае не употребляет алкоголь или табак.
В качестве предварительной медикаментозной подготовки прописывают:
- антигистаминные препараты – для предотвращения аллергических реакций;
- седативные препараты – для уменьшения эмоционального напряжения;
- препараты, снижающие артериальное давление;
- иммунодепрессанты – чтобы во время или сразу после операции организм не отторгнул орган, как чужеродное тело.
Как проходит ортотопическая трансплантация
Ортотопическая трансплантация печени – полное замещение органа реципиента на здоровый донорский орган или его часть. Пересадку выполняют хирург, гепатолог и анестезиолог, в особых случаях приглашают кардиолога и пульмонолога.

Операция по пересадке проходит в 3 этапа:
- Гепатэктомия – удаление собственной печени реципиента, длится от 2 до 4 часов. Если в ходе болезни орган утратил свою анатомическую конфигурацию или удалению предшествовали другие операции на печени, например, попытка желчеотведения при атрезии у детей, этап может затянуться. После удаления печени хирург сшивает сосуды и формирует обходной путь для венозной крови.
- Имплантация донорского органа и реваскуляризация (восстановление кровообращения) трансплантата. На этом этапе сосуды соединяют с новой печенью, проверяют состояние и цвет желчи.
- Восстановление желчных протоков. Печень пересаживают без желчного пузыря, после трансплантации хирург сшивает места соединения сосудов желчных протоков, дренирует открытую рану и зашивает полость.
Скорость операции зависит от координации бригад врачей: тех, кто изымает донорскую печень и тех, кто помещает её в организм пациента. Если донор и реципиент находятся в одной больнице, всю процедуру может проделать одна бригада. Операция длится от 12 до 20 часов.
Жизнь после операции
После успешной трансплантации пациента переводят в реанимацию на 3-7 дней.
Медикаментозная терапия после пересадки органа:
- Циклоспорин. Назначают курс иммуносупрессоров – препаратов для снижения действия антител на новый орган. Возможен пероральный прием до операции, после пересадки дозы вводят внутривенно около 7-10 дней.
- Метилпреднизолон и Азатиоприн. В случаях слабого функционирования почек.
- Такролимус. Назначают при отторжении печени.
Кровь регулярно проверяют на концентрацию лекарств. Если осложнений нет, пациента отпускают домой через 7-14 дней и назначают прием лекарств перорально.
Важно! Риск отторжения нового органа может остаться на всю жизнь, поэтому имунносупрессивную терапию продолжают не менее 5 лет.
Год после первой пересадки пациент придерживается диеты, чтобы уменьшить нагрузку на печень.
В список разрешенных продуктов входят:
- мясо на пару;
- овощи: свёкла, морковь, капуста, сладкий перец, тыква;
- фрукты: чернослив, виноград, яблоки;
- супы на овощном бульоне;
- овсянка, гречка и рис;
- ржаной хлеб.
В течение всего восстановления запрещается употреблять соленую, сладкую, жареную, острую пищу, жирные молочные продукты, алкоголь.
Важно! В 70% случаев после хорошо перенесенной операции, пациент будет жить более 5 лет. 87% детей восстанавливаются и нормально развиваются как физически, так и психологически.
Возможные осложнения
Осложнения после операции могут проявиться как у донора, так и у пациента.
Тяжелые последствия для донора
Внутреннее кровотечение или инфекция возникают менее чем в 1% случаев, они связаны с неаккуратной техникой забора органа. Уже через полгода печень восстановится до 85% начального объема.
Для реципиента
Помимо риска отторжения, возможны осложнения на протяжении от 1 до 26 недели после операции:
- 1-4 неделя: осложнения почечной, дыхательной и нервной систем, тромбоз печеночной артерии.
- 5-12 недели: вирусный гепатит С или гематит от CMV (из-за подавления иммунной системы).
- 13-26 недели: желчеистечение, клеточное отторжение, медикаментозный гепатит, рецидив исходного заболевания и тромбоз воротной вены.
Противопоказания к трансплантации
| Абсолютные | Относительные |
| 1. Активные, неизлечимый инфекционные заболевания (вирусный гепатит, туберкулез, ВИЧ). |
2. Онкология на стадии метастаза.
3. Неоперабельные нарушения внутренних органов: сердечная, дыхательная, почечная недостаточность.
4. Инфекции, локализованные в других органах.
2. Наличие ранних операций на органы брюшной полости.
3. Тромбоз воротной и брыжеечной вен.
4. Возраст более 60 лет.
5. Удаленная селезенка.
Где делают трансплантацию и сколько стоит?
Пересадку печени в России делают в институтах трансплантологии в Москве и Санкт-Петербурге, стоимость платной операции варьируется от 2,5 до 3 млн. рублей.

Важно! Официально граждане могут получить квоту на бесплатную пересадку. Однако тогда придется ждать очереди на сдачу анализов и саму операцию не менее года (если болезнь не смертельна). Ежегодно Минздравом выделяется ограниченное количество бесплатных трансплантаций, приоритет отдается тем, кто без донора не выживет.
Центры трансплантологии существуют по всему миру, больше всего операций проводят США, Германия, Израиль и Южная Корея. Средняя цена трансплантации в этих странах — 160-200 тыс. евро.
Строгая диета, употребление лекарств и регулярные обследования в трансплантологии – цена за здоровую печень и долгую жизнь. Не всегда можно дождаться операции по квоте, если есть шанс, лучше делать пересадку платно, чтобы не потерять драгоценные месяцы или годы здоровья.
Центры пересадки печени по всему миру сталкиваются с огромным дефицитом органов для пациентов в листе ожидания. Рассматриваются различные типы инноваций для расширения этого пула доноров. В данной статье рассмотрен вопрос трансплантации органов от доноров с гепатитом В.
Введение
Трансплантация печени является окончательным методом лечения прогрессирующих или декомпенсированных заболеваний печени. Трансплантация дает пациентам разумные шансы улучшить качество их жизни, а также возможность снова стать полноценными членами общества.
По данным UNOS за прошлый год выполнен 8082 операции по пересадке печени. 367 из них были родственными трансплантациями, а в остальных случаях использовались органы от посмертных доноров.
В то же время, в листе ожидания печени по данным UNOS находится 14232 человека. За последние 10 лет количество донаций оставалось низким. В 2017 году около 10% пациентов в листе ожидания были исключены, поскольку они стали слишком тяжелыми по соматическому статусу для выполнения трансплантации. Еще 10% умерли, ожидая появления органа.
Программы трансплантации во всех клиниках рассматривают новаторские способы увеличения пула донорских органов. Более активно стала проводится трансплантация фрагментов печени от живых доноров, также используется SPLIT-трансплантация печени от посмертного донора. Однако этих мер остаётся недостаточно, поэтому приходится увеличивать пул доноров за счёт расширенных критериев.
Так, например, в последние годы в мире практикуют изъятие печени у пациентов после сердечной смерти, печени с жировой дистрофией, органы доноров старше 50 лет.
В некоторых случаях трансплантацию печени проводят от доноров с положительным маркёром антител к гепатиту B (анти-HBc +). Такие органы использовались для ортотопической трансплантации печени с начала программ трансплантации печени, и считались органами с высоким риском. Положительный анти-HBs может свидетельствовать о прошлом воздействии инфекции HBV, ранней или разрешающей инфекции (если IgM положительный). В некоторых случаях он представляет собой ложноположительную реакцию антител. У реципиентов на фоне приёма препаратов иммуносупрессии может в последствии выявляться HBsAg.
Таблица 1. Интерпретация различных серологических маркёров HBV.
| HBV маркёр | Интерпретация |
|---|---|
| HBsAg | Текущая инфекция (острая или хроническая). |
| Anti-HBc | IgM указывает на острую инфекцию или реактивацию IgG гепатита В. |
| Anti-HBs | Показатель прошедшей инфекции или иммунизации. |
| HBeAg | Указывает на активную репликацию вируса (репликативная стадия). |
| Anti-HBe | Нерепликативная стадия или хроническая инфекция HBV. |
Доноры с положительным Anti-HBs антигеном.
Во всем мире насчитывается около 257 миллионов человек, хронически инфицированных гепатитом B (определяется как положительный HBsAg). Сообщалось, что в США распространенность инфекции HBV составляла 0,4% (приблизительно 800 000 жителей США). Исследования NHANES (National Health and Nutrition Examination Survey) свидетельствуют о том, что распространенность HBsAg-положительных пациентов в США составляет 0,30%.
По данным UNOS доля анти-HBc + органов была увеличена с 1,8% с 1994 года до 6% к 2006 году (рисунок 1).
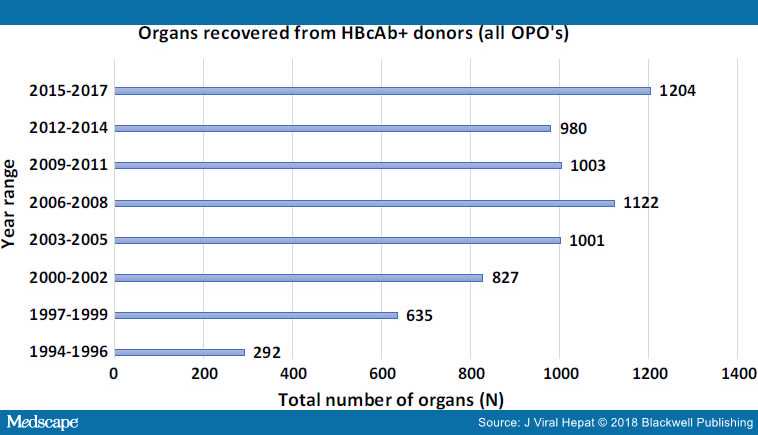
Рисунок 1. Количество органов, пересаженных от HBs-Ag+ доноров.
Безопасно ли это?
Dickson и соавторы изучили 1109 пациентов в четырех центрах и показали, что скорость передачи HBV была очень высокой, когда анти-HBc + органы использовались для пересадки HBV-отрицательным реципиентам, если профилактика гепатита В не проводилась после трансплантации (78 % против 0,5%).
Uemto и его коллеги впервые продемонстрировали (период исследования с 1990 по 1996 год), что можно безопасно использовать анти-HBc + органы, если анти-HB иммуноглобулин использовался для профилактики.
Dodson и соавторы изучали комбинацию применения иммуноглобулина anti-HB и Ламивудина для профилактики Гепатита В de-novo, и сообщали в 1999 году, что ни у одного из 8 пациентов, получавших комбинированную профилактику, не было Гепатита В de-novo в течение среднего времени наблюдения (459 дней). Два исследования с 2001 по 2006 год с небольшим количеством пациентов с использованием монотерапии ламивудином показали 0% случаев развития Гепатита В de-novo.
Текущие протоколы лечения и профилактики Гепатита В de-novo варьируются от центра к центру и включают в себя различные продолжительности введения анти-HB иммуноглобулина (HBIG) и использование аналогов нуклезидов, таких как ламивудин, а в последнее время — энтекавир и тенофовир. В центрах, где используется HBIG, нагрузочная доза вводится интраоперационно во время безпеченочной фазы, а затем назначается поддерживающая терапия, чтобы уровень HBIG достигал от 100-200 МЕ / л. Данная терапия проводится от 6 месяцев до пожизненного применения. Недавний метаанализ, который выполнили Wang и соавт. в 2014 году, рассматривающий девятнадцать исследований с 1484 пациентами, показал, что HBIG необходим для уменьшения развития Гепатита В de-novo в посттрансплантационном периоде у пациентов с виремией. В той же работе было показано, что 1-летняя, 3-летняя и 5-летняя выживаемость у пациентов, которые принимали противовирусную терапию перорально составила 97; 87 и 75% соответственно.
Более недавнее исследование, проведенное Shen и соавт., сравнивало комбинацию HBIG с ламивудином или энтекавиром и показало, что последняя комбинация имела улучшенную выживаемость в течение 1, 3 и 5 лет (86,2% против 94,4%, 76,9% против 86,6%, 73,7 % против 82,4%, соответственно, P <0,001).
Результаты трансплантации анти-HВc — положительных органов
В нескольких исследованиях были рассмотрены результаты таких трансплантаций. 30-дневная, 1-летняя и 5-летняя выживаемость пациентов 92% (против 96%), 74% (против 89%) и 74% (против 76%) по сравнению с пациентами, которым проведена трансплантация печени от анти-HBc-отрицательных доноров.
Выживаемость трансплантата в том же исследовании была отмечена как 92% против 94%, 74% против 86% и 65% против 73% (рассмотрены две группы: реципиенты, с органом от донора с анти-HBc + и реципиенты, получившие орган от донора с отрицательным анти-HBc). Также, в исследовании рципиенты с анти-HBc + органами имели более высокий показатель MELD, чем контрольная группа.
На рисунках 2, 3 и 4 показано, что использование этих органов растет. Также показана выживаемость трансплантата и пациента на основе статистики, запрошенной авторами из базы данных UNOS.
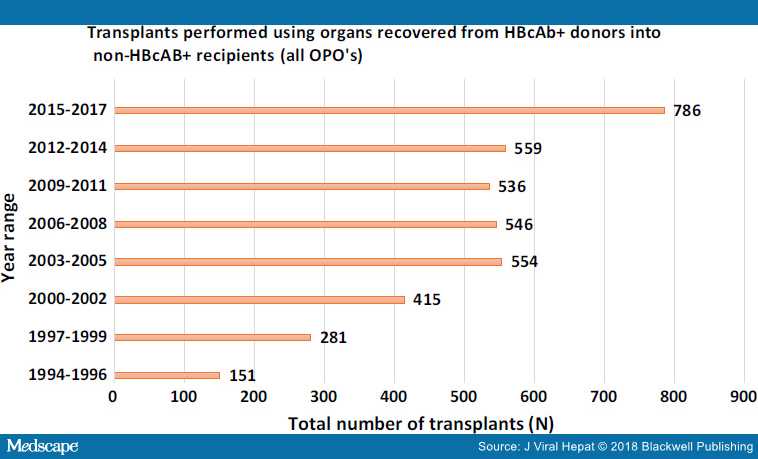
Рисунок 2. Количество трансплантаций, году доноры были с положительным анти-HBc (база данных UNOS).
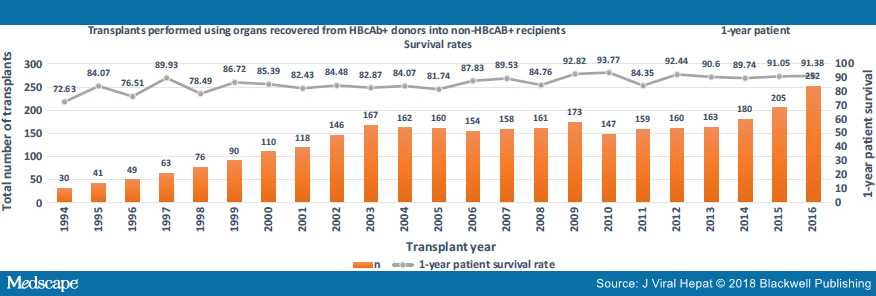
Рисунок 3. Выживание трансплантата с использованием анти-HBc + органов (база данных UNOS)
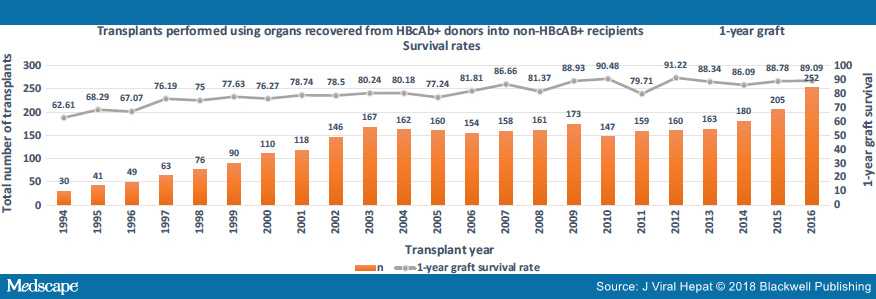
Рисунок 4. Выживание пациентов с использованием анти-HBc + органов (база данных UNOS)
Этично ли использовать такие органы?
Обсудив полезность и безопасность использования анти-HBc + органов, мы можем теперь сосредоточить наше внимание на том, соответствует ли практика использования таких органов стандартам медицинской этики. Четыре основных принципа, которые учитываются при оценке процедуры:
Принцип автономии.
Принцип автономии определяется как право пациента на полную независимость в принятии медицинских решений.
Пациент должен иметь полную информацию о различных доступных вариантах лечения, о рисках и преимуществах этих вариантов лечения и о результатах лечения. Как отмечено выше, органы против HBc + классифицируются как органы повышенного риска. UNOS изложило свою политику в отношении использования органов, связанных с повышенным риском передачи инфекций, и в этой связи предусмотрено специальное информированное согласие.
Исследователи считают, что необходимо получить специальное согласие у пациента, если он выбрал орган с высоким риском передачи инфекций. Поэтому, по мнению авторов, что в этом отношении соблюдается принцип автономии.
Принцип благодеяния.
Даный принцип относится к концепции делать добро для пациента. Пациенты в списке ожидания декомпенсируются и в силу этого увеличивается их смертность. Предлагая им возможность трансплантации печени, врачи могут устранить причину их заболеваемости, снизить их смертность и значительно улучшить качество жизни. В соответствии с этим стандартом использование анти-HBc + органов для успешной трансплантации выполняет принцип благодеяния.
Принцип невмешательства.
Данный принцип призывает не причинять вреда пациенту. Хотя органы анти-HBc + потенциально могут вызывать гепатит B у реципиентов, имеются много данных, как показано выше, показывающие, что при использовании соответствующих лекарств вирус гепатита B может оставаться бездействующим и вероятность получить активный гепатит В крайне мала.
Центры трансплантации, которые приняли практику использования анти-HBc + органов, включили профилактику HBV как часть протокола лечения после трансплантации. Несмотря на то, что данные протоколы варьируется от центра к центру, адекватное подавление вируса включается в лечение, чтобы гарантировать, что гепатит B не выявится у таких пациентов.
Исходя из вышеперечисленного, использование анти-HBc + органов не ставит реципиентов на неоправданный риск и соответствует определению критерия невмешательства.
Принцип справедливости.
Органы должника справедливо распределяться между реципиентами, исходя из того, как долго они находятся в листе ожидания (очередь). Соответственно, если приходит очередь конкретного пациента, и он согласен получить орган от анти-НВс + донора, то он может получить его. В противном случае, этот реципиент будет ждать орган от потециально не опасного донора.
Исходя из вышеперечисленного, принцип справедливости будет соблюден.
Выводы.
Использование анти-HBc + органов для трансплантации печени не является новым методом. Текущий опыт трансплантации таких органов существует более 25 лет. Существует множество исследований, которые показывают безопасность и эффективность использования таких органов.
В эпоху, когда существует мощная терапия, способная подавлять вирусный гепатит В, можно считать расточительсвом не использования подобного пула доноров. Посттрансплантационная терапия сейчас развилась до такой степени, что эти органы можно безопасно использовать и позволить пациентам с декомпенсированным циррозом вернуться в состояние относительного здоровья и принести пользу обществу в целом. Следующей границей в лечении гепатита B является разработка лекарств и методов лечения, которые обеспечивают функциональное лечение активной репликативной инфекции в значительной степени. Когда эти успехи будут реализованы, использование HBsAg-положительных органов станет возможностью, которая еще увеличит доступность органов и расширит пул доноров.
Читайте также:

