Можно ли вылечить вирусный цирроз печени
Обновлено: 18.04.2024
В статье представлены наиболее важные заключения рабочего совещания Baveno VI по использованию инвазивных и неинвазивных методов диагностики и наблюдения пациентов с портальной гипертензией, профилактике декомпенсации, помощи при кровотечении, профилактик
Strategy of conducting patients with portal hypertension syndrome against the background of cirrhosis (according to materials of Baveno VI consensus, 2015)
The article highlights the most important conclusions of the working meeting of Baveno VI on use of invasive and non-invasive diagnostic methods and observation of patients with portal hypertension, prevention of decompensation, help in bleeding, prevention of complications.
Портальная гипертензия (ПГ) — гемодинамическое нарушение, связанное с наиболее тяжелыми осложнениями цирроза печени, включающими асцит, печеночную энцефалопатию и кровотечения из варикозно расширенных вен пищевода/желудка. Оценка диагностических подходов, дизайн и проведение надлежащих клинических исследований в лечении ПГ всегда были трудной задачей. Понимание этих трудностей обусловило проведение ряда встреч по консенсусу. Первая из них была организована A. Burroughs в городе Гронинген в 1986 г. [1]. За этой встречей последовал ряд других: в 1990 г. в городе Бавено (Италия) (Baveno I) [2], в 1995 году вновь в Бавено (Baveno II) [3, 4], в 1992 г. в Милане (Италия) [5], в 1996 г. в Рестоне (США) [6], в 2000 г. в Стрезе (Италия) (Baveno III) [7, 8], в 2005 г. в Бавено (Италия) (Baveno IV) [9, 10], в 2007 г. в Атланте [11], в 2010 г. в Стрезе (Италия) (Baveno V) [12, 13]. Цель встреч — анализ доказательств по течению синдрома портальной гипертензии и разработка рекомендации по ведению данной категории пациентов. Оценка уровня доказательств и рекомендации ранжированы согласно Оксфордской системе [14].
Скрининг на наличие портальной гипертензии
Критерии, позволяющие врачу заподозрить ХВКЗП
- Обнаружение при эластографии повышения плотности печени достаточно, чтобы заподозрить ХВКЗП у лиц без симптомов, но при наличии известных факторов хронического поражения печени; эластография часто дает ложноположительные результаты, поэтому ее рекомендуется выполнять дважды в разные дни в состоянии натощак (5; D).
- Значение эластографии менее 10 kPa при отсутствии других клинических признаков исключает наличие ХВКЗП, значения от 10 до 15 kPa позволяют заподозрить наличие ХВКЗП, однако требуют дальнейших обследований; значения более 15 kPa с большой степенью вероятности указывают на наличие ХВКЗП.
Критерии, позволяющие подтвердить ХВКЗП
- Биопсия печени с обнаружением выраженного фиброза или сформировавшегося цирроза (1b; A); определение относительной площади, занимаемой коллагеном, в печеночном биоптате позволяет количественно оценить выраженность фиброза и имеет прогностическое значение (2b; B).
- Эндоскопия верхних отделов желудочно-кишечного тракта: обнаружение варикозно расширенных вен (1b; A).
- Измерение печеночного венозного градиента давления (Hepatic venous pressure gradient — HVPG). Величина его более 5 мм рт. ст. указывает на синусоидальную портальную гипертензию (1b; A).
Диагностика клинически выраженной портальной гипертензии (КВПГ)
- У пациентов без признаков клинически выраженной портальной гипертензии нет варикозно расширенных вен пищевода/желудка (ВРВПЖ) и риск их развития в течение 5 лет низок (1b; A); измерение HVPG является золотым стандартом диагностики, при повышении этого показателя ≥ 10 мм рт. ст. (1b; A) ставят диагноз клинически выраженной портальной гипертензии.
- У больных с ХВКЗП вирусной этиологии достаточно использовать неинвазивные методики для определения группы риска по наличию КВПГ (пациентов, у кого высока вероятность обнаружения эндоскопических признаков портальной гипертензии). Для этой цели может быть использовано: определение плотности печени по данным эластографии, с подсчетом числа тромбоцитов и определением размеров селезенки. (Риск КВПГ высок при эластографии ≥ 20–25 кРа при как минимум двух определениях в разные дни в состоянии натощак. Следует быть внимательным при резких повышениях уровня АЛТ. Необходимо обратиться к рекомендациям Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) для правильной интерпретации критериев.)
- При заболевании печени другой этиологии значение величины эластографии для диагностики КВПГ подлежит уточнению (5; D).
- Методы визуализации, указывающие на наличие коллатерального кровотока, являются достаточными для подтверждения наличия КВПГ у больных ХВКЗП любой этиологии (2b; B).
Выявление пациентов с ХВКЗП, у которых можно избежать необходимости проведения эндоскопии с целью скрининга
- У больных с показателем эластографии менее 20 кРа и числом тромбоцитов более 150 000 риск наличия варикозных вен, требующих лечения, очень низок, и у таких пациентов можно избежать проведения эндоскопии (1b; A). Таких пациентов можно наблюдать, определяя им показатель эластографии и уровень тромбоцитов крови ежегодно (5; D).
- При увеличении плотности печени или снижении числа тромбоцитов пациентам необходимо проведение эзофагогастродуоденоскопии (ЭГДС) с целью скрининга (5; D).
Динамическое наблюдение пациентов с варикозным расширением вен пищевода/желудка
- У компенсированных больных при отсутствии признаков ВРВПЖ при скрининг-эндоскопии и с продолжающимся повреждением печени (прием алкоголя, отсутствие устойчивого вирусологического ответа при гепатите С) необходимо проведение ЭГДС с целью динамического наблюдения 1 раз в 2 года (5; D).
- У компенсированных больных с небольшим расширением вен и продолжающимся повреждением печени (прием алкоголя, отсутствие устойчивого вирусологического ответа при гепатите С) необходимо проведение ЭГДС с целью динамического наблюдения 1 раз в год (5; D).
- У компенсированных больных при отсутствии признаков ВРВПЖ при скрининг-эндоскопии, у которых этиологический фактор был удален (наличие устойчивого вирусологического ответа при гепатите С, длительная абстиненция у алкоголиков) и у которых нет ко-факторов (например, ожирения), ЭГДС с целью динамического наблюдения необходимо проводить 1 раз в 3 года (5; D).
- У компенсированных больных с небольшим расширением вен, у которых этиологический фактор был удален (достигнут устойчивый вирусологический ответ при гепатите С, длительная абстиненция у алкоголиков) и у кого нет ко-факторов (например, ожирения) необходимо проведение ЭГДС с целью динамического наблюдения 1 раз в 2 года (5; D).
Из-за разного прогноза пациенты с компенсированным циррозом должны быть разделены на тех, у кого есть признаки КВПГ, и тех, у кого их нет (1b; A). Цель лечения в первой подгруппе — профилактика развития КВПГ, а во второй — профилактика декомпенсации.
Профилактика развития КВПГ
- Изменение HVPG является приемлемым суррогатным маркером клинического исхода у больных с нехолестатическим циррозом (2b; B), значимым считается изменение HVPG на 10% и более (1b; A); этиотропное лечение может привести к уменьшению портальной гипертензии и предотвратить развитие осложнений у больных с сформировавшимся циррозом (1b; A); ожирение ухудшает естественное течение компенсированного цирроза любой этиологии (1b; A); алкогольная абстиненция должна поощряться у всех больных циррозом вне зависимости от его этиологии (2b; B); применение статинов является перспективным и должно быть изучено в клинических исследованиях III фазы (1b; A).
Профилактика декомпенсации
- Воздействие на этиологический фактор при хроническом заболевании печени может привести к улучшению структуры и функции печени, что в свою очередь снизит величину HVPG (1b; A).
- Сопутствующие заболевания (ожирение, диабет, рак, остеопороз, легочные, почечные и сердечно-сосудистые заболевания) часто встречаются у больных компенсированным циррозом печени; некоторые из них могут внести свой вклад в развитие декомпенсации, другие являются следствием болезни печени (2b; B).
- Недостаточность питания и дефицит мышечной массы оказывают влияние на выживаемость больных циррозом (1b; A).
- Пациенты с небольшим варикозным расширением вен с красными рубчиками или с классом С по Child Pugh имеют повышенный риск развития кровотечения (1b; A) и должны получать неселективные бета-блокаторы (НСББ) (5; D).
- Пациенты с небольшим варикозным расширением вен без признаков повышенного риска кровотечений могут получать лечение НСББ с целью профилактики кровотечений (1b; A).
- Рекомендуется применение НСББ или эндоскопическое лигирование сосудов с целью профилактики первого кровотечения из варикозных вен среднего и большого размера (1b; A).
- Выбор терапии должен быть основан на локальных возможностях, наличии опыта, предпочтениях и особенностях пациента, наличии противопоказаний и возможности нежелательных явлений (5; D).
- Традиционные НСББ (пропранолол, надолол) (1а; A) и карведилол (1b; A) являются надежными средствами первой линии.
- Карведилол более эффективен, чем традиционные НСББ, в снижении HVPG (1а; A), однако прямых сравнительных исследований этого препарата с НСББ не проводилось.
- Решение о применении бета-блокаторов должно быть основано на показаниях, независимо от того, есть ли возможность измерения HVPG или нет (1b; A).
- Снижение HVPG по меньшей мере на 10% от исходного или до < 12 мм рт. ст. после продолжительной терапии НСББ имеет клиническое значение в плане первичной профилактики кровотечения (1b; A).
Применение НСББ у больных с терминальной стадией болезней печени
- Безопасность применения НСББ в подгруппах больных с терминальной стадией болезни (рефрактерный асцит и/или спонтанный бактериальный перитонит) подвергнута сомнению (2b; B).
- НСББ могут не быть противопоказаны, если такая терапия проводится впервые. Ее следует мониторировать на фоне эволюции заболевания (5; D).
- Тщательное наблюдение необходимо за пациентами с рефрактерным асцитом. Следует иметь в виду уменьшение дозы или полную отмену при снижении артериального давления (АД) или нарушении функции почек (4; С).
- При отмене НСББ необходимо выполнить процедуру эндоскопического лигирования (5; D).
Ведение больных с острым кровотечением
Цель реанимационных мероприятий — сохранить перфузию тканей, инициировать восстановление объема циркулирующей крови для стабилизации гемодинамики.
- Трансфузии эритроцитарной массы следует проводить осторожно при достижении целевого уровня гемоглобина крови в 7–8 г/дл, хотя тактика трансфузий у каждого пациента должна учитывать иные факторы, такие как: сердечно-сосудистые заболевания, возраст, гемодинамический статус и возможность продолжающегося кровотечения (1 b; A).
- На основании имеющихся на данный момент сведений нельзя дать рекомендаций по лечению коагулопатии и тромбоцитопении (5; D); протромбиновое время и международное нормализованное отношение не являются надежными индикаторами состояния коагуляции у больных циррозом (1b; A).
Антибиотикопрофилактика
- Антибиотикопрофилактика является неотъемлемой частью лечения больных циррозом печени и кровотечением из верхних отделов желудочно-кишечного тракта и должна быть начата сразу при поступлении пациента (1а; A).
- Риск бактериальной инфекции и смертности очень низок у больных с циррозом в стадии А по Чайлду–Пью (2b; B), однако необходимо больше проспективных исследований для оценки того, насколько необходима антибиотикопрофилактика в этой подгруппе пациентов.
- При выборе препарата первой линии для проведения антибиотикопрофилактики при остром кровотечении из варикозно расширенных вен необходимо учитывать индивидуальные факторы риска каждого пациента и локальную картину резистентности к антибиотикам в каждом центре (5; D).
- Цефтриаксон внутривенно в дозе 1 г/24 часа (1b; A) рекомендован при выраженном циррозе печени (1b; A) при нахождении пациента в стационаре, где преобладают хинолон-резистентные инфекции, а также у больных, которым ранее проводилась профилактика хинолонами (5; D).
Профилактика печеночной энцефалопатии
Профилактика повторных кровотечений из варикозных вен
- Терапия первой линии для всех пациентов — комбинация НСББ (пропранолол или надолол) и эндоскопического лигирования вен (1а; A).
- Эндоскопическое лигирование вен не следует использовать изолированно, за исключением тех случаев, когда имеются противопоказания к НСББ (1а; A).
- При циррозе печени монотерапию НСББ следует применять у пациентов, которые не хотят проведения лигирования, либо у которых эта процедура неосуществима (1а; A).
- При неудаче первой линии терапии (НСББ + лигирование) методом выбора является наложение ТВПСШ с использованием стентов с покрытием (2b; B).
- Так как нет сравнительных исследований карведилола с современными стандартами лечения, его использование не может быть рекомендовано в профилактике повторных кровотечений (5; D).
Вторичная профилактика у пациентов с рефрактерным асцитом
- У больных циррозом и рефрактерным асцитом [16] НСББ (пропранолол, надолол) следует использовать с осторожностью и при тщательном мониторировании уровня АД, натрия и креатинина сыворотки (4; С).
- До появления результатов рандомизированных исследований доза НСББ должна быть уменьшена, либо эти препараты следует отменить, если у пациента с рефрактерным асцитом развилось одно из следующих осложнений (5; D):
1) снижение САД до уровня менее 90 мм рт. ст.;
2) гипонатриемия < 130 мэкв/л;
3) появились признаки острой почечной патологии [17] (подразумевается, что другие препараты, могущие вызвать эти явления (например, НПВП, диуретики) были отменены). - Последствия отмены НСББ в плане вторичной профилактики неизвестны.
- Если перечисленные явления были спровоцированы каким-либо конкретным фактором (например, спонтанным бактериальным перитонитом, кровотечением), возобновление лечения НСББ возможно лишь после того, как перечисленные параметры вернутся к исходному уровню после прекращения действия провоцирующего фактора (5; D).
- При возобновлении терапии НСББ следует вновь титровать дозу начиная с минимальной ее величины (5; D).
- Если у пациента сохраняется непереносимость НСББ и он является подходящим кандидатом на проведение ТВПСШ, следует осуществить эту методику с использованием стентов с покрытием (5; D).
В заключение следует подчеркнуть, что в России, как и в других странах, с учетом сложившейся эпидемиологической ситуации и особенностей системы здравоохранения разработаны свои национальные рекомендации по ведению пациентов с циррозом печени. Обзор международных рекомендаций, ознакомление с международной практикой ведения больных позволит не только сравнить методические подходы, но и полнее использовать резервы отечественного здравоохранения по оказанию помощи данной категории пациентов. Трансплантация печени была и остается наиболее эффективным методом лечения больных с терминальной стадией. Согласно национальным рекомендациям, пациенты с циррозом печени должны быть направлены на трансплантацию печени в следующих случаях: при развитии печеночно-клеточной недостаточности (шкала Чайлда–Тюркотта–Пью ≥ 7 и MELD ≥ 15); первого серьезного осложнения (асцит, кровотечение из варикозно расширенных вен пищевода, печеночной энцефалопатии); гепаторенального синдрома I типа (рекомендуется направлять таких пациентов на трансплантацию немедленно), гепатопульмонального синдрома. После трансплантации выживаемость реципиентов в течение года достигает 90%, пятилетняя — 75%, десятилетняя — 60%, двадцатилетняя — 40% [18].
Литература
Е. А. Лялюкова, доктор медицинских наук, профессор
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
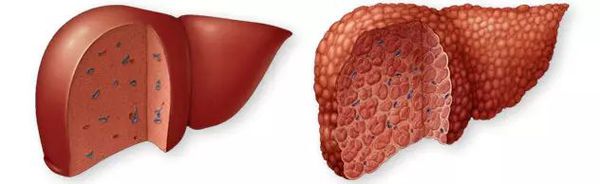
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
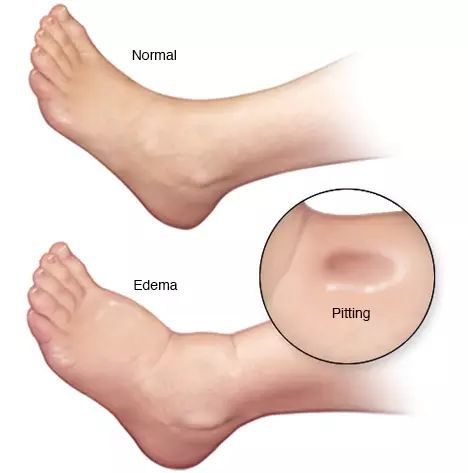
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
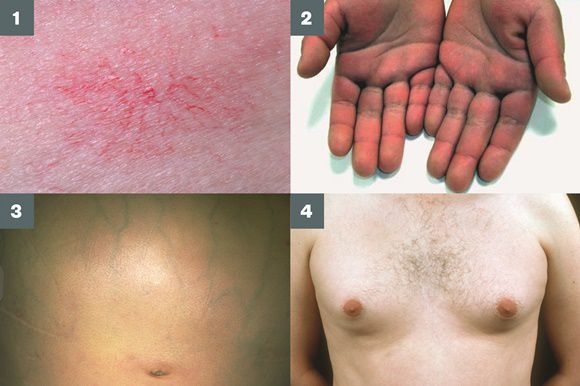
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Цирроз печени – хроническая болезнь, обусловленная патологической заменой паренхиматозной ткани, из которой в норме состоит структура печени, фиброзной соединительной или стромой. Результат – нарушение кровообращения в органе и ухудшение его функционирования, приводящий к сбоям в работе всего организма.

Статистические данные
Цирроз – одна из распространенных причин смертности в возрасте 30-60 лет. От этого заболевания в мире каждый год умирает порядка 300 тысяч человек, что составляет 14-30 случаев на 100 тысяч смертей.
С каждым годом частота летальных исходов стремительно растет, за последнее десятилетие смертность возросла на 12%. Бессимптомно заболевание протекает у 12% людей, имеющих алкогольную зависимость. Примерно в 20% случаев о том, что человек страдал от данного заболевания, удается узнать лишь после его гибели.

У мужчин цирроз встречается в три раза чаще, чем у женщин, в большинстве случаев после 40 лет (хотя развиться может вы любом возрасте).
Как проявляется цирроз: первые признаки
Не всегда удается вовремя обнаружить признаки заболевания, ведь зачастую цирроз протекает незаметно. Но к ранним симптомам относятся:
- Временные боли в области правого подреберья, усиливающиеся при выполнении физических нагрузок. Также боль в этом участке тела может возникать после приема жареной или жирной пищи, алкогольных напитков.

В большинстве случаев цирроз протекает остро, поэтому не всегда удается диагностировать его на ранних стадиях.
Прогрессирование заболевания и новые признаки
С постепенным развитием болезни могут добавляться и следующие симптомы (основные):
- Боли в правом подреберье нарастают, принимают характер колики. Могут сопровождаться чувством тяжести, нарастать (если дополнительно наблюдается гипокинетическая дискенизия).
- У больного наблюдается рвота и тошнота. В рвотных массах иногда заметна кровь, что свидетельствует о кровотечении из пищевода или вен желудка.

Внешние характерные признаки цирроза печени
По мере развития заболевания у больного начинают происходить заметные изменения внешности:
-
Кожа приобретает желтый оттенок, начинает шелушиться. Выраженная желтуха говорит о том, что болезнь находится в последней стадии. Изначально желтый оттенок приобретают склеры глаз, слизистая ротовой полости, стопы и ладони, а уже после этого – все тело.

Многие из перечисленных признаков появляются только на поздних и самых тяжелых стадиях цирроза.

Почему возникает цирроз: причины
Возникновение цирроза может быть обусловлено многими причинами: иными заболеваниями печени и других органов, длительным приемом некоторых лекарств или алкоголя.
Более 80% случаев заболевания циррозом обусловлены вирусным гепатитом (преимущественно С и В) и алкоголизмом.
Причины, вызывающие болезнь, следующие:

Часто (примерно в 20% случаев) установить точную причину болезни не удается. Тогда цирроз называют криптогенным.
Риск развития заболевания существенно повышает комбинированное влияние сразу нескольких факторов, например, алкоголизма в сочетании с вирусом гепатита.

Диагностика болезни: основные методы
- проведение биохимического анализа крови;
- анализ крови на вирусный гепатит;
- коагулограмму;
- УЗИ органов брюшной полости, УЗИ печени;
- гастроскопию: для исследования вен пищевода и оценки риска кровотечений.
Среди дополнительных диагностических мероприятий стоит упомянуть:

Опытный специалист может заподозрить цирроз только по одному биохимическому анализу крови: его показатели изменяются по определенной схеме. Так, количество билирубина в крови определяется в избыточном количестве, повышаются показатели трансаминаз, щелочной фосфатазы, глобулинов и специфических печеночных ферментов. При этом показатели холестерина, протромбина и мочевины падают.
Какие существуют виды болезни
Цирроз печени может быть нескольких видов, которые разнятся между собой по течению (симптоматике) и прогнозу.
- Алкогольный. Данный тип цирроза возникает у людей, длительное время потребляющих спиртосодержащие напитки в большом количестве. В большинстве случаев сопутствует уже имеющемуся алкогольному гепатиту. Особенность данного типа заболевания – эффективное лечение при полном отказе от употребления алкоголя.

Аутоиммунная форма - одна из тяжелейших для лечения.
Стадии заболевания: степень тяжести
Для каждой стадии болезни характерны отличительные симптомы. Также стадия определят общее состояние человека и необходимую терапию.
| Стадия | Первая (компенсированная) | Вторая (субкомпенсированная) | Третья (терминальная) | Четвертая |
| Особенности | Начальная стадия характеризуется практически бессимптомным течением. Если удается выявить болезнь в этот период, то результативная терапия возможна при помощи лекарственных средств. Человек может чувствовать себя абсолютно здоровым (допустимы редкие боли в правом боку), но изменения уже видны при биохимическом анализе крови. | Данная стадия характеризуется выраженным снижением функционирования органа. В этот период наблюдаются первые признаки болезни: снижение работоспособности и ухудшение общего самочувствия, тошнота и рвота. При грамотно подобранном лечении, возможно перевести больного из второй стадии в первую. | Для данной стадии характерно быстрое нарастание симптомов болезни, дальнейшее развитие печеночной недостаточности. Шансы на улучшение самочувствия есть, но они малы. Больной человек должен находиться в стационаре: наблюдается нарушение обмена веществ, часто развивается асцит. | Последняя стадия болезни имеет весьма неблагоприятный прогноз: без пересадки печени нельзя остановить прогрессирование цирроза - все заканчивается смертью. Боли настолько выражены, что человеку приходится постоянно принимать сильные обезболивающие препараты. |
Причиной летального исхода могут тать очень серьезные осложнения цирроза, среди которых: рак печени, перитонит, пневмония, печеночная кома.

Есть ли шансы вылечить заболевание: терапия цирроза
Без пересадки донорского органа полностью избавиться от цирроза на сегодняшний день невозможно. Однако если заболевание было выявлено на ранней стадии своего возникновения, то возможно остановить его прогрессирование при верно подобранной терапии лекарственными средствами. Если болезнь находится на поздних этапах, то можно попытаться отсрочить или предотвратить развитие серьезных осложнений.
Лечение основывается на:
-
Устранении причина, поспособствовавшей развитию патологии. В случаях, если болезнь находится в компенсированной стадии.

Не рекомендуется при циррозе лечение теплом. Также без консультации врача нельзя пользоваться средствами народной медицины.
Последствия цирроза и прогноз

При субкомпенсированной стадии заболевания средняя продолжительность жизни – 5 лет, на более поздних стадиях – не более 40% людей живут 3 года. В большинстве случаев человек погибает от развивающихся осложнений, несовместимых с жизнью.
В некоторых случаях правильная терапия позволяет компенсировать заболевание на довольно долгий срок (до 20 и более лет) и поддерживать функционирование пораженного органа.
Цирроз печени, симптомы у мужчин – сколько живут люди с таким диагнозом, зависит от своевременного выявления болезни и подбора правильной терапии. Даже с развившимся асцитом при медикаментозной терапии можно прожить около 2 лет, но при отказе от лечения только 25-50% от количества больных циррозом людей переживают полгода.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Читайте также:

