Наука и жизнь вирусы
Обновлено: 22.04.2024
В наши дни интерес к вирусам неизмеримо возрос. Это естественно. Ведь лоток информации о вирусах, их свойствах и изменчивости сопровождает, например, каждую эпидемию гриппа.
Вирус герпеса под электронным микроскопом. На снимках довольно отчетливо просматривается строение оболочки, состоящей из пятигранных (слева) и шестигранных (справа) призм.
Схематическое изображение частицы вируса герпесе, оболочка которой построена из 150 шестигранных и 12 пятигранных призм.
Вирионы гриппа. Сквозь частично разрушенную внешнюю оболочку видна плотная упаковка трубчатого внутреннего содержимого — рибонуклепротеина.
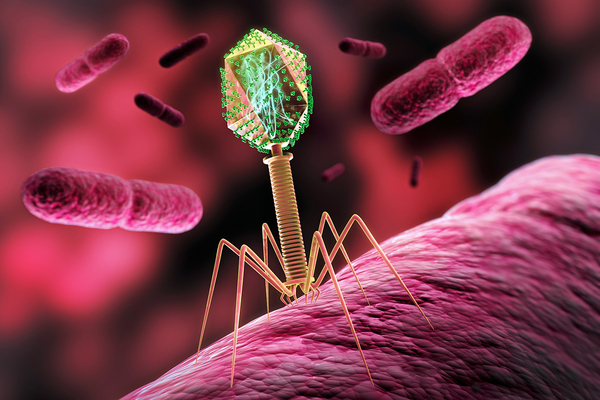
Схематическое строение различных фагов. Вверху — фагочастица в активном состоянии, в центре и внизу — в неактивном (колющий аппарат вышел наружу).
Увеличивается во всем мире и число сторонников вирусной теории рака. Исследования сотен лабораторий свидетельствуют, что именно вирусы — наиболее вероятная причина рака, саркомы, лейкемии.
И. Губарев, наш специальный корреспондент, обратился к директору Института вирусологии имени И. Д. Ивановского АМН СССР, академику АМН СССР, профессору Виктору Михайловичу Жданову с просьбой рассказать об истории и сегодняшнем дне Вирусологии, о стратегии борьбы С вирусными болезнями.
Вирусология — наука молодая. 80 лет прошло со времени открытия И. Д. Ивановским первого вируса — возбудителя мозаичной болезни табака. Много позже — в 50-х годах — было получено первое несовершенное изображение этого инфекционного агента. Самые значительные исследования в области вирусологии были выполнены лишь за последние 15—20 лет.
С исследованиями вирусологов сегодня связано уничтожение инфекционных заболеваний на планете, борьба против рака. Вирусологии же, изучающей наиболее простые формы существования, предстоит дать ответ на многие вопросы, связанные с происхождением жизни на Земле.
Итак, что же мы знаем и «его еще не знаем о вирусах?
Пример: до недавнего времени мы почти ничего не знали о специфических обезьяньих вирусах. В 1960-х годах было начато массовое производство вакцины против полиомиелита, изготавливаемой на обезьяньих почках. Необходимо было обеспечить стерильность этой вакцины, то есть полностью исключить проникновение в нее каких-либо микроорганизмов. И вот в ходе исследований, направленных на обеспечение такого рода стерильности, был открыт целый ряд до тех пор неизвестных вирусов, специфичных для обезьян.
К настоящему времени мы располагаем сведениями примерно о тысяче видах вирусов. Безусловно, лучше других нам известны вирусы, поражающие человека. Их выявлено около 500 видов. Весьма обширна группа вирусов, найденных у лабораторных животных — мышей, кроликов, морских свинок.
Сравнительно много мы знаем о вирусах сельскохозяйственных животных и растений, меньше — о вирусах, опасных для птиц и других животных, древесных и кустарниковых пород лесе. И уж вовсе малоизвестны и числом и повадками вирусы папоротников, мхов, лишайников.
Вирусы проявляют себя не всегда одинаково. В одних случаях они нападают лишь на определенные виды живых существ. Скажем, уже выявлены специфические вирусы гриппа свиней, кошек, чаек, поражающие только этих животных и безопасные для других. Подчас специализация становится своеобразно утонченной: мельчайшие вирусы бактерий — фаги Р-17 выбирают в качестве объекта лишь мужские особи только одной разновидности кишечной палочки. А вот в числе объектов онкогенных вирусов — пресмыкающиеся, птицы, млекопитающие. Рекорд побивают, пожалуй, так называемые пулевидные вирусы, названные так благодаря их характерному очертанию на микрофотографии. Внешне вирусы этой разновидности очень схожи. А болезни они вызывают самые разнообразные, поражая при этом весьма далекие друг от друга виды живых существ. Они могут стать причиной бешенства — тяжелейшего поражения нервной системы млекопитающих (в том числе, разумеется, и человека) и таких болезней, как везикулярный стоматит крупного рогатого скота (передаваемый, кстати, через насекомых), желтой карликовости картофеля и полосатой штриховатости пшеницы. Эти же вирусы провоцируют тяжелое заболевание у мухи дрозофилы, приводящее насекомое к гибели в результате повышения чувствительности к углекислому газу.
Человек, животные, насекомые, растения. Болезни общие для многих видов и узко-специфичные. Откуда такой широкий спектр агрессивных возможностей? Под влиянием каких условий сложились эти свойства? Сколько еще существует в природе вирусов специализированных и универсальных?
На все эти вопросы лишь предстоит ответить.
Гипотезы, гипотезы.
С вирусами связано немало загадочного, неясного, а если быть точным до конца — еще не выясненного.
Признавая существование возбудителей инфекционных болезней, по размерам намного меньших, чем бактерии, ученые долго не могли прийти к единому мнению: какие они? Так, известный голландский микробиолог М. Бейеринк, к примеру, предполагал, что вирусы — необъяснимая загадка. Он дал им название Cоntagium vivum fluidum — живое жидкое заразное начало.
Другие исследователи пытались связать данные о вирусах с привычными для них представлениями о живом организме (клеточное строение, размножение путем деления с последующим ростом до размеров взрослой особи и т. д.). Не будем перечислять здесь другие предположения, высказанные на заре развития вирусологии. Все они — как наивные, так и наделенные долей предвидения — строились на одних лишь догадках, вслепую.
Много неясного и в современных гипотезах о происхождении вирусов. Так, одни исследователи считают, что вирусы — это потомки древних доклеточных форм жизни, застывшие, остановившиеся в своем развитии на определенном этапе. Разнообразие генетического вещества, говорят сторонники гипотезы, отражает ход эволюции этих существ. Природа как бы опробовала на вирусах все возможные варианты наследственного вещества, прежде чем остановиться окончательно на двухспиральной ДНК.
Вирусы — потомки бактерий или других одноклеточных организмов, по неизвестным причинам двинувшиеся в своем развитии вспять, деградировавшие, говорят другие ученые. Возможно, некогда их устройство было сложней, но со временем они многое утратили, и их нынешнее состояние, в том числе и разнообразие носителей генетической информации, лишь отражает разные уровни деградации, которых достигли различные их виды.
Наконец, существует гипотеза, согласно которой вирусы представляют собой составные части клеток живых существ, по неизвестной причине ставшие автономными системами. Процесс возникновения вирусов, согласно этой гипотезе, относится не только к глубокой древности, когда они уже, безусловно, существовали, но и к нашему времени. Иными словами, эта гипотеза признает возможность повсеместного, происходящего непрерывно образования вирусов клеточными элементами. Возможно ли такое, способны ли составные части клеток стать автономными, да еще и саморепродуцирующимися (способными к воспроизведению) системами?
Логика и парадоксы микромира
Устройство вирусов поражает своей чисто математической завершенностью, логикой симметрии. Возьмем, к примеру, наиболее просто организованный вирион (зрелый вирус) табачной мозаики.
Сотни белковых кристаллообразных структур уложены в виде тугой спирали. Сердцевина нити, образующей спираль, представляет собой своеобразную капсулу, где находится молекула нуклеиновой кислоты. В результате общий вид вириона — предельно лаконичный цилиндр, полая трубка.
А вот другая форма: двадцатигранник, икосаэдр, грани которого образованы треугольниками. Основной материал, из которого сложен икосаэдр, — те же белковые структуры. Внутри — полость, где покоится молекула нуклеиновой кислоты. Это вирион полиомиелита.
— Позвольте, — возражали многие ученые еще в недавнем прошлом, — да можно ли вообще после этого называть вирусы живыми существами? Может быть, это кристаллообразные вещества, наделенные болезнетворными свойствами?
— Либо, — говорили другие, — это пограничные формы между живым и неживым мирами.
Кто же прав? Скорей всего наиболее многочисленная группа исследователей, которая считает, что вирусы — представители живой природы, го есть не вещества, а существа. Правда, существа крайне своеобразные, ведущие сугубо паразитический образ жизни.
Вирус проникает в клетку
Вирусы, имеющие иное строение, проникают в клетку не столь затейливым путем. Притянутые к оболочке клетки и воздействующие на нее ферментами, они провоцируют втягивание внутрь того участка мембраны, на котором осели. Образуется своего рода капсула-вакуоль с вирусной частицей внутри. Вакуоль эта затем отрывается, и в ней, путешествующей внутри клетки, продолжают идти одновременно два процесса — вирусная частица с помощью своих ферментов разрушает окутывающие ее стенки капсулы, а ферменты клетки разрушают внешние оболочки вируса, освобождая, как это было и в случае с фагом Т2, нуклеиновую кислоту.
Фабрика вирусов
Итак, нуклеиновая кислота покинула белковую оболочку и исчезла, бесследно растворилась в клеточной среде. Что же дальше?
Мы еще не имеем возможности получить полный ответ на этот вопрос. До сих пор удалось установить характер лишь некоторых изменений, происходящих на этом этапе в различных частях клетки. И по этим отдельным штрихам мы воссоздаем, пытаемся представить себе полностью происходящее.
Формирование вирусов начинается, по-видимому, с подавления нормальных процессов обмена веществ в клетке. Установлено, в частности, что рибонуклеиновая кислота (РНК) вируса гриппа способна синтезировать на клеточных элементах — рибосомах, ведающих выработкой белка,— особое вещество, также белковой природы,— гистон, который, в свою очередь, связывается с ДНК клетки и прекращает синтез клеточной РНК. Некоторые другие вирусы, например, вирусы полиомиелита, не нуждаются в окольном пути, так как сами способны вмешаться в деятельность рибосом и прекратить синтез клеточных белков. Выявлены и другие механизмы подавления вирусами клеточного обмена, их вмешательства в жизнедеятельность клетки, но в конечном счете все сводится к одному: клеточные ресурсы перестают расходоваться на нужды самих клеток и поступают в распоряжение вирусной нуклеиновой кислоты.
Беззащитна ли клетка!
Цикл превращений, связанных с размножением вирусов, как правило, краток. В одних случаях проникновение вирусной нуклеиновой кислоты в клетку отделяет от появления вирионов 13—15 минут, в других — 40 минут. Вирусы одной из наиболее распространенных инфекций, гриппа, проходят этот путь примерно за 6—8 часов. И каждый раз около погибшей клетки оказываются десятки, а порой и сотни вирионов. Причем каждый из них, в свою очередь, готов к продолжению процесса размножения. Количество вирусной инфекции нарастает буквально лавинообразно.
Но так как главное действующее лицо — вирус остается за кадром (в обычный микроскоп он не виден), на экране только последствия его агрессии. Картина перед наблюдателем разворачивается впечатляющая. Вначале крайние клетки, первыми подвергшиеся нападению, начинают терять свойственные им округлые очертания. Постепенно истончаются их мембраны, клеточные элементы, клетка как бы взрывается. В этот момент, как мы знаем (но не видим этого), опустошенную оболочку покидают полчища вирионов, направляющихся к очередным своим жертвам. И через самое непродолжительное время точно так же изменяются, а затем лопаются соседние клетки, за ними другие, еще и еще.
. Колония клеточной культуры как бы охвачена пламенем. Вот она рассечена обезжизненными структурами на островки. Вот сжимаются и эти островки, уменьшаются в размерах, и. все кончено. Колония разрушена дотла.
Обладай вирусы такими же возможностями в естественных условиях, и человеку и любому другому живому существу пришлось бы плохо. Однако этого не происходит, ибо на страже — отработанные за миллионы лет защитные приспособления организма, ограничивающие могущество вирусов.
Безграничному расширению вирусной агрессии препятствуют прежде всего сами вирусы. Еще в 30-х годах ученые заметили, что размножение в клетке одного вируса нередко препятствует размножению в этой же клетке другого вируса.
Кстати, если говорить серьезно, одна из многочисленных гипотез, пытавшихся объяснить это явление, так и гласила: всему причиной конкуренция вирусов, борющихся за клеточные компоненты. Без малого три десятилетия понадобилось, чтобы раскрыть существо этого явления, получившего название интерференции. И, как оказалось, в данном случае инициатива принадлежала не вирусам, а самой клетке. На проникновение вируса (чему воспрепятствовать клетка, увы, не может) она отвечает немедленной выработкой особого белкового вещества — интерферона. Правда, интерферон не спасает уже пораженную клетку, но препятствует продвижению вирусной инфекции к другим клеткам организма. Иными словами, за первыми же вирионами, прорвавшимися в организм, возникает барьер интерфероновой защиты.
Антитела, появляющиеся позже, существуют несравненно дольше. Именно они и становятся основой стойкого иммунитета, благодаря которому многие инфекционные болезни не повторяются дважды в жизни одного индивидуума.
Медицина — в наступлении
Среди инфекционных заболеваний 80 процентов вирусных. Эта цифра — свидетельство победы человека над бактериальными инфекциями. Чума, холера, тиф, некогда безоговорочно первенствовавшие в медицинских статистических сводках, с приходом антибиотиков и сульфопрепаратов навсегда сдали свои позиции. Их место заняли болезни, вызываемые вирусами.
Как известно, и с этими недугами ведется успешная борьба. Побежден полиомиелит. Тягостным воспоминанием ушла в прошлое оспа. Широким фронтом идет наступление на корь: лишь за последнее пятилетие число перенесших заболевание корью снизилось в 5 раз; на повестке дня — полное искоренение этой инфекции на территории нашей страны.
Значительные усилия направляются на борьбу с гепатитом, гриппом, паротитом, вирусными респираторными заболеваниями, однако здесь решающие достижения еще впереди.
Наряду с этим ученые работают над созданием других эффективных лекарственных веществ, способных подавить вирусную инфекцию.
Работа эта начата. Во все концы нашей страны и за рубеж отправляются специальные экспедиции вирусологов. Уже получены чрезвычайно ценные данные о перемещениях вирусной гриппозной инфекции из Всемирного противогриппового центра, в деятельность которого вносит существенный вклад региональный противогриппозный центр СССР.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Глобальная проблема человечества
По данным отчета Всемирной организации здравоохранения (ВОЗ) за 2019 год, по меньшей мере 700 тысяч человек ежегодно умирают из-за антибиотикорезистентности. Вызванные резистентными штаммами микроорганизмов инфекции трудно поддаются лечению, более тяжело протекают, чаще требуют госпитализации и применения комбинированной терапии с использованием альтернативных препаратов. В итоге выздоровление пациента становится сложнее, дороже и создает условия для распространения эпидемии.

Исследователи из Тбилисского института бактериофагов
Одной из причин возникновения антибиотикорезистентного кризиса стала легкодоступность антибактериальных препаратов, а также распространенность самолечения и необоснованное назначение антибиотиков врачами. Пандемия COVID-19 дополнительно усугубила существующую проблему. Отсутствие базовой осведомленности о влиянии антибиотиков на вирусы и страх перед новой неизвестной инфекцией участили безрецептурный доступ к антибиотикам, особенно в странах с низким и средним уровнем доходов, где затруднен доступ населения в медицинские учреждения и плохо контролируются продажи антибактериальных препаратов, пишут сотрудники Центрального НИИ эпидемиологии Роспотребнадзора. Из попавших в стационар только 15 процентов пациентов, у которых были диагностированы соответствующие бактериальные инфекции, нуждались в антибактериальной терапии, но антибиотики назначались 75 процентам заболевших.
госпитализированных с COVID-19 нуждались в приеме антибиотиков
Воздействие антибиотиков на коронавирусную инфекцию изучали и китайские ученые из Хуачжунского университета науки и технологий. Они проанализировали данные 1500 заболевших COVID-19, которые поступили в состоянии средней тяжести. 996 пациентам вводили антибиотики в течении первых двух суток после госпитализации, а второй группе либо совсем не давали антимикробные препараты, либо назначали спустя два дня. Оказалось, что коронавирус перешел в тяжелую стадию у 36 процентов испытуемых из первой группы и у 22 процентов — из второй. В результате ученые пришли к выводу, что применение антибиотиков при COVID-19 связано с более высокой вероятность развития тяжелого течения заболевания.
Очень скоро некоторые виды антибактериальных препаратов — например, третье поколение класса цефаспоринов — могут потерять свою эффективность, поскольку в начале пандемии COVID-19 в ряде европейских медицинских учреждений вирус пытались лечить антибиотиками.
В ВОЗ проблему антибиотикорезистентности поднимают регулярно, недавно ее включили в список десяти наиболее серьезных угроз человечеству. Всемирная ассамблея здравоохранения в 2016 году приняла Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам, который предполагает комплекс мер для всестороннего решения проблемы.
Что такое бактериофаги
Одним из перспективных направлений борьбы с резистентностью инфекций к антибиотикам являются бактериофаги, или просто фаги. Они представляют собой крошечные вирусы, которые повсеместно распространены на Земле и способны атаковать только бактерии или патогенные микроорганизмы. Как большинство вирусов, бактериофаги размножаются в клетках хозяина, способны репродуцироваться в бактериальных клетках и вызывать в них лизис (растворение). Фаги оказывают существенное воздействие на состав, динамику и активность микробных скоплений, на эволюцию микробов и их взаимодействие, участвуют в контроле экспрессии собственных генов микроорганизмов.
Официально бактериофаги открыли в 1915-1917 годах, когда независимо друг от друга их обнаружили Фредерик Туорт и Феликс д’Эрелль. Появление современного технического оснащения лабораторий и усовершенствование методов подготовки препаратов к микроскопии позволили более тщательно изучить бактериофаги. Выяснилось, что структура фагов крайне разнообразна и сложнее, чем у вирусов растений и некоторых вирусов человека и животных.


Бактериофаги обладают строгой специфичностью — это означает, что они способны паразитировать лишь на ограниченном круге микроорганизмов, например, только на стрептококках или стафилококках. Возможность использования фагов для лечения бактериальных инфекций интересовала ученых еще в XX веке, однако появление пенициллина послужило причиной приостановки работ в этой области.
Из-за повсеместно возрастающей антибиотикорезистентности и проблем с синтезированием новых видов антибиотиков в научном сообществе вновь проснулся интерес к фаготерапии. Исследования в области бактериофагов сейчас проводятся в России, Грузии, Польше, Франции, Германии, Финляндии, Канаде, США, Великобритании, Мексике, Израиле, Индии, Австралии.
Спасенные фаготерапией
Одной из ведущих стран в сфере изучения и применения бактериофагов является Грузия. В небольшой кавказской стране изучать фаги начали еще в XX веке. Грузинский ученый Георгий Элиава в 1920-х годах работал в парижском Институте Пастера совместно с одним из первооткрывателей бактериофагов — Феликсом д'Эреллем. По возвращении в СССР Элиаве удалось убедить Иосифа Сталина открыть в Тбилиси Институт бактериофагов, но сам он в 1937 году подвергся политическим репрессиям, был арестован и расстрелян.

Сейчас в институте продолжают начатое Элиавой дело и добились значительных результатов. Одним из показательных случаев стало излечение бельгийской женщины, которая более двух лет страдала от серьезной бактериальной инфекции. Назначенная терапия ей не помогала, но бактериофаги Klebsiella pneumoniae, выделенные грузинскими учеными из сточных вод, вылечили пациентку за несколько месяцев.
В 2016 году 30-летняя бельгийка пострадала в результате теракта. После частичной ампутации таза и фиксации бедренной кости врачи оценили ее состояние как стабильное и назначили антибиотики. Через четыре дня у нее случился септический шок — крайне опасное для жизни состояние, которое наступает в ответ на тяжелую инфекцию. В образце, взятом из зараженных тканей, медики обнаружили целый спектр патогенной микрофлоры: Enterococcus faecium, Pseudomonas aeruginosa, Enterobacter cloacae и Klebsiella pneumoniae.
Врачи назначили длительную терапию с большими дозами антибиотиков, однако это не помогло. За два года лечения антибактериальными препаратами у пациентки появились побочные реакции, а также начался некроз (отмирание) пересаженных мышечных тканей. Помимо этого у нее наблюдались стойкая лихорадка и нарушение функции почек, которое сопровождалось мукормикозом. Медики предложили пациентке экспериментальное лечение бактериофагами. Этический комитет бельгийской больницы разрешил использование экспериментальной фаготерапии еще в 2016 году, и больная подписала информированное согласие на экспериментальное лечение.
Однако врачи долгое время не могли прийти к единому мнению, можно ли применять такую терапию и как ее использовать. Поскольку фармакологические данные этого вида терапии были не слишком обширны, фаги было решено вводить прямо в очаг воспаления с помощью катетера. Вместе с тем пациентка продолжала принимать антибиотики.

Научно-исследовательский институт бактериофага, микробиологии и вирусологии имени Георгия Элиавы
Позитивный эффект врачи отметили уже через несколько дней, но полную оценку комбинированной терапии провели только спустя три месяца: у больной исчезли гнойные и некротизированные очаги, восстановилась чувствительность мышц левого бедра, она набрала вес и чувствовала себя лучше. Анализы крови подтвердили положительную динамику, а компьютерная томография показала, что бедренная кость частично восстановилась. В образцах костных фрагментов роста бактериальных культур не наблюдалось.
Еще одним пациентом, которому удалось вылечиться с помощью бактериофагов, стал 34-летний американский инженер-механик, у которого бактериальное заболевание перешло в хроническую стадию и продолжалось шесть лет. В разговоре с журналистами Agence France Presse он заявил, что почувствовал себя лучше уже через две недели терапии. Пациент рассказал, что в США он перепробовал все возможные методы лечения, после чего решил приехать в Тбилисский институт.
Это только один из сотен пациентов, которые приезжают в Грузию со всего мира для фаготерапии, когда традиционный арсенал противомикробных средств уже не помогает
Сотрудник Института бактериофагов Мзия Кутателадзе считает, что этому виду терапии необходимы дополнительные клинические исследования, чтобы правительства других стран могли одобрить такой метод лечения. В 2019 году Управление по контролю за продуктами и лекарствами США (FDA) разрешило клинические испытания по использованию бактериофагов для лечения вторичных инфекций у пациентов с COVID-19.
Не только медицина
Помимо применения бактериофагов в сфере медицины, они перспективны и для использования в сельском хозяйстве — как в животноводстве, так и в растениеводстве. Предполагается, что они могут стать дешевой альтернативой антибиотикам в защите сельскохозяйственных культур и животных от бактерий. В Тбилисском институте бактериофагов уже провели ряд исследований на хлопке и рисе.

Фото: Sunshine Seeds / Shutterstock
Американская некоммерческая организация Phages for Global Health (PGH) разрабатывает ряд программ по производству и поставкам бактериофагов в Африку и Азию для использования в сельском хозяйстве. Создатели компании считают, что фаговые обработки могут иметь конкурентоспособные с антибиотиками цены и позволят фермерам применять их для борьбы с вредными бактериями.
Бактериофаги также могут применяться в противодействии биологическому оружию и биотерроризму. В 2018 году ученые из Университета Бригама Янга опубликовали научную работу, в которой исследовался потенциал фагов в защите от биологических атак с использованием возбудителя сибирской язвы.
Читайте также:

