Нейтропения при лечении гепатита с
Обновлено: 22.04.2024
Целью настоящего исследования послужило изучение динамики содержания лейкоцитов и нейтрофилов в крови больных хроническим гепатитом С (ХГС) на фоне комбинированной терапии стандартным или пегилированным интерфероном в сочетании с рибавирином. До лечения, а также на разных сроках комбинированной противовирусной терапии исследовались абсолютные показатели лейкоцитов и нейтрофилов крови у больных ХГС. Кроме того, изучалась зависимость между динамикой содержания лейкоцитов и нейтрофилов крови и исходными клинико-лабораторными показателями (пол, возраст, индекс массы тела (ИМТ), генотип вируса, уровень виремии, исходный уровень лейкоцитов и нейтрофилов, активность АЛТ, индекс гистологической активности, степень фиброза), а также вариантом комбинированной терапии. Установлено, что снижение лейкоцитов и нейтрофилов наблюдалось уже со 2-й недели лечения независимо от варианта комбинированной терапии. Применение ПИФН-α-2а вызывало достоверно более выраженную лейкопению и нейтропению по сравнению с лечением простым ИФН-α-2а. Кроме того, развитие нейтропении ассоциировалось с достижением устойчивого вирусологического ответа при обеих схемах противовирусной терапии. Также установлены прогностические критерии, указывающие на возможное развитие выраженной лейко- и нейтропении на фоне лечения: возраст старше 45 лет, высокая исходная репликативная активность вируса (>800 000 МЕ/мл).
Ключевые слова
Об авторах
Список литературы
1. Лобзин, Ю.В. Вирусные гепатиты: клиника, диагностика, лечение / Ю.В. Лобзин [и др.]. – СПб.: Фолиант, 2003. – 192 с.
2. Fried, M.W. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection / M.W. Fried [et al.] // N. Engl. J. Med. – 2002. – V. 347. – Р. 975–982.
3. Manns, M.P. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomized trial / M.P. Manns [et al.] //Lancet. – 2001. – V. 358. – P. 958–965.
4. Никитин, И.Г. Лечение хронического гепатита С: вчера, сегодня, завтра / И.Г. Никитин // Росс. журн. гастроэнтерол., гепатол., коло проктол. – 2002. – № 6. – С. 11–16.
5. Kowdley, K.V. Hematologic side effects of interferon and ribavirin therapy / K.V. Kowdley // J. Clin. Gastroenterol. – 2005. – V. 39, Suppl. – P. S. 3–8.
6. Mark, A. Interferons play a central role in the natural defense and therapeutic management of hepatitis C: a re view / A. Mark, R.N. Outzen // Internet J. Gastroenterol. – 2007. – V. 5 (2). – P. 24–48
7. Ong, J.P. Managing the hemotologic side effects of antiviral therapy for chronic hepatitis C: anrmia, neutropenia, and thrombocytopenia / J.P. Ong, Z.M. Younossi //Cleveland Clin. J. Med. – 2004. – V .71, Suppl. 3. – P. S17–S.21
8. Sulkowski, M.S. Management of the hematologic complications of hepatitis С therapy / M.S. Sulkowski // Clin. Liver. Dis. – 2005. – V. 9. – P. 601–616.
9. Pellicano, R. Autoimmune manifestation during interferon therapy in patients with chronic hepatitis C: the hepatologist’s view / R. Pellicano [et al.] // Minerva gastroenterol. dietol. –2005. – V. 51. – P. 55–61.
10. Davis, G.L. Early virologic response to treatment with peg interferon alfa-2b plus ribavirin in patients with chronic hepatitis C / G.L. Davis [et al.] // Hepatology. – 2003. –V. 38. – P. 645–652.
11. Peck-Radosavljevic, M. Rapid suppression of hematopoiesis by standard or pegylated interferon-alpha / M. Peck-Radosavljevic [et al.] // Gastroenterology. – 2002. – V. 123. –P. 141–151.
Прогноз лейкопении и нейтропении у больных хроническим гепатитом С на фоне противовирусной терапии с применением ингибиторов протеазы 1-го и 2-го поколений
- Пименов Н.Н., Чуланов В.П., Комарова С.В., Карандашова И.В., Неверов А.Д., Михайловская Г.В., Долгин В.А., Лебедева Е.Б., Пашкина К.В., Коршунова Г.С. Гепатит С в России: эпидемиологическая характеристика и пути совершенствования диагностики и надзора. Эпидемиология и инфекционные болезни. 2012;3:4–10.
- Ющук Н.Д., Знойко О.О., Дудина К.Р., Шутько С.А., Сафиуллина Н.Х., Белый П.А., Рахманова А.Г., Хубутия М.Ш., Якушечкина Н. Социально-экономическое бремя гепатита С: методология оценки и трудности расчета в Российской Федерации. Медицинские технологии. Оценка и выбор. 2012;4:46–51.
- Poordad F., McCone J., Bacon B.R., et al. Boceprevir for untreated chronic HCV genotype 1 infection. New England Journal of Medicine. 2011;364(13):1195–206.
- Bacon B. R., Gordon S. C., Lawitz E., Marcellin P., Vierling J.M., Zeuzem S., Poordad F., Goodman Z.D., Sings H.L., Boparai N., Burroughs M., Brass C.A., Albrecht J.K., Esteban R. Boceprevir for previously treated chronic HCV genotype 1 infection. N. Engl. J. Med. 2011;364:1207–17.
- Абдурахманов Д.Т., Морозов В.Г., Никитин И.Г. и др. Безопасность и эффективность телапревира в лечении хронического гепатита C у больных российской популяции, включенных в исследование по программе раннего доступа. Росс. журн. гастроэнтерол., гепатол., колопроктол. 2014;1:39–46.
- EASL Recommendation on Treatment of Hepatitis C. Hepatology. 2015;63:199–236.
- Andreone P., Colombo M., Enejosa J., et al. ABT-450, Ritonavir, Ombitasvir and Dasabuvir achieves 97% and 100% sustained virological response with or without Ribavirin in treatment-experienced patients with HCV genotype 1b infection. Gastroenterology. 2014;147(2):359–65.
- Буеверов А.О. Профилактика и коррекция гематологических побочных эффектов противовирусной терапии хронического гепатита С. Росс. журн. гастроэнтерол., гепатол., колопроктол. 200919(3):76–81.
- Kowdley K.V. Hematologic side effects of interferon and ribavirin therapy. Clin.Gastroenterol. 2005;39(Suppl.):3–8.
- Донцов Д.В., Амбалов Ю.М. Способ прогноза интерферон-рибавирин-индуцированной нейтропении у больных хроническим гепатитом С. Кубанский научный медицинский вестник. 2011;3(126):67–70.
- Бакулин И.Г., Сандлер Ю.Г., Шарабанов А.С. Гематологические нежелательные явления при проведении противовирусной терапии у больных хроническим гепатитом С Гепатологический форум. 2011;4:2–14.
- Рекомендации по диагностике и лечению взрослых больных гепатитом С. Экспертная группа. Руководство для врачей. M., 2014. 32–3.
- Моисеев С.В., Абдурахманов Д.Т. Как улучшить результаты стандартной противовирусной терапии у пациентов с хроническим гепатитом С: роль кроветворных факторов роста. Клиническая фармакология и терапия. 2011;20(2):35–40.
- Sulkowski M.S. Management of the hematologic complications of hepatitis C therapy. Clin. Liver Dis. 2005;9:601–16.
- Soza A., Everhart J.E., Ghany M.G., Doo E., Heller T., Promrat K., Park Y., Liang T.J., Hoofnagle J.H. Neutropenia during combination therapy of interferon alfa and ribavirin for chronic hepatitis C. Hepatology. 2002;36:1273–79.
- Cooper C.L., Al-Bedwawi S., Lee C., Garber G. Rate of infectious complications during interferon-based therapy for Hepatitis C is not related to neutropenia. Clin. Infect. Dis. 2006;42:1674–78.
- Hezode C., Dorival C., Zoulium F., et al. Safety of Telaprevir or Boceprevir in Combination with Peginterferon alfa/Ribavirin, in Cirrhotic Non Responders. First Results of the French Early Access Program (ANRS CO-20-CUPIC). 47 Annual Meeting of the European Association for the Study of the Liver (EASL 2012). Barcelona, 2012; 18–22.
- Шиффман Ф.Д. Патофизиология крови. Монография. М., 2014. 133 с.
- Бакулин И.Г., Шарабанов А.С. клиническое значение лейко- и нейтропении у больных хроническим гепатитом С при проведении различных режимов противовирусной терапии. Клиническая гастроэнтерология. 2010;5:27–32.
- Бакулин И.Г., Дианова Н.Х., Юнусова Ю.М., Рейзен Е.В. Лекарственно-индуцированная организующаяся пневмония – редкое нежелательное явление при противовирусной терапии цирроза печени HCV-этиологии. Эффективная фармакотерапия. 2014;43:30–5.
Об авторах / Для корреспонденции
Ю.А. Алексеева, Р.И. Вабищевич
ФЦСКЭ им. В.А. Алмазова, Санкт-Петербург
Поздняя отсроченная нейтропения (ПОН) относится к редким состояниям, чаще протекающим без высокого риска инфекционных осложнений. Генез данного состояния до конца не ясен, возможными механизмами считаются выработка антинейтрофильных антител, подавление нейтрофилов за счет образования больших гранулярных лимфоцитов, изменение созревания гранулоцитов в условиях реконституции В-клеточной линии, цитокиновая дезрегуляция. В ряде случаев развитие ПОН происходит у пациентов, получающих ритуксимаб. В настоящее время накапливается клинический опыт, свидетельствующий о возможности возобновления лечения ритуксимабом после разрешения ПОН.
При лечении онкологических пациентов с использованием химиотерапии одним из наиболее частых осложнений является развитие нейтропении. Использование ритуксимаба в комбинации с химиотерапией больных лимфомами не сопровождается увеличением частоты миелосупрессии [1]. В большинстве случаев наличие этого побочного эффекта обусловлено цитостатическим составом схемы и зависит от степени инфильтрации костного мозга опухолевыми клетками, объема цитостатической нагрузки на предшествующих этапах лечения. Расширение сферы использования ритуксимаба в сторону состояний, при которых пациенты не получают цитостатики (например, ревматологические заболевания или этапы поддерживающего лечения ритуксимабом при лимфомах), позволило выделить нейтропению, которая развивается отсроченно и не может быть объяснена другими причинами,
кроме терапии ритуксимабом. По данным литературы, это явление относится скорее к редким, хотя встречаются публикации с его частотой от 3 до 27 % [2]. Вероятно, это объясняется включением в анализ случаев нейтропении с разной длительностью и глубиной.
К факторам риска развития поздней отсроченной нейтропении (ПОН) относят проведение аутологичной трансплантации в анамнезе, лечение пуриновыми аналогами и наличие ВИЧ-инфекции. Кроме того, возможно влияние развернутой стадии болезни и высокой частоты применения
введений ритуксимаба [3]. В группе пациентов с ревматологической патологией изучается ассоциация ПОН с дефицитом иммуноглобулинов класса М и выработкой ANCA (антинейтрофильные антитела) [4]. В литературе обычно указывается на небольшой риск инфекции при данном состоянии, однако в работе D. Tesfa и соавт. представлены данные о высокой частоте сепсиса и других тяжелых инфекций у ревматологических пациентов с ПОН, получавших ритуксимаб. В той же группе больных прослеживается связь между частотой ПОН и вариантом основного диагноза: так, при синдроме Вегенера и системной красной волчанке она составила 23 и 20 % соответственно, а при ревматоидном
артрите – только 3 %. Авторы считают, что высокая частота инфекции у указанной категории больных обусловлена особенностями пациентов с системной красной волчанкой и синдромом Вегенера, у которых исходно наблюдается гипогаммаглобулинемия [5]. Природа ПОН до конца не ясна.
Рассматриваются следующие причины ее развития: дисфункция Т-клеточного механизма регуляции, относительная недостаточность стромальных регуляторов хоумингэффекта и дифференцировки клеток, BAFF-ассоциированная цитокиновая дизрегуляция, влияние полиморфизма FCgRIIIa-рецептора [2–4].
Ритуксимаб является моноклональным антителом с конкретной точкой приложения – рецептором CD-20 на поверхности нормальных и злокачественных В-лимфоцитов. Клетки нейтрофильного ряда не имеют данного рецептора. Поэтому основными механизмами действия ритуксимаба, как то антителозависимой клеточной цитотоксичностью, комплемент-зависимой цитотоксичностью, непосредственным апоптотическим эффектом, обьяснить развитие нейтропении нельзя.
Рядом работ показана роль SDF-1/CXCL12 (фактор стромальных клеток 1) в регуляции нейтрофильного
ростка и ранних предшественников В-лимфоцитов. Основными функциями SDF-1 являются обеспечение хемотаксиса В-лимфоидных клеток, участие в ангиогенезе, хоуминг-эффекте. Изучается роль SDF-1 в прогрессировании и метастазировании ряда опухолей, а также при инвазии лимфоцитов вирусом иммунодефицита 1-го типа. SDF-1 взаимодействует с рецептором CXCR4, расположенным как
на клетках – предшественницах В-лимфоцитов, так и на стволовых клетках миелоидной направленности. Активное восстановление клеток В-лимфоидной линии после завершения терапии ритуксимабом приводит к относительному дефициту SDF-1. При этом абсолютного дефицита фактора SDF-1 не формируется [2, 3]. Снижение хоуминг-эффекта в клетках нейтрофильного ряда приводит к их меньшей устойчивости к воздействию гранзимов и перфоринов, продуцирующихся активированными Т-клетками, и вследствие этого к гибели нейтрофилов. С этой теорией не очень согласуется несовпадение сроков начала реконституции В-клеточной линии и периодом ПОН: первая, как правило, наблюдается в более позднем периоде.
Рисунок. Модель развития поздней отсроченной нейтропении, зависимой от SDF-1/CXCL12.
При развитии ПОН показано изменение кинетики цитокинов, ответственных за стимуляцию, дифференцировку и активацию лимфоидных клеток В- и Т-ряда, в частности фактора BAFF (В-клеточный активатор семейства факторов некроза опухоли) [6]. Влияние этого фактора способствует значимому преобладанию созревания лимфоидного ростка над миелоидным. B. Terrier и соавт. предлагают использовать определение уровня фактора BAFF в качестве прогностического теста в отношении риска развития ПОН.
Было отмечено, что в ряде случаев терапия ритуксимабом сопровождается выработкой больших гранулярных лимфоцитов (БГЛ). Появление БГЛ в крови может наблюдаться при редком клональном лимфопролиферативном заболевании – Т-лейкозе из БГЛ, проявлением которого обычно является
панцитопения. Персистенция CD3+, CD8+, CD57+ БГЛ после терапии ритуксимабом не имеет клонального характера, что подтверждается исследованием Т-клеточного рецептора методом полимеразной цепной реакции. Однако при этом наблюдается схожая с лейкозом из БГЛ картина
костного мозга: задержка в созревании нейтрофильного ростка [7]. Ряд публикаций с описанием клинических случаев ПОН также содержит указания на остановку созревания нейтрофилов на уровне промиелоцита в период развития этого состояния [8].
За 2003–2012 гг., в период активного применения ритуксимаба в лечении лимфом, мы наблюдали 6 случаев длительной ПОН, однако при большинстве из них имели место дополнительные факторы, способные оказать содействие развитию нейтропении (колебания степени инфильтрации костного мозга лимфоцитами, что настораживало в плане прогрессирования лимфопролиферативного заболевания; наличие сопутствующей медикаментозной терапии с потенциальным риском гаптенового агранулоцитоза; рецидивирующая цитомегаловирусная инфекция; хронический вирусный гепатит; возможная недостаточность аутотрансплантата костного мозга в силу сильной предлеченности пациента; использование пуриновых аналогов). Представляется, что ПОН является достаточно редким состоянием и требует проведения дифференциально-диагностического анализа на предмет поиска другой этиологии нейтропении.
В публикации Е. Besada и соавт. (2012) сообщается о 8 ревматологических пациентах с развитием ПОН
после терапии ритуксимабом. Время развития нейтропении от начала применения ритуксимаба составило 23 недели, средняя ее длительность – 6,5 дня. Шести пациентам после разрешения нейтропении была возобновлена терапия ритуксимабом. Рецидивов ПОН не наблюдалось [4]. Эти факты подтверждают тран-
зиторный характер гематологических нарушений, развивающихся после терапии ритуксимабом, что позволяет не отказываться от продолжения патогенетической терапии с использованием этого препарата после разрешения нейтропении. Применение гранулоцитарного колониестимули-
рующего фактора в подобных случаях обычно оказывается эффективным.
Таким образом, ПОН относится к редким состояниям, чаще протекающим без высокого риска инфекционных осложнений [9], генез которого до конца не ясен. В ряде случаев развитие ПОН происходит у пациентов, получающих ритуксимаб. В настоящее время накапливается клинический опыт, свидетельствующий о возможности возобновления лечения ритуксимабом после разрешения ПОН.
Литература
1. Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large β-cell lymphoma. N Eng J Med 2002;346:235– 42.
2. Dunleavy K, Tay K, Wilson WH. Rituximabassotiated neutropenia. Semin Hematol 2010;47(2):180–86.
3. Dunleavy K, Hakim F, Kim HK, et al. β-cell recovery following rituximab-based therapy is associated with perturbations in stromal derived factor-1 and granulocyte homeostasis. Blood 2005;106(3):795–802.
4. Besada E, Koldingsnes W, Nossent J. Characteristics of late onset neutropenia in rheumatologic patients treated with rituximab: a case review analysis from a single center. QJM 2012;105(6):545–50.
4. Tesfa D, Ajeganova S, Hagglund H, et al. Late-onset neutropenia following rituximab therapy in rheumatic diseases: Association with B-lymphocyte depletion and infections. Arthritis Rheum 2011;63(8):2009–14.
5. Terrier B, Ittah M, Tourneur L, et al. Late-onset neutropenia following rituximab results from a hematopoietic lineage competition due to an excessive BAFF-induced β-cell recovery. Haematologica 2007;92(2):e20–3.
6. Marinos L, Economaki E, et al. T-LGL related neutropenia. The 3rd Neutropenia Network Conference. Hematology Meeting Reports 2008;2(3).
7. Kim M, Lee JK, Hong YJ, et al. Late-onset neutropenia following rituximab therapy as a treatment of diffuse large β-cell lymphoma: a single institution study. Korean J Lab Med 2010;30(6):575–79.
8. Kimby E. Tolerability and safety of rituximab. Cancer Treat Rev 2005;31:456–73.
9. Ram R, Ben-Bassat I, Shpilberg O, et al. The late adverse events of rituximab therapy: Rare but there! Leuk Lymphoma 2009;50:1083–95.
Об авторах / Для корреспонденции
Алексеева Ю,А. – д.м.н., профессор, заведующая отделением химиотерапии онкогематологических заболеваний с блоком ТКМ ФЦСКЭ им. В.А. Алмазова
ВАбищев Р.И. – д.м.н., профессор отделения химиотерапии онкогематологических заболеваний с блоком ТКМ ФЦСКЭ им. В.А. Алмазова
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
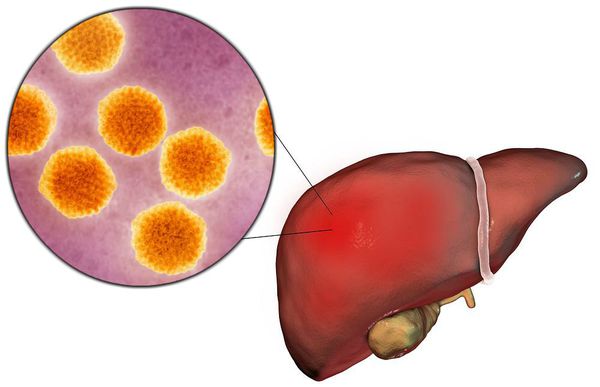
Этиология
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
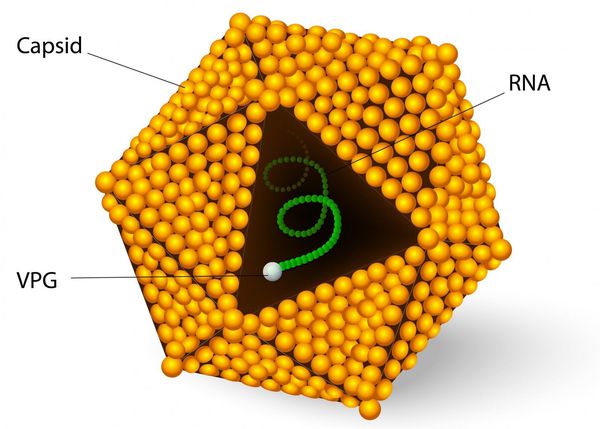
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
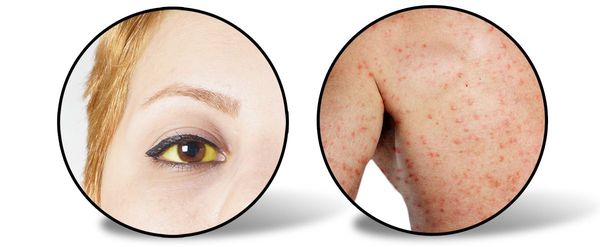
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
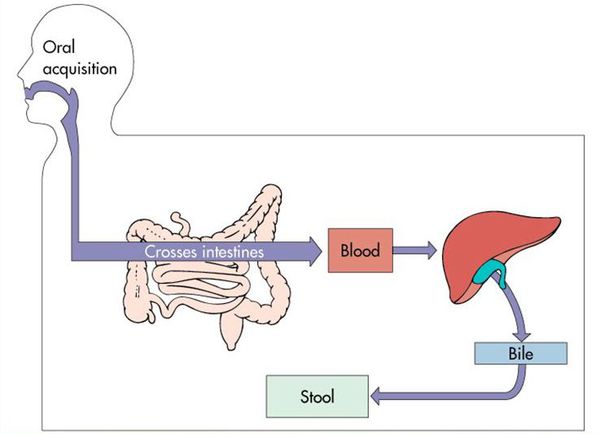
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
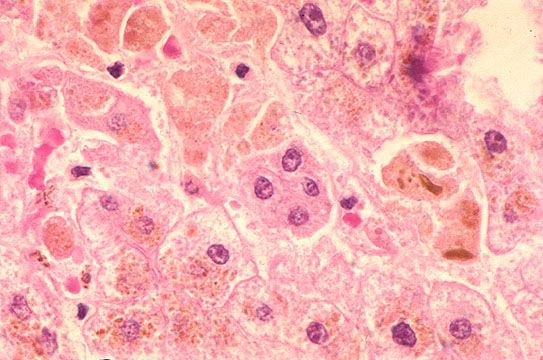
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
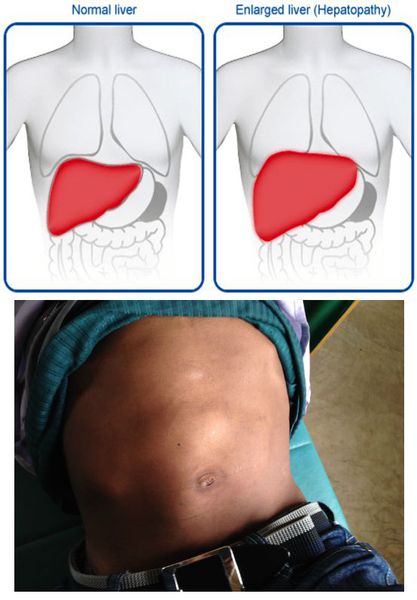
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
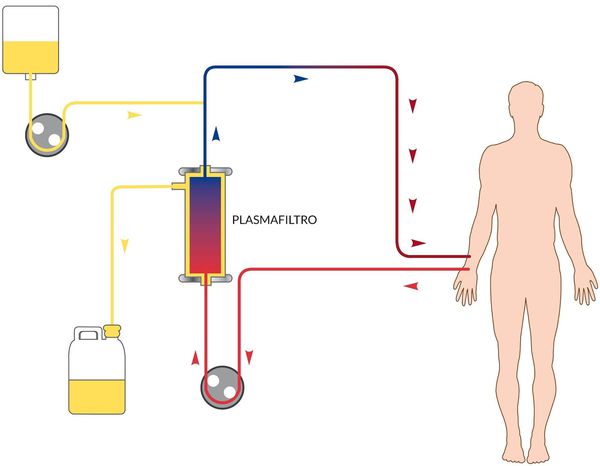
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.
Читайте также:

