Необходимо подавляет иммунную систему человека вирус вызывающий
Обновлено: 18.04.2024
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
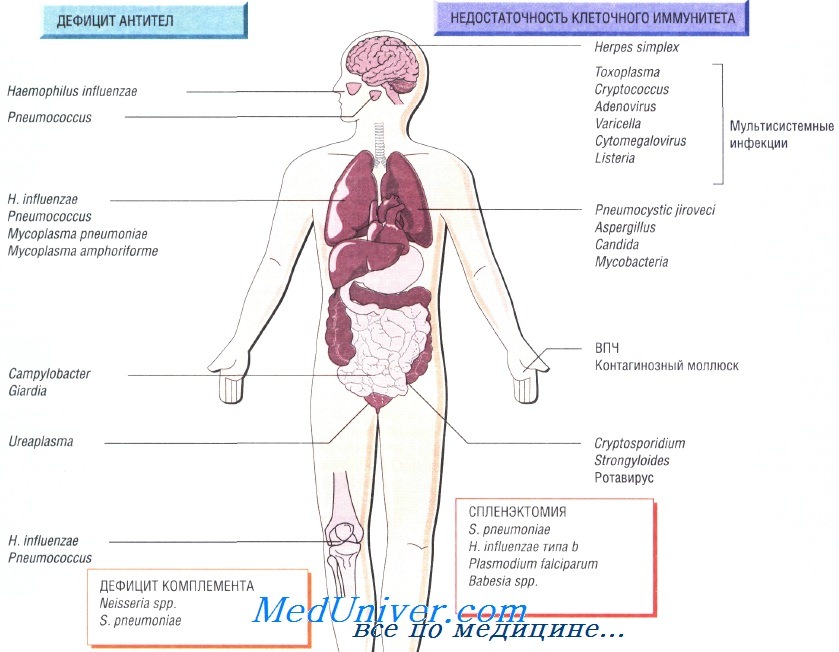
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Лекарства подавляющие иммунитет (иммунодепрессанты)
Как профилактика отторжения трансплантата, так и лечение аутоиммунных заболеваний требуют подавления иммунных реакций. Однако иммунная супрессия влечет за собой ослабление защитных сил против инфекционных возбудителей и повышение риска развития опухоли в отдаленный период.
Специфический иммунный ответ начинается со связывания антигена лимфоцитами, несущими рецепторы с соответствующим антигенсвязываю-щим участком. В-лимфоциты распознают структуры поверхностного антигена с помощью мембранных рецепторов, которые похожи на образованные впоследствии антитела. Т-лимфоцитам (и интактным В-клеткам) требуется антиген на поверхности макрофагов или других клеток в сочетании с главным комплексом гистосовместимости (МНС); последний обеспечивает распознавание антигенных структур посредством рецепторов Т-клеток. Т-хелперы несут комплексы CD3 и CD4, цитотоксические Т-клетки — комплекс CD8.
Интерлейкин-1 образуется макрофагами, а другие интерлейкины (IL), в т. ч. IL-2, образуются Т-хелперами. При пролиферации антигенспецифических лимфоцитов запускается иммунная защита. I.
I. Воздействие на распознавание антигена. Муромонаб CD3 — моноклональное антитело, направленное против CD3 мышей, которое блокирует распознавание антигена Т-лимфоцитами (используется при отторжении трансплантата).
Глатирамера ацетат состоит из пептидов различной длины, полимеризованных в случайной последовательности из аминокислот глутамина, лизина, аланина и тирозина. Его используют при лечении рассеянного склероза наряду с IFN-β. Данное заболевание является результатом аутоагрессии Т-лимфоцитов направленной против олигодендроцитов, которые образуют миелиновые оболочки аксонов ЦНС.
Причинный антиген, очевидно, является основным миелиновым белком. Глатирамер имеет сходство с последним. Блокируя рецепторы антигена, он нарушает распознавание антигена лимфоцитами.
Абатацепт — слитный белок, состоящий из инертной молекулы лимфоцита CD28 и Fc-фрагмента антитела. Он имитирует физиологическое торможение в результате антигенной стимуляции Т-клеток и применяется при ревматоидном артрите.
Циклоспорин и родственные соединения ингибируют продукцию цитокинов, в частности IL-2. В отличие от глюкокортикоидов его применение не сопровождается множеством сопутствующих метаболических эффектов.
Анакинра — рекомбинантная форма эндогенного антагониста рецепторов IL-1, применяется при ревматоидном артрите.
Даклизумаб и базиликсимаб являются моноклональными антителами против рецепторов IL-2. Они состоят из Fab-фрагмента мышей и Fc-фрагмента человека. Их используют для подавления реакций отторжения трансплантата.
III. Нарушение метаболизма клетки в результате подавления пролиферации. В дозах ниже, чем требуюгся для лечения злокачественных опухолей, некоторые цитостатики также используются для иммуносупрессии (азатиоприн, метотрексат и циклофосфамид). Антипролиферативный эффект неспецифичен для лимфоцитов и касается как Т-, так и В-клеток.
Микофенолата мофетил оказывает более специфическое действие на лимфоциты, чем на другие клетки. Он ингибирует инозинмонофосфатдегидроге-назу, которая катализирует синтез пуринов в лимфоцитах. Препарат используется при острых реакциях отторжения ткани.
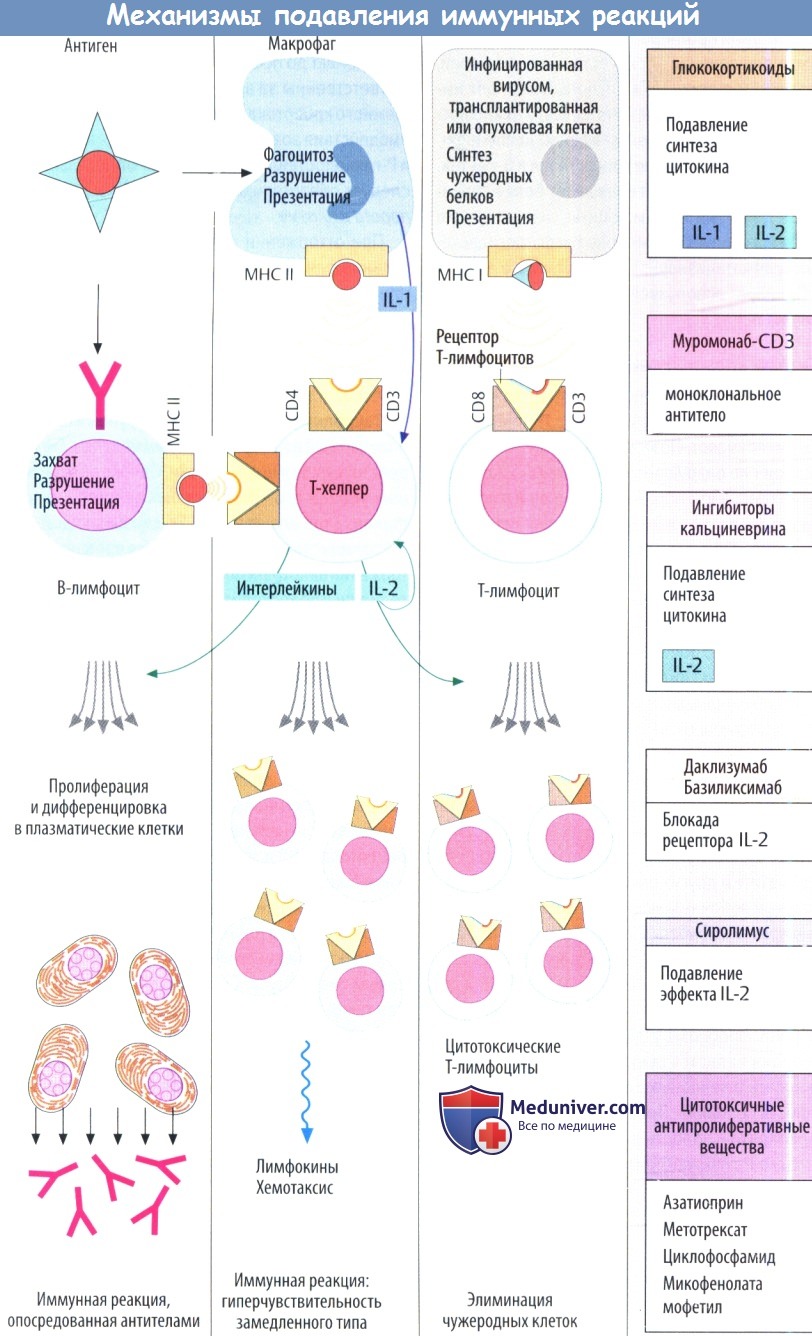
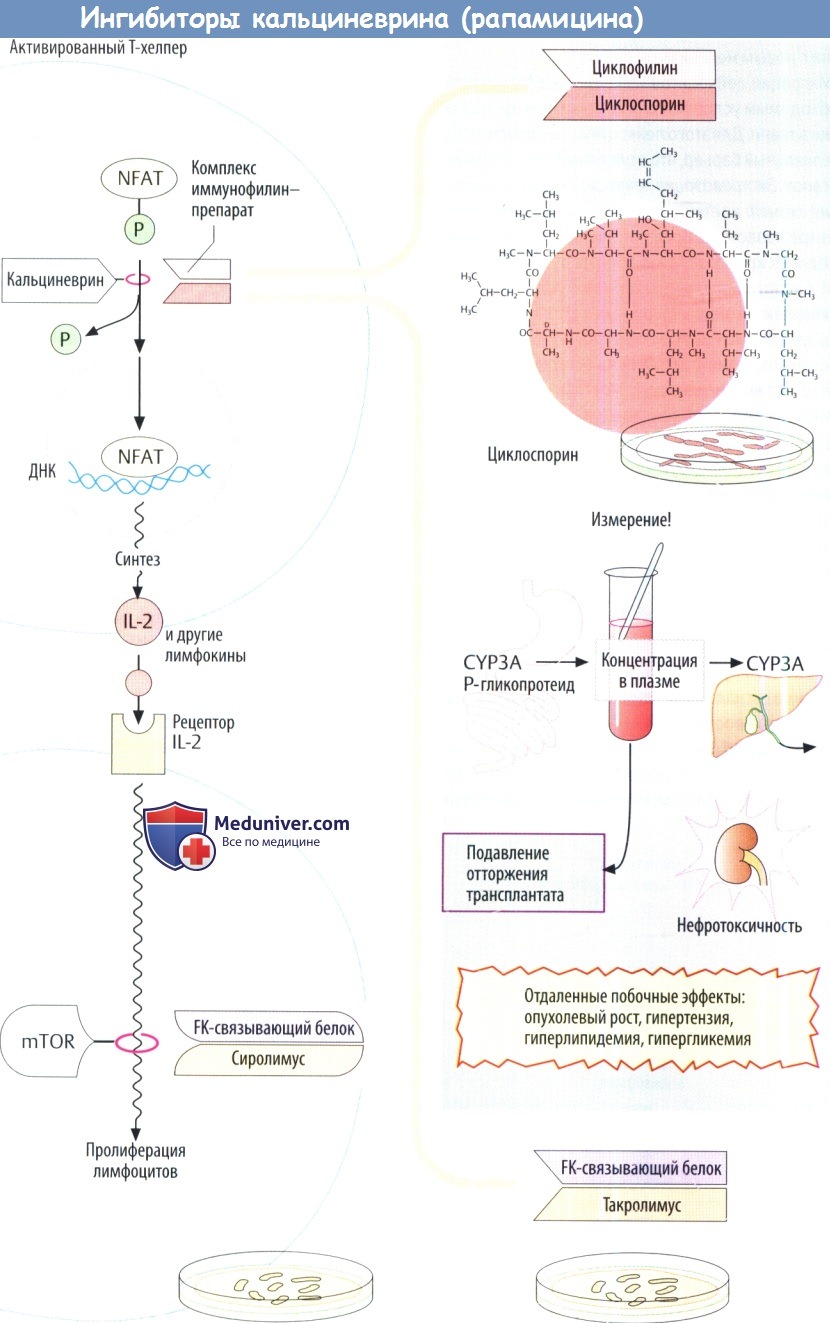
IV. Ингибиторы кальциневрина (сиролимус). Циклоспорин имеет грибковое происхождение. Он является пептидом, состоящим из 11 отчасти атипичных аминокислот. Поэтому при введении внутрь циклоспорин не разрушается желудочно-кишечными протеазами. В клетках Т-хелперов он ингибирует продукцию IL-2 за счет изменения уровня регуляции транскрипции. Обычно ядерный фактор активированных Т-клеток (NFAT) стимулирует экспрессию IL-2. Это требует дефосфорилирования предшественника, фосфорилированного NFAT, с помощью фосфатазы кальциневрина, что обеспечивает поступление NFAT в клеточные ядра из цитозоля.
Циклоспорин связывается с белком циклофилином внутренней среды клетки, а образующийся комплекс ингибирует кальциневрин и, следовательно, продукцию IL-2.
Достижения в современной трансплантологии связаны в основном с введением в практику циклоспорина. В настоящее время он также используется при некоторых аутоиммунных заболеваниях, атопическом дерматите и других расстройствах.
Основным побочным эффектом циклоспорина является нефротоксичность. Поэтому его дозу необходимо титровать таким образом, чтобы уровень препарата в крови не был слишком высоким (риск повреждения почек) и не слишком низким (реакция отторжения). Проблема усложняется еще и тем, что циклоспорин является веществом, которое трудно использовать в лечебных целях. Пероральная био-доступность неполная. Происходит обратный транспорт препарата в полость кишечника посредством выносящего Р-гликопротеидного насоса в дополнение к метаболизму цигохромоксидазами подгрупп 3А.
Печеночные изоферменты CYP3A4 способствует выведению до поступления в системный кровоток и ответственны за выведение циклоспорина из системного кровотока. Различные лекарственные взаимодействия возникают в результате влияния CYP3, и Р-гликопротеида. При подборе оптимальной дозы следует обязательно контролировать уровень препарата в плазме.
При отторжении трансплантата требуется длительное лечение препаратами, вызывающими супрессию. Длительная иммуносупрессия несет в себе повышенный риск развития злокачественных опухолей. Факторами риска сердечно-сосудистых заболеваний могут быть нежелательные реакции — критический и важный момент в отдаленном прогнозе
Сиролимус (рапамицин) — еще один макролид, продуцируемый Streptomyces hydroscopicus. Иммуносупрессивное действие не связано с ингибированием кальциневрина. Он образует комплекс с FK белком, вызывая особые конформационные изменения, а комплекс далее ингибирует фосфатазу mTOP (мишени рапамицина млекопитающих). Последний управляет сигнальным путем, который начинается рецептором IL-2 и заканчивается активацией митоза в лимфоцитах. Следовательно, сиролимус ингибирует пролиферацию лимфоцитов. Препарат одобрен для профилактики отторжения трансплантата.
Структура и действие эверолимуса аналогичны таковым сиролимуса. Сиролимус также используется для покрытия стентов, которые установлены в атеросклеротических коронарных артериях для сохранения просвета сосудов после баллонной дилатации. Сиролимус предназначен для остановки процессов пролиферации в сосудистой стенке, которая может привести к сужению просвета. Темсиролимус используется при лечении почечноклеточного рака.
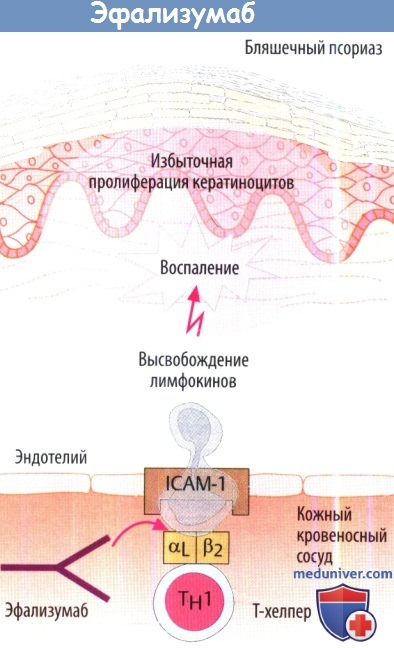
V. Ингибиторы миграции лейкоцитов. Натализумаб и эфализумаб — блокаторы интегрина с новым механизмом действия.
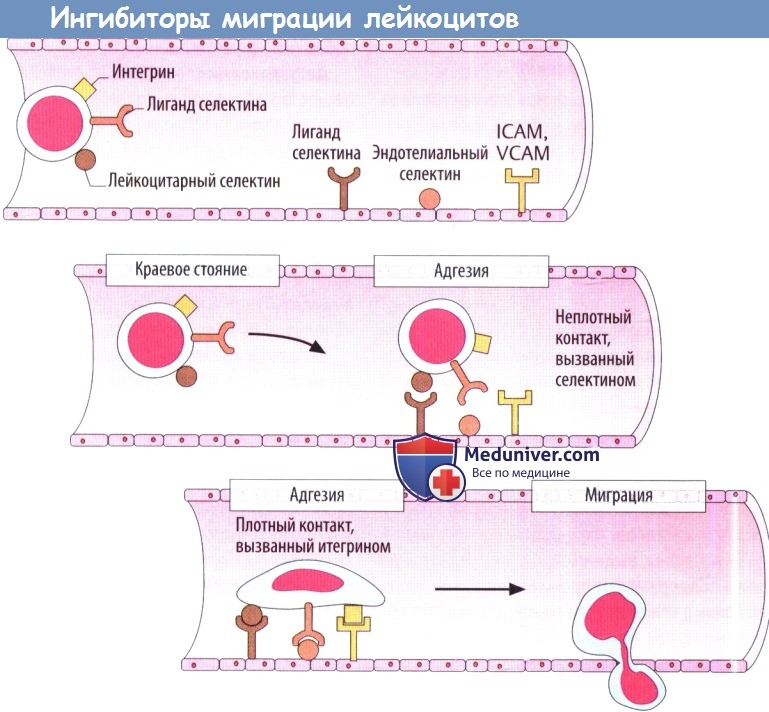
Миграция лейкоцитов из кровотока является необходимым условием для переноса иммунной реакции в ткани. Для этого лейкоциты преодолевают эндотелиальный барьер, что осуществляется в несколько этапов. Экстравазация лейкоцитов в месте повреждения тканей: клетки крови обычно располагаются в центре кровотока. Воспалительная вазодилатация замедляет кровоток, а лейкоциты лучше контактируют с эндотелиальными клетками. Адгезия: между лейкоцитами и эндотелиальными клетками образуются адгезивные мостики.
В первую очередь селектины с некоторыми углеводными остатками контактируют со смежными клетками. Мостики нестабильные, но открываются повторно, что замедляет движение лейкоцитов к эндотелию. Стабильная адгезия с остановкой лейкоцитов обусловлена интегринами в лейкоцитах и белками адгезии в эндотелии (ICAM — внутриклеточная молекула адгезии; VCAM — сосудистая клеточная молекула адгезии). Эндотелиальные клетки в воспаленной области связывают большее количество белков адгезии на мембране. Лейкоциты движутся между контактами эндотелиальных клеток, затем проходятсквозьокружающиебазальные мембраны и мигрируют в ткань, притягиваемые хемотаксическими сигнальными веществами, которые продуцируются при воспалений.
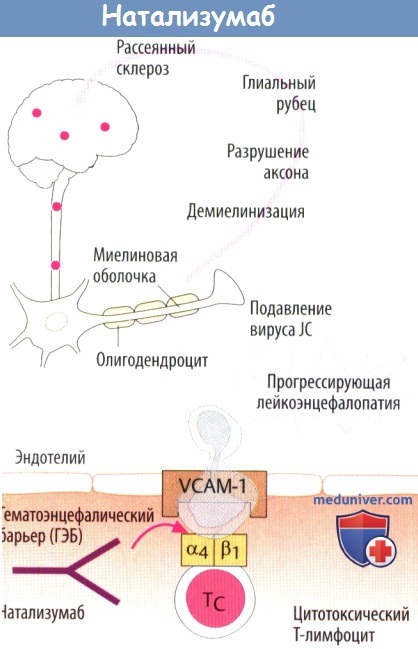
Натализумаб — человеческие антитела против α4-субъединицы интегринов. Интегрины являются гетеродимерными белками, состоящими из субъединиц α и β. Существуют разные изоформы. Связывание натализумаба блокирует миграцию Т-лимфоцитов в ЦНС. Это можно использовать при лечении рассеянного склероза. При данном аутоиммунном заболевании цитотоксические Т-лимфоциты атакуют олигодендроциты, которые продуцируют миелин в ЦНС. Редкой, но очень опасной нежелательной реакцией является прогрессирующая мультифокальная лейкоэнцефалопатия.
Она возникает в результате растормаживания вируса JC (от инициалов пациента у которого впервые выделен вирус). Данный вирус широко распространен, но обычно контролируется иммунной системой. Натализумаб является резервным препаратом, и его нельзя вводить вместе с другими иммуносупрессивными средствами против рассеянного склероза (IFN-β, глатирамера ацетат).
Эфализумаб используют при умеренной и тяжелой формах бляшечного псориаза. Известно, что данное заболевание аутоиммунное. Эфализума действует против а-субъединицы (αL, также известной как CD11) интегрина (LFA-1) Т-хелперов. Это останавливает миграцию лимфоцитов из сосудистого русла. Кроме того, блокируется контакт с клетками пораженной области кожи (клетки, несущие антиген кератиноциты). Побочные эффекты: выраженные гриппоподобные симптомы, повышение числа лимфоцитов. Из-за случаев прогрессирующей мультифокальной лейкоэнцефалопатии, о которых сообщалось у некоторых пациентов после лечения эфализумабом, данный препарат в настоящее время не используется в США и ЕС.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Авторы
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Чтобы защитить нас от опасных заблуждений, давайте разберемся:
- как устроен вирус ;
- зачем вирусу попадать в организм человека;
- как иммунитет реагирует на вирусы;
- как медицина может помочь иммунитету, если сам он не справляется.
В статье речь идет в основном о новом коронавирусе. — Ред.
Видео. Вирусы и иммунитет: кто кого?
Как устроен вирус
Человек состоит из клеток, в которых очень важную роль играют белки. В ядре клетки хранится ДНК: все вы, наверное, видели картинки с этими переплетенными нитями из разноцветных кусочков.

Кусочки эти одинаковые у всех: и у людей, и у животных, и у растений, и у вирусов. Именно последовательность кусочков ДНК определяет особенности белков в нашем организме, а значит, влияет на наш внешний вид, работу органов и состояние здоровья.
Чтобы разобраться, как клетки производят белки, давайте представим следующее.
Допустим, вы производите посуду. Суперценный образец хранится в сейфе, и вы не готовы вынимать свой эталон из сейфа, даже чтобы сделать новый экземпляр. Поэтому специальный человек прямо в сейфе делает слепок кружки и приносит этот слепок рабочим, которые изготовят новую кружку по форме, получая от курьеров необходимые кусочки материала.

В ядре клетки, как в сейфе, хранится ДНК. С помощью белков-ферментов с ДНК снимается копия — информационная РНК. РНК попадает в рибосому, где начинается сборка белка. А транспортная РНК подносит фрагменты, из которых и собираются белки .

Так работает производство белка не только у человека, но и у многих других живых существ.
Все они адаптируются к среде, как могут, чтобы выжить и дать потомство. Человек тоже приспособился, и в этом ему сильно помог головной мозг. Он позволил ему придумывать приспособления для выживания и передавать информацию другим людям. Благодаря обмену знаниями и их накоплению человек может жить очень долго, потому что поселился в прочных зданиях, изобрел множество приспособлений и научился справляться с болезнями [1].
Раньше людям с рождения угрожали хищники, погодные катаклизмы, огромное количество вирусов и бактерий. Оспа, чума, грипп, малярия, бешенство, энцефалит, столбняк — люди умирали сотнями и тысячами и от эпидемий, и от банальных царапин. Но благодаря достижениям медицины мы научились лечить и предотвращать многие из них [2], [3].
Сейчас может показаться, что этих угроз вообще никогда не существовало. А если окажется, что они существуют до сих пор, очень хочется обвинить кого-нибудь в их создании, как будто они сами не могли появиться из природы. Но вообще-то могли.
Зачем вирусу попадать в организм человека
Вирус отличается от других живых организмов, потому что не питается, не выдает отходы жизнедеятельности, не стареет (вокруг вирусов до сих пор идет дискуссия, стоит ли их вообще считать формой жизни). Но, как и мы, вирус размножается и может умереть. Вирус похож на флешку: снаружи оболочка с шипиками-разъемами для подключения, а внутри информация (ДНК или РНК).

С помощью шипиков вирус пытается попасть внутрь клетки организма, как флешка пытается подключиться к компьютеру. Если все получилось, вирус забирается внутрь, раздевается и начинает диверсию [4].
Если у вируса внутри ДНК, он контрабандой доставляет ее в ядро, запускает копирование этой ДНК, создание РНК и далее по порядку. Если это РНК, он просто подменяет родную РНК клетки на свою [5].
В обоих случаях клетка делает белки не для себя, а для новеньких вирусов.

Когда клетка изжила весь свой ресурс, она лопается. Оттуда прут детки-вирусы, которые с помощью своих шипиков проникают в другие клетки, и процесс повторяется [6], [7].
Как иммунитет реагирует на вирусы
Итак, в организм ворвался чужак, использует наши клетки. Организм должен как-то отреагировать.
Иммунная система как раз отвечает за способность человека противостоять внешним угрозам. Как происходит иммунная реакция именно на вирусы?
Ключевые иммунные клетки — это фагоциты, B-лимфоциты , T-хелперы и T-киллеры.
Латинская буква B происходит от латинского названия bursa fabricii — иммунного органа птиц, в котором их впервые обнаружили.

Когда вирус попадает в клетку, та выставляет на поверхности сигнал о том, что она болеет. На этот сигнал тревоги приходят T-киллеры и фагоциты и пытаются уничтожить зараженные клетки и вирусы.

По пути фагоциты хватают сигнальную метку и передают ее T-хелперам. Это клетки-курьеры, которые отправляют полученный материал на изучение B-лимфоцитам. Они разрабатывают специальное оружие против вирусов и зараженных клеток — антитела. Антитела, как черная метка, цепляются за пораженную клетку, и T-киллеры могут быстрее ее обнаружить.

Если метка зацепилась за вирус, на сигнал приходит еще одно оружие — система комплемента, похожая на гранату, которая срабатывает, если два кусочка гранаты соединить вместе.

То есть антитела — это ускоритель иммунной реакции, который обращает внимание T-киллеров на зараженные клетки и подключает систему комплемента. Таким образом организм справляется гораздо быстрее и теряет меньше здоровых клеток.
Часть B-лимфоцитов, изучив вирус, вместо того чтобы создавать антитела прямо сейчас, остается с новыми знаниями про запас, на случай повторного заражения, и превращаются в клетки памяти. Если организм столкнется с вирусом еще раз, то просто активирует клетки памяти. И мы получим моментальные точные выстрелы снайперов и гранатометчиков [8], [9].

Пока вся эта канитель происходит, человеку может стать так плохо, что потребуется госпитализация или даже реанимация. Но накопленный опыт, технологии и медицина как-то должны помогать таким пациентам.
Как медицина может помочь иммунитету, если сам он не справляется
На каком этапе иммунной реакции человек может вмешаться?
Начнем с этапа, когда вирус пытается взломать клетку. У коронавируса есть ключики от слизистых: можно потрогать зараженный объект руками и перенести заразу себе, прикоснувшись к лицу. Носители могут чихнуть или кашлянуть на вас. Капельки слюны распыляются, когда вы разговариваете или смеетесь [10].
С руками все просто: можно смыть верхний слой кожного жира, на котором остаются вирусные частицы. А вот клетки слизистых надо как-то отгородить, например, маской . Но она не защищает глаза. Вирусы, попадая на маску, никуда не исчезают — они там копятся. Важно не занести их, когда вы будете поправлять или снимать маску. А самодельные тканевые маски могут быть бесполезны, если у них широкие поры.
Кардинальный метод защиты (и пока лучший) — уйти на карантин. Но в таком случае плохо становится не здоровью людей, а экономике.
Поможет ли молитва? Нет, клетки устроены одинаково и у церковнослужителя, и у бабули, и у знаменитости.
Поможет ли водка от вируса? Нет. Когда вы пьете алкоголь, вы не дезинфицируете организм, а ослабляете его. Так иммунным клеткам придется даже сложнее [12].
Чеснок, имбирь и другие чудеса народной медицины не работают антисептиком [11]. Чтобы разрушить вирусную частицу, нужен раствор с содержанием спирта не менее 60%, например, специальный антисептик для рук. Им логично протирать руки, поручни, дверные ручки и мобильные телефоны.
Допустим, попадание вируса в организм предотвратить не удалось. Начинается месиво: фагоциты и T-киллеры не справляются, B-лимфоциты стараются делать антитела и клетки памяти, пока вирус вовсю использует наши клетки. За это время человеку может стать очень плохо.
Можно ли помочь B-лимфоцитам? Да, можно еще до заражения ввести мертвый вирус, кусок вируса или подобие вируса, чтобы B-лимфоциты потренировались и заранее сделали антитела. Такой метод называется прививкой [13–16].


Создание лекарств занимает годы. Нужно найти действующее вещество, способ доставлять его в клетки, сделать из него препарат, который не испортится при хранении и не убьет побочными эффектами .
Сайт-агрегатор отчетов по клиническим исследованиям — ClinicalTrials.gov.
Если человеку стало очень плохо, нужно поддержать его организм, чтобы он выжил, пока побеждает вирус. Для этого людям нужны койки в больницах, аппараты ИВЛ и врачи. Но если инфекция быстро распространяется, много людей одновременно нуждаются в помощи.
Напомним, что ивазивная ИВЛ травматична и сама по себе опасна: например, тем, что может повлечь за собой заражение пациента дополнительной внутрибольничной инфекцией. — Ред.

Чтобы люди не умирали без помощи медиков, нужно искусственно замедлить скорость распространения вируса — сидеть дома. Чем больше людей игнорируют карантин, тем больше тех, кому не хватит медицинской помощи, а значит, будет больше смертей [18].
Если организм справился с инфекцией, у него появляются клетки памяти, поэтому он не будет носителем и не заразит других людей. Если клетки памяти будут у большинства, появится коллективный иммунитет. В таких условиях человек из группы риска вряд ли встретит носителя. Когда все носители переболеют, вирус среди людей не будет встречаться.

Некоторые страны уже снимают карантин. Но еще не понятно, есть ли коллективный иммунитет и не вызовет ли это новую волну заражений. В случае с коронавирусом пока неизвестно, сколько живут клетки памяти [19].
В России все еще каждый день заболевает по 8–10 тысяч человек. Возможно, в вашем регионе пандемия только набирает обороты . А значит, любой человек на улице может оказаться носителем.
В наших силах если не остановить, то хотя бы замедлить темпы, чтобы люди не умирали без помощи медиков.
Что же делать людям в борьбе с вирусом?
Защищаться мытьем рук и антисептиками? Искать вакцину или лекарство? Ждать, когда появится коллективный иммунитет? Или замедлять социальную активность, чтобы одновременно не заболело много людей? Сейчас мы делаем всё сразу.
Большинство стран мира следуют рекомендациям ВОЗ. Сайт этой организации переведен на русский язык. Там можно найти комментарии к мифам о коронавирусе и официальные рекомендации как для медиков, так и для населения. Если кто-то предлагает вам чудесное лекарство от болезни, проверьте, написали ли о нем эксперты ВОЗ.
Читайте также:

