Неструктурные белки вирусов это
Обновлено: 22.04.2024
Вирус гепатита В и его антигены
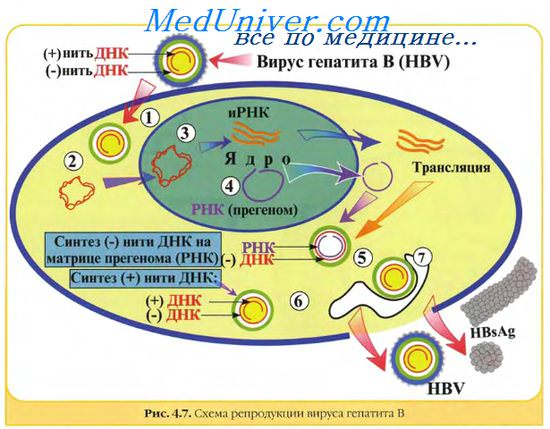
Среди вирусов, вызывающих гепатит у людей, HBV — единственный ДНК-содержащий вирус. Размер его генома всего 3,2 Кб, т. е. это мельчайший из ДНК-содержащих вирусов, вызывающих инфекционные заболевания у человека. Кольцевая ДНК вируса имеет двухцепочечную структуру лишь на протяжении части своей длины, тогда как значительный участок ДНК варьирующего размера остается одноцепочечным. Эндогенная ДНК-полимераза позволяет вирусу достраивать недостающий участок второй цепи из присутствующих в клетке нуклеотидов на основе вирусной матрицы.
Перед репликацией генома вирус синтезирует прегеном, представляющий собой полномерную одноцепочечную РНК-копию DNA HBV. Далее, используя эту РНК-копию в качестве матрицы, вирусная ДНК-полимераза (обратная транскриптаза) синтезирует ДНК-геном. Таким образом, HBV обладает главным свойством ретровирусов — способностью к обратной транскрипции. Полномерная прегеномная РНК выполняет также и вторую функцию: она служит матрицей для трансляции вирусных белков. Вирион состоит из белково-нуклеинового комплекса — нуклеокапсида, окруженного оболочкой — липопротеиновой мембраной.
Липиды оболочки представлены триглицеридами, фосфолипидами и холестерином, причем все они являются продуктами клетки хозяина. Нуклеокапсид имеет форму икосаэдра, присущую белку core (HBcAg) и содержит вирусную ДНК и полимеразу. Оболочка тесно связана с поверхностным (S-) антигеном (HBsAg) — трансмембранным белком, существующим в трех сходных формах. Все три формы белка являются продуктами одного гена, транслируемыми в S-OPC (открытую рамку считывания), но имеют три разных сайта начала трансляции (ATG). Общий стоп-кодон (ТАА) объясняет идентичность карбокситерминальной части всех трех форм белка.
Эти все формы, охарактеризованные пока неполностью и все вместе, называют поверхностным антигеном вируса гепатита В (HBsAg). HBsAg первоначально называли антигеном гепатита, или антигеном, связанным с гепатитом или австралийским антигеном.
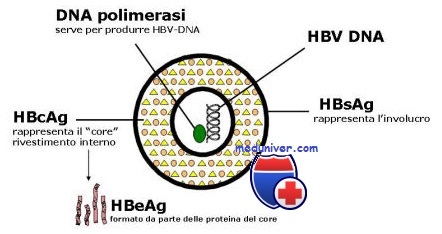
Геном HBV содержит 4 взаимно перекрывающихся открытых рамки считывания. По конечным продуктам экспрессии 4 ОРС названы: S (поверхностные белки), Р (полимераза), С (core) и X. В участке генома S выделяют области S, преSl и преS2. Область S кодирует основную, наименьшую по размеру форму HBsAg, состоящую из 226 аминокислот. Это наиболее обильно экспрессируемый белок вириона, составляющий также основную часть сферических и тубулярных частиц. Аббревиатуру HBsAg иногда применяют в узком смысле именно для обозначения этого белка.
Важным элементом стабилизации его трехмерной структуры служат дисульфидные связи. HBsAg — важнейший антиген HBV, так как именно он содержит эпитопы, к которым вырабатывается защищающий от HBV иммунитет и служит основным компонентом коммерческих вакцин. Установлено, что присутствие в сыворотке одних только антител к HBsAg достаточно для защиты от HBV-инфекции [5, 10]. Средняя по размеру форма HBsAg кодируется областями S и preS2 и содержит дополнительные 55 аминокислот, а максимальная по размеру форма кодируется областями S, preS2 и preSl и содержит еще 119 или 108 аминокислот в зависимости от субтипа (генотипа) вируса. Мембрана ьириона содержит смесь всех трех форм HBsAg как в гликозилированной, так и негликозилированной форме. Известно 6 генотипов HBV, обозначаемых латинскими буквами A-F. В основе разделения HBV на различные генотипы лежат отличия в последовательности нуклеотидов S-гена в сегменте между позициями 256 и 796.
Белок core (HBcAg) и секретируемый е-белок (HBeAg) являются продуктами гена pre-core и core и имеют примерно 160 общих аминокислот. HBeAg представляет собой полипептидный фрагмент HBcAg, подвергшийся посттрансляционному процессингу. HBeAg экспрессирован также на поверхности гепатоцитов и, по-видимому, служит важной мишенью для механизмов иммунитета, разрушающих гепатоциты. HBeAg индуцирует иммунологигескую толерантность и, таким образом, связан с хронической инфекцией.
Он также способен модулировать репликацию HBV, супрессируя инкапсулирование прегеномной РНК в нуклеокапсиды. Корпускулярный нуклеокапсидный антиген (HBeAg) в свободной форме может быть обнаружен в ядрах инфицированных гепатоцитов. В сыворотке крови его выявляют только в частицах Дейна.
Помимо структурных и секретируемых белков вирус способен синтезировать различные неструктурные белки. Ген Р кодирует вирусную ДНК-полимеразу (обратную транскриптазу). Р-ОРС перекрывает все другие ОРС вируса ГВ. Ген X кодирует Х-антиген (HBxAg), белок, биологические функции которого пока еще охарактеризованы неполностью. Известно, однако, что он играет регуляторную роль в процессе размножения вируса и способен активировать транскрипцию ДНК вируса при помощи ряда клеточных промоторов.
Структурные белки делятся на 2 группы:
1) капсидные белки, образующие капсид, т. е. футляр для нуклеиновой кислоты вируса (от лат. сарза — вместилище), и входящие в состав капсида геномные белки, и ферменты;
2) суперкапсидные белки, входящие в состав суперкапсида, т. е. наружной вирусной оболочки.
Просто организованные вирусы, представляющие собой нуклеокапсид, содержат только капсидные белки. Сложно организованные вирусы содержат капсидные и суперкапсидные белки.
В составе капсида некоторых вирусов (пикорнавирусы, паповавирусы, аденовирусы) содержатся белки, ковалентно связанные с вирусным геномом (геномные белки). Эти белки являются терминальными, т. е. соединенными с концом вирусной нуклеиновой кислоты. Функции их неразрывно связаны с функциями генома и их регуляцией.
У ряда сложно организованных вирусов в составе капсида имеются ферменты, осуществляющие транскрипцию и репликацию вирусного генома — РНК и ДНК (РНК- и ДНК-полимеразы), а также ферменты, модифицирующие концы иРНК. Если ферменты и геномные белки представлены единичными молекулами, то капсидные белки представлены множественными молекулами. Эти белки и формируют капсидную оболочку, в которую у сложно организованных вирусов вставлены молекулы белков с другими функциями.
Основным принципом строения капсидной оболочки вирусов является принцип субьединичности, т. е. построение капсидной оболочки из субъединиц-капсомеров, образованных идентичными полипептидными цепями. Правильно построенные белковые субъединицы — капсомеры возникают благодаря способности вирусных капсидных белков к самосборке. Самосборка объясняется тем, что упорядоченная структура — капсид имеет наименьшую свободную энергию по сравнению с неупорядоченными белковыми молекулами. Сборка капсидной оболочки из субъединиц запрограммирована в первичной структуре белка и происходит самопроизвольно или при взаимодействии с нуклеиновой кислотой.
Суперкапсидные белки. Гликопротеиды. Суперкапсидные белки, или пепломеры, располагаются в липопротеидной оболочке (суперкапсиде или пеплосе) сложно устроенных вирусов. Они либо пронизывают насквозь липидный бислой как, например, гликопротеиды альфа-вирусов (вируса леса Семлики), либо не доходят до внутренней поверхности. Эти белки являются типичными внутримембранными белками и имеют много общего с клеточными мембранными белками. Как и последние, суперкапсидные белки обычно гликозилированы. Углеводные цепочки прикреплены к молекуле полипептида в определенных участках. Гликозилирование осуществляют клеточные ферменты, поэтому один и тот же вирус, продуцируемый разными видами клеток, может иметь разные углеводные остатки: может варьировать как состав углеводов, так и длина углеводной цепочки и место прикрепления ее к полипептидному остову[18].

Основной функцией гликопротеидов является взаимодействие со специфическими рецепторами клеточной поверхности. Благодаря этим белкам осуществляется распознавание специфических клеточных рецепторов и прикрепление к ним вирусной частицы, т. е. адсорбция вируса на клетке. Поэтому гликопротеиды, выполняющие эту функцию, называют вирусными прикрепительными белками.
Другой функцией гликопротеидов является участие в слиянии вирусной и клеточной мембран, т. е. в событии, ведущем к проникновению вирусных частиц в клетку. Вирусные белки слияния ответственны за такие процессы, как гемолиз и слияние плазматических мембран соседних клеток, приводящие к образованию гигантских клеток, синци-тиев и симпластов.
Неструктурные белки. Неструктурные белки изучены гораздо хуже, чем структурные, поскольку их выделяют не из очищенных препаратов вирусов, а из зараженных клеток, и возникают трудности в их идентификации и очистке от клеточных белков.
К неструктурным белкам относятся:
1) предшественники вирусных белков, которые отличаются от других неструктурных белков нестабильностью в зараженной клетке в результате быстрого нарезания на структурные белки;
2) ферменты синтеза РНК и ДНК (РНК- и ДНК-26 полимеразы), обеспечивающие транскрипцию и репликацию вирусного генома;
4) ферменты, модифицирующие вирусные белки, например протеиназы и протеинкиназы.
Однако многие неструктурные белки при ряде вирусных инфекций еще не идентифицированы и функции их не определены. Типы структурных и неструктурных белков просто и сложно устроенных вирусов и их функции показаны на схеме (рис.6).
  Белки просто устроенных вирусов |

 Предшественники структурных | |
 | Капсидные |
 Структурные |  Полимеразы |
| Геномные | |
  Ферменты, модифицирующие белки | Неструктурные |
| Функции не идентифицированы |
  Белки сложно устроенных вирусов |
 | Капсидные |  Предшественники структурных | |
  В составе капсида | Геномные |  Полимеразы | |
 | |||
 Структурные | Полимеразы |   Регуляторы синтеза РНК, ДНК | Неструктурные |
| В составе суперкапсида |    | Белки слияния | Функции не идентифицированы |
| Ферменты, модифицир- ующие белки | |||
| Прикрепительные |
Рис. 6. Типы структурных и неструктурных белков просто и сложно устроенных вирусов.
Липиды вирусов
Липиды обнаружены у сложно организованных вирусов и в основном находятся в составе липопротеиднои оболочки (суперкапсида), формируя ее липидной бислой, в который вставлены суперкапсидные белки.
Все сложно организованные РНК-содержащие вирусы имеют в своем составе значительное количество липидов (от 15 до 35% от сухого веса). Из ДНК-содержащих вирусов липиды содержат вирусы оспы, герпеса и гепатита В. Примерно 50—60% липидов в составе вирусов представлено фосфолипидами, 20—30% составляет холестерин.
Липидный компонент стабилизирует структуру вирусной частицы. Экстракция липидов органическими растворителями, обработка вирусной частицы детергентами или липазами приводит к деградации вирусной частицы и потере инфекционной активности[19].
Вирусы, содержащие липопротеидную мембрану, формируются путем почкования на плазматической мембране клеток (или на мембранах эндоплазматической сети с выходом во внутриклеточные вакуоли). Поэтому липопротеидная оболочка этих вирусов представляет собой мембрану клетки-хозяина, модифицированную за счет наличия на ее наружной поверхности вирусных супер-капсидных белков. Из этого следует, что состав липидов почкующихся вирусов близок к составу липидов клетки-хозяина. К почкующимся вирусам относятся крупные
РНК-содержащие вирусы: ортомиксовирусы, парамиксо
вирусы, рабдовирусы, тогавирусы, ретровирусы, бунья
вирусы, аренавирусы, коронавирусы.
В связи с клеточным происхождением липидов общий состав липидной фракции и содержание ее отдельных компонентов у одного и того же вируса могут существенно различаться в зависимости от клетки-хозяина, где происходила репродукция вируса. Наоборот, если разные почкующиеся вирусы репродуцировались в одних и тех же клетках, их липиды оказываются более или менее сходными[20].
У вирусов оспы и гепатита В липиды имеют иное происхождение, так как эти вирусы не почкуются через плазматическую мембрану. У вирусов оспы липиды не образуют дифференцированной оболочки. Обработка вируса осповакцины эфиром не приводит к потере инфекционной активности или каким-либо структурным изменениям вириона. Липиды вируса гепатита В и его НВз-антигена образуются путем инвагинации мембран эндоплазматической сети. Вирус герпеса формируется путем почкования через ядерную оболочку, поэтому в его составе есть липиды ядерной оболочки.
Углеводы вирусов
Углеводный компонент вирусов находится в составе гликопротеидов. Количество Сахаров в составе гликопротеидов может быть достаточно большим, достигая 10—13% от массы вириона. Химическая специфичность их полностью определяется клеточными ферментами, обеспечивающими перенос и присоединение соответствующих сахарных остатков. Обычными сахарными остатками, обнаруживаемыми в вирусных белках, являются фруктоза, сахароза, манноза, галактоза, нейраминовая кислота, глюкозамин. Таким образом, подобно липидам, углеводный компонент определяется клеткой-хозяином, благодаря чему один и тот же вирус, Взращенный в клетках разных видов, может значительно различаться по составу Сахаров в зависимости от специфичности клеточных гликозилтрансфераз.
Углеводный компонент гликопротеидов играет существенную роль в структуре и функции белка. Он является каркасом для локальных участков гликопротеида, обеспечивая сохранение конформации белковой молекулы, и обусловливает защиту молекулы от протеаз. Возможны и другие функции углеводов, пока достоверно не установленные[21].
Заключение
В итоге работы можем сделать следующие выводы.
Вирусы — это неклеточные формы жизни, различимые только под электронным микроскопом. Это внутриклеточные паразиты. За пределами клетки они не проявляют своих свойств и имеют кристаллическую форму.
Наиболее просто организованные вирусы представляют собой нуклеопротеид, состоящий из нуклеиновой кислоты (ДНК или РНК) и белковой оболочки (капсида). Сложные вирусы могут иметь дополнительную оболочку из липопротеина. Некоторые вирусы (бактериофаги) имеют аппарат транспортировки своего генома в бактерии, после проникновения в клетку капсид остается за пределами клетки. Тело бактериофага имеет сложное строение, оно содержит головку, хвостик (трубку, через которую геном проталкивается в клетку) и хвостовые отростки.
В клетку вирусы могут попасть вместе с пиноцитозными пузырьками или путем погружения части оболочки клетки с приклеившимся к ней вирусом в цитоплазму, а также путем растворения оболочки клетки.
Вирусы вносят в клетку свою генетическую информацию, и клетка начинает производить подобные вирусы.
Внутри клетки начинает синтезироваться ДНК или РНК вируса и образуется множество вирусов. В результате клетка гибнет, и вирусы выходят наружу, заражая новые клетки. Встроенный в геном клетки геном вируса может существовать в таком виде долгое время.
Вирусы вызывают табачную мозаику у растений, оспу, грипп, полиомиелит, гепатит, СПИД у человека. Наибольшую опасность в наше время представляет вирус СПИДа. Он попадает в организм человека при переливании крови, при половых контактах. Этот вирус поражает клетки организма, отвечающие за иммунитет. В результате человек оказывается беззащитным перед инфекционными болезнями и быстро погибает.
Вирусы, благодаря мутированию и способности быстро размножаться внутри клеток, становятся устойчивыми к действию лекарств, и это обстоятельство затрудняет лечение таких вирусных заболеваний, как грипп, гепатит и др.
Список литературы
1. Агол В.И. Биосинтез вирусных нуклеиновых кислот // Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. М.: 1990.
3. Борисов Л.Б. Микробиология, иммунология, вирусология. М.: МИА, 2005. – 736с.
4. Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 17-19
5. Вилляреал Л. Вирус: существо или вещество? // В мире науки. 2005. - №3.
6. Вирусология. Под редакцией Филдса Б., Найта Д., тт. 1–3, М.: Медицина, 1989- 492с.
7. Дяченко С. С., Синяк К. М., Дяченко Н. С. Патогенные вирусы человека. – Киев: Здоров'я, 1980. – 448 с.
9. Микробиология и иммунология. / Под ред. А.А. Воробьева. – М.: Медицина, 1999. – 464с.
10. Николаев А.Я. Биологическая химия. – М.: МИА, 2004. – 566 с.
11. Поздеев О. К. Медицинская микробиология. – Москва: ГЭОТАР – Мед., 2001.
12. Прозоркина Н. В., Рубашкина Л. А. П 78 Основы микробиологии, вирусологии и иммунологии: Учебное пособие для средних специальных медицинских учебных заведений. — Ростов нД: Феникс, 2002. -416с.
13. Фролов А. Ф., Шевченко Л. Ф., Широбоков В. П. Практическая вирусология. – Киев: Здоровье, 1989.
[1] Прозоркина Н. В., Рубашкина Л. А. П 78 Основы микробиологии, вирусологии и иммунологии: Учебное пособие для средних специальных медицинских учебных заведений. — Ростов нД: Феникс, 2002. -416с.
[2] Вилляреал Л. Вирус: существо или вещество? // В мире науки. 2005. - №3.
[4] Агол В.И. Биосинтез вирусных нуклеиновых кислот // Молекулярная биология: Структура и биосинтез нуклеиновых кислот / Под ред. А.С.Спирина. М.: 1990. С. 260-333.
[5] Микробиология и иммунология. / Под ред. А.А. Воробьева. – М.: Медицина, 1999. – 464с. С. 44-45.
[7] Николаев А.Я. Биологическая химия. – М.: МИА, 2004. – 566 с.
[8] Фролов А. Ф., Шевченко Л. Ф., Широбоков В. П. Практическая вирусология. – Киев: Здоровье, 1989. с. 217 – 225.
[9] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 17-19
[10] Вирусология. Под редакцией Филдса Б., Найта Д., тт. 1–3, М.: Медицина, 1989- 492с.
[11] Поздеев О. К. Медицинская микробиология. – Москва: ГЭОТАР – Мед., 2001. С. 459 – 465.
[12] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 17-19.
[13] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 19-22.
[14] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 19-22.
[15] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 19-22.
[16] Дяченко С. С., Синяк К. М., Дяченко Н. С. Патогенные вирусы человека. – Киев: Здоров'я, 1980. – 448 с.
[17] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 22-27
[18] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 22-27.
[19] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 28
[20] Борисов Л.Б. Микробиология, иммунология, вирусология. М.: МИА, 2005. – 736с., С. 603.
[21] Букринская А.Г. Вирусология. – М.: Медицина, 1986. – 336с. С. 29-30.
Белки и антигены вируса гепатита С. Диагностика ВГС
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Химический состав вирусов. Вирусные геномы. Виды вирусных геномов.
Химический состав вирусов отличается от других форм жизни необычайной простотой. Кроме геномной ДНК или РНК вирусы позвоночных содержат белки, масса которых составляет 57—90% массы вириона. Количество вирионных белков может колебаться в широких пределах в зависимости от сложности строения вируса. Среди белков, кодируемых вирусным геномом, различают структурные и неструктурные вирусспецифические белки. Первые входят в структуру вириона, вторые не входят. Структурными белками являются капсидные белки, белки оболочки и в некоторых случаях белки тегумента и ферменты.
У многих вирусов некоторые структурные вирусные белки не являются первичными продуктами генов, а образуются в результате посттрансляционного расщепления полипептида-предшественника вирусспецифическими и клеточными протеазами.
Неструктурными вирусными белками являются белки, кодируемые вирусным геномом, но не являющиеся составными частями вириона. Одни из них участвуют в репликации вирусных компонентов, другие — в сборке вирионов, третьи нарушают нормальный клеточный синтез. Они включают различные типы репликаз, связанные с репликацией ДНК, транскриптазы, транскрибирующие мРНК на геномной дцДНК или дцРНК или (-)оцРНК, вирусные протеазы, геликазы и лигазы. У ретро- и гепаднавирусов найдена обратная транскриптаза, транскрибирующая ДНК на матрице РНК. У ретровирусов найден уникальный фермент, участвующий в интеграции ДНК-продукта в хромосомальную ДНК клетки. Вирусы оспы, которые размножаются в цитоплазме и имеют много уникальных ферментов для процессинга РНК-транскриптов и репликации вирусной ДНК, мало зависят от метаболизма клетки. Вирусные белки имеют молекулярную массу 5-200 кД. Наиболее просто устроенные вирусы (вирусы-сателлиты, дефектные вирусы) кодируют синтез только одного белка, многие патогенные вирусы кодируют синтез 5—10 белков, крупные вирусы, такие как вирусы оспы, герпесвирусы, кодируют синтез до 200 белков. Хотя это немного по сравнению с клетками прои эукариотов (кодируют соответственно более 5000 и 100000 белков).
Разные вирусы демонстрируют различные варианты стратегии экспрессии своих генов и репликации геномов.
Вирусные геномы. Виды вирусных геномов.
Все вирусные геномы являются гаплоидными, т.е. содержат одну копию каждого гена. Исключение составляют ретровирусы, которые обладают диплоидным геномом. Геномы ДНК-вирусов позвоночных представлены одной двуспиральной молекулой за исключением парво- и цирковирусов.
Геномы полиома-, папиллома-, гепадна- и цирковирусов представлены кольцевой ДНК. ДНК гепаднавирусов частично двуспиральная, частично односпиральная. ДНК вирусов полиомы и папилломы является суперспиральной. Большинство линейных вирусных ДНК обладает способностью приобрести циркулярную конфигурацию, которая требуется для репликации по вращающемуся кольцевому механизму. Две цепи ДНК вируса оспы ковалентно связаны своими концами и при денатурации образуют большое одноцепочечное кольцо. У некоторых ДНК-вирусов (так же как у РНК-ретровирусов) имеются концевые повторяющиеся последовательности. Инвертированные концевые повторы обнаружены у адено- и парвовирусов. У адено-, гепадна- и парвовирусов, так же как у некоторых РНК-вирусов (пикорна- и калицивирусов), с 5'-концом генома ковалентно связан белок, играющий важную роль в его репликации.
Все РНК-вирусы позвоночных за исключением рео- и бирнавирусов имеют одноцепочечные геномы. Геном некоторых РНК-вирусов состоит из нескольких (2-12) уникальных фрагментов, каждый из которых кодирует, как правило, один белок. РНК-вирусы с односпиральным геномом могут иметь различную полярность. Если они имеют ту же полярность, что и мРНК, то они могут прямо индуцировать синтез вирусного белка и считаются положительно (+) полярными.
Если геномная нуклеотидная последовательность комплементарна мРНК, то они считаются отрицательно (—) полярными. К ним относятся: парамиксо-, рабдо-, фило-, ортомиксо-, арена- и буньявирусы. Все они имеют вирионную РНК-зависимую полимеразу (транскриптазу), которая в инфицированной клетке транскрибирует положительно-полярную РНК на матрице геномной вирусной РНК. У аренавирусов, по крайней мере, у одного рода буньявирусов, один из РНК-сегментов является двуполярным. Обычно у (+)полярных РНК-вирусов З'-конец имеет polyA-последовательность, а 5'-конец имеет кэп-структуру.
Размер геномов РНК-вирусов (одноцепочечных 1,7—21 т.н.; двуцепочечных — 18—27 т.п.н.) значительно меньше размера генома многих ДНК-вирусов. Поэтому РНК-вирусы, как правило, кодируют меньше белков, чем ДНК-вирусы. Масса генома различных вирусов находится в пределах от 1 % (орто- и пара-миксовирусы) до 32% (парвовирусы) от массы вириона.
Различные семейства вирусов позвоночных значительно различаются по структуре и функции генома. Основные типы вирусных геномов можно представить следующим образом:
1) двуцепочечной линейной молекулой ДНК с открытыми (герпесвирусы, аденовирусы, иридовирусы) или ковалентно связанными концами (вирусы оспы, асфаровирусы);
2) одноцепочечной линейной молекулой ДНК (парвовирусы);
3) одноцепочечной кольцевой молекулой ДНК (цирковирусы);
4) двуцепочечной кольцевой молекулой ДНК (папилломавирусы, полиомавирусы);
5) частично двуцепочечной кольцевой незамкнутой молекулой ДНК (гепаднавирусы);
6) одноцепочечной молекулой РНК, являющейся мРНК (положительно-геномные вирусы: пикорнавирусы, тогавирусы, флавивирусы, астровирусы, калицивирусы, коронавирусы, артеривирусы, нодавирусы);
7) одноцепочечной единой (рабдовирусы, парамиксовирусы, филовирусы, бор-навирусы) или фрагментированнои (ортомиксовирусы) линейной молекулой РНК, комплементарной мРНК — отрицательно-геномные вирусы;
8) одноцепочечной фрагментированнои кольцевой ковалентно несвязанной отрицательной или двуполярной РНК (буньявирусы, аренавирусы);
9) двуцепочечной линейной фрагментированнои молекулой РНК (реовирусы, бирнавирусы);
10) двумя идентичными линейными молекулами плюс-РНК, являющимися матрицами для синтеза ДНК (ретровирусы).
Молекулярная масса ДНК различных вирусов позвоночных варьирует в широких пределах: от 0,7—1,5 МД у цирковирусов и парвовирусов, до 150—200 МД у вирусов оспы. Молекулярная масса генома у РНК вирусов колеблется менее значительно - от 2,0 до 20,0 МД.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

