Нет устойчивости к вирусам
Обновлено: 25.04.2024
Как появляется иммунитет к вирусам?
Так возникает иммунитет к вирусам, хорошо известным человеку. Но SARS-CoV-2 с нами меньше года и пока неясно, у всех ли появляется иммунитет к вирусу. Также неизвестно, защитит ли иммунитет от повторного заражения, а если нет – будет ли болезнь протекать легче.
Спасут ли нас антитела к COVID-19?
Спойлер: У большинства переболевших людей вырабатываются антитела к вирусу. Но нет уверенности, что они защитят от повторного заражения.
Какую информацию дают тесты на антитела?
Всегда ли появляются антитела к COVID-19?
У большинства пациентов с COVID-19 независимо от наличия симптомов вырабатываются антитела, среди которых преобладают именно нейтрализующие. При этом у некоторых пациентов с легким течением инфекции таких антител может быть мало или совсем не быть. Как правило, выявить IgM в сыворотке можно, начиная с 5–7 дня после возникновения симптомов, а через 28 дней их уровень начинает падать. Обнаружить антитела IgG можно на 7–10 день, их количество начинает уменьшаться примерно через 49 дней. Падение уровня антител часто вызывает опасения, что защита ослабнет и иммунитет пропадет. Но после острой фазы инфекции антител всегда становится меньше, поскольку производящие их В-клетки живут недолго.
Как долго сохраняются нейтрализующие антитела?
Недавно ученые проанализировали данные 30 082 пациентов, переболевших COVID-19 в легкой и среднетяжелой форме. У большинства из них нейтрализующие антитела сохранялись в течение пяти месяцев. Но для получения более точной картины за пациентами нужно наблюдать и дальше – хотя бы в течение года.
Судя по единичным случаям повторного заражения, антитела не гарантируют пожизненного иммунитета к SARS-CoV-2. И это нормально для респираторных инфекций. Иммунитет к коронавирусам, вызывающим MERS и SARS, длится как минимум пару лет, а к коронавирусам, вызывающим простуду – не больше года. Однако наличие антител с большой вероятностью должно смягчить симптомы в случае реинфекции (повторного заражения).
А если антител мало?
Для защиты от SARS-CoV-2 важно не только количество, но и качество антител. Например, у многих выздоравливающих пациентов мало антител, зато они очень хорошо нейтрализуют вирус. Но определять качество антител сложнее и дольше, чем измерять их уровень, поэтому такой подход встречается редко.
Даже отсутствие антител еще не означает отсутствия иммунитета к вирусу. Защищать могут и выжившие В-клетки памяти. Уже на ранних этапах повторной инфекции они быстро размножаются, что приводит к росту уровня специфичных антител.
Главный вопрос – какой уровень антител необходим для защиты. Зная это, мы сможем проводить вакцинацию более эффективно.
Можно ли надеяться на Т-клетки?
Спойлер: Т-лимфоциты могут защитить от SARS-CoV-2, даже если в организме мало специфичных антител или они еще не появились. Именно Т-клетки, а не антитела, могут быть наиболее важными для возникновения стойкого иммунитета к вирусу.
Как меняется уровень Т-клеток при COVID-19?
Уровень Т-клеток повышается как у переболевших COVID-19, так и у получивших одну из экспериментальных вакцин. Специфичные Т-лимфоциты появляются уже в первую неделю после заражения, а Т-клетки памяти – через 2 недели и остаются в организме более 100 дней с начала наблюдения. Если человек перенес COVID-19 бессимптомно и не выработал антитела, единственный способ подтверждения болезни – определение уровня специфичных Т-лимфоцитов. Но оценивать их количество дольше и сложнее, чем измерять уровень антител, поэтому такой метод практически не используют.
Может ли Т-клеточный иммунитет к SARS-CoV-2 быть у тех, кто не болел?
Можно ли повторно заразиться COVID-19?
Спойлер: Подтвержденные случаи есть, но их мало, и они не позволяют прогнозировать течение заболевания. Скорее всего, случаев повторного заражения будет все больше.
Многие ли заболевают повторно?
Как подтвердить повторное заражение?
Стандартные тесты ищут в мазках и образцах слюны генетический материал SARS-CoV-2 – молекулу РНК. В отличие от самого вируса она может долго – до нескольких недель – сохраняться в организме и стать причиной ложноположительного результата теста. Может показаться, что человек снова заразился, и болезнь протекает бессимптомно, но на самом деле это не так. А бывает и ложноотрицательный результат, когда недостаточно чувствительные тесты не находят вирусную РНК, несмотря на присутствие вируса в организме.
Чего ждать при реинфекции COVID-19?
Повторное заболевание может быть как бессимптомным, так и протекать тяжелее, чем в первый раз. Легкое течение инфекции может быть обусловлено защитой Т-клеток, а осложненное – более агрессивным штаммом вируса, чувствительность которого к антителам уменьшилась из-за мутаций.
Когда у нас будет коллективный иммунитет?
Спойлер: Нескоро. Переболело слишком мало людей, и вакцины пока не появились в широком доступе.
Что такое коллективный иммунитет?
Согласно концепции коллективного иммунитета, распространение заболевания в популяции прекращается, когда большая ее часть приобретает устойчивость к возбудителю. У каждого заболевания свой порог защиты – доля людей, у которых должен выработаться иммунитет. Он может возникать естественным способом – после болезни, или искусственным – в результате вакцинации.
Правда ли, что всем нужно переболеть COVID-19?
Полагаться на возникновение группового иммунитета после свободного распространения SARS-CoV-2 – неэтичная и, возможно, неэффективная стратегия. По мнению ВОЗ, в большинстве стран вирусом инфицировано менее 10% населения – значит, до всеобщей устойчивости еще далеко. При летальности инфекции примерно 0,3–1,3%, цена достижения коллективного иммунитета естественным путем может быть слишком высока. Нельзя не учитывать и риск осложнений у пациентов с COVID-19, а также чрезмерную нагрузку на систему здравоохранения, возникающую при таком подходе. Кроме того, мы мало знаем о надежности естественной защиты: возможно, для возникновения стойкого иммунитета нужно будет переболеть несколько раз.
Последний факт может стать проблемой и для вакцинации – более безопасного способа добиться коллективного иммунитета. Если защитный эффект антител будет недолгим, а SARS-CoV-2 продолжит изменяться, нам придется постоянно модифицировать вакцины и прививаться с определенной периодичностью – как в случае с вирусом гриппа.
Что будет дальше?
Пока никто не знает, как долго сохраняется иммунитет к SARS-CoV-2 и какой уровень антител и Т-клеток необходим для защиты. Но информация о новом коронавирусе постоянно обновляется, и со временем ученые найдут ответ на эти вопросы. Предварительные выводы делают на основе данных о родственных коронавирусах, а также исследований на животных и клинических испытаний вакцин, которые идут прямо сейчас. Кажется, что перенесенная инфекция в целом защищает от повторного заражения, подтвержденные случаи которого пока довольно редки. Но ситуация в любой момент может измениться – и к этому нужно быть готовым.
Благодарим врача-инфекциониста Оксану Станевич за помощь в подготовке текста
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.
по теме

Лечение
Лучшие научпоп-статьи 2018 года
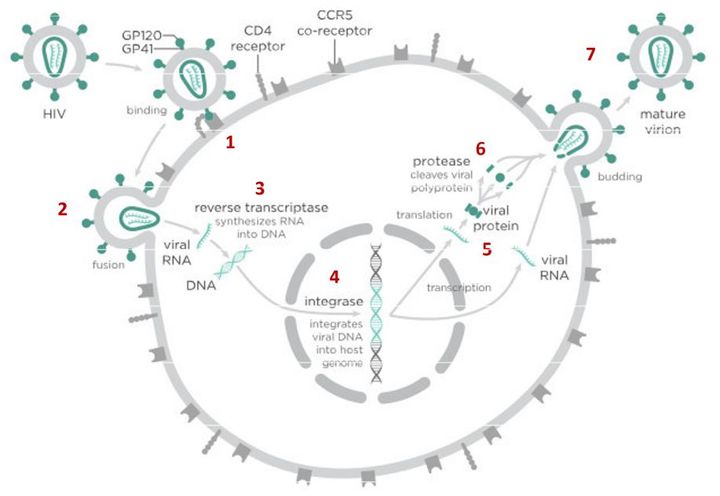
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.

На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Были времена, когда эпидемии чумы, чёрной оспы, холеры могли беспрепятственно выкосить целый город, когда практически все дети болели корью и скарлатиной, а многие — и дифтерией, и смертность от этих болезней порой превышала 50%.
Люди были бессильны перед инфекциями — выживали те, кому повезло. Успех таких мер как вакцинация (поначалу встречавшая отпор и непонимание) и введение противодифтерийной сыворотки резко подняли авторитет врача и медицины в целом. А с изобретением антибиотиков смертность от инфекций упала в десятки и сотни раз. Многие опасные заболевания (такие как чёрная оспа) были побеждены полностью, другие (чума, проказа) — стали редкостью. Даже нового грозного врага — ВИЧ — удалось взять под контроль антиретровирусной терапией. Казалось, что борьба с инфекциями отныне будет встречаться с трудностями скорее социальными, чем медицинскими.
Но появилась новая опасность — нарастание резистентности к антибиотикам.
Использование большего количества антибиотиков также может повысить шанс появления устойчивых микроорганизмов. Это часто происходит в больницах, где разные штаммы одного микроорганизма могут быстро и легко обмениваться между собой генетической информацией. Кроме того, во многих странах, в том числе и в России, антибиотики широко используются в растениеводстве, животноводстве, в пищевой и консервной промышленности. В результате антибиотики попадают в человеческий организм и оказывают негативное влияние на его микрофлору.

Быстрое развитие устойчивых к антибиотикам бактерий приводит к росту числа инфекций, которые трудно поддаются лечению. В 2018 году в США и Европе от устойчивых инфекций умерло около 50000 человек, а к 2050 году смертность может составить 10 млн человек в год по всему миру. Устойчивый к лекарственной терапии туберкулез уже сейчас уносит жизни многих россиян.
Неужели нас снова ждёт мир, где любая операция или открытый перелом грозят гибелью, а от пневмонии гибнет 30% заболевших? Затруднительным станет и лечение, снижающее иммунитет, например, химиотерапия рака. Одним словом, крах антибиотиков может привести к весьма неприятным последствиям для человечества. Что же делать?
Замедлить распространение резистентности
США и Европа осознали масштаб проблемы и действуют. Принимаются меры, позволяющие замедлить распространение резистентности к антибиотикам: в корм запрещают добавлять препараты, которые используют для лечения человека; а во многих европейских странах не разрешено использование антибиотиков для стимуляции роста животных и птиц.
Ведётся борьба с необоснованными назначениями антибиотиков при вирусных или грибковых инфекциях, самодеятельностью пациентов в антибиотикотерапии , более того запрещается продажа антибиотиков без рецептов. Вместо использования препаратов широкого спектра действия, по возможности, применяются препараты узкого спектра: при сфокусированном ударе по конкретному виду бактерий резистентность развивается медленнее.
И, разумеется, каждый человек может внести свой вклад в борьбу с резистентностью, принимая антибактериальные препараты строго по назначению врача, пропив курс антибиотика полностью, а не пять дней вместо десяти. Увы, пока развивающиеся страны (включая Россию) не включены в эту борьбу в полной мере.
Разрабатывать вакцины
Одним из решений проблемы устойчивости к антибиотикам является предупреждение развития инфекции, т.е. заражения. Для этого широко применяется вакцинация. В отличие от антибиотиков, к ним резистентность не вырабатывается: вакцина не борется с конкретными штаммами, а создает специфический иммунитет против них заранее.
В последнее время идет активная разработка новых антибиотиков , которые взаимодействуют с такими базовыми структурами внутри бактерии, что тем не удается с ходу изменить их и приспособиться.
Менахем Шоам из Кливлендского университета заражал мышей устойчивым к антибиотикам стафилококком (смертельной бактерией MRSA, против которой сейчас не существует никакого лечения), дожидался сепсиса и вводил им молекулы, которые не дают бактериям вырабатывать токсины. Все мыши выжили, в то время как без лечения умерло две трети зараженных животных.
Еще один способ усилить эффект антибиотика был предложен учеными из Бостонского университета. Они добавляли к антибиотику ионы серебра. Зная антисептические свойства серебра, исследователи предположили, что современный антибиотик при добавлении небольшого количества этого вещества может убить в 1000 раз больше бактерий.
Взять в союзники врагов наших врагов
Так, в 2018 году Грэм Хэтфул из университета Питтсбурга спас пятнадцатилетнюю девушку, больную муковисцидозом. После пересадки легких ее организм атаковали бактерии, устойчивые к антибиотикам, и она умерла бы, если бы не экспериментальное лечение: врачи ввели ей генетически модифицированные вирусы, убивающие этот вид бактерий. Девушка выздоровела, а бактерии не показали никаких признаков формирования устойчивости к вирусам.
Отучить бактерии вырабатывать резистентность
Кто быстрее эволюционирует — бактерии или мы? Ответ на этот животрепещущий вопрос мы узнаем через несколько десятилетий.
Читайте также:

