Обмен веществ вируса грипп
Обновлено: 25.04.2024
Рецепторы клеток в условиях вирусной инфекции.
Проблема адренергического контроля, да и вообще проблема передачи регуляторного сигнала внутрь клетки в условиях вирусной инфекции настолько сложна и интересна, насколько не изучена. Ведь даже выяснение роли липидов во взаимодействии вируса гриппа с клеткой-хозяином может пролить свет на понимание характера и причин изменений липидного матрикса мембран, опосредующего трансдукцию разнообразных регуляторных влияний в условиях вирусной инфекции.
Липиды вируса образуют бислой, присущий всем биологическим мембранам. Генез вирусной мембраны, представляющей дифференцированный сегмент плазматической мембраны клетки-хозяина, обусловливает высокую степень сходства этих мембран по липидному составу. Результаты изучения вируса гриппа и других оболочечных вирусов позволяют считать, что их липидный состав отражает состав доменов плазматической мембраны в момент сборки на них вирионов. Как известно, оболочки вирусов содержат значительно больше холестерина, чем мембраны клетки-хозяина.
Естественно, что в процессе инфекции, вызванной вирусом гриппа, липидный метаболизм клетки-мишени может модифицироваться. Если учесть, что эритроциты (наряду с лейкоцитами и макрофагами) рассматриваются как реальные вирусоносители не только при вирусемии в острый период, но и на этапе персистенции, а возможность прикрепления к эритроцитам и даже визуализация этого процесса убедительно продемонстрирована, то можно ожидать, что вирус способен индуцировать изменение микровязкости в эритроцитарных мембранах.

Эта модификация может быть обусловлена, в частности, обогащением вирусной мембраны холестерином. Кстати, только адсорбция на поверхности клеток оболочечных вирусов (в том числе вируса гриппа) сопровождается быстрым и значительным повышением текучести мембранных липидов инфицированных клеток.
Изменения микровязкости липидного матрикса при кратковременном и длительном воздействии на клетки-мишени, несомненно, могут модифицировать и рецепторно-мембранные события при опосредовании связывания самых различных лигандов (токсинов, медиаторов, гормонов, лектинов, антител). При этом для адренергической активации могут быть характерны так называемые парадоксальные ответы вследствие инверсии проведения сигнала.
Весьма любопытны данные о том, что неполный вирус гриппа по сравнению со стандартным вирусом характеризуется более низким содержанием холестерина и повышенной текучестью вирусной мембраны, что определяет низкую инфекционность неполного вируса, опосредующего развитие персистентной инфекции.
Подытоживая раздел об особенностях мембрано-рецепторных изменений при остром бактериальном и вирусном воспалении в бронхолегочной системе, необходимо еще раз подчеркнуть фрагментарность знаний по данной проблеме. Судя же по имеющимся данным, можно сделать вывод о том, что острая бактериальная и вирусная инфекция могут вызывать изменения конечного эффекторного механизма в адренореактивной системе, хотя конкретные звенья этой рецепторной системы (количество и аффинитет адренорецепторов, свойства сопрягающих N-белков, аденилатциклазы) не изучены.
По-видимому, существует обратимость изменений в мембрано-рецепторном комплексе, отражающая фазу воспаления.
И, наконец, - при вирусной инфекции наблюдаются наиболее выраженные изменения МРК, приводящие к формированию так называемых парадоксальных или извращенных конечных эффектов, а также к нарушениям негативного контроля в рецепторных системах.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Новость
Вирионы вируса гриппа штамма H1N1
Автор
Редактор
Возможность предсказывать эволюционную динамику вируса гриппа A чрезвычайно важна для здравоохранения: разработанная в соответствии с предсказаниями вакцина, применяющаяся во время сезонных вспышек заболевания, должна обеспечивать эффективную защиту от этой тяжелой инфекции, чреватой серьезными осложнениями. Аминокислотные замены в двух ключевых белках вируса гриппа A, взаимодействующих с иммунной системой, — нейраминидазе и гемагглютинине — происходят довольно часто и помогают вирусу избегать противодействия иммунной системы хозяина. Ученые из Сколковского института науки и технологий и других российских научно-исследовательских институтов показали, что для частоты таких аминокислотных замен характерна любопытная особенность: чем больше времени прошло с момента возникновения очередного варианта участка белка с антигенными свойствами, тем больше вероятность, что он будет заменен другим вариантом. Результаты этого биоинформатического анализа недавно были опубликованы в журнале PNAS.
Вирус гриппа A очень изменчив и постоянно подстраивается под иммунную систему хозяина с помощью аминокислотных замен в двух поверхностных белках, обладающих свойствами антигенов, — гемагглютинине (HA) и нейраминидазе (NA). Эти два белка уже стали классическими примерами, иллюстрирующими адаптивную эволюцию (рис. 1–3). Названия штаммов вируса гриппа также происходят от вариантов этих белков: так, название H1N1 означает, что вирусные частицы содержат гемагглютинин первого типа и нейраминидазу первого типа.

Рисунок 1. Общий вид вириона вируса гриппа A в разрезе

Рисунок 2. Молекула нейраминидазы, заякоренная в мембране вириона

Рисунок 3. Молекула гемаглютинина в мембране вириона
В гемагглютинине и нейраминидазе постоянно происходят несинонимичные аминокислотные замены, которые подхватываются или отбраковываются отбором. Но от чего зависит скорость эволюционирования определенных аминокислотных позиций? Как сообщается в недавней статье российских ученых, вышедшей в PNAS, важным фактором является время возникновения новой аллели (варианта гена): чем больший срок прошел с момента ее возникновения, тем выше вероятность появления в ней новых мутаций [1].
Стоит, однако, отметить, что предложенный авторами статьи подход имеет ряд ограничений. В частности, для правильных оценок времени возникновения варианта белка необходимо иметь достоверное филогенетическое дерево и восстановленный предковый вариант белка, что можно получить далеко не всегда. Тем не менее можно надеяться, что разработанный подход поможет улучшить наше понимание эволюционной динамики патогенов и принимать соответствующие меры по предотвращению вспышек и эпидемий, улучшая качество предсказаний при разработке вакцин.

Обзор
Автор
Редактор
Вирус гриппа

Рисунок 1. Вирус гриппа. Слева — электронная микрофотография вирионов гриппа, увеличение ≈100 000 раз. Справа — молекулярное строение вируса гриппа; из 11 вирусных белков, закодированных в геноме, состоящем из нескольких фрагментов РНК, подписаны только гликопротеины оболочки гемагглютинин ( HA ) и нейраминидаза ( NA ).
Впервые появившись в XVI веке, грипп вызывает регулярные эпидемии и пандемии, причём с серотипом А связывают эпидемии с промежутками 2–3 года (наиболее крупные эпидемии и пандемии сведены в таблицу), а с серотипом B — каждые 4–6 лет. Серотип С эпидемий не вызывает; исключение составляют единичные вспышки у детей и ослабленных людей.
| Год | Серотип | Распространение |
|---|---|---|
| 1889–1890 | H2N8 | Тяжёлая эпидемия |
| 1900–1903 | H3N8 | Умеренная эпидемия |
| 1918–1919 | H1N1 | Тяжёлая пандемия [1] |
| 1933–1935 | H1N1 | Средняя эпидемия |
| 1946–1947 | H1N1 | Средняя эпидемия |
| 1957–1958 | H2N2 | Тяжёлая пандемия |
| 1968–1969 | H3N2 | Умеренная пандемия |
| 1977–1978 | H1N1 | Средняя пандемия |
| 1995–1996 | H1N1 и H3N2 | Тяжёлая пандемия |
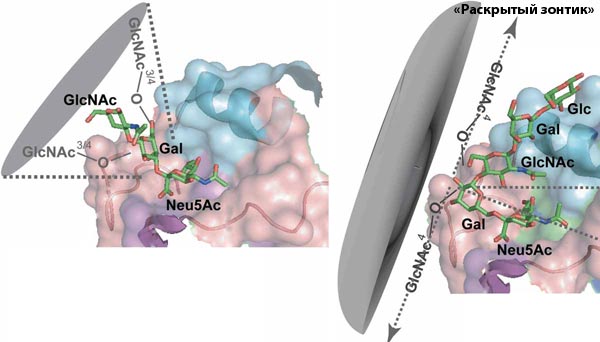
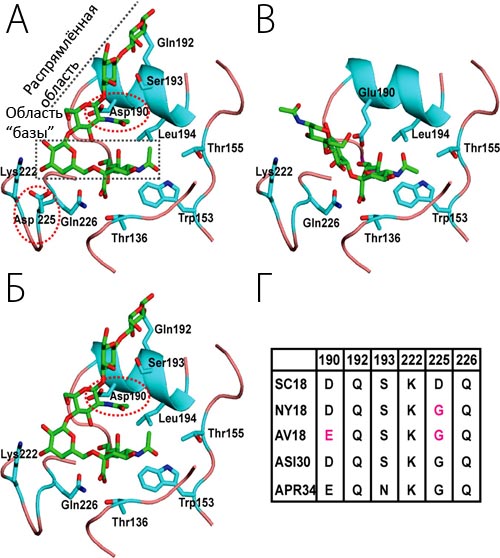
Переборов сопротивление ослабленных ресничек, возбудитель попадает в носоглотку и поддается действию высокоактивного секрета клеток. Белки секрета слизистых желез способны неспецифически ингибировать гемагглютинирующую и инфекционную активность вируса гриппа. Это действие обусловлено наличием в секрете гликопротеидов, которые содержат значительное количество N-ацетилнейраминовой кислоты. Существуют сезонные колебания содержания ингибиторов. Наиболее активны они в летне-осенний период, а в период эпидемии гриппа (зима) содержание ингибиторов снижается. Погибшие клетки отрываются и захватываются макрофагами, а также удаляются с секретом дыхательных путей. В подслизистом слое в результате высвобождения биологически активных веществ (гистамин, серотонин, кинины, простагландины) возникает реакция сосудов, форменных элементов крови, образование мелких тромбов и кровоизлияний, диапедез мо-нонуклеаров и нейтрофильных лейкоцитов, отек, местные нарушения метаболизма, изменения рН среды в кислую сторону и тому подобное. При этом патологический воспалительный процесс наиболее выражен в трахее и бронхах.
Наличие токсикоза при гриппе является существенной особенностью патогенеза. Симптомы интоксикации являются следствием резорбции токсичных субстанций вирусов, продуктов нарушенного обмена веществ, что прямо или опосредованно влияет на органы и системы. Вирус обладает токсическим действием на сосудистую систему, значительно повышая проницаемость и ломкость сосудов, что в комплексе с расстройствами микроциркуляции может приводить к развитию геморрагического синдрома. В возникновении циркуляторных расстройств, кроме прямого действия на сосудистую стенку, большое значение имеет нейротропность вируса. Характерны фазовые повреждения вегетативной нервной системы, касающиеся двух ее частей (симпатической и парасимпатической): гипертензия изменяется гипотензией, тахикардия — брадикардией, повышается секреция слизи в дыхательных путях, появляется потливость.
Проникая в более глубокие слои эпителия, вирус встречается со второй линией специфической обороны (интерферон, циркулирующие антитела классов IgM, IgG, IgE, температурная реакция). Механизмы иммунного ответа при гриппе представлены на рис. 3.
Рис. 3. Механизмы иммунного ответа при гриппе
При гриппе в ответ на инфицирование развиваются ранние цитокиновые реакции (РЦР) как наиболее быстрый ответ на вирус. Здесь мы имеем дело с естественным (врожденным) и наиболее распространенным вариантом РЦР на вирус гриппа как на внутриклеточного паразита, когда вирус сам включает систему интерферона, играя роль природного индуктора.
Каскад внутриклеточных событий, который наблюдается после внедрения вируса, обусловлен индукцией образования ИФН и в последующем разрушением вирусных информационных РНК, благодаря действию 2'-5'-олигоаденилсинтетазы и активации эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует а-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков. Все это приводит к угнетению репродукции широкого спектра РНК и ДНК-содержащих вирусов за счет прямого внутриклеточного антивирусного эффекта. Эти явления происходят в течение первых часов после проникновения вируса гриппа в организм.
Интерфероны (в первую очередь ИФН-b или так называемые интерфероны I типа) имеют способность к активации естественных киллеров (ЕК) и цитотоксических лимфоцитов. В результате на этом этапе вирусного инфицирования локально осуществляются три взаимосвязанных действия:
- внутриклеточная ингибиция интерферонами репродукции вирусов;
- удаление посредством ЕК и ЦТЛ инфицированного материала;
- защита вновь образованным интерфероном окружающих незараженных клеток от возможного заражения.
Интерферон распределяется по организму, связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. С интерферонсвязанных неинфицированных клеток вокруг очага вирусной инфекции образуется заслон для последующего распространения инфекции. Кроме того, интерферон активирует почти все иммунные реакции (модуляция взаимосвязи между эндокринной и иммунной системами, активация макрофагов, повышение цитотоксичности, стимуляция экспрессии антигенов ГКГ I и II классов).
Однако описанные эффекты ИФН нередко являются недостаточными для завершения инфекционного процесса. Подобное имеет место при сниженном сопротивлении организма, дефектности системы ИФН и иммунитета, неблагоприятной экологической ситуации, действии стрессов и др.
В итоге развивается острое заболевание, которое сопровождается продукцией каскада ранних цитокинов (второй этап РЦР), активацией CD4+ и CD8+ Е-клеток с последующим развитием специфического, опосредствованного Т- и В-клеточного иммунитета. В этих случаях кроме ИФН 1-го типа синтезируются такие ранние цитокины, как фактор некроза опухоли, образуются интерлейкины (IL) 1b, 6, 10 и 15, а также трансформирующий фактор роста (TGF). На этом этапе уже отмечается вариабельность РЦР при разных вирусных инфекциях. Продукция ИФН-b считается ключевым доминантным признаком инфицирования вирусом.
ИФН а/b вызывает лейкопению, лимфаденопатию, миграцию клеток из красной пульпы селезенки в белую пульпу, то есть происходит перераспределение клеток для последующих иммунорегуляторных эффектов. ИФН а/b могут усилить специфический иммунный ответ при гриппе в период первичной инфекции за счет притягивания популяции В- и Е-клеток в места воспаления для антигенной презентации.
Первыми на инфекцию начинают реагировать макрофаги, в них происходит расщепление вирусной частицы на отдельные пептиды, которые продвигаются к поверхности клетки, здесь (на мембране макрофага) они контактируют с молекулами ГКГ I и II классов. ИФН, который секретируется ИЛ-1, усиливает экспрессию антигена ГКГ. Выраженное синергичное действие ИЛ-1 и ИЛ-2 способствует пролиферации предшественников Т-клеток в вилочковой железе. В очаг инфекции направляются Т-лимфоциты (хелперы), которым и предоставляются фрагменты антигена в комплексе с молекулами ГКГ. В активации Т-хелперов принимают участие ИЛ-4, ИЛ-6 и ФНО. Возможна ситуация, когда Т-лимфоциты способны непосредственно связывать вирусные антигены при участии антигенов II класса ГКГ. Потом подключаются ЦТЛ и NK-клетки, которые являются основными факторами ликвидации инфицированных вирусом клеток. Но роль CD8+ ЦТЛ двойственна: с одной стороны, они более эффективно по сравнению с другими субпопуляциями элиминируют вирус из отделов нижних дыхательных путей, с другой — усиливают реакции локального воспаления, вызывая в эксперименте синдром респираторного дистресс-синдрома. Результатом этого взаимодействия может стать победа вируса, тогда макроорганизм подключает факторы гуморального иммунитета (местного и общего).
Основу специфического местного иммунитета составляет секреторный IgA. В его синтезе принимают участие клетки реснитчатого эпителия, макрофаги, Т-лимфоциты, клетки секреторного эпителия. Макрофаги, локализованные в пространствах между эпителиальными клетками, захватывают обломки разрушенных вирусом клеток, метаболизируют их. Антигены, подготовленные макрофагами, активизируют Т- и В-лимфоциты, которые превращаются в плазмоциты, продуцируют антитела класса IgA. Выполняя важные эффекторные функции, IgA играет роль молекулы, которая регулирует функции клеток иммунной системы, в частности альвеолярных макрофагов, несущих рецепторы к Fc-фрагменту этого Ig. Так, иммунные комплексы, которые содержат антитела класса А, индуцируют в моноцитах-макрофагах синтез ФНО-а и СЗ-комплемента С. Секреторные IgA связывают вирус и препятствуют его выходу из организма в активной форме, что ограничивает циркуляцию вируса среди людей.
При первой встрече с вирусом через 3-5 дней образуются антитела класса IgM. Повышение их содержания свидетельствует об остроте инфекционного процесса. Высокое содержание Ig в крови является показателем устойчивости организма к инфекции. IgE — единственный тип антител, который вступает во взаимодействие с мембраной тучных клеток (в клинической картине наблюдаются приступы бронхоспазма).
Иммунные механизмы при первичной встрече с вирусом запоминаются организмом в виде информации, заложенной в клетки памяти (иммунологическая память), и при повторной встрече с вирусом той же антигенной разновидности иммунные реакции протекают быстрее и более эффективно. Создание иммунной памяти об антигене является целью применения вакцин. С их помощью создается и поддерживается защитная концентрация противогриппозных антител. Антитела, вступая во взаимосвязь с антигеном, образуют иммунные комплексы. Иногда вместе с защитными функциями они могут стать причиной тяжелых иммунопатологических состояний. Циркулируя по всему организму, они оседают в тканях, вызывая воспалительные реакции в капиллярах клубочков почек и синовиальных оболочек суставов. Частично вирус из организма выделяется почками, что, возможно, и обусловливает тот факт, что в эпителии дистальных канальцев, как и в эндотелии капилляров клубочков, оказывается значительное количество антигена вируса. Почками также выделяются иммунные комплексы, фрагменты клеток, что приводит к сенсибилизации тканей почки и впоследствии, через несколько недель и даже месяцев после перенесенного заболевания, может послужить причиной возникновения гломерулонефрита. Инициатором в этом случае может быть фактор, который имеет антигенную природу (например, переохлаждение).
Находясь в окружении антител, вирус может сохранять свою структуру и при разрушении комплекса опять поражать чувствительные клетки. Длительная циркуляция комплексов приводит к инфицированию все большего количества клеток, к поддержке инфекции и к персистенции. В данное время не исключается возможность длительной персистенции вируса гриппа в ЦНС по типу медленной инфекции с развитием впоследствии такого патологического состояния, как паркинсонизм. Это изменяет представление о гриппе как об острой инфекции. Установлено, что в 50% случаев антиген вируса гриппа сохраняется в периферических лимфоидных клетках и в крови до 120-200 и более дней.
При гриппе роль антигена могут играть не только структура вируса, но и измененные вирусом структуры клеток, и уже к ним синтезируются антитела, с которыми начинают вступать во взаимодействие нормальные клетки, в результате чего возникает угроза развития аутоиммунопатологического состояния.
Изменения во внутренних органах однотипны, обусловлены генерализованной вазодилятациеи. При массивной вирусемии, которая быстро развивается в первые часы болезни, может возникнуть инфекционно-токсический шок с развитием сердечно-сосудистой недостаточности. В его основе лежат несколько факторов: сосудистый (непосредственное действие вируса на сосуды с повышением их проницаемости, вазодилятациеи), геморрагический синдром с повреждением надпочечников и дефицитом гормонов, нарушение функции миокарда. У таких больных смерть может наступить в ближайшие часы от начала заболевания.
В результате токсического повреждения сосудистого аппарата ЦНС наступает гиперсекреция спинномозговой жидкости, нарушается ликвородинамика, что приводит к повышению внутричерепного давления, может наступить отек мозга. Чаще все-таки повреждаются мягкие мозговые оболочки, сосудистое сплетение, где можно выявить антигены вируса гриппа.
Инфекционно-алергический процесс после перенесенной гриппозной инфекции может возникнуть также в эндокарде. Изменения в миокарде, определенные на ЭКГ как миокардиодистрофия, обусловлены токсикозом и циркуляторными расстройствами.
В патогенезе отека легких имеют значение много факторов: нарушения гемодинамики, связанные с токсикозом, воспалительные процессы в бронхах и легких, снижение сократительной функции левого желудочка, что чаще развивается у лиц с сопутствующими заболеваниями сердечно-сосудистой системы. Необходимо подчеркнуть, что начальные стадии отека легких, на которых повреждается интерстициальная ткань, определяются лишь рентгенологически в виде нерезких, расплывчатых теней, которые сливаются и распространяются от корней к периферии легочных полей.
В механизмах устойчивости организма к генетически инородной информации принимают участие два основных феномена: наследственная резистентность и приобретенный иммунитет:
- природная видовая наследственная резистентность, связанная с врожденной стойкостью организма, которая развивается с возрастом, к возбудителям инфекций, основанная на отсутствии чувствительных клеток или повышении их резистентности к репродукции вируса, а также на их биологической инактивации при участии интерферона, фагоцитарных факторов, нормальной температуры тела или неспецифических ингибиторов крови;
- приобретенный иммунитет создается после болезни или искусственной иммунизации вакцинами.
Приобретенный иммунитет опирается на формирование местной секреторной защиты. Секреторный иммунитет предупреждает или смягчает тяжесть заболевания во входных воротах гриппозной инфекции при участии антител класса IgA, которые синтезированы в процессе кооперации между В-лимфоцитами и эпителиальными клетками. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от инвазии вируса.
Длительность противогриппозного иммунитета ограничена не дву-мя-тремя годами, как это считалось бесспорным до 1977 г. (в этот год особенно тяжело болели молодые люди, рожденные после 1957 г., когда вирус A (H1N1) исчез из циркуляции и появился снова в 1977 г.). В случае возвращения к активной циркуляции уже известного подтипа через 20 и более лет — выявляется сохранение специфической невосприимчивости к возбудителю, который вернулся, у части населения, которая контактировала с ним раньше. Такая длительная иммунологическая память обусловлена, конечно, не антителами (их титры в крови падают ниже защитного порога через 6-12 месяцев, а в секрете дыхательных путей — еще быстрее). Длительный постинфекционный иммунитет обеспечивают клеточные механизмы (Т- и В-лимфоциты), в том числе местные, во входных воротах возбудителя инфекции. Существует четко выраженная корреляция невосприимчивости к гриппу с концентрацией антител в крови (в основном IgG) и в секрете дыхательных путей (IgA). Однако в частных случаях гриппом могут заболеть люди с высоким исходным уровнем гуморального иммунитета и не заболевают инфицированные лица с низким начальным титром антител. Такие примеры подчеркивают сложность и многогранность иммунной защиты организма, где роль отдельных факторов интегрирована в общем результате.
Между специфическими механизмами противогриппозного иммунитета существует распределение защитных функций:
- секреторные антитела, которые подавляют репродукцию вируса во входных воротах инфекции, обеспечивают противоэпидемическую защиту, направленную на ограничение рассеивания и передачи возбудителя от инфицированных лиц здоровому окружению; в связи с широким диапазоном нейтрализующего эффекта секреторные антитела способны подавлять любые антигенные варианты вируса гриппа А в пределах своего подтипа;
- сывороточные антитела нейтрализуют токсичные продукты вируса и регулируют клиническую тяжесть болезни;
- клеточно-обусловленные факторы иммунитета устраняют резервуар вируса в инфицированных клетках, малодоступных влиянию антител.
Напряженность противовирусного иммунитета зависит от уровня циркулирующих антител и образования цитотоксических лимфоцитов. Цитотоксические лимфоциты вызывают лизис инфицированных вирусом клеток.
Повторное заболевание гриппом обусловлено высокой изменчивостью вируса гриппа и формированием иммунитета только к конкретному штамму, что и объясняет необходимость ежегодной вакцинации.
Ключевую роль в патогенности вирусов гриппа играют практически все гены и кодирующиеся ими вирус-специфические белки. Это гемагглютинин, нейраминидаза, белок М2, NS-1, белок РВ1- F2. Особого внимания заслуживает гемагглютинин. Изменения его структуры составляют основу ускользания вирусов гриппа от специфического иммунного ответа, а как рецептор-связывющему белку, ему принадлежат 2 ключевых свойства: способность распознавать клеточный рецептор и определять способность вируса к преодолению межвидовых барьеров, а распознавание рецептора нейраминидазы определяет способность вируса к проникновению в клетки и развитию в них репродуктивного процесса. Неструктурный белок NS-1 локализуется в ядре, контролирует вирусные мРНК, антогонист интерферона 1 типа. РВ1-F2 (виропорин) индуцирует апоптоз. Перечисленные свойства позволяют отнести вирус к факторам патогенности 5-6 1 .
Вирус гриппа попадает в организм человека через дыхательные пути вместе с каплями влаги и частицами пыли. Чем меньше величина капель и частиц, тем глубже проникает вирус в дыхательные пути. Благодаря короткому инфекционному циклу (6-8 час) при попадании в дыхательные пути одной вирусной частицы уже через 8 час количество инфекционного потомства достигает 10 3 , а к концу суток 10 27 . Репродукция (воспроизводство) вируса происходит в клетках эпителия слизистой оболочки дыхательных путей. Пораженные клетки отторгаются, продукты их распада попадают в кровь, вызывая интоксикацию организма, вирус разносится по всему организму, активируя систему протеолиза, повреждая клетки эндотелия сосудов, что приводит к повышенной их проницаемости и дополнительному повреждению тканей. Вирус гриппа, попадая в кровь, вызывает изменения в иммунной системе, чем объясняется присоединение интеркуррентных заболеваний, появление осложнений, вызванных бактериями и другими вирусами.
Повторные заболевания гриппом обусловлены высокой изменчивостью вируса гриппа, формированием иммунитета только к конкретному штамму, объясняя необходимость ежегодной вакцинации. Длительный постгриппозный иммунитет обеспечивают клеточные его механизмы, включая и местные, во входных воротах возбудителя инфекции.
Центральным звеном в антивирусной защите клеток при гриппозной инфекции является дсРНК-зависимая протеинкиназа ( PKR) и индукция интерферона 1 типа (альфа-ИФН). При гриппозной инфекции и эффективной репродукции вируса клеточная гибель наступает через 20-40 часов после начала репликации вируса. Вирусиндуцированный апоптоз (гибель)сопровождается активацией PKR, а высокая ее активность и синтез интерферона 1 типа (альфа-ИФН) потенцируют апоптоз, в котором непосредственное участие принимают и вирусные белки (NA и NS1), на этом уровне и решается судьба инфицированной вирусом клетки.
Элиминацию возбудителя обеспечивают гиперактивная PKB, интерферон-альфа (1 типа) и 2,5-олигоаденилатсинтетаза. Известно, что интерферон 1 типа способен индуцировать синтез 2,5-олигоаденилатсинтетазы, обеспечивая при этом гидролиз вирусспецифических мРНК, осуществляющих перенос информации о синтезе вирусных белков на рибосомы клеток и возможность трансляции клеточных мРНК, осуществляющих перенос информации с РНК на специфическую последовательность аминокислот. Продуктом индукции интерферона 1 типа является Мх-белок, подавляющий активность вирусной РНК-зависимой РНК-полимеразы. Интерферон 1 типа контролирует развитие Th1 иммунного ответа, повышая жизнеспособность и пролиферативную активность Т-клеток, обеспечивая активацию противовирусного иммунитета. Таким образом, инфицированная клетка должна быть санирована системой интерферона 1 типа, который несет важнейшую функцию на первом уровне защиты от вирусной инфекции, предупреждения тяжелых осложнений и становления устойчивого протективного иммунитета. Эта защита надежна на всех стадиях репродукции вируса.
Лечение заболевания необходимо начинать в ранние сроки гриппозной инфекции. К средствам для лечения и профилактики гриппа следует отнести: ремантадин, метилглюкамина акридонацетат (циклоферон), озельтамавир (тамифлю).
Из группы ингибиторов нейраминидазы препарат озельтамавир (тамифлю) блокирует ключевой фермент репликации вирусов гриппа А - нейраминидазу, нарушает выход вирионов из инфицированной клетки. Частота появления резистентных штаммов не превышает 1.5%. Мутации в нуклеотидной последовательности, приводящие к устойчивочти к тамифлю, выявлены у 7 из 12 секвенированных штаммов H1N1 2008 года выделения.
Весьма перспективным и эффективным препаратом для экстренной профилактики и лечения гриппа, в максимально ранние сроки инфекции, является циклоферон (метилглюкамина акридонацетат). Препарат способствует ингибированию репродукции, индуцирует синтез альфа-интерферона (1 тип) в ранние сроки. Индуцированный циклофероном альфа-интерферон появляется в крови уже после 4-х часов от момента введения препарата, пик продукции приходится на 8 часов, оптимальный уровень ИФН сохраняется до 24 часов, С помощью циклоферона удается добиться нескольких фармакотерапевтических эффектов: стимуляции синтеза интерферона -альфа и гамма (1-го и 2-го типа), активации естественного иммунитета, стабилизирующего и корригирующего адаптивный иммунитет (контроль Th1 иммунного ответа, активации противовирусного иммунитета). Применение его у больных гриппом А обосновано, поскольку больные гриппом в 73% случаев чувствительны к препарату.
Читать дальше: Введение
1 О.И.Киселев Пути эволюции вирусов гриппа типа А: роль белка NS-1 в патогенности //Грипп и гриппоподобные инфекции, включая особооспасные формы гриппозной инфекции. Фундаментальные и прикладные аспекты изучения. Бюллетень проблемной комиссии.-Санкт-Петербург.-2008.-С.49-63.
Читайте также:

