Оборудование для изучения вирусов
Обновлено: 25.04.2024
Специфика деятельности микробиологических лабораторий связана с изучением и выявлением микроорганизмов, то есть грибков, вирусов, бактерий и простейших. Исследование микроорганизмов требуется для поиска и определения наиболее эффективных методов диагностики и лечения различных заболеваний людей, растений и животных.
Микробиологические лаборатории присутствуют в диагностических учреждениях, многопрофильных больницах, научных институтах и т.д. Как правило, их деятельность направлена на проведение анализа проб воды, почвы, воздуха, а также физиологических материалов и продуктов питания.
Правила технического оснащения микробиологических лабораторий
Любые виды работ, осуществляемые в микробиологических лабораториях, должны проводится в соответствии с утвержденными инструкциями и регламентами. Такие документы обеспечивают безопасность лаборантов, а также гарантируют достоверность полученных результатов.
Для оснащения микробиологической лаборатории используется современное оборудование. В перечне обязательных технических средств присутствуют:
- микроскопы различных типов, то есть иммерсионные и люминесцентные;
- термостаты, сушильные шкафы, а также водяные бани, стерилизаторы и эксикаторы;
- дистилляторы, предназначенные для приготовления дистиллированной воды;
- электронные весы;
- оборудование для подготовки проб, то есть центрифуги, смесители, устройства для фильтрации, в том числе, вакуумной;
- газовые горелки и плитки;
- лабораторные инструменты: дозаторы, пинцеты, пипетки и т.д.
Также при оснащении микробиологической лаборатории необходимо закупить специализированную посуду, а в частности: колбы, пробирки, чешки Петри, весовые стаканчики и проч. Помимо этого, в ходе исследовательской деятельности потребуются фильтровальные материалы, готовые фильтры бактериальные.
Большинству микробиологических лабораторий для ведения исследовательской деятельности требуются химические реактивы, а также материалы, предназначенные для приготовления и/или окрашивания питательных сред.
Деятельность некоторых микробиологических лабораторий подразумевает необходимость выращивания культур, в данном случае при оснащении требуется устройство термостатной комнаты, в которой располагают:
- центрифуги различного размера;
- термостаты, с их помощью культурам обеспечиваются стабильные условия;
- устройства, предназначенные для анаэробных культур;
- оборудование, с помощью которого культуры выращивают в атмосфере с заданными характеристиками;
- низкотемпературный термостат, а также холодильник, в которых хранят сыворотки, вакцины, образцы;
- автоклав и суховоздушный шкаф.
Правила оснащения рабочих мест и рекомендуемая одежда для сотрудников
При оснащении микробиологической лаборатории следует уделить внимание устройству рабочего места сотрудника. Оно должно быть хорошо освещенным, помимо этого требуется наличие:
- сосуда, в котором находится дезинфицирующий раствор;
- газовой горелки (также подходит спиртовка) для стерилизации инструментов;
- штатива для размещения пробирок;
- необходимого набора инструментов, то есть пинцетов, пипеток, микробиологических петель и т.д.
Сотрудники, работающие в микробиологической лаборатории, в обязательном порядке должны носить специальную одежду и СИЗ, то есть: халаты, резиновые перчатки, сменную обувь и шапочки. В некоторых случаях требуется наличие масок или марлевых повязок на лицо.
В методических разработках содержится описание лабораторных занятий по разделам общей микробиологии. К каждой теме дается краткая характеристика темы занятия, список заданий по лабораторному практикуму и контрольные вопросы. Издание предназначено для самостоятельной подготовки к лабораторным занятиям по микробиологии и контроля усвоения материала.
Рекомендовано РИСом университета
УДК 576.8 (075)
ББК 28.4 я73
Кабардино-Балкарский государственный университет, 2005
РАЗДЕЛ I. МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
ТЕМА 1. МИКРОБИОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ. МЕТОДЫ МИКРОСКОПИИ
Лабораторные занятия по микробиологии, вирусологии и иммунологии начинаются с ознакомления студентов с организацией микробиологической лаборатории, её оборудованием, основными методами исследования.
В микробиологических лабораториях выполняется бактериологические, вирусологические и серологические анализы материалов, полученных от больных (с целью диагностики заболеваний), обследуются бактерионосители и проводятся санитарно – микробиологические исследования воды, воздуха, почвы, пищевых продуктов. Микробиологические лаборатории создаются при лечебных, учебных и научных учреждениях, санитарно – эпидемиологических станциях (СЭС).
Работа с болезнетворными микробами требует обязательного соблюдения ряда правил личной профилактики.
Правила работы в микробиологических лабораториях
1. Работа в лаборатории должна проводиться в сменной обуви, в медицинских халатах и шапочках. В необходимых случаях на лицо надевается маска. При работе с особо опасными микроорганизмами необходимо руководствоваться специальными инструкциями.
2. В лаборатории не разрешается курить и принимать пищу, а также делать лишние передвижения.
3. Рабочее место должно быть в образцовом порядке, личные вещи следует хранить в специально отведенных местах. Из личных вещей студента на рабочем столе допускается иметь только рабочую тетрадь, в которой делаются записи и зарисовки.
4. При случайном попадании заразного материала на стол или на пол это место тщательно обрабатывается дезинфицирующим раствором.
5. После окончания работы нужно тщательно вымыть руки и при необходимости обработать их дезинфицирующим раствором.
6. Хранение и уничтожение микроорганизмов проводится согласно специальным инструкциям.
Методы микробиологических исследований
Все микробиологические исследования могут быть сведены к 5 основным методам:
– микроскопический метод состоит в изучении исследуемого материала с помощью различных микроскопов;
– бактериологический (микологический, вирусологический) метод заключается в искусственном культивировании микроорганизмов и выделении чистых культур с последующей их идентификацией (определением вида);
– серологический метод основан на определении специфических антител к антигенам в крови и других биологических жидкостях пораженного организма с помощью различных реакций иммунитета;
– биологический; или экспериментальный, метод заключается в заражении животных исследуемым материалом с целью воспроизведения инфекционного заболевания или последующего выделения возбудителя;
– аллергический метод заключается в постановке кожных аллергических проб с соответствующими аллергенами с целью обнаружения повышенной чувствительности макроорганизма к определенным возбудителям инфекционных заболеваний или продуктам их жизнедеятельности.

Микроскопический метод исследования
Изучение морфологии микроорганизмов ввиду их малой величины возможно только с помощью микроскопа. Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцентный, электронный) и специальные методы микроскопии.
Современные световые микроскопы характеризуются предельной разрешающей способностью 0,2 мкм, под которой понимают наименьшее расстояние между двумя точками, различимое с помощью микроскопа. Разрешающая способность микроскопа (d) описывается формулой: d =l/NA, где l – длина волны проходящего света, NА – численная (нумерическая) апертура объектива, равная n×sins (n – показатель преломления среды между объектом и объективом, а s – половина отверстного угла, образуемого двумя крайними лучами, попадающими в объектив). Для иммерсионных объективов NA=1,25, для объективов сильного увеличения – 0,65, для объективов слабого увеличения – 0,2.
Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. В повседневной практике обычно используют увеличение порядка 630 – 900.
Основными разновидностями метода световой микроскопии являются:
Микроскопия в темном поле. Ее применяют для изучения неокрашенных микробов, их подвижности. Этот метод микроскопии требует специального конденсора с затемненной центральной частью, которая, задерживая центральную часть пучка лучей, пропускает лишь боковые косо направленные лучи. В связи с этим поле зрения остается неосвещенным, в то время как объекты, находящиеся в препарате, ярко светятся на темном фоне.
Люминесцентная микроскопия. Люминесценция – это свечение объекта, возбуждаемое поглощенной световой энергией (коротковолновая и ультрафиолетовая части спектра). Микробы обладают слабой собственной первичной люминесценцией, и поэтому на практике пользуются наведенной люминесценцией путем обработки объекта растворами; люминесцирующих красителей – флюорохромами, которые светятся под влиянием ультрафиолетовых и коротковолновых синих лучей. Отдельные флюорохромы обладают избирательностью, т. е. связываются с отдельными клеточными структурами (ядро, цитоплазма, включения). Для люминесцентной микроскопии необходим источник ультрафиолетового света и набор светофильтров.
Фазово–контрастная микроскопия. Изучение живых неокрашенных микробов затруднено в связи с их малой контрастностью. В видимом свете они прозрачны. Однако при прохождении света через микробную клетку происходит изменение фазы световых лучей, что обусловлено различиями толщины и показателей преломления отдельных структур. Эти изменения могут быть обнаружены при использовании специальных фазово–контрастных устройств, в результате чего микроорганизмы и отдельные части микробной клетки становятся контрастными и видимыми человеческим глазом.
В электронном микроскопе вместо световых лучей используется поток электронов, излучаемых специальным источником (электронная пушка). На пути потока электронов помещены электромагнитные линзы, которые для электронных лучей являются фокусирующими, т. е. действует подобно линзам для световых лучей. Исследуемый препарат, приготовленный на тончайшей пленке, помещают в безвоздушной среде на пути потока электронов после их прохождения через конденсорную линзу. Затем пучок электронов проходит через объективную и проекционные линзы. Изображение микроскопируемого объекта наблюдают на флюоресцирующем экране. Возникновение изображения на экране обусловлено тем, что различные части исследуемого объекта обладают неодинаковой проницаемостью для электронов.
Электронная микроскопия дает возможность изучать объекты величиной 10 – 10000 нм. Ее широко применяют для исследования тончайших структур бактериальной клетки и функциональных особенностей ее компонентов, для изучения морфологии и биологических свойств вирусов и фагов.
В сканирующем-зондовом микроскопеиспользуют используют комбинации инвертированного оптического и зондового микроскопов. Минимальный шаг сканирования составляет 0,01нм. Сканирующая-зондовая микроскопия применяется для определения плотности и размеров бактерий и вирусов, определения параметров состояния мембран (эластичности, проводимости), исследования структуры ДНК, особенностей биомакромолекул и антигенов поверхности клеток.
1. Ознакомиться с основным оборудованием микробиологической лаборатории, с лабораторной посудой, оборудованием рабочего места.
Микробиологическая лаборатория должна иметь лабораторные столы, покрытые материалами (линолеум, пластик), которые хорошо моются и могут подвергаться обработке дезинфицирующими растворами; винтовые табуреты, удобные как для микроскопирования, так и для другой работы; шкафы для посуды, питательных сред, реактивов.
Необходимым оборудованием микробиологической лаборатории являются: термостат, автоклав, сушильный шкаф, микроанаэростат, компрессор, холодильники, центрифуги, весы лабораторные и аналитические. Лаборатория оснащается необходимой посудой и инструментарием: пробирки бактериологические, серологические и центрифужные, чашки Петри, пипетки градуированные и пастеровские, стекла предметные и покровные, наборы инструментов, шприцы, стерилизаторы для инструментов, водяные бани, аппаратура для фильтрования и др. Для повседневной работы лаборатория должна располагать необходимыми питательными средами, химическими реактивами, диагностическими сыворотками и другими и лабораторными материалами.
Лабораторный стол оборудуется биологическим микроскопом, иммерсионным маслом, газовыми горелками (или спиртовками), бактериологической петлей, дезинфицирующим раствором, штативом для пробирок. Для окраски препаратов на столе должны находиться набор красителей, спирт, фильтровальная бумага, эмалированный кювет, емкость с водой, предметные стекла, пинцет для извлечения стекол, банка для отработанных стекол.
2. Освоить особенности работы с иммерсионной системой микроскопа при исследовании готовых препаратов.
При иммерсионной микроскопии окрашенных препаратов необходимо создавать хорошее освещение, для чего надо максимально поднять конденсор, открыть диафрагму конденсора, поставить малый сухой объектив на расстоянии 5 – 7 см от предметного столика и с помощью плоского зеркала установить равномерное освещение поля зрения. При работе с иммерсионной системой во избежание порчи объектива необходимо соблюдать следующие правила: после нанесения на поверхность препарата небольшой капли иммерсионного масла под контролем глаза сбоку погрузить в нее фронтальную линзу иммерсионного объектива, а затем, глядя в окуляр, при помощи сначала макрометрического, а затем микрометрического винта установить препарат в фокусе микроскопа. Микроскопирование необходимо проводить, не снимая руки с микрометрического винта, что дает возможность, изменяя фокусное расстояние, рассмотреть всю поверхность поля зрения. После работы иммерсионная система и столик микроскопа должны быть очищены от масла.
3. Микроскопировать нативные препараты бактерий.
При микроскопировании живых микроорганизмов можно, наряду с формой бактерий, наблюдать за их подвижностью, а также определить количество клеток в исследуемом объеме. Живые микроорганизмы исследуют в препаратах "висячая" и "раздавленная" капля.
Приготовление препарата "висячая капля"
На середину покровного стекла нанести каплю исследуемой жидкой культуры. Каплей вниз опустить покровное стекло на предметное стекло с углублением (лункой), края которого смазаны вазелином. Капля должна свободно свисать и не касаться дна краев углубления. Создается герметически закрытая камера, в которой бактерии можно наблюдать длительное время (4-6 часов). При малом увеличении найти край капли, после чего переместить ее в центр поля зрения и микроскопировать с объективом сильного увеличения и с иммерсионным объективом.
Приготовление препарата "раздавленная капля"
На середину предметного стекла нанести каплю жидкой бактериальной культуры. Осторожно накрыть её покровным стеклом, чтобы не было пузырьков воздуха, после чего микроскопировать с малым сухим, а затем с большим сухим и иммерсионным объективами.
Прижизненная окраска бактерий
Для такой окраски применяются сильно разбавленные растворы красителей, которые не оказывают токсического действия на бактерии. На предметное стекло нанести каплю 0,001% раствора метиленового синего, в которую внести взвесь бактерий, после чего приготовить препарат "раздавленная капля" и микроскопировать его.
Контрольные вопросы
1. Что является предметом изучения микробиологии?
2. Какие разделы включает микробиология?
3. Основные этапы развития микробиологии.
4. Каковы принципы таксономии микроорганизмов?
5. В чем состоит нумерическая таксономия микроорганизмов?
6. Как строится номенклатура микроорганизмов?
7. Каково назначение микробиологической лаборатории?
8. В чем состоят основные правила работы в микробиологической лаборатории?
9. Каковы методы микробиологических исследований?
10. Из каких частей состоит биологический микроскоп?
11. Как определить увеличение микроскопа?
12. Что собой представляет разрешающая способность микроскопа? От чего она зависит?
Все микробиологические, биохимические и моле-кулярно-биологические исследования микроорганизмов проводят в специальных лабораториях, структура и оборудование которых зависят от объектов исследования (бактерий, вирусов, грибов, простейших), а также от их целевой направленности (научные исследования, диагностика заболеваний). Изучение иммунного ответа и серодиагностика заболеваний человека и животных осуществляют в иммунологических и серологических (serum — сыворотка крови) лабораториях.
Бактериологические, вирусологические, микологические и серологические (иммунологические) лаборатории входят в состав санитарно-эпидемиологических станций (СЭС), диагностических центров и крупных больниц. В лабораториях СЭС выполняют бактериологические, вирусологические и серологические анализы материалов, полученных от больных и контактировавших с ними лиц, обследуют бактерионосителей и проводят санитарно-микробиологические исследования воды, воздуха, почвы, пищевых продуктов и т.д.
В бактериологических и серологических лабораториях больниц и диагностических центров проводят исследования с целью диагностики кишечных, гнойных, респираторных и других инфекционных заболеваний, осуществляют микробиологический контроль за стерилизацией и дезинфекцией.
Диагностику особо опасных инфекций (чума, туляремия, сибирская язва и др.) проводят в специальных режимных лабораториях, организация и порядок деятельности которых строго регламентированы.
В вирусологических лабораториях диагностируют заболевания, вызванные вирусами (грипп, гепатит, полиомиелит и др.), некоторыми бактериями — хламидиями (орнитоз и др.) и риккетсиями (сыпной тиф, Ку-лихорадка и др.). При организации и оборудовании вирусологических лабораторий учитывают специфику работы с вирусами, культурами клеток и куриными эмбрионами, требующую строжайшей асептики.
В микологических лабораториях проводят диагностику заболеваний, вызываемых патогенными грибами, возбудителями микозов.
Лаборатории обычно размещаются в нескольких помещениях, площадь которых определяется объемом работ и целевым назначением.
В каждой лаборатории предусмотрены:
а) боксы для работы с отдельными группами возбудителей;
б) помещения для серологических исследований;
в) помещения для мойки и стерилизации посуды, приготов
ления питательных сред;
г) виварий с боксами для здоровых и подопытных живот
ных;
д) регистратура для приема и выдачи анализов.
Наряду с этими помещениями в вирусологических лабораториях имеются боксы для специальной обработки исследуемого материала и работы с культурами клеток.
Оборудование микробиологических лабораторий
Лаборатории снабжены рядом обязательных приборов и аппаратов.
1. Приборы для микроскопии: биологический иммерсионный микроскоп с дополнительными приспособлениями (осветитель, фазово-контрастное устройство, темнопольный конденсор и др.), люминесцентный микроскоп.
2. Термостаты и холодильники.
3. Приборы для приготовления питательных сред, растворов и т.д.: аппарат для получения дистиллированной воды (дистиллятор), технические и аналитические весы, рН-метры, аппаратура для фильтрования, водяные бани, центрифуги.
4. Набор инструментов для манипуляций с микробами: бактериологические петли, шпатели, иглы, пинцеты и др.
5. Лабораторная посуда: пробирки, колбы, чашки Петри, матрацы, флаконы, ампулы, пастеровские и градуированные пипетки и др., аппарат для изготовления ватно-марлевых пробок.
Крупные диагностические комплексы имеют автоматические анализаторы и компьютеризированную систему оценки полученной информации.
В лаборатории выделено место для окраски микроскопических препаратов, где находятся растворы специальных красителей, спирт, кислоты, фильтровальная бумага и др. Каждое рабочее место снабжено газовой горелкой или спиртовкой и емкостью с дезинфицирующим раствором. Для повседневной работы лаборатория должна располагать необходимыми питательными средами, химическими реактивами, диагностическими препаратами и другими материалами.
В крупных лабораториях имеются термостатные комнаты для массового выращивания микроорганизмов, постановки серологических реакций. Для выращивания, хранения культур, стерилизации лабораторной посуды и других целей используют следующую аппаратуру.

1. Термостат. Аппарат, в котором поддерживается постоянная температура. Оптимальная температура для размножения большинства патогенных микроорганизмов 37 "С. Термостаты бывают воздушными и водяными.
2. Микроанаэростат. Аппарат для выращивания микроорганизмов в анаэробных условиях.
3. С02 -инкубатор. Аппарат для создания постоянной температуры и атмосферы определенного газового состава. Предназначен для культивирования микроорганизмов, требовательных к газовому составу атмосферы.
4. Холодильники. Используют в микробиологических лабораториях для хранения культур микроорганизмов, питательных сред, крови, вакцин, сывороток и прочих биологически активных препаратов при температуре около 4 °С. Для хранения препаратов при температуре ниже О °С применяют низкотемпературные холодильники, в которых поддерживается температура —20 °С или —75 "С.
5. Центрифуги. Применяют для осаждения микроорганизмов, эритроцитов и других клеток, для разделения неоднородных жидкостей (эмульсии, суспензии). В лабораториях используют центрифуги с различными режимами работы.
6. Сушилъно-стерилизационный шкаф (печь Пастера). Предназначен для суховоздушной стерилизации стеклянной лабораторной посуды и других жаростойких материалов.
7. Стерилизатор паровой (автоклав). Предназначен для стерилизации перегретым водяным паром (под давлением). В микробиологических лабораториях используют автоклавы разных моделей (вертикальные, горизонтальные, стационарные, переносные).
БАКТЕРИОЛОГИЧЕСКИЕ, ВИРУСОЛОГИЧЕСКИЕ, МИКОЛОГИЧЕСКИЕ, ИММУНОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ. УСТРОЙСТВО СОВРЕМЕННЫХ МИКРОСКОПОВ. МЕТОДЫ МИКРОСКОПИИ. МЕТОДЫ ИЗУЧЕНИЯ МОРФОЛОГИИ МИКРООРГАНИЗМОВ
1. Правила работы и организация микробиологических (бактериологических, вирусологических, микологических) лабораторий.
2. Основные приборы и оборудование микробиологической лаборатории.
3. Микроскопы и микроскопическая техника. Правила работы с иммерсионным микроскопом (объективами).
Демонстрация
1. Устройство и применение основных приборов и оборудования, используемого в микробиологических лабораториях: термостата, центрифуг, автоклава, сушильного шкафа, инструментария и посуды.
2. Устройство биологического микроскопа. Различные методы микроскопии: темнопольная, фазово-контрастная, люминесцентная, электронная.
3. Препараты микробов (дрожжей и бактерий) при различных методах микроскопии.
1. Микроскопировать и зарисовать препараты дрожже-подобных грибов рода Candida, используя различные виды микроскопии.
Методические указания
Правила работы в микробиологических лабораториях.
Работу в микробиологической лаборатории медицинского учреждения проводят с возбудителями инфекционных заболеваний — патогенными микроорганизмами.
Поэтому для предохранения от заражения персонал обязан строго соблюдать правила внутреннего распорядка:
2. В лаборатории запрещается курить и принимать пищу.
3. Рабочее место должно содержаться в образцовом порядке. Личные вещи сотрудников следует хранить в специально отведенном месте.
4. При случайном попадании инфицированного материала на стол, пол и другие поверхности это место необходимо тщательно обработать дезинфицирующим раствором.
5. Хранение, наблюдение за культурами микробов и их уничтожение должны производиться согласно специальной инструкции. Культуры патогенных микробов регистрируют в специальном журнале.
6. По окончании работы руки следует тщательно вымыть, а при необходимости обработать дезинфицирующим раствором.
Микроскопы и методы микроскопии
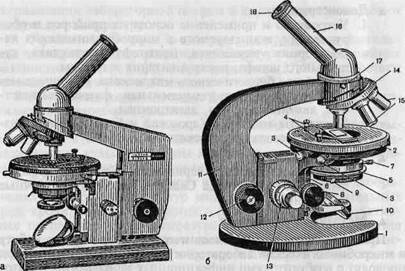
Рис. 1.1. Микроскопы.
а — общий вид микроскопа "Биолам"; б — микроскоп МБР-1: 1 — основание микроскопа; 2 — предметный столик; 3 — винты для перемещения предметного столика; 4 — клеммы, прижимающие препарат; 5 — конденсор; 6 — кронштейн конденсора; 7 — винт, укрепляющий конденсор в гильзе; 8 — рукоятка перемещения конденсора; 9 — рукоятка ирисовой диафрагмы конденсора; 10 — зеркало; 11 — тубусодержатель; 12 — рукоятка макрометричес-кого винта; 13 — рукоятка микрометрического винта; 14 — револьвер объективов; 15 — объективы; 16 — наклонный тубус; 17 — винт для крепления тубуса; 18 — окуляр.
Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцентный, электронный) и специальные методы микроскопии (фа-зово-контрастный, темнопольный).
В микробиологической практике применяют микроскопы отечественных марок: МБР-1, МБИ-2, МБИ-3, МБИ-6, "Биолам" Р-1 и др. (рис. 1.1). Они предназначены для изучения формы, структуры, размеров и других признаков различных микробов, величина которых не менее 0,2—0,3 мкм.
Иммерсионная микроскопия
Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло, вода), имеющую высокий коэффициент преломления, близкий к таковому стекла, препятствует рассеянию света от объекта.
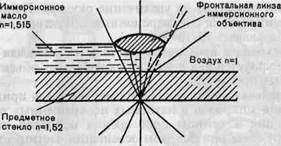
Рис. 1.2. Ход лучей в иммерсионной системе, п — показатель преломления.
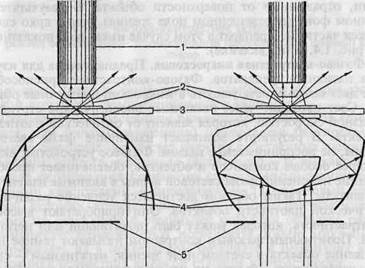
Рис. 1.3. Ход лучей в темнопольных конденсорах, а — параболоид-конденсор; б — кардиоид-конденсор; 1 — объектив; 2 — иммерсионное масло; 3 — препарат; 4 — зеркальная поверхность; 5 — диафрагма.
Таким образом достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, снабженные меткой (МИ — масляная иммерсия, ВИ — водная иммерсия). Предельная разрешающая способность иммерсионного микроскопа не превышает 0,2 мкм. Ход лучей в иммерсионной системе показан на рис. 1.2.
Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90 x 10 = 900.
Микроскопия в проходящем свете (светлопольная микроскопия) используется для изучения окрашенных объектов в фиксированных препаратах.
Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе (рис. 1.3). При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Препарат в этом случае имеет вид, показанный на рис. 1.4, б (на вклейке).
Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне (см. рис. 1.4; на вклейке).
Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4 (рис. 1.5), а также специальные осветители.
Люминесцентная (или флюоресцентная) микроскопия. Основана на явлении фотолюминесценции.
Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминес-цирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта.
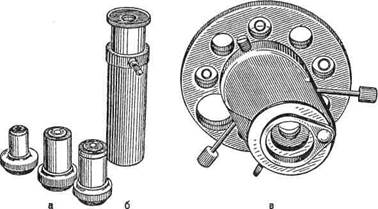
Рис. 1.5. Фазово-контрастное устройство, а — фазовые объективы; б — вспомогательный микроскоп; в — фазовый конденсор.
Длина волны излучаемого света (цвет люминесценции) зависит от физико-химической структуры люминесцирующего вещества.
Первичная люминесценция биологических объектов (собственная, или биолюминесценция) наблюдается без предварительного окрашивания за счет наличия собственных люминес-цирующих веществ, вторичная (наведенная) — возникает в результате окрашивания препаратов специальными люминесци-рующими красителями — флюорохромами (акридиновый оранжевый, ауромин, корифосфин и др.). Люминесцентная микроскопия по сравнению с обычными методами обладает рядом преимуществ: возможностью исследовать живые микробы и обнаруживать их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности.
В лабораторной практике люминесцентную микроскопию широко применяют для выявления и изучения многих микробов.
Электронная микроскопия. Позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Электронный микроскоп применяют для изучения вирусов, тонкого строения различных микроорганизмов, макромолекулярных структур и других субмикроскопических объектов. Световые лучи в таких микроскопах заменяет поток электронов, имеющий при определенных ускорениях длину волны около 0,005 нм, т.е. почти в 100 000 раз меньше длины волны видимого света. Высокая разрешающая способность электронного микроскопа, достигающая 0,1-0,2 нм, позволяет получить общее полезное увеличение до 1 000 000.
Наряду с приборами "просвечивающего" типа используют сканирующие электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов "просвечивающего" типа.
Правила работы с микроскопом
Работа с любым световым микроскопом включает установку правильного освещения поля зрения и препарата и его микроскопию различными объективами. Освещение может быть естественным (дневным) или искусственным, для чего используют специальные источники света — осветители разных марок.
При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка:
1) на приготовленный на предметном стекле и окрашенный мазок нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами;
2) повернуть револьвер до отметки иммерсионного объектива 90х или 10Ох;
3) осторожно опустить тубус микроскопа до погружения объектива в каплю масла;
4) установить ориентировочный фокус при помощи макрометрического винта;
5) провести окончательную фокусировку препарата микро метрическим винтом, вращая его в пределах только одного оборота. Нельзя допускать соприкосновения объектива с пре
паратом, так как это может повлечь поломку покровного стекла или фронтальной линзы объектива (свободное расстояние иммерсионного объектива 0,1—1 мм).
По окончании работы микроскопа необходимо удалить масло с иммерсионного объектива и перевести револьвер на малый объектив 8х.
Для темнопольной и фазово-контрастной микроскопии используют нативные препараты ("раздавленная" капля и др., см. тему 2.1); микроскопируют с объективом 40х или специальным иммерсионным объективом с ирис-диафрагмой, позволяющей регулировать численную апертуру от 1,25 до 0,85. Толщина предметных стекол не должна превышать 1 — 1,5 мм, покровных — 0,15—0,2 мм.
Вирусологическая лаборатория — это учреждение, деятельность которого направлена на изучение вирусов и вирусных заболеваний, производство вирусных препаратов, к числу которых относятся вакцины, иммунные сыворотки и проч. Вирусная лаборатория состоит непосредственно из лаборатории, а также подсобных помещений. В последних проводятся работы, связанные с:
- Обработкой и стерилизацией лабораторной посуды.
- Приготовлением питательных сред.
- Лиофилизацией вирусов и т.п.
Компания Gluvex предоставляет полный спектр услуг по проектированию и организации вирусологических лабораторий. Нам вы можете без сомнений доверить разработку нормативно-проектной документации, планирование помещений, подбор оборудования, мебели и расходных материалов, проведение установочных и пуско-наладочных работ.
Особенности проектирования и организации вирусологической лаборатории
Фактически при организации и оборудовании вирусологической лаборатории руководствуются теми же принципами и правилами, что и при создании бактериологической лаборатории. Единственное отличие — необходимость обеспечения условий, при которых становится возможным:
- Выращивание тканевых и клеточных культур.
- Ультрацентрифугирование.
- Хранение вирусов при низких температурных значениях и т.п.
Задачи, решаемые в условиях вирусологических лабораторий
При организации и оборудовании вирусологической лаборатории создаются условия, делающие возможным проведение следующих типов работ:
- Диагностические: например, связанные с выделениями вирусов и проведением серологических реакций.
- Изучение свойств вирусов, а также их структуры.
- Выполнение генетических исследований и т.д.
Специалисты Gluvex осуществляют проектирование и организацию вирусологических лабораторий с учетом специфики проводимой научно-исследовательской деятельности, а также индивидуальных пожеланий заказчика. Значительный опыт в этой сфере позволяет оперативно и безошибочно решать даже самые сложные задачи.
Требования к помещениям
Для организации вирусологической лаборатории используют изолированный отсек, который состоит из 5-6 отдельных помещений. В качестве основной рабочей зоны используют светлое помещение, которое делят на две зоны — предбоксник и бокс.
Помещение вирусологической лаборатории в обязательном порядке должно быть оборудовано системой эффективной приточно-вытяжной вентиляции, водопроводной системой (ГВС и ХВС), электрифицировано. Помимо этого, желательно наличие централизованной системы сжатого воздуха и вакуума.
Оснащение бокса и предбоксника вирусологической лаборатории
Отдельное помещение, для проведения работ в стерильных условиях, состоит из двух отделений, которые отделяются друг от друга стеклянной перегородкой:
- Бокс — внутреннее помещение, имеет стандартную площадь 6-8 кв.м. В нем должна быть предусмотрена дверь в предбоксник. В этом помещении располагают исключительно рабочие столы, стулья и необходимые для работы принадлежности. Лабораторные столы должны иметь поверхность, покрытую нержавеющей сталью, стеклом или пластиком. Над рабочей поверхностью размещают бактерицидные лампы.
- Предбоксник — помещение, где сотрудники лаборатории смогут одеть СИЗ и соответствующую рабочую одежду. Фактически здесь же и хранится стерильная одежда и используемое в процессе исследований оборудование.
Стерилизация бокса и предбоксника осуществляется с использованием специальных бактерицидных ламп, также в них обеспечивают подачу стерильного воздуха (он поступает из приточной вентиляции, обрабатывается фильтрами).
Также при создании вирусологической лаборатории отводят несколько дополнительных комнат:
- Приемная, где регистрируются поступающие материалы.
- Автоклавная, предназначенная для стерилизации посуды, питательных сред, обезвреживания инфекционных материалов. Обратите внимание: в обязательном порядке устанавливаются два автоклава: один — для чистых материалов, а второй — для инфицированных.
- Моечная, где происходит очистка приборов, посуды и аппаратуры.

Стандартное оборудование для бокса вирусологической лаборатории
- Стерилизатор для инструментов.
- Лабораторная посуда.
- Инструменты, необходимые для проведения исследования.
- Бак с крышкой для зараженных материалов.
- Емкости с дезинфицирующими растворами.
Дополнительное оборудование для вирусологической лаборатории
Также при организации и оборудовании вирусологической лаборатории необходима покупка:
- Гомогенизатора, предназначенного для измельчения тканей.
- Магнитных мешалок.
- Микроскопов: требуются электронные модели и световые, необходимые для выполнения исследований при обычном и УФ освещении.
- Центрифуги различной мощности, в том числе имеющие функцию охлаждения.
- Термостаты, способные одновременно работать при различной температуре (в среднем от 25 до 40 градусов по Цельсию). В ряде случаев требуется использование термостатных комнат.
- Лабораторных рефрижераторов или холодильных камер.
- Сосудов Дьюара, предназначенных для хранения культур клеток.
Отметим, организация и оборудование вирусологической лаборатории подразумевает создание отделения по приготовлению сред. В нем должен присутствовать полный набор стандартной лабораторной посуды, а также специальные установки для обработки воды. Вода, принимающая участие в подготовке сред, должна быть дважды подвергнута процедуре дистилляции в специальных стеклянных аппаратах или деионизации в колонках с ионообменными смолами. При необходимости стерилизации растворов, которые нельзя подвергать процедуре автоклавирования, применяются асбестоцементные стерилизующие пластины Зейтца. Процедура фильтрации в данном случае выполняется при давлении 0,5 Атм.
Комплексное оснащение вирусологических лабораторий
Ваши преимущества с Gluvex:

Влияние вирусов на население огромно, поскольку они могут вызывать серьезные эндемические и даже пандемические заболевания, такие как испанский грипп (вирус гриппа H1N1), СПИД (вирус иммунодефицита человека ВИЧ), лихорадка денге (вирус денге DENV) или недавний Covid-19 (коронавирус SARS-CoV-2).
Изучение вирусов, их взаимодействие с клетками-хозяевами и формирование иммунного ответа помогает разработать вакцины и методы лечения вирусных патогенов. Таким образом, вирусология часто тесно связана с иммунологией.
В клинической практике существует множество лабораторных методов обнаружения вирусных инфекций. С появлением молекулярных методов и повышением чувствительности серологического анализа вирусология быстро изменяется при использовании большого разнообразия образцов для вирусологических испытаний.
Многие вирусы можно вырастить в клеточной культуре в лаборатории. Для этого вирусолог добавляет образцы вирусов к подходящим клеткам-хозяевам. В результате этого процесса, называемого адсорбцией или инокуляцией, клетки инфицируются и производят больше копий вируса. Для некоторых вирусов требуется определенный тип клеток для репликации, поэтому существуют клеточные культуры, которые поддерживают рост большого разнообразия вирусов. В их числе клетки почек африканской зеленой мартышки (клетки Vero), фибробласты легких человека (MRC-5) и клетки эпидермоидной карциномы человека (HEp-2).
Один из способов узнать, успешна ли репликация вируса, — обнаружить изменения в морфологии клетки или программируемую гибель клеток (апоптоз), изучив клеточную культуру с помощью инвертированного микроскопа. Эти индуцированные морфологические изменения называются цитопатическим действием (CPE).
Световая микроскопия также является важным инструментом для быстрого и эффективного наблюдения за цитопатологическими изменениями, такими как типичная агрегация вируса внутри клеток в так называемых цитоплазматических тельцах-включениях. Один из ярких примеров — тельца Бабеша-Негри, которые представляют собой более крупные патогномические клеточные включения, наблюдаемые, как правило, при окрашивании гематоксилин-эозином в различных нервных клетках для определения инфекций бешенства, вызванных лиссавирусом.
Флуоресцентная микроскопия приобретает всё большую важность в вирусологии. Одним из методов диагностики и количественной оценки некоторых вирусных инфекций является иммунофлуоресценция. Развитие методов флуоресцентной микроскопии открывает дальнейшие возможности для более точных исследований взаимодействия между хозяином и вирусом, распространения вируса и его репликации, например, посредством совместной локализации между клеточными компартментами и вирусом. Повышенная чувствительность, улучшенное разрешение и автоматизация современных микроскопических систем обеспечивают основу для скрининга. Такие инструменты позволяют исследователям получать большое количество информации об инфицированных вирусом клетках, например, при медикаментозном воздействии.
Для изучения ультраструктуры и идентификации определенных вирусов широко используется электронная микроскопия. В частности, корреляция световой и электронной микроскопии (CLEM) может дать уникальное понимание взаимодействия между вирусом и хозяином.
Требования к микроскопам
Незаменимым инструментом для надежного цифрового документирования при наблюдении и поддержании клеточных культур являются компактные, оснащенные высококачественной оптикой и светодиодной флуоресценцией, удобные в использовании инвертированные световые микроскопы. Иммунофлуоресцентный анализ позволяет быстро обнаруживать вирусные агенты прямым (пМФА) и непрямым (нМФА) методами, том числе с помощью наборов антител к вирусу простого герпеса (HSV), вирусу гриппа А и другим респираторным вирусам и энтеровирусам.
Для лабораторных условий с высоким потоком образцов лучше всего подходят автоматизированные корпусные микроскопы со встроенной системой калибровки и контроля среды, а также функцией флуоресценции. Они позволяют проводить как двух-, так и трехмерный полностью автоматический скрининг клеточных культур и тканей. Конфокальные микроскопы позволяют вирусологам подробно изучать клеточную инвазию и готовить пробу к дальнейшему изучению методами иммуноэлектронной микроскопии.
Новейшие разработки в области сканирующей электронной микроскопии (СЭМ) позволили добиться разрешения и качества изображения, необходимого для вирусологических исследований. Режим визуализации с широким полем обзора в сочетании с корреляционной световой микроскопией и автоматизированным рабочим процессом позволяет сэкономить ценное время при поиске нужного вируса и получить быстрый результат даже с трехмерными изображениями.






Световые микроскопы ZEISS для вирусологии

Инвертированный микроскоп ZEISS Primovert идеально подходит для универсальных задач в клинической работе, например, для наблюдения и поддержания лабораторной клеточной культуры. Он устанавливается непосредственно в ламинарный бокс и позволяет быстро и эффективно исследовать неокрашенные клетки с помощью фазового контраста и GFP-меченные клетки – при помощи флуоресценции.
Изучение карбапенем-резистентной энтеробактерии (CRE) и анализ количества живых и мертвых клеток проводятся достаточно просто. С помощью специализированной цифровой камеры можно использовать приложение ZEISS Labscope для iPad для совместного обсуждения изображения на мониторе в группе. На микроскопе можно делать снимки, добавлять аннотации и составлять отчеты, а также передавать их по беспроводной сети.

ZEISS Axio Vert.A1 — это идеальный инструмент как для базовых, так и для сложных задач вирусологии и иммунологии. Он предоставляет возможность выбора между основными стандартными методами контрастирования, включая дифференциально-интерференционный контраст (DIC), а также DIC для работы с пластиковой посудой.
ZEISS Axio Vert.A1 оснащается флуоресценцией и рекомендуется для выполнения иммунофлуоресцентных наблюдений для обнаружения вирусов, исследования CRE или проведения анализа соотношения живых/мертвых клеток. Он позволяет получать высококачественные изображения в процессе исследований, обладает большим диапазоном функций, при этом достаточно компактен и займет совсем немного места рядом с инкубатором.
ZEISS Labscope — это приложение для визуализации, которое позволяет без труда получать многоканальные флуоресцентные изображения с помощью iPad или компьютера, работающего на ОС Windows.
Оптимальный инструмент для решения задач вирусологии и иммунологии >>

Ученым нужны изображения наилучшего качества с четким контрастом и высоким разрешением вне зависимости от предмета исследований. Это особенно важно в вирусологии. Также большое значение имеет максимальная чувствительность для неповреждающей визуализации живых или фиксированных образцов.

ZEISS Celldiscoverer 7 сочетает удобство использования автоматизированного корпусного микроскопа с качеством изображения и гибкостью классического инвертированного биологического микроскопа. ZEISS Celldiscoverer 7 калибруется самостоятельно, автоматически обнаруживает образцы и фокусируется на них. Надежная автоматизированная платформа для визуализации живых клеток позволит собрать больше информации за более короткий срок при работе с клеточными культурами или фрагментами тканей в 2D или 3D.
Высокая пропускная способность и скрининг с высоким разрешением очень важны в прикладном вирусологическом исследовании или при изучении клеточного ответа на определенные лекарства. ZEISS Celldiscoverer 7 также можно оснастить новым модулем ZEISS LSM 900 Airyscan 2 для неповреждающей динамической визуализации живых образцов с высокой частотой кадров в режиме сверхразрешения.
Автоматический микроскоп для визуализации живых клеток >>

ZEISS GeminiSEM 500 позволяет работать с вирусными патогенами с высоким разрешением и с широким полем обзора. Оптика Gemini зарекомендовала себя временем и более 20 лет используется в автоэмиссионной сканирующей электронной микроскопии (FESEM) ZEISS. Визуализация вирусов осуществляется в проходящих электронах с высоким разрешением с помощью детектора aSTEM.
Это сравнимо с визуализацией в трансмиссионном электронном микроскопе (ТЭМ), но со всеми преимуществами более простых процедур подготовки образцов, простоты работы и более высокой автоматизацией. С помощью корреляционной световой и электронной микроскопии (CLEM) можно получить уникальные данные о взаимодействии вируса и хозяина.
Визуализация проб с нанометровым разрешением >>
Читайте также:

