Обработка инфицированных ран ультразвуком
Обновлено: 22.04.2024
Изобретение относится к медицине и может быть использовано в хирургии, травматологии и предназначено для лечения гнойно-септических заболеваний и инфицированных ран. Осуществляют санацию раны или полости больного 5%-ным водным раствором повиаргола с 1%-ной перекисью водорода в соотношении 10 : 1 и воздействием ультразвуком в условиях проточно-промывного дренажа частотой 25 - 30 кГц и амплитудой колебаний 40 - 45 мкм в течение 4 - 5 мин до отрицательных результатов на флору в пробах. Способ позволяет предотвратить развитие сепсиса и связанных с ним летальных исходов. 1 табл.
Формула изобретения
Способ лечения гнойно-септических осложнений и инфицированных ран, включающий механическую обработку, химическую и ультразвуковую санацию, отличающийся тем, что рану или санируемую полость заполняют 5%-ным водным раствором повиаргола с 1%-ной перекисью водорода в соотношении 10 : 1 и воздействуют ультразвуком частотой 25 - 30 кГц амплитудой колебаний 40 - 50 мкм в течение 4 - 5 мин в условиях проточно-промывного дренажа до отрицательных результатов на флору в пробах.
Описание изобретения к патенту
Изобретение относится к медицине и может быть использовано в хирургии, травматологии для лечения гнойно-септических заболеваний и инфицированных ран, вызванных антибиотикорезистентными микроорганизмами.
Известно, что гнойные осложнения, например при выполнении операций в условиях открытого сердца у больных с приобретенными пороками сердца и хроническим эндокардитом, составляют 10-40% (1).
Известны способы лечения и профилактики гнойно-хирургической инфекции с использованием низкочастотного ультразвука через слой жидкости (растворов антибиотиков, 0,1% р-р перекиси водорода, 0,1% р-р муравьиной кислоты, 0,001% р-р перманганата калия), часто при температуре этих растворов до 40 o C. Интенсивность ультразвука составляла 22-60 кГц, экспозиция зависит от площади инфицированной раны. Недостатки: имеют место рецидивы и отсутствие эффекта из-за привыкания микроорганизмов к этим лекарствам (2).
Наиболее близким рассматривается способ лечения инфицированных ран (3), по которому на поверхность наносят ионизированный раствор металлов (Ag, Al) и воздействуют ультразвуком с амплитудой колебаний 25-45 мкм при резонансной частоте акустического узла 26,5 кГц, перемещая инструмент над поверхностью раны в течение 5 мин.
В качестве контактной среды берут физиологический раствор, а источником ионов серебра или алюминия является сам инструмент, волновод которого изготовлен из одного из этих металлов.
Под воздействием ультразвуковых колебаний в озвучиваемый физиологический раствор переходят коллоидные серебро или алюминий и их ионы, способствуя ускорению заживления.
Недостатки прототипа: способ и инструмент для него предназначены, в основном, для наружной санации различных ран и неприемлем (в первую очередь чисто технически) в отношении внутренних структур, например для санации сердечных камер или брюшной полости или перитоните.
Для повышения эффективности и расширения областей лечения осложнений, в первую очередь при хирургических вмешательствах, например эмпиемы плевры, медиастинитов, костно-хондральной инфекции у больных с приобретенными пороками сердца и при воспалительных процессах других органов, оперированных в условиях хронической инфекции септического характера, предлагаем способ лечения с помощью комплексной физико-химической санации в условиях проточно-промывного дренажа до отрицательных результатов на флору в пробах.
Способ осуществляется следующим образом.
Больному с инфицированной полостью осуществляют санацию 5% водным раствором повиаргола с добавлением в него 1% раствора перекиси водорода в соотношении 10:1, которым заполняют санируемую полость, погружают волновод и подвергают ультразвуковой обработке в следующем режиме параметров озвучивания и в сравнении с прототипом (см. таблицу). Одновременно проводят проточно-промывной дренаж.
Павиаргол представляет собой коллоидную дисперсию металлического серебра в гемодезе и выпускается АООТ "Курским комбинатом лекарственных средств". Препарат растворим в воде. Соотношение повиаргола и перекиси водорода 10:1 обеспечивает решение нескольких задач: во-первых, атомарный кислород интенсифицирует переход серебра в ионное состояние, что способствует его проникновению до внутриклеточного уровня. Избыток же перекиси является необходимым для усиления антисептического воздействия, которое невозможно достичь применением их порознь. Это преумножение эффекта, возможно, обеспечивается биохимическим взаимодействием антисептика и окислителя с составляющими клеток организма, в первую очередь с жирами, разрушая их молекулы, что особенно важно для более полного удаления дренированием зараженных возбудителями слоев с поверхности уже санированных (механически) ран или полостей, то есть тех, которые оставлены при визуальном контроле санирования.
Больной Ч. , 42 лет, поступил с диагнозом: Первичный септический эндомиокардит, подострое течение, активность 3 ст., перикардит, аортальная недостаточность 3 ст. , митральная недостаточность 2 ст., миокардит, синусовая тахикардия, НК 26, нефрит, гепатит, резидуальная тромбэмболия мелких ветвей левой легочной артерии. Анемия. Состояние тяжелое, температура 38,5-39,0 o C. И.б. N 1218.
Бак. исследование: в зеве, носоглотке - обильный рост зеленящего стрептококка, микрококка. Посев крови: отрицательный.
По клиническим данным - единственный способ спасения жизни больного при высокой опасности риска активации сепсиса и низкими исходными резервами компенсации - хирургическая коррекция порока путем протезирования аортального клапана с использованием заявленного способа лечения антисептиками в комплексе с ультразвуковой обработкой операционной и послеоперационной раны. Больному выполнено протезирование аортального клапана. В послеоперационном периоде явления переднего медиастинита. Установлен проточно-промывочной дренаж и волновод в переднем средостении. Раневая поверхность переднего средостения постоянно промывалась 5% водным раствором повиаргола с 1% раствором перекиси водорода 10:1. Воздействие ультразвуком с амплитудой колебаний 40-50 мкм и частотой 25-30 кГц осуществлялось периодически в течение 4-5 мин. На 8 сутки пробочно-промывной дренаж вместе с волноводом удален. Заживление раны первичным натяжением. Выписан на 4-ой неделе после операции в удовлетворительном состоянии.
Способ применим для лечения наружных или открытых ран, а также обеспечивает возможность лечения внутренних ран и полостей и предотвращает развитие сепсиса и связанных с ним летальных исходов.
Источники информации
1. Пальцев А.В. Экстракорпоральная гемоиммунокоррекция в лечении больных с тяжелой хирургической инфекцией. Автореферат диссертации, 14.00.27, Новосибирск, 1997, с. 3.
Ультразвуковая обработка ран (UAW) – эффективный метод удаления биопленки на поверхности ран, которая замедляет процесс заживления.
При обработке ран данным методом используется эффект кавитации.
Кавитация разрушает наложения и биопленки на ране.
Осуществляется ультразвуковым аппаратом.
Преимущества: не увеличивает рану и не повреждает здоровую ткань.
Лечение выполняется в отделении:
Отделение хирургических инфекций
Комплексное лечение ран различной этиологии с применением современных аппликационно-сорбционных и интерактивных методик, при которых используются инновационные перевязочные средства.
Этот метод лечения проводится при заболеваниях
Используемое оборудование и технологии





HANSAPOR™ - повязка из нетканого полиамидного водоотталкивающего материала высокого качества для послеоперационных.




INTRASITE™ CONFORMABLE - повязка из нетканой вискозы, пропитанная гидрогелем, предназначенная для очищения.


OPSITE™ FLEXIGRID™ - проницаемая для паров влаги прозрачная полиуретановая пленка с системой аппликации

Связанные статьи
Врачи-хирурги отделения гнойной хирургии приняли участие в мастер-классе «Метод лечения ран отрицательным.
16-17 мая 2016 года в г. Москве состоялась Международная научно-практическая конференция «Реконструктивные.
10-11 ноября 2016 года на базе ГБУЗ «Научно-исследовательский институт - Краевая клиническая больница.
21 октября 2016 года в г. Казани состоялась VIІI Всероссийская научно-практическая конференция с международным.
Другие методы лечения, проводимые в отделении
Колл-центр
(пн-пт 8:00-20:00, сб-вс 9:00-15:00)
8 (495) 620-80-95
Госпитализация (круглосуточно)
8 (499) 394-67-57
Скорая помощь (круглосуточно)
8 (495) 620-84-04
8 (499) 390-80-84
Метод ультразвуковой кавитации при лечении ран различной этиологии
Фисталь Э.Я.
Коротких Д.М.
Солошенко В.В.
Фисталь Н.Н.
Колесник А.И.
Арефьев В.В.
Институт неотложной и восстановительной хирургии им. В.К.Гусака АМН Украины
Кафедра комбустиологии, пластической хирургии и урологии ДонГМУ
Донецк, Украина
До недавнего времени использование ультразвука (УЗ) ограничивалось преимущественно в физиотерапевтической и диагностической практике. Интерес хирургов к УЗ возрос после изучения его биологических и физических свойств, что привело к более широкому использованию УЗ в хирургии [1].
Биологические свойства УЗ обусловлено выраженным бактерицидным и бактериостатическим действием на различные микроорганизмы. [1,2,6,7]. Бактерицидный эффект связан с повреждающим действием ультразвуковой волны на микробную клетку, повышением температуры озвучиваемой среды, образованием в ней гибельно действующих на микроорганизмы химических соединений, снижением антибиотикорезистентности возбудителей раневой инфекции и др. Наряду с собственным бактерицидным эффектом низкочастотный УЗ существенно усиливает действие многих антибиотиков и антисептиков на различные микроорганизмы [1,3].
Ультразвук (УЗ) стимулирует внутриклеточный биосинтез и регенераторные процессы, вызывает расширение кровеносных сосудов и увеличение регионарного кровотока в 2-3 раза, инициирует благоприятные изменения в микроциркуляторном русле и адвентиции сосудов, развитие коллатералей, что очень важно при воспалительных и гнойно-деструктивных процессах.
Кроме улучшения микроциркуляции, УЗ оказывает противовоспалительное действие за счет улучшения устранения застойных явлений, рассасывания инфильтратов, повышения фагоцитарной активности лейкоцитов и уровня неспецифической защиты.
УЗ низкой частоты не только повышает эластичность соединительной ткани, но и способствует разволокнению соединительных волокон и усилению их синтеза фибробластами, поэтому воздействие УЗ на поврежденные ткани сопровождается образованием нежного и рыхлого рубца.
Применение низкочастотного УЗ в комплексном лечении (с применением механической очистки язв от некротизированных свободно лежащих тканей, химических антисептиков и протеолитических ферментов – местно) трофических язв, обусловленных хронической венозной недостаточностью нижних конечностей, обладает многими ценными качествами, усиливающими терапевтическую эффективность, что имеет важное значение при наличии у больных противопоказаний к радикальному оперативному лечению или в период подготовки к операции [1,2,4,5]. Активизация УЗ лизосомальных ферментов макрофагов приводит к очищению воспалительного очага от клеточного детрита и патогенной микрофлоры в экссудативной стадии. Наряду с этим УЗ-волны ускоряют синтез коллагена фибробластами и образование грануляционной ткани в пролиферативной стадии воспаления.
Большое значение имеет также окислительное действие кислорода, который активизируется ультразвуком. Перекись водорода, образующаяся при обработке ран УЗ губительно действует на многие бактерии (особенно на клостридиальную микрофлору)
Механизм работы воздействия УЗ кавитации на раневой процесс (УЗ) заинтересовал нас при лечении ожогов, ран после гнойно-некротических заболеваний, травм и трофических язв с точки зрения очищения и подготовки ран и язв различной этиологии к аутодермопластике, для стимуляции их самостоятельного заживления.
Материалы и методы
Исследования проведены Донецком ожоговом центре ИНВХ им. В.К.Гусака АМН Украины у 192 больных. В основную группу наблюдения вошли 92 больных, пролеченных за период 2004-2006 гг., которым в лечении использовался ультразвуковой кавитатор. Группу контроля составили 100 пациентов, которым грануляции и некротические ткани иссекали традиционным способом. Обе группы сравнимы, по полу, возрасту, нозологии, локализации и глубине и площади поражения.
Группы были разделены на подгруппы в соответствии с этиологическими факторами повреждения :
1. Пациенты с ожоговыми гранулирующими ранами (у одного пациента, как правило, сочетаются гранулирующие раны с участками некроза) которым выполнялась ультразвуковая кавитация (УЗК) с целью подготовки ран к одномоментной аутопластике – 33 человека (35,87%).
2. С трофическими язвами различной этиологии, которым выполнялась УЗК с целью подготовки ран к аутопластике и стимуляции репаративных процессов – 35 пациентам (38,04%)
3. С гнойно-некротическими заболеваниями кожи, которым выполнялась УЗК с целью подготовки ран к аутопластике – 24 больных (26,09%)
Контрольная группа соответствующим образом как и основная была разделена на 3 подгруппы, в которые вошли: 1-я подгруппа — 20 больных, 2-я подгруппа — 65 больных, 3-я подгруппа — 15 больных.

Рис. 1 Ультразвуковой кавитатор Sonoca – 190
В первой основной подгруппе очищение от остатков некроза и иссечение грануляций выполняли с помощью УЗК, после чего проводилась одномоментная аутопластика. В группе контроля очищение ран осуществляли по стандартной методике острым путем с помощью скальпеля, ножниц и щетки так же с одномоментной аутодермопластикой.
Во 2 основной подгруппе очищение язв от остатков некроза и иссечение грануляций выполняли с помощью УЗК, после чего выполнялась одномоментная или этапная аутопластика. В группе контроля некрэктомию выполняли по стандартной методике острым путём.
Больным 3 основной подгруппы, с целью подготовки к аутодермопластике, выполнялась УЗ некрэктомия с отсечением соединительнотканных перемычек и сосудов электроножом. В группе контроля некрэктомию выполняли по стандартной методике с помощью скальпеля.
Результаты и обсуждение.
При сравнении показателей первых подгрупп были выявлены следующие закономерности: приживление одномоментно пересаженной аутокожи увеличилось с 58% до 65% в основной группе. Данная тенденция прослеживается вне зависимости от площади раны, изменяясь всего на ± 2% . Количество операций, проведенных данной группе больных так же были объектом нашего исследования. Общее количество аутодермопластик проведённых в основной группе было на 7% меньше, чем в группе контроля, что, по нашему мнению, объясняется в первую очередь более хорошим приживлением аутокожи. Количество койко-дней уменьшилось с 10,7 до 12,2.
Рис. 2 Ожог кипятком III ст.* левой стопы. УЗ некрэктомия, аутодермопластика
При сравнении результатов приживления аутолоскутов вовторой подгруппе были получены следующие результаты: приживление одномоментно пересаженной аутокожи увеличилось с 59% до 63,5% в основной группе.
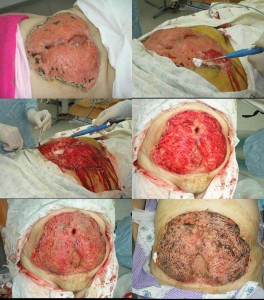
Рис. 3. Обширная гранулирующая рана у пациентки, перенесшей перитонит, осложнившийся флегмоной передней брюшной стенки с некрозом мягких тканей. УЗ кавитация, аутодермопластика.
Применение ультразвуковой кавитации в лечении больных с гнойно-некротическими заболеваниями кожи (рожа, гнойный целлюлит, фасцит, флегмоны, гнойные затеки) позволило добиться в группе исследования приживляемости аутолоскутов до 85,04±6,5%, по сравнению с группой контроля 68,18±7,4%., что свидетельствует о более лучшей подготовке раневой поверхности к восприятию аутотрансплантата. В результате средний койко-день в группе исследования снизился в среднем на 3 суток, количество аутопластик так же уменьшилось с 2,4 до 1,6 операций на пациента.
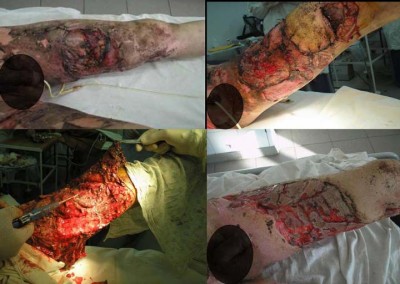
Рис. 4. Комбинированная травма – ожог пламенем взрыва II-IIIст. туловища, рук, ног S=20% п.т. Скальпированные раны ног, живота. Перелом ключицы справа, травматическая ампутация 1 пальца правой кисти. УЗ кавитация, аутодермопластика.
Таким образом, данные, полученные в процессе исследования эффективности применения ультразвуковой кавитации в лечении ран различной этиологии свидетельствуют о том, что использование методики УЗ некрэктомии удлиняет время операции, однако позволяет увеличить приживление одномоментно пересаженных аутолоскутов. Ультразвуковая кавитация достоверно уменьшает сроки лечения больных с трофическими язвами, однако не уменьшает количество оперативных вмешательств.
1. Любенко Д.Л. Применение ультразвука в медицине. / / Лечебное дело. – 2004. — №3-4. – С.25-27.
2. Вишневский В.А., Магомедов М.Г. Ультразвуковые аппараты для хирургической мобилизации (Auto Sonix Scalpel, Sono Surg). / / Эндоскопическая хирургия. – 2003. — №1. – С.43-45.
3. Денищук П.А. Ультразвук в хирургии. / / Хирургия. – 2001. — №5. – С.42-43.
4. Чмырев И.В. Ультразвуковая диссекция при оперативном лечении глубоких ожогов: автореферат диссертации на соискание ученой степени кандидата медицинских наук. – Санкт-Петербург, 2005. – 25с.
5. Будкевич Л.И., Воздвиженский С.И., Гуруков Ш.Р., Пеньков Л.Ю., Шурова Л.В. Новая концепция хирургического лечения ожоговой раны – неотложное оперативное вмешательство. / / Вестник неотложной и восстановительной медицины. – 2002. — №3. – С.405-407.
6. Липатов К.В., Сопрамадзе М.А., Шехтер А.Б., Руденко Т.Г., Емельянов А.Ю. комбинированная озоно-ультразвуковая терапия в лечении гнойных ран. / / Хирургия. – 2002. — №1. – С.36-39.
7. Жаров В.П., Меняев Ю.А., Кабисов Р.К., Альков С.В., Нестеров А.В., Саврасов Г.В. Разработка и применение низкочастотного ультразвука и его комбинации с лазером в хирургии и терапии. / / Биомедицинская электроника. – 2000. — №4. – С.13-23.
* — глубина ожогов приведена в соответствии с классификацией, принятой на Украине.
Д.А. Соловьев, С.И. Щукин, С.П. Скворцов, А.П. Николаев, П.В. Лужнов
Аннотация
Проанализирован опыт применения низкочастотного ультразвука при лечении инфицированных ран. Обоснована роль кавитации как первопричины лечебного эффекта. Предложена новая концепция организации обратной связи в ультразвуковых аппаратах на основе контроля параметров кавитационной области.
Сведения об авторах
Список литературы
1. Галимзянов Ф.В. Лечение инфицированных ран и раневой инфекции / Уч. пособие. – Екатеринбург: УГМА, 2012. 88 с.
3. Зайнутдинов А.М. Применение ультразвуковой кавитации при хирургических инфекциях // Казанский медицинский журнал. 2009. Т. 90. № 3. С. 414-420.
5. Unger P.G. Low-frequency, noncontact, nonthermal ultrasound therapy: A review of the literature // Ostomy Wound Manage. 2008. Vol. 54. PP. 57-60.
8. Сидоренко С.В. Микробиологические аспекты хирургических инфекций // Инфекции в хирургии. 2003. Т. 1. № 1. С. 22-27.
9. Саврасов Г.В. Технологии ультразвуковой хирургии / Уч. пособие. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2009. 36 с.
10. Лощилов В.И., Веденков В.Г., Орлова А.А. Исследование влияния акустических колебаний на процессы ультразвуковой обработки инфицированных ран / Труды МВТУ им. Н.Э. Баумана. 1975. Ультразвук и другие виды энергии в хирургии. С. 32-35.
11. Лощилов В.И., Веденков В.Г., Орлова А.А. Физические основы способа обработки инфицированных ран / Труды МВТУ им. Н.Э. Баумана. 1975. Ультразвук и другие виды энергии в хирургии. С. 27-32.
15. Driver V.R., Min Yao, Miller C.J. Noncontact low-frequency ultrasound therapy in the treatment of chronic wounds: A meta- analysis // Wound Rep. Reg. 2011. Vol. 19. PP. 475-480.
16. Uhlemann Ch., Wollina U. Wirkungsphysiologische Aspekte des Therapeutischen Ultraschalls in der Wundbehandlung // Phlebologie. Jan. 2003. Vol. 32. № 04. PP. 81-85.
17. Улащик В.С. Низкочастотная ультразвуковая терапия с применением отечественного аппарата АНУЗТ-1-100 / Метод. рекомендации. – Минск: БГМУ, 2009. 16 с.
18. Wollina U., Heinig B. et al. Effects of low-frequency ultrasound on microcirculation in venous leg ulcers // Indian Journal of Dermatology. March 2011. Vol. 56. № 2. PP. 174-179.
20. Акопян В.Б., Ершов Ю.А. Основы взаимодействия ультразвука с биологическими объектами: ультразвук в медицине, ветеринарии и экспериментальной биологии / Под ред. С.И. Щукина. – М.: МГТУ им. Н.Э. Баумана, 2005. 224 с.
21. Iida K., Luo H., Hagisawa K., Akima T., Shah P.K., Naqvi T.Z. et al. Noninvasive low-frequency ultrasound energy causes vasodilation in humans / J. Am. Coll. Cardiol. 2006. Vol. 48. № 3. PP. 532-537.
22. Седов В.М., Гордеев Н.А., Кривцова Г.Б. Лечение инфицированных ран и трофических язв ультразвуком низкой частоты // Хирургия. 1998. № 4. С. 39-41.
23. Использование низкочастотного ультразвука в лечении хирургической инфекции / Учебно-методическое пособие для врачей. – Екатеринбург: УГМУ, 2016. 82 с.
24. Физика и техника мощного ультразвука. В 3-х т. Т. 2. Мощные ультразвуковые поля / Под. ред. Л.Д. Розенберга. – М.: Наука, 1968. 267 с.
27. Чмырев И.В., Степаненко А.А., Рисман Б.В. Применение ультразвуковой кавитации при лечении ожоговых ран, пролежней, язв и отморожений // Вестник СПбГУ. 2011. Т. 11. № 4. С. 86-92.
31. Умудов Х.М., Кулиев Р.А. Влияние ультразвукового лечения на течение гнойного воспаления // Клин. хирургия. 1997. № 7/8. С. 15-17.
32. Обоскалова Т.А., Глухов Е.Ю., Лаврентьева И.В. и др. Лечение воспалительных заболеваний женских половых органов с использованием лекарственных растворов, кавитированных низкочастотным ультразвуком / Практич. руководство. – Екатеринбург: УГМА, 2012. 41 с.
34. Миллер Э., Хилл К., Бэмбер Дж., Дикинсон Р., Фиш П., тер Хаар Г. Применение ультразвука в медицине: физические основы. – М.: Мир, 1989. 568 с.
35. Скворцов С.П. Методы контроля параметров ультразвуковой кавитации // Наука и образование (МГТУ им. Н.Э. Баумана). 2015. № 02. С. 83-100.
Использование: медицина, медтехника для ультразвуковой обработки инфицированных ран. Сущность изобретения: в полость инфицированной раны вводятся нагретые до 23-42 o C лекарственные средства, для этого на ране размещают герметическую камеру, заполненную этими средствами, проводят озвучивание ультразвуком низкой частоты, при этом в камере создают избыточное давление 0,05-0,15 МПа. Устройство для реализации способа содержит незамкнутую камеру с отверcтиями для введения лекарственного раствора и ультразвукового волновода, выполненную с возможностью установки открытым концом на поверхности обработки, дополнительно на камере размещены датчик давления в полости камеры и элементы ее крепления на теле пациента. Технический результат: интенсификация проникновения лекарственных веществ в биоткань. 2 с.п. ф-лы, 3 ил.
Формула изобретения
1. Способ ультразвуковой обработки инфицированных ран, включающий введение в полость раны лекарственного раствора, нагретого до 23 42 o С, с последующей обработкой ультразвуком низкой частоты, отличающийся тем, что ультразвуковую обработку инфицированных тканей осуществляют в герметической камере, размещенной на ране, заполненной нагретым лекарственным раствором, при этом создают избыточное давление 0,05 0,15 МПа.
2. Устройство для ультразвуковой обработки инфицированных ран, содержащее незамкнутую камеру с отверстиями для введения лекарственного раствора и ультразвукового волновода, выполненную с возможностью установки открытым концом на поверхности обработки, отличающееся тем, что дополнительно на камере размещены датчик давления в полости камеры и элементы ее крепления на теле пациента.
Описание изобретения к патенту
Изобретение относится к области медицины, конкретно к ультразвуковой обработке инфицированных ран.
Известен способ ультразвуковой бактерицидной обработки инфицированных тканей с использованием различных лекарственных веществ [1] Лекарственный раствор подавался на поверхность инфицированной раны и подвергался ультразвуковому воздействию за счет введения в озвучиваемую среду ультразвукового инструмента. Обработка осуществлялась при частоте колебаний 26,6 кГц и амплитуде смещения торца инструмента 55-60 мкм, в качестве озвучиваемой среды использовались антибиотики.
Описанный способ не отличается универсальностью. При относительно малых ранах и выступании раневой поверхности над близлежащей частью тела лекарственный раствор не удерживается в ране, он безвозвратно теряется, не оказывая какого-либо лечебного действия. Кроме того, современные штаммы стафилококковой микрофлоры отличаются высокой антибиотикорезистентностью, в том числе и при ультразвуковом воздействии.
Известны результаты использования низкокачественного ультразвука при первичной хирургической обработке инфицированных ран [2] В рассматриваемом случае сохраняются недостатки ранее описанного способа санации инфицированных ран, кроме того, отмечается относительно слабое бактерицидное действие ультразвуковых колебаний на золотистый стафилококк.
Известна работа Захаровой Г.Н. посвященная применению низкочастотного ультразвука в профилактике и лечении гнойных ран [3] где показана возможность совмещения действия ультразвука и антисептических растворов. Однако и в этом случае не наблюдался бактерицидный эффект при воздействии на стафилококковую микрофлору; достаточно устойчивыми к низкочастотному ультразвуку оказались также протей и синегнойная палочка.
Известны результаты ультразвуковой обработки ран [4] когда в качестве озвучиваемых сред использовались как антибиотики (тетрациклин), так и антисептики (фурацилин). Оказывается, что бактерицидный эффект проявляется при сравнительно больших временных дозах ультразвукового воздействия от 30 до 180 с/см 2 , что приводило к усилению воспалительного процесса, а при дозе 180 с/см 2 отмечался некроз мышц.
Наиболее близким по своей сути к предлагаемому способу лечения инфицированных ран является способ, включающий повышение температуры озвучиваемых лекарственных растворов, выбранных за прототип [5]
Известно, что повышение температуры озвучиваемых лекарственных растворов способствует интенсификации бактерицидной способности ультразвуковых колебаний [5] В работе описаны эксперименты по совмещению действия ультразвука с антисептическими растворами малой концентрации при оптимальном повышении температуры озвучиваемого раствора. Озвучивание раневой микрофлоры с концентрацией 40-4210 3 микробных тел в 1 мл (мг/мл) раствора объемом 50 мл осуществлялось с рабочей частотой 26,5 кГц и амплитудой колебаний 50-60 мкм. В качестве дезинфицирующих средств использовались растворы 0,1%-ный Н 2 O 2 , 0,1% -ный НСООН и 0,001%-ный КМпО 4 при дискретном изменении температуры озвучиваемой среды в пределах 23-42 o C. Наибольший бактерицидный эффект проявляется при совместном действии ультразвука с подачей в рану нагретого до температуры 37 o C раствора перекиси водорода или раствора перманганата калия, что позволяет сократить время подавления бактериальной микрофлоры в 1,5-2,0 раза по сравнению с процессом озвучивания микробных тел в растворе антисептика при комнатной температуре (при 23 o C). Так, необходимое время бактерицидной обработки снижалось при озвучивании стафилококковой микрофлоры с 14 до 9 мин, растворов с преобладанием кишечной палочки с 13 до 8, синегнойной палочки с 12 до 7, протея с 10 до 6 мин.
Приведенные результаты исследований показывают, что время экспозиции, при котором обеспечивается бактерицидная обработка биотканей, остается достаточно большим и колеблется в пределах от 6 до 9 мин в зависимости от вида бактериальной микрофлоры. В этом случае возможно проявление негативного действия ультразвука на здоровые клетки и грануляционный слой раны.
Кроме того, и в данном способе не гарантируется активное попадание лекарственного раствора во все полости и карманы инфицированной раны. Эффективность способа значительно снижается при малых размерах раны или выступании раневой поверхности, что не позволяет лекарственному раствору надежно накапливаться на озвучиваемых биотканях.
Задача, на решение которой направлено заявляемое изобретение, усиление бактерицидной способности ультразвуковых колебаний, создание благоприятных условий для ультразвуковой обработки любых ран независимо от размеров и состояния раневой поверхности, интенсификация проникания лекарственных веществ в биоткани, сокращение времени стерилизации инфицированных ран и процесса заживления в целом.
Указанная задача решается тем, что ультразвуковая обработка инфицированных биологических тканей осуществляется в герметичной камере, заполненной нагретым лекарственным раствором под внешним статистическим давлением в диапазоне 0,05-0,15 МПа. Камера в виде воронки накладывается на раневую поверхность и закрепляется на ней, полностью закрывая наружные края раны. В камеру на глубину 10-15 мм вводится волновод, не касающийся каких-либо участков поверхности инфицированной раны, после чего в камеру под давлением 0,05-0,15 МПа подается предварительно нагретый до температуры 37-42 o C раствор лекарственного вещества, в качестве которого первоначально опробовались антисептики окислительной группы.
Нагретый антисептический раствор, подаваемый в камеру под давлением, выполняет роль постоянно присутствующей контактной среды и способствует непрерывности процесса озвучивания ран любой формы и размеров. Избыточное статистическое давление обеспечивает надежное попадание антимикробных средств во все полости и карманы инфицированной раны. Наложение оптимальной величины внешнего статистического давления на озвучиваемую среду приводит к повышению гидростатического давления, что в свою очередь увеличивает скорость захлопывания кавитационных полостей (каверн), интенсифицирует действие ударных волн и усиливает процесс кавитации в целом. В этом случае активизируется химическое (окислительное) действие ультразвука с образованием в растворе большого числа химически активных радикалов, увеличивается проницаемость клеточных мембран, усиливается диффузионное проникание химически активных веществ через оболочки клеток, что в целом значительно сокращает необходимое время санации инфицированных ран.
Постоянное присутствие лекарственной среды в камере обеспечивает непрерывность процесса ультразвукового воздействия и возможность ультразвуковой обработки различного типа ран независимо от их формы и размеров на разных стадиях протекания раневого процесса. С другой стороны, наличие оптимальной величины внешнего давления усиливает бактерицидное действие ультразвуковых колебаний, создает условия для надежного попадания лекарственного вещества во все полости и карманы раны, способствуя распространению ультразвуковых колебаний по всему объему раны, интенсифицирует накопление лекарственных веществ в биотканях, активизирует очистку и массаж раневых поверхностей от некротических налетов, обеспечивает условия для эпитализации раны и значительно снижает сроки заживления. Признаки, отличающие заявляемый способ обработки инфицированных ран от способа, изложенного в прототипе, не выявлены в других способах при изучении данной и смежных областях медицины и, следовательно, обеспечивают заявляемому решению соответствие критерию "изобретательский уровень".
Для выполнения указанного способа обработки инфицированных ран разработано устройство для введения лекарства в организм.
Известно устройство для введения лекарств в организм, которое содержит рукоятку, камеру с мембраной, заполненную лекарственной жидкостью, аппликатор ультразвука и согласующий элемент в виде тампона, примыкающего к аппликатору со стороны дистальной части устройства и соединенный с камерой. Тампон выполнен эластичным [6]
Данное устройство не позволяет вводить лекарственную жидкость под заданным избыточным статическим давлением, тем самым не обеспечивается надежное попадание антимикробных средств во все полости и карманы инфицированной раны.
Наиболее близким по технической сути к предлагаемому устройству обработки инфицированных ран является устройство введения лекарств в организм [7] содержащее незамкнутую камеру с отверстиями для введения лекарственного раствора и ультразвукового волновода, устанавливаемую открытым концом на поверхность обработки.
Данное устройство также не позволяет вводить лекарственную жидкость под заданным избыточным статическим давлением, тем самым не обеспечивается надежное попадание антимикробных средств во все полости и карманы инфицированной раны.
Сравнительный анализ показал, что заявляемое решение отличается от прототипа наличием элементов крепления устройства на теле, обеспечивающих герметизацию, и датчика давления, что обеспечивает критерий изобретения "новизна".
Признаки, отличающие заявляемое устройство от прототипа, не выявлены в других аналогах при получении данной и смежных областях медицины и, следовательно, обеспечивают заявляемому решению соответствие критерию "изобретательный уровень".
На фиг. 1 представлено устройство для реализации способа ультразвуковой обработки инфицированных ран, вид сверху; на фиг.2 общий вид устройства в разрезе; на фиг.3 схема обработки инфицированной раны.
Устройство состоит из корпуса (камеры) 1 с двумя отверстиями 2 и 3 для ввода лекарственного раствора и волновода через втулку 4 и гайку 5, а также поворотного клапана 6 регулирования поступления раствора в камеру, на торце камеры предусмотрено резиновое уплотнение 7 с прокладкой 8. В корпус встроен датчик давления, состоящий из втулки 9, цилиндра 10, плунжера 11, винта 12 и отторированной пружины 13. Устройство снабжено гайкой 14 с прорезями 15 18 крепления бандажных жгутов.
Способ обработки инфицированной раны осуществляют следующим образом.
На предварительном этапе реализации способа по общеизвестным методикам проводят клинический анализ крови и мочи, исследуют мазки из раневой полости на флору. Бактериологическими исследованиями устанавливают виды патогенной микрофлоры, присутствующие в ране, преобладающий вид микроорганизмов, а также наличие микробных ассоциаций. По результатам исследований выбирают основные параметры процесса ультразвуковой обработки. Больного укладывают в положение, при котором устройство накладывают на раневую поверхность и закрепляют на ней, полностью закрывая наружные края раны. Закрепление устройства обеспечивают натяжением бандажных жгутов 19, захваты которых входят в прорези 15 18 гайки 14. Степень натяжения определяют условиями герметизации, обеспечивают вручную и фиксируют специальным зажимом.
В камеру устройства вводят волновод 20 через отверстие 3 гайки 5 и уплотнительной втулки 4. Расстояние между излучающим торцем волновода и раневой поверхностью не должно быть меньше 5-10 мм, что исключает термомеханическую деструкцию тканей раны.
Через отверстие 2 клапана 6 во внутреннюю полость устройства подается предварительно нагретый до температуры 37-42 o C лекарственный раствор, выбор которого определяется превалирующим видом микрофлоры в ране. Подачу раствора осуществляют с помощью медицинского шприца, наконечник которого вводят в отверстие 2 до упора в валик клапана 6. За счет принудительного нагнетания раствора в камере искусственно создают избыточное давление в пределах 0,05-0,15 МПа. При достижении в камере заданной величины давления валик клапана 6 поворачивают на 90 o путем нажатия на лепесток с насечкой, что перекрывает отверстие для подачи раствора в камеру.
В процессе осуществления бактерицидной обработки допускаются некоторая разгерметизация стыка и незначительные утечки жидкости из камеры при условии сохранения в ней величины избыточного давления в пределах 0,05-0,15 МПа, что достигается периодической принудительной подпиткой в камеру лекарственного раствора. Включают источник низкочастотных ультразвуковых колебаний и осуществляют обработку раны при общепринятых оптимальных параметрах процесса озвучивания биотканей: частота ультразвуковых колебаний 26,5 кГц; амплитуда колебаний излучающего торца волновода-инструмента 40-50 мкм; продолжительность ультразвукового воздействия 4-5 мин, что соответствует интенсивности озвучивания 20-25 с/см 2 .
Возникающие при этом физико-химические процессы, инициируемые повышенными температурой раствора, статическим давлением, кавитацией, акустическими течениями, переменным звуковым давлением, вызывают распространение лекарственного раствора по всему объему раны, его попадание во все полости и карманы. При этом в зоне развитой кавитации ультразвукового поля увеличивается проницаемость клеточных мембран, в озвучиваемой среде появляются химически активные радикалы H , OH , HO 2 , химически активные вещества проникают через оболочки бактериальных клеток, нарушают или прекращают окислительно-восстановительные процессы в микробных клетках, вызывают их гибель. Высокоактивные первичные и вторичные продукты звукохимических реакций разносятся по всему объему обрабатываемой раневой полости, депортируются в поверхностном слое раны, где скапливается основная масса патогенных микроорганизмов. В то же время проявлением "обратного" ультразвукового капиллярного эффекта обеспечивается экстракция патологического содержимого и патогенной микрофлоры из капиллярно-пористой системы поверхности раны, осуществляется интенсивная очистка раневой полости. По окончании процесса обработки инфицированной раны ультразвуковые колебания выключают, снимают камеру, производят визуальный контроль раны, накладывают стерильную повязку.
Повторный визуальный, а при необходимости микробиологический и патологический контроль осуществляют периодически при смене повязки. По результатам контроля делают заключение о целесообразности и сроках проведения повторной обработки раны. Количество сеансов обработки инфицированной раны предлагаемым способом определяют в каждом конкретном случае индивидуально, в зависимости от типа и состояния раны, степени ее бактериальной загрязненности, микробного пейзажа раны, состояния организма больного, динамики протекания послеоперационного периода заживления. Общее количество сеансов за весь курс лечения не превышает пяти-семи.
Разработанный способ обработки инфицированных ран позволяет не только обеспечить эффективное подавление бактериальной микрофлоры независимо от формы и размеров ран на различных стадиях протекания раневого процесса, но и снизить опасность метастазирования инфекции из зоны гнойного очага в слои биотканей, прилегающих к области озвучивания за счет интенсивной очистки раневых поверхностей, активной импрегнации в них лекарственных растворов с превышением минимально подавляющей концентрации.
1. Николаев Г.А. Лощилов В.И. Ультразвуковая технология в хирургии. М. Медицина, 1980, с. 222.
2. Горячев А.Н. и др. Низкочастотный ультразвук при первичной хирургической обработке. Тезисы докладов II-й Всесоюзной конференции "Рана и раневая инфекция". М. 1986, с. 27.
3. Захарова Г.Н. и др. Применение низкочастотного ультразвука в профилактике и лечении гнойных ран. Тезисы докладов II-й Всесоюзной конференции "Раны и раневая инфекция". М. 1986.
4. Младенцев П.И. и др. Применение кавитационного ультразвука при хирургической обработке ран. Тезисы докладов II-й Всесоюзной конференции. "Раны и раневая инфекция". М. 1986.
5. Черкашин В. В. и др. Влияние физико-химических факторов на усиление бактерицидного действия ультразвука. Сб. Ультразвук в физиологии и медицине. -Тезисы докладов III-й Всесоюзной конференции. Ташкент, 1980, с. 176.
Читайте также:

