Обязательно ли при инфицированных ранах фтл
Обновлено: 18.04.2024
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (< 1200 в 1 мкл), восстановления функции кишечника (обычно примерно после недельного курса лечения).
Инфицирование послеоперационных ран относится к разряду внутрибольничных инфекций, где возможны разные варианты эмпирической антибиотикотерапии в зависимости от тяжести течения раневой инфекции и особенностей формирования резистентности бактерий к антибиотикам. При неосложненных инфекциях мягких тканей, как правило, обходятся монотерапией, в то время как осложненные инфекции, требующие повторных оперативных вмешательств и нередко приобретающие системный характер, чаще нуждаются в назначении антибиотиков более широкого спектра действия или проведении комбинированной антибиотикотерапии.
При лечении тяжелых и жизнеугрожающих инфекций препаратами выбора становятся аминогликозиды, спектр действия которых охватывает подавляющее большинство аэробных грам(-) и грам(+) бактерий (за исключением стрептококков и пневмококков), а в комбинации с пенициллином они оказывают синергическое бактерицидное действие на энтерококки. Однако, несмотря на их активность против Staphylococcus spp., аминогликозиды не следует применять в качестве стартовой монотерапии при стафилококковой инфекции. Гентамицин наиболее широко применяется в практике, однако имеется много свидетельств о высоком удельном весе резистентных к нему микробных изолятов от стационарных больных, что снижает эффективность лечения хирургической инфекции. Наиболее активным среди аминогликозидов является нетилмицин (нетромицин), который, по нашим данным, превосходит другие антибиотики этой группы и некоторые цефалоспорины 3-го поколения и сопоставим по антимикробной эффективности лишь с фторхинолонами (см. табл. 2). У него наименее выражен ото- и нефротоксический эффект, что позволяет вводить суточную дозу препарата однократно без увеличения частоты побочных осложнений. Такой режим введения существенно увеличивает ударное антимикробное действие нетилмицина и имеет экономические преимущества. По стоимости он гораздо доступнее амикацина и, по нашему опыту, должен занять первостепенное положение среди аминогликозидов в лечении оппортунистических инфекций.
Таблица 2
АНТИБИОТИКОЧУВСТВИТЕЛЬНОСТЬ ГРАМ(-) БАКТЕРИЙ ПРИ ИНФЕКЦИЯХ КОСТЕЙ И МЯГКИХ ТКАНЕЙ (%)
| Антибиотики | E.col (n=28) | KES* (n=48) | Proteus spp. (n=22) | P.aeruginoza (n=37) | Acinetobacter (n=19) |
| Нетромицин | 100 | 90 | 73 | 74 | 88 |
| Амикацин | 75 | 40 | 57 | 67 | 75 |
| Тобрамицин | 58 | 34 | 22 | 63 | 43 |
| Гентамицин | 50 | 36 | 30 | 58 | 27 |
| Цефтазидим | 83 | 40 | 70 | 57 | 40 |
| Ципрофлоксацин | 100 | 88 | 79 | 83 | 80 |
Нельзя обойти вниманием и фторхинолоны, которые все чаще становятся препаратами выбора при системных инфекциях. Среди них ципрофлоксацин (ципробай, ципринол) занял прочное место в хирургической практике, в то время как другие препараты этой группы чаще используются для лечения больных терапевтического профиля. Наличие инфузионной формы препарата существенно повышает его конкурентоспособность при лечении больных в реанимационных отделениях, а возможность проведения так называемой ступенчатой терапии с переходом на пероральный прием антибиотика (без существенного снижения его концентрации в крови из-за высокой биоусвояемости при всасывании) значительно снижает стоимость курса лечения. Область применения ципрофлоксацина в хирургии с одинаковым успехом распространяется на инфекции костей и мягких тканей, интраабдоминальные инфекции, инфекции органов грудной полости и малого таза и, конечно, при лечении сепсиса.
Таким образом, применение антибиотиков в хирургии с профилактической и лечебной целью имеет свои особенности, а знание спектра возбудителей хирургических инфекций и антимикробного действия химиопрепаратов является основой правильного их применения в клинике.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии //РМЖ. Медицинское обозрение. 2018. № 00. С. 1-6.
Antibacterial drugs for topical therapy of the wounds of various etiologies
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
Abstract
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfonamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 00. P. 1-6.
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные - постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже - грамотрицательные бактерии), и транзиторные - в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек - до 30-50%, человека - 70-80% 1.
Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл. 1).
Таблица 1. Этиология и микробный спектр ран
| Этиология ран | Спектр возбудителей раневых инфекционных осложнений |
| Раны в результате несчастных случаев | Чаще встречаются Enterobacteriaceae spp. и S. aureus, в т. ч. возможны и внебольничные MRSA-штаммы, Staphylococcus spp. [4]. При ранах в области верхних конечностей, особенно кистей рук, преобладают кокковые формы: 90% стафилококк (57% в чистой культуре и 33% - в ассоциации со спороносными палочками); реже обнаруживаются дифтероиды, аэробные спороносные палочки и различные сапрофиты воздушного происхождения; при травме нижних конечностей встречаются кишечная палочка и протей -13,5%, реже - анаэробы [5]. В перианальной области в ране содержатся разнообразные комбинации грамположительных кокков (стафилококки, стрептококки и энтерококки) и энтеробактерий (кишечная палочка, клебсиелла, энтеробактер и др.) в возможной ассоциации с анаэробами (пептострептококки, бактероиды, фузобактерии, клостридии и др.) [6]. При ранении в морской воде - Vibrio spp, Mycobacterium marinun, в пресной воде - Pseudomonas aeruginosa, Aeromonas spp. и Mycobacterium spp. (чаще - M. marinum, Mycobacterium avium), Vibrio spp, Enterobacteriaceae spp. [7, 8]. Повреждения, сопровождающиеся нарушением кровоснабжения и резким снижением оксигенации тканей, наиболее благоприятны для развития C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Ожоговые раны | Чаще всего рану колонизируют стафилококк, вегетирующий в виде сапрофитной флоры на неповрежденной коже, и стрептококк. На госпитальных этапах - нозокомиальные инфекции (больничная полирезистентная флора), частота MRSA-штаммов -37-50% [9]. Монокультуры микроорганизмов встречаются в 57% случаев, микробные ассоциации - в 43%, они включают: S. aureus и Proteus vulgaris; S. aureus и S. epidermidis; S. aureus и P. aeruginosa; P. vulgaris, E. coli, S. aureus; P. aeruginosa, K. pneumonia, S. aureus (Моррисон В.В., 2015). |
| Укушенные раны | При укусах животных первое место по числу занимают микробные аэробно-анаэробные ассоциации - 50-65%, Pasteurella spр. - 2075% (Pasteurella multocida - 60% и P. canis - 18%), а также Peptostreptococcus spp, S. aureus - 20-40% и Streptococcus mitis, Moraxella spp, Corynebacterium spp. и Neisseria spp. 10. При укусах кошки: P. multocida, S. aureus, MRSA, Cl. tetani; при укусах свиньи: полимикробная флора (грамположительные кокки, грамотрицательные палочки, Pasteurella spp. + анаэробы, Cl. tetani); при укусах крысы: S. moniliformis, Cl. tetani; при укусах змеи: Pseudomonas spp, Enterobacteriaceae spp., Clostridium spp. [1, 4]. При укусах человека спектр возбудителей представлен преимущественно Streptococcus spp. (17-90%), S. aureus (13-50%), Eikenella corrodens (10-29%), Haemophilus influenza (17-26%), Bacteroides spp, Fusobacterium spp. (12-33%), Peptostreptococcus spp. (22%), преобладает смешанная флора [4, 9-10, 12]. Возможны внебольничные MRSA-штаммы, особенно при укусах животных [13]. |
| Раны после разделки мяса или рыбы | Erysipelothrixrhusiopathiae [7]. |
| Раны, полученные в результате боевых действий и других ЧС | Часто грамотрицательные аэробные возбудители: Enterobacteriaceae spp, Pseudomonas spp, а также Staphylococcus spp. При повреждениях полых органов, например при проникающих абдоминальных ранениях: контаминация раны грамотрицательными возбудителями из семейства Enterobacteriaceae и анаэробами [4]. При глубоких ранах, загрязненных землей, с нарушением кровоснабжения и резким снижением оксигенации тканей: C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Послеоперационные раны | S. aureus - 20% (в т. ч. MRSA-штаммы), коагулазонегативные стафилококки - 14%, энтерококки - 12%, E. coli - 8%, P. aeruginosa - 8%, Enterobacter spp. - 7%, P. mirabilis - 3%, K. pneumoniae - 3%, C. albicans - 3-9,5%, другие грамположительные аэробы - 2%, Bacteroides fragilis - 2% [1, 4]. |
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. ß-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10-25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4-84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения 7.
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
Таблица 2. Характеристика антибактериальных препаратов для наружного применения
Примечание: ПАБК - парааминобензойная кислота
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12*10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Таблица 3. Показания, побочные эффекты и ограничения для антибактериальных препаратов для наружного применения
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов - мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15-16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов.
При глубоких ранениях в полость раны вносят 5-15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет - 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения - Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.
Одной из особенностей лечения и восстановления при ранах и переломах является не только сложность процесса заживления, но и профилактика гнойных инфекций, наблюдающихся при открытых травмах. Частота послеоперационных гнойных осложнений по официальным данным достигает 10-12%. Причиной этого является как устойчивость возбудителей инфекционных заболеваний к антибиотикам, так и недостаточная иммунная реактивность организма. Так же организм бывает ослаблен в результате травмы и длительной болезни.
Процесс образования и заживления раны
Рана, или раневой процесс — сложный комплекс как местных реакций в зоне повреждения, так и общих, развивающихся в организме в ответ на повреждение. Разделяется раневой процесс на 3 стадии:
- расплавление тканей и восстановление раны через воспаление ( до 3-х суток )
- замещение раневого дефекта, начало формирование грануляционной ткани ( от 3 до 6 суток )
- образование рубца и заживление ( с 6 суток )
Физиотерапия при ранах и переломах
Выбор реабилитационных и физиотерапевтических процедур нужно проводить с учетом одного важного фактора. Необходимо учитывать, является ли рана чистой от инфекционного повреждения ( асептической раной ) или же она инфицирована. В этом случае, помимо воздействия на процесс заживления мы должны учитывать инфекционно — воспалительный процесс и воздействовать на него.
Лечение асептических ран
Асептические, не подврежденые инфекционному повреждению раны являются чистыми, и заживают гораздо быстрее. Края раны сопоставляются близко, процесс первичного натяжения проходит без осложнений. Основными методиками физиолечения при асептических ранах являются:
Так же рекомендуется проводить лазеротерапию не только на рану и в месте повреждения. Доказана эффективность применения лазеротерапии на крупные кровеносные узлы, зоны Захарьина-Геда. Это способствует укреплению и усилению иммунного ответа организма в целом.
Физиотерапия инфицированных ран
Физиотерапия при ранах и переломах с присоединением инфекции оказывает сходное действие, но с учетом необходимости воздействия на инфекцию. Приоритетным направлением при доказанной инфекции является УФ облучение. Так как в случае инфицирования процесс заживления течет гораздо медленнее, есть необходимость в устранении и подавлении причины инфекции. Чем выше инфицирование раны, тем больше должна быть биодоза УФ облучения. Так же УФ облучение стимулирует кровоток, ускоряет отторжение пораженных тканей, что способствует вымыванию из раны патологической микрофлоры. При первых процедурах назначаются 3 — 5 биодоз, в процессе лечения увеличивают до 8 — 10 биодоз.
Так же важное значение в лечении инфицированных ран приобретает сочетанное использование УФ облучения с антисептическими и бактериостатическими препаратами. Сочетание методик дает ускоренное проникновение этих препаратов с поверхности кожи в кровоток.
Так же, помимо традиционных методик, при инфицированных ранах, особенно при переходе инфицирования во вторую стадию применяют электрофорез с антибиотиками. Эта методика позволяет подавлять вирусную микрофлору, уменьшает воспалительную реакцию, способствует ускорению оттока гнойного отделяемого. В лечении острой гнойной инфекции часто используется внутритканевой электрофорез с поперечным или продольным расположением электродов. Помимо антибактериального воздействия, сам по себе электрофорез оказывает противоболевое действие.
Оптимальным вариантом является электрофорез цинка в сочетании с 3% раствором йодида калия.
Из последних, более современных рекомендаций физиотерапия при ранах и переломах при присоединении инфекции включает в себя
- Гипербарическую оксигенацию — методику, увеличивающую парциальное давление кислорода, способствующую нормализации окислительно-восстановительных процессов в инфицированной ране. Так же гипербарическая оксигенация способствует усилению клеточного иммунитета, угнетает лейкоцитарные реакции.
- Лечение озоно-кислородными смесями. Методика получила распространение с середины 90-х годов прошлого века. Смеси обладают бактерицидным действием, детоксикационным и биостимулирующим эффектом.
- Дарсонвализация. Применяется в комплексной терапии инфицированных ран, язв. При проведении процедуры на поверхности кожи так же образуется озон, который оказывает бактериостатическое действие.
Остальные методики физиотерапии схожи с таковыми при лечении асептических ран. После подавления возбудителя заболевания приоритет отдается УВЧ, КВЧ-терапии, магнитотерапии.
Раневая инфекция – это комплекс общих и местных патологических проявлений, возникающих при развитии инфекции в случайных или операционных ранах. Патология проявляется болью, ознобом, лихорадкой, увеличением регионарных лимфатических узлов и лейкоцитозом. Края раны отечные, гиперемированные. Наблюдается выделение серозного или гнойного отделяемого, в отдельных случаях образуются участки некроза. Диагноз выставляется на основании анамнеза, клинических признаков и результатов анализов. Лечение комплексное: вскрытие, перевязки, антибиотикотерапия.
МКБ-10
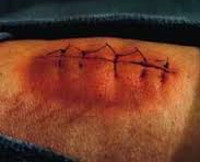
Общие сведения
Раневая инфекция – осложнение раневого процесса, обусловленное развитием патогенной микрофлоры в полости раны. Все раны, в том числе и операционные, как в гнойной хирургии, так и в травматологии считаются первично загрязненными, поскольку какое-то количество микробов попадает на раневую поверхность из воздуха даже при безукоризненном соблюдении правил асептики и антисептики. Случайные раны загрязнены сильнее, поэтому в таких случаях источником инфекции обычно является первичное микробное загрязнение. При операционных ранах на первый план выступает эндогенное (из внутренней среды организма) или внутригоспитальное (вторичное) инфицирование.

Причины
В большинстве случаев возбудителем инфекции в случайных ранах становится стафилококк. Редко в качестве основного возбудителя выступает протей, кишечная и синегнойная палочка. В 0,1% случаев встречается анаэробная инфекция. Через несколько дней пребывания в стационаре флора меняется, в ране начинают преобладать устойчивые к антибактериальной терапии грамотрицательные бактерии, которые обычно становятся причиной развития раневой инфекции при вторичном инфицировании как случайных, так и операционных ран.
Раневая инфекция развивается в случае, когда количество микробов в ране превышает некий критический уровень. При свежих травматических повреждениях у ранее здорового человека этот уровень составляет 100 тыс. микроорганизмов на 1 г ткани. При ухудшении общего состояния организма и определенных особенностях раны этот порог может существенно снижаться.
К числу местных факторов, повышающих вероятность развития раневой инфекции, относится присутствие в ране инородных тел, сгустков крови и некротических тканей. Также имеет значение плохая иммобилизация при транспортировке (становится причиной дополнительной травмы мягких тканей, вызывает ухудшение микроциркуляции, увеличение гематом и расширение зоны некроза), недостаточное кровоснабжение поврежденных тканей, большая глубина раны при малом диаметре раневого канала, наличие слепых карманов и боковых ходов.
Общее состояние организма может провоцировать развитие раневой инфекции при грубых расстройствах микроциркуляции (централизация кровообращения при травматическом шоке, гиповолемические расстройства), нарушениях иммунитета вследствие недостаточного питания, нервного истощения, химических и радиационных поражений, а также хронических соматических заболеваний. Особенно значимы в таких случаях злокачественные новообразования, лейкемия, уремия, цирроз, сахарный диабет и ожирение. Кроме того, снижение сопротивляемости инфекции наблюдается при проведении лучевой терапии и при приеме ряда лекарственных средств, в том числе – иммунодепрессантов, стероидов и больших доз антибиотиков.
Классификация
В зависимости от преобладания тех или иных клинических проявлений гнойные хирурги выделяют две общие формы раневой инфекции (сепсис без метастазов и сепсис с метастазами) и несколько местных. Общие формы протекают тяжелее местных, вероятность летального исхода при них повышается. Самой тяжелой формой раневой инфекции является сепсис с метастазами, который обычно развивается при резком снижении сопротивляемости организма и раневом истощении вследствие потери больших количеств белка.
К числу местных форм относятся:
- Инфекция раны. Является локализованным процессом, развивается в поврежденных тканях с пониженной сопротивляемостью. Зона инфицирования ограничена стенками раневого канала, между ней и нормальными живыми тканями есть четкая демаркационная линия.
- Околораневой абсцесс. Обычно соединен с раневым каналом, окружен соединительнотканной капсулой, отделяющей участок инфекции от здоровых тканей.
- Раневая флегмона. Возникает в случаях, когда инфекция выходит за пределы раны. Демаркационная линия исчезает, процесс захватывает прилежащие здоровые ткани и проявляет выраженную тенденцию к распространению.
- Гнойный затек. Развивается при недостаточном оттоке гноя вследствие неадекватного дренирования или зашивании раны наглухо без использования дренажа. В подобных случаях гной не может выйти наружу и начинает пассивно распространяться в ткани, образуя полости в межмышечных, межфасциальных и околокостных пространствах, а также в пространствах вокруг сосудов и нервов.
- Свищ. Образуется на поздних стадиях раневого процесса, в случаях, когда на поверхности рана закрывается грануляциями, а в глубине сохраняется очаг инфекции.
- Тромбофлебит. Развивается через 1-2 мес. после повреждения. Является опасным осложнением, обусловлен инфицированием тромба с последующим распространением инфекции по стенке вены.
- Лимфангит и лимфаденит. Возникают вследствие других раневых осложнений, исчезают после адекватной санации основного гнойного очага.
Симптомы раневой инфекции
Как правило, патология развивается спустя 3-7 дней с момента ранения. К числу общих признаков относится повышение температуры тела, учащение пульса, ознобы и признаки общей интоксикации (слабость, разбитость, головная боль, тошнота). В числе местных признаков – пять классических симптомов, которые были описаны еще во времена Древнего Рима врачом Аулусом Корнелиусом Сельсусом: боль (dolor), местное повышение температуры (calor), местное покраснение (rubor), отек, припухлость (tumor) и нарушение функции (functio laesa).
Характерной особенностью болей является их распирающий, пульсирующий характер. Края раны отечны, гиперемированы, в полости раны иногда имеются фибринозно-гнойные сгустки. Пальпация пораженной области болезненна. В остальном симптоматика может варьироваться в зависимости от формы раневой инфекции. При околораневом абсцессе отделяемое из раны нередко незначительное, наблюдается выраженная гиперемия краев раны, резкое напряжение тканей и увеличение окружности конечности. Образование абсцесса сопровождается снижением аппетита и гектической лихорадкой.
При раневых флегмонах выявляется существенное повышение местной температуры и резкое ухудшение состояния больного, однако рана выглядит относительно благополучно. Формирование гнойного затека также сопровождается значительным ухудшением состояния пациента при относительном благополучии в области раны. Температура повышается до 40 градусов и более, отмечаются ознобы, вялость, адинамия и снижение аппетита. Гнойное отделяемое отсутствует или незначительное, гной выделяется только при надавливании на окружающие ткани, иногда – удаленные от основного очага инфекции. При свищах общее состояние остается удовлетворительным или близким к удовлетворительному, на коже формируется свищевой ход, по которому оттекает гнойное отделяемое.
Осложнения
Осложнения обусловлены распространением инфекции. При гнойных тромбофлебитах общее состояние ухудшается, в зоне поражения определяются умеренные признаки воспаления, при расплавлении стенки вены возможно формирование флегмоны или абсцесса. Лимфангит и лимфаденит проявляются болезненностью, отечностью мягких тканей и гиперемией кожи в проекции лимфатических узлов и по ходу лимфатических сосудов. Отмечается ухудшение общего состояния, ознобы, гипертермия и повышенное потоотделение. При сепсисе состояние тяжелое, кожа бледная, наблюдается снижение АД, выраженная тахикардия, бессонница и нарастающая анемия.
Лечение раневой инфекции
Лечение заключается в широком вскрытии и дренировании гнойных очагов, а также промывании раны антисептиками. В последующем при перевязках используются сорбенты и протеолитические ферменты. В фазе регенерации основное внимание уделяется стимуляции иммунитета и защите нежных грануляций от случайного повреждения. В фазе эпителизации и рубцевания при больших, длительно незаживающих ранах выполняют кожную пластику.
Прогноз и профилактика
Прогноз определяется тяжестью патологии. При небольших ранах исход благоприятный, наблюдается полное заживление. При обширных глубоких ранах, развитии осложнений требуется длительное лечение, в ряде случаев возникает угроза для жизни. Профилактика раневой инфекции включает в себя раннее наложение асептической повязки и строгое соблюдение правил асептики и антисептики в ходе операций и перевязок. Необходима тщательная санация раневой полости с иссечением нежизнеспособных тканей, адекватным промыванием и дренированием. Пациентам назначают антибиотики, проводят борьбу с шоком, алиментарными нарушениями и белково-электролитными сдвигами.
Гнойные раны – это повреждения кожных покровов и подлежащих тканей с формированием гнойного очага. Патология проявляется значительным отеком, гиперемией окружающих тканей и интенсивным болевым синдромом. Боли могут быть дергающими, распирающими, лишающими сна. В ране видны омертвевшие ткани и скопления гноя. Наблюдается общая интоксикация, сопровождающаяся повышением температуры, ознобами, головной болью, слабостью и тошнотой. Лечение комплексное, включает в себя промывание и дренирование ран (при необходимости производится вскрытие гнойных затеков), лечебные повязки, антибиотикотерапию, дезинтоксикационную терапию, иммунокорригирующую терапию и стимуляцию восстановительных процессов.
МКБ-10
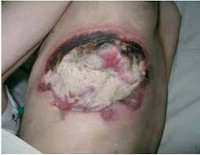
Общие сведения
Гнойная рана – дефект тканей, в просвете которого содержится гнойный экссудат, а по краям определяются признаки воспаления. Гнойные раны являются самым распространенным осложнением чистых ран, как случайных, так и хирургических. По различным данным, несмотря на строгое соблюдение стерильности в ходе операций, количество нагноений в послеоперационном периоде колеблется от 2-3 до 30%. Возбудителями гнойного процесса в случайных и хирургических ранах чаще всего становятся так называемые гноеродные микробы (стафилококки, стрептококки и т. д.). Лечением ранее необработанных гнойных ран занимаются хирурги, лечение случайных ран, нагноившихся после ПХО, осуществляют травматологи-ортопеды. Лечение нагноившихся хирургических ран находится в ведении специалистов, проводивших операцию: хирургов, травматологов, сосудистых хирургов, торакальных хирургов, нейрохирургов и т. д.

Причины
В настоящее время как в травматологии и ортопедии, так и в хирургии принято считать, что любая случайная рана является инфицированной, то есть, содержит определенное количество бактерий. Однако бактериальное загрязнение не обязательно влечет за собой нагноение. Для развития инфекции необходимо сочетание следующих факторов: достаточное повреждение тканей; наличие в полости раны нежизнеспособных тканей, инородных тел и излившейся крови; достаточная концентрация патогенных микроорганизмов. Чаще всего в гнойных ранах обнаруживаются гноеродные бактерии (стрептококки, стафилококки, клебсиеллы, протей, кишечная палочка, псевдомонады и т. д.). Вместе с тем, в ряде случаев гнойный процесс может быть вызван пневмококками, шигеллами, сальмонеллами, микобактериями и т. д.
В числе других факторов, увеличивающих вероятность развития гнойного процесса, - локализация и вид раны, общее состояние организма, наличие соматических заболеваний, сахарного диабета и сосудистых нарушений, возраст, конституция и даже время года. Гнойные раны - частое осложнение случайных колотых, рвано-ушибленных ран и ран, сопровождающихся размозжением мягких тканей. Причиной нагноения колотых ран является затруднение оттока вследствие небольшого отверстия на коже, тонкого и длинного раневого канала. Высокая вероятность нагноения рвано-ушибленных ран и ран с размозжением мягких тканей обусловлена наличием обильных загрязнений и/или большого количества нежизнеспособных тканей. Реже всего, благодаря неглубокому раневому каналу и незначительному повреждению краев, нагнаиваются резаные раны.
Лучше всего заживают раны в области головы и шеи. Несколько чаще нагноение возникает при ранах ягодичной области, спины, груди и живота, еще чаще – при повреждении верхних и нижних конечностей. Хуже всего заживают раны стоп. Хороший иммунитет снижает вероятность развития гнойных ран при незначительном бактериальном осеменении. При значительном осеменении и удовлетворительном состоянии иммунной системы нагноение протекает более бурно, но процесс обычно носит локализованный характер и быстрее завершается выздоровлением. Иммунные нарушения становятся причиной более вялого и длительного заживления гнойных ран. Увеличивается вероятность распространения инфекции и развития осложнений.
Тяжелые соматические заболевания влияют на общее состояние организма и, как следствие – на вероятность нагноения и скорость заживления ран. Однако особенно сильное негативное влияние в силу сосудистых и обменных нарушений оказывает сахарный диабет. У пациентов, страдающих этим заболеванием, гнойные раны могут возникать даже при небольших травмах и незначительном бактериальном осеменении. У таких больных наблюдается плохое заживление и выраженная тенденция к распространению процесса. У здоровых молодых людей раны, в среднем, нагнаиваются реже, чем у пожилых, у худых – реже, чем у полных. Вероятность нагноения раны увеличивается летом, особенно в жаркую и влажную погоду, поэтому плановые операции рекомендуют проводить в холодное время года.
Симптомы гнойных ран
Выделяют местные и общие симптомы патологии. К местным симптомам относится дефект тканей с наличием гнойного экссудата, а также классические признаки воспаления: боль, местное повышение температуры, местная гиперемия, отек окружающих тканей и нарушение функции. Боль при гнойной ране может быть давящей или распирающей. При затруднении оттока (вследствие образования корки, формирования затеков, распространении гнойного процесса), скоплении гноя и повышении давления в воспаленной области боль становится очень интенсивной, дергающей и нередко лишает пациентов сна. Кожа вокруг раны горячая. На начальных стадиях, в период образования гноя, наблюдается покраснение кожных покровов. При длительном существовании раны краснота может сменяться багровой или багрово-синюшной окраской кожи.
В месте поражения можно выделить два типа отека. В краях раны – теплый воспалительный. Совпадает с зоной гиперемии, обусловлен нарушением кровотока. Дистальнее раны – холодный реактивный. Гиперемия в этой зоне отсутствует, а отечность мягких тканей вызвана нарушением оттока лимфы из-за сдавления лимфатических узлов в области воспаления. Нарушение функции пораженного отдела связано с отеком и болью, выраженность нарушения зависит от размеров и локализации гнойной раны, а также от объема и фазы воспаления.
Основным признаком гнойной раны является гной – жидкость, содержащая бактерии, тканевый детрит, глобулины, альбумины, ферменты лейкоцитарного и микробного происхождения, жиры, холестерин, примесь ДНК и погибшие лейкоциты. Цвет и консистенция гноя зависят от вида возбудителя. Для стафилококка характерен густой желтый или белый гной, для стрептококка – жидкий зеленоватый или желтоватый, для кишечной палочки – жидкий буро-желтый, для анаэробных микробов – бурый зловонный, для синегнойной инфекции – желтоватый, отливающий сине-зеленым на повязке (этот оттенок гной приобретает при контакте с кислородом во внешней среде). Количество гноя может существенно различаться. Под гноем могут обнаруживаться участки некротической ткани и грануляции.
Из раны в организм пациента поступают токсины, что обуславливает появление симптомов общей интоксикации. Характерно повышение температуры, потеря аппетита, потливость, слабость, ознобы, головная боль. В анализах крови выявляется ускорение СОЭ и лейкоцитоз со сдвигом влево. В анализе мочи обнаруживается белок. В тяжелых случаях возможно повышение уровня мочевины, креатинина и билирубина в крови, анемия, лейкопения, диспротеинемия и гипопротеинемия. Клинически при тяжелой интоксикации может наблюдаться резкая слабость и нарушения сознания вплоть до комы.
В зависимости от преобладающего процесса выделяют следующие стадии гнойного процесса: формирование гнойного очага, очищение и регенерация, заживление. Все гнойные раны заживают вторичным натяжением.
Осложнения
При гнойных ранах возможен целый ряд осложнений. Лимфангит (воспаление лимфатических сосудов, расположенных проксимальнее раны) проявляется красными полосами, направленными от раны к регионарным лимфатическим узлам. При лимфадените (воспалении лимфатических узлов) регионарные лимфоузлы увеличиваются и становятся болезненными. Тромбофлебит (воспаление вен) сопровождается появлением болезненных красных тяжей по ходу подкожных вен. При контактном распространении гноя возможно развитие гнойных затеков, периостита, остеомиелита, гнойного артрита, абсцесса и флегмоны. Самым тяжелым осложнением гнойных ран является сепсис.
Если заживления не происходит, гнойная рана может перейти в хроническую форму. Зарубежные специалисты рассматривают раны без тенденции к заживлению в течение 4 и более недель, как хронические. К числу таких ран относят пролежни, трофические язвы, случайные или операционные длительно незаживающие раны.
Диагностика
Из-за наличия явных местных признаков диагностика гнойных ран не представляет затруднений. Для исключения вовлеченности подлежащих анатомических структур может выполняться рентгенография, МРТ или КТ пораженного сегмента. В общем анализе крови определяются признаки воспаления. Для определения вида и чувствительности возбудителя производится посев отделяемого на питательные среды.
Лечение гнойных ран
Тактика лечения зависит от фазы раневого процесса. На стадии формирования гнойного очага основной задачей хирургов является очищение раны, ограничение воспаления, борьба с патогенными микроорганизмами и детоксикация (при наличии показаний). На второй стадии проводятся мероприятия по стимуляции регенерации, возможно наложение ранних вторичных швов или проведение кожной пластики. На стадии закрытия раны осуществляется стимуляция образования эпителия.
При наличии гноя проводится хирургическая обработка, включающая в себя рассечение краев раны или кожи над очагом, удаление гноя, исследование раны для выявления затеков и, при необходимости – вскрытие этих затеков, удаление некротических тканей (некрэктомию), остановку кровотечения, промывание и дренирование раны. Швы на гнойные раны не накладывают, наложение редких швов допускается только при организации проточно-промывного дренирования. Наряду с традиционными методами лечения гнойных ран применяются современные методики: вакуум-терапия, местная озонотерапия, гипербарическая оксигенация, обработка с использованием лазера, ультразвуковая обработка, криовоздействие, обработка пульсирующей струей антисептика, введение в рану сорбентов и т. д.
По показаниям осуществляется детоксикация: форсированный диурез, инфузионная терапия, экстракорпоральная гемокоррекция и т. п. Все перечисленные мероприятия, как традиционные, так и современные, проводятся на фоне рациональной антибиотикотерапии и иммунокоррекции. В зависимости от тяжести процесса антибиотики могут назначаться перорально, внутримышечно или внутривенно. В первые дни используются препараты широкого спектра действия. После определения возбудителя антибиотик заменяют с учетом чувствительности микроорганизмов.
После очищения гнойной раны предпринимаются меры для восстановления анатомических взаимоотношений и закрытия раны (ранние и поздние вторичные швы, кожная пластика). Наложение вторичных швов показано при отсутствии гноя, некротических тканей и выраженного воспаления окружающих тканей. При этом необходимо, чтобы края раны можно было сопоставить без натяжения. При наличии дефекта тканей и невозможности сопоставить края раны выполняется кожная пластика с использованием островкового и марочного способов, пластика встречными лоскутами, пластика свободным кожным лоскутом или пластика кожным лоскутом на сосудистой ножке.
Читайте также:

